“难溶电解质的溶解平衡”优质课教学设计案例赏析
2016-08-16北京赵晓冉指导教师
◇ 北京 赵晓冉指导教师 王 春
“难溶电解质的溶解平衡”优质课教学设计案例赏析
◇ 北京 赵晓冉1指导教师 王 春2
1 教学背景分析
1.1 学习内容分析
本节课的主要任务是建立起电解质的沉淀溶解平衡模型,以及对溶解平衡的简单应用.“难溶电解质的溶解平衡”属于概念课,期望通过客观事实以及学生已有的平衡理论,分析归纳总结,得出概念.学生通过已有知识揭示沉淀溶解平衡的本质并掌握概念的简单应用.通过本节的学习,使学生对离子反应的本质有更深刻的理解.
1.2 学生情况分析
学生已经学习了化学平衡、电离平衡、水解平衡,并能利用勒夏特列原理解决平衡移动的相关问题,但是对难溶电解质的溶解平衡还没有认识,本节课将借助实验事实,通过分析、归纳、总结建立起沉淀溶解平衡概念.拓展溶度积的相关知识,使学生能从定量的角度分析沉淀转移的本质,加深对离子反应本质的认识.
2 教学目标设计
2.1 知识与技能
1)建立电解质的溶解平衡模型,能初步运用沉淀溶解平衡原理分析、解决问题.2)深入理解离子反应的本质,掌握沉淀间转化的规律.
2.2 过程与方法
1)通过数字化实验直观地认识难溶电解质的溶解性,建立难溶电解质的溶解平衡.
2)通过分析改变沉淀溶解平衡的条件,初步建立分析沉淀转化问题的思维方法.
3)建立“理论分析—设计方案—实验验证—归纳总结”的化学学习模式.
2.3 情感态度与价值观
通过数字化实验建立沉淀溶解平衡模型,体验手持技术在解决科学问题中的必要性;激发学生学习化学的兴趣,体验化学学科的自然科学价值.
3 教学重、难点
1)重点:电解质沉淀溶解平衡模型的建立.
2)难点:应用沉淀溶解平衡原理分析和解决实际问题.
4 教学过程设计
环节1 新课引入.
讲解成语“水滴石穿”的寓意,引导学生从科学的角度分析“水滴石穿”是物理变化还是化学变化?(谜底待本节课后揭晓)
(设计意图:通过成语“水滴石穿”蕴含的化学原理,引出新课,激发学生的学习兴趣.)
环节2 建立易溶电解质的沉淀溶解平衡.
【复习回顾】回顾饱和溶液的相关知识,学生回答课前预留学案问题:1)什么是饱和溶液?2)如何判断一瓶氯化钠溶液是否为饱和溶液?(展示学生学案,指出不足,强调科学规范表述.)
【提出问题】氯化钠饱和溶液中的氯化钠晶体是否就不再溶解了?
【展示图片】展示饱和溶液中晶体生长变化的图片,图1为饱和氯化钠溶液与饱和重铬酸钾溶液中晶体的变化,晶体形状发生改变,总质量不发生改变,这一现象说明了什么.

图1
【学生分析】氯化钠晶体不断溶解,溶液中离子不断形成晶体,达到平衡状态,是可逆过程.
学生初始写的不带状态,引导学生与氯化钠电离方程式对比,纠正并强调物质状态书写的必要性.
【实验1】向饱和食盐水中滴加浓盐酸,观察实验,描述现象,分析原理.
【学生回答】学生观察实验,描述现象,应用勒夏特列原理分析原因.
(设计意图:通过实验事实及已掌握的平衡理论分析得到氯化钠的溶解平衡,拓展对饱和溶液的认知,建立起易溶电解质的溶解平衡.学生在书写氯化钠的沉淀溶解平衡方程式时,有时会忽略物质状态的标注,通过分析电离与溶解平衡的区别,认识书写物质状态的必要性.)
环节3 建立难溶电解质的溶解平衡.
【引导过渡】易溶电解质饱和溶液存在溶解平衡,难溶电解质是否也存在溶解平衡?难溶电解质是否一点不溶?阅读课本第61页资料表3-4,能得到哪些信息?
【学生回答】物质溶解性不同,难溶物质也有一定的溶解度.
【讲解】讲解溶解度与溶解性的关系,学生找出表中的易溶、微溶、难溶物质.
【实验2】利用数字化实验测AgCl的电导率,与纯水电导率对比,探究其溶解性.
【结论】难溶物质AgCl仍有一定的溶解性.
展示溶解平衡曲线,学生分析由此曲线可以得到哪些信息.
AgCl固体加入水中,部分溶解,经过一段时间后,达到饱和状态,电导率的变化曲线如图2所示.

图2
引导学生分析AgCl沉淀溶解平衡建立的过程,书写AgCl的沉淀溶解平衡方程式.
(设计意图:学会知识的迁移运用,前面建立起易溶物质的沉淀溶解平衡,通过简单的实验,容易得出难溶电解质的沉淀溶解平衡.)
环节4 难溶电解质溶解平衡的移动及沉淀的转移.
【提出问题】根据勒夏特列原理,分析如何使AgCl的溶解平衡发生移动,并设计实验验证.
【学生活动】讨论设计实验方案并展示:1)改变温度.2)加水.3)加Ag+或Cl-.
【实验3】如何利用电导率传感器验证温度、离子浓度对溶解平衡的影响.
资料:1)溶液的电导率与溶液的离子总浓度呈正比.2)相同离子浓度的溶液电导率随温度升高而增大.
【学生讨论】引导分析原AgCl饱和溶液中的离子电导率随温度升高而变大,因此用AgCl饱和溶液的清液做对照实验,如图3所示.
图3中展示的是先升高温度,后降低温度电导率的变化,分析AgCl的溶解是吸热还是放热.
【学生回答】吸热过程.
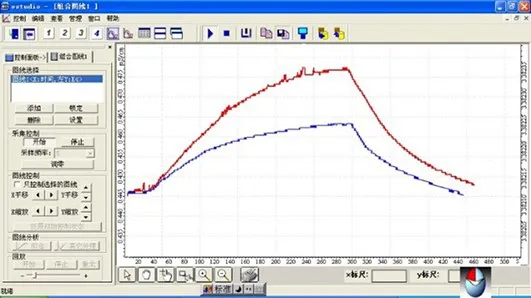
图3
【引导分析】试分析加入氯离子后AgCl沉淀溶解平衡的移动、溶液离子浓度的变化,如图4为AgCl饱和溶液中加入氯化钠固体浊液浊度的变化?

图4
根据勒夏特列原理,增加了氯离子的浓度,平衡向AgCl析出的方向移动,因此浊度变大,氯离子的浓度变大,银离子的浓度变小.
根据溶解度定义分析,一定温度下,一定溶剂中溶解的溶质的量是一定的,此时加入氯化钠固体,会有沉淀生成.此温度下,一定溶剂中溶解的AgCl变少了,可见对于非单一溶质的溶液中,溶解度不能很好地描述物质在溶剂中的溶解能力.因此我们引入一个新的概念,溶度积Ksp.(介绍溶度积Ksp及表示的意义,引导学生分析浓度商Qc与Ksp的关系.)
【学生实验】已知25℃时,3种银盐的溶度积常数(Ksp)如表1.

表1
根据已知信息设计实验方案改变AgCl的沉淀溶解平衡.
实验用品:物质的量浓度均为0.1mol·L-1的AgNO3、NaCl、KI、Na2S溶液.
学生先设计实验方案,教师加以引导,根据提供的溶度积信息,要降低Ag+的物质的量浓度,可使之生成更难溶的物质,得出沉淀转移的规律,写出离子转化的过程,并用离子方程式表示.
【回扣开题】试分析“水滴石穿”的道理.
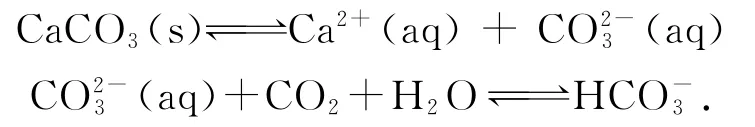
(设计意图:锻炼学生运用已有知识分析解决问题的能力,将平衡原理的知识运用到沉淀溶解平衡中.训练其实验设计能力,通过分组实验探究认识沉淀转移的本质,加深对离子反应本质的认识.通过实验使学生体会分工合作、实验探究的乐趣,提高实验方案设计能力.建立起“理论分析—设计方案—实验验证—归纳总结”的化学学习模式.)
5 教学设计特色说明
本节课的关键创新点在于打破对难溶电解质沉淀溶解平衡的狭隘认识.沉淀溶解是存在于电解质中的常见现象,无论是难溶还是易溶.易溶电解质的沉淀溶解平衡也常遇到并应用于生产生活,比如重结晶,以及让我们感到自豪的氯碱工业.通过学生已有平衡理论的知识,借助实验事实分析归纳总结,建立易溶电解质的溶解平衡.对于生成沉淀的离子反应,学生较为熟悉,但对于沉淀的溶解平衡,学生目前没有概念,通过数字化实验测难溶电解质的电导率可以让学生直观地感受难溶电解质的溶解性,建立起难溶电解质的溶解平衡.通过勒夏特列原理分析如何改变难溶电解质的溶解平衡,学生分析并设计实验验证.根据学生已有知识容易分析温度、浓度及加入同离子对平衡的影响.通过分析加入同离子分析离子浓度的改变,发现一定温度下,溶剂不变,有溶质析出,溶解的电解质质量发生变化,对于多溶质的溶液,溶解度不能很好地描述在溶液中的溶解性,因此引出溶度积的概念.给出几种物质的溶度积,学生设计实验改变AgCl沉淀溶解平衡,从定量的角度分析沉淀的转移.
1.北京景山学校远洋分校2.北京教育学院 )
