紫堇属植物中异喹啉类生物碱的化学结构和生物活性的研究进展
2016-08-15吴立军杨春娟
刘 璐,吴立军,杨春娟
·综述·
紫堇属植物中异喹啉类生物碱的化学结构和生物活性的研究进展
刘璐,吴立军,杨春娟*
哈尔滨医科大学药学院,哈尔滨 150081
[摘要]目的综述紫堇属中异喹啉类生物碱的化学成分和生物活性的研究进展。方法阅读国内外文献数据库中近年来关于紫堇属植物的文献,从化学结构和生物活性方面对文献进行整理和综述。结果紫堇属植物含有丰富的异喹啉类生物碱,按照结构类型可分为9类:原小檗碱类、原阿片碱类、苯酞异喹啉类、苯菲啶类、苄基异喹啉类、阿朴菲类、枯拉灵类、螺苄异喹啉类、其他类。紫堇属植物中的生物碱具有清热解毒、消炎止痛等功效,还具有免疫、抗菌、抗炎等生物活性。结论本文对紫堇属植物中含有的异喹啉类生物碱的化学结构和生物活性进行了整理,为紫堇属植物的深入研究和临床应用提供理论依据。
[关键词]紫堇属;生物活性;化学结构
0 引言
紫堇属(CorydalisDC.)是广义罂粟科(Papaveraceae)的最大属,全世界紫堇属植物约有440种,共41组。紫堇属在我国有298种,约占69.6%,归入38组[1]。其分布于我国各地,西南地区最多。从古至今,中国、韩国、日本等医药事业发达的国家早将紫堇属植物(如苦地丁、延胡索等)应用于各种疾病的治疗,如抗炎、抗病毒、抗疟疾、抗心律不齐等。也有一些生物碱可用于治疗老年痴呆和癌症等危险疾病。因其疗效显著,所以国内外对其化学结构和生物活性研究都很活跃。以下对近年来国内外关于紫堇属植物中异喹啉生物碱的化学结构和生物活性的最新研究进行综述。
1 化学结构
异喹啉类生物碱是紫堇属植物的有效成分。目前从该属植物中分离得到的生物碱可以分为9大类。见图1。
1.1原阿片碱类原阿片碱类生物碱虽然在紫堇属中的数目并不多,但广泛分布于延胡索,C.ternata,C.ochotensistutcz.等植物中,结构母核见图1(Ⅰ),代表药物为原阿片碱(1)。原阿片碱(1)在紫堇属生物碱中不仅含量高分布也十分广泛,存在于很多种紫堇属植物中。结构图见图2。
1.2原小檗碱类原小檗碱类生物碱是紫堇属植物中数量最多的一种生物碱,广泛分布在RhizomaC.Yanhusuo、C.adunca等植物中,结构母核见图1(Ⅱ),代表药物为小檗碱(10)、黄连碱(11)、去氢碎叶紫堇碱(12)、四氢巴马亭(44)等。结构见图3~图8。
1.3苯酞异喹啉类苯酞异喹啉类生物碱分布也比较广泛,如C.taliensis、C.thyrsiflora、C.mucronifera、C.ochotensistutcz.、C.marschalliana等植物中,结构母核见图1(Ⅲ),代表药物有山缘草碱(59)、北美黄连碱(60)等。结构见图9。

图1 紫堇属植物中异喹啉类生物碱类化合物结构母核

图2 紫堇属中原阿片碱型异喹啉类生物碱化学结构

图3 紫堇属中原小檗碱型异喹啉类生物碱化学结构
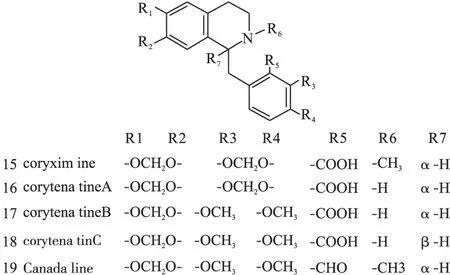
图4 紫堇属中原小檗碱型异喹啉类生物碱化学结构
1.4阿朴菲类阿朴菲类生物碱分布于RhizomaC、Yanhusuo、高加索紫堇、C.caucasica等紫堇属植物中,代表药物有glaucine(70)、dehydroglaucine(72)、dehydronantenine(75)等,结构母核见图1(Ⅳ)。结构见图10~图11。
1.5螺苄异喹啉类螺苄异喹啉类生物碱分布于C.longipes等植物中,分离得到norochotensimine(97)、欧朝紫堇碱(87)、sibiricine(86)等,结构母核见图1(Ⅴ)。结构见图12。
1.6苄基异喹啉类苄基异喹啉类生物碱的分布不如其他类型生物碱分布广泛,如从C.ternata中分离出的demethylcorydalmine。其结构母核如图1(Ⅵ)。结构见图13。

图5 紫堇属中原小檗碱型异喹啉类生物碱化学结构

图6 紫堇属中原小檗碱型异喹啉类生物碱化学结构
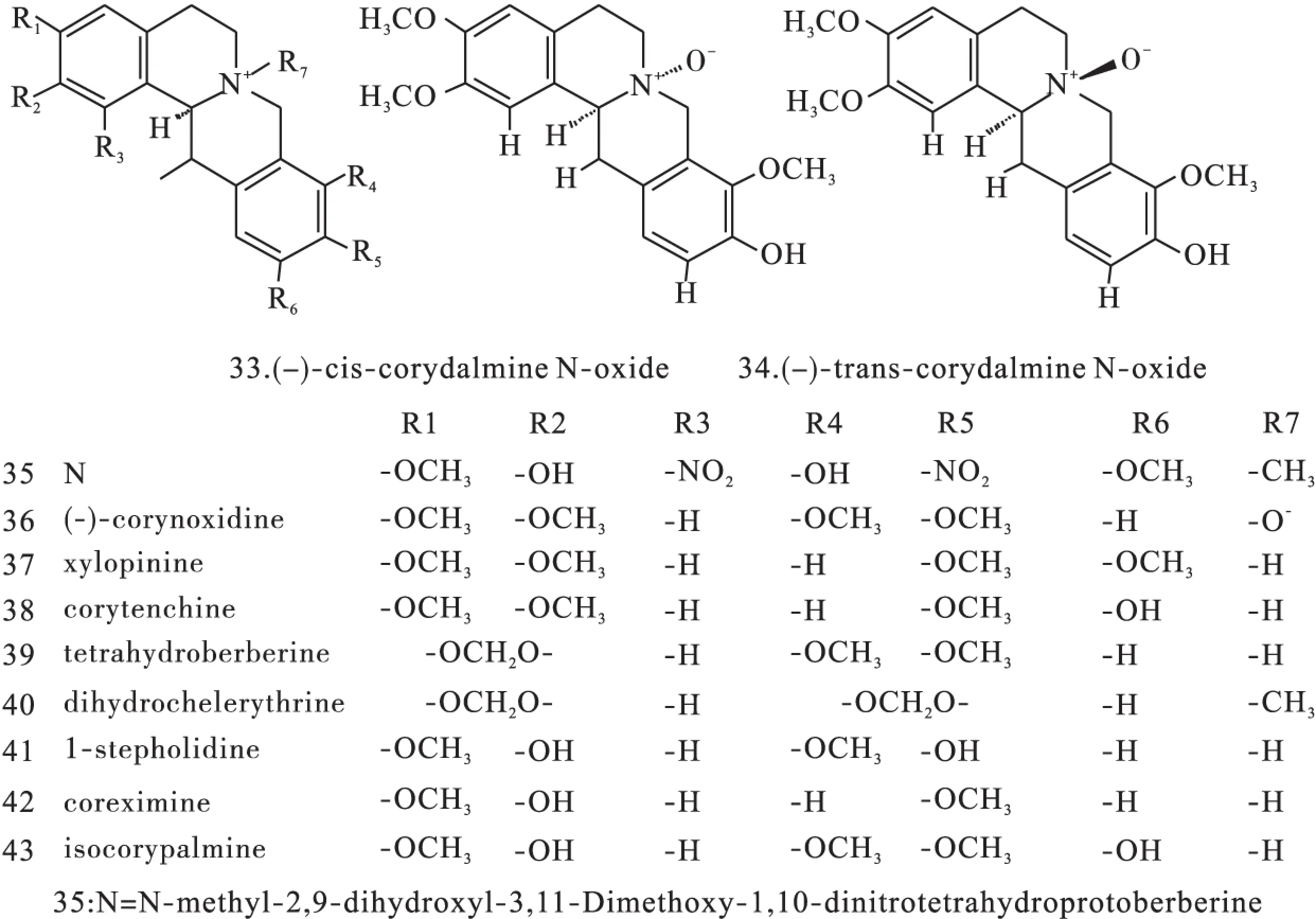
图7 紫堇属中原小檗碱型异喹啉类生物碱化学结构
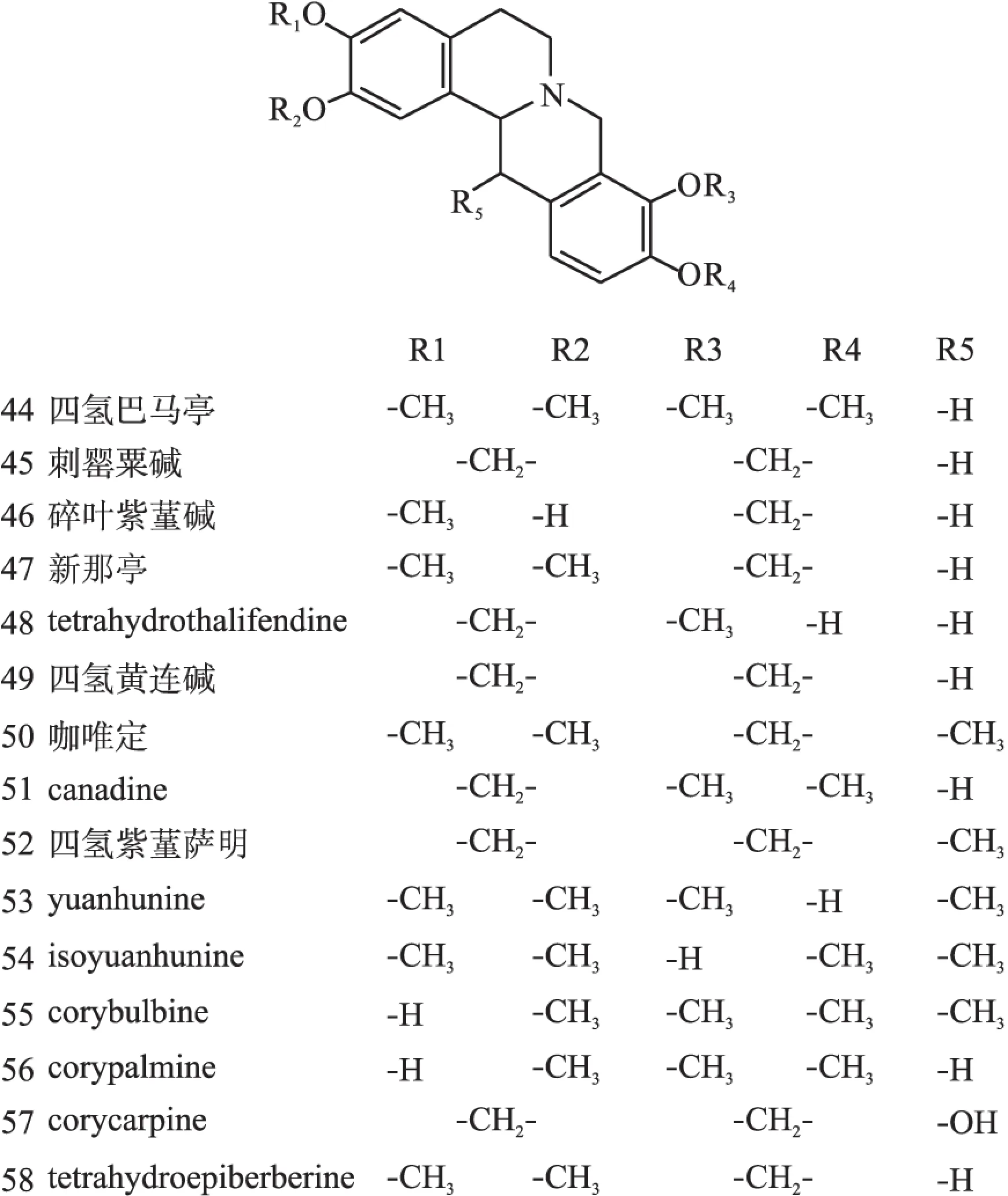
图8 紫堇属中原小檗碱型异喹啉类生物碱化学结构
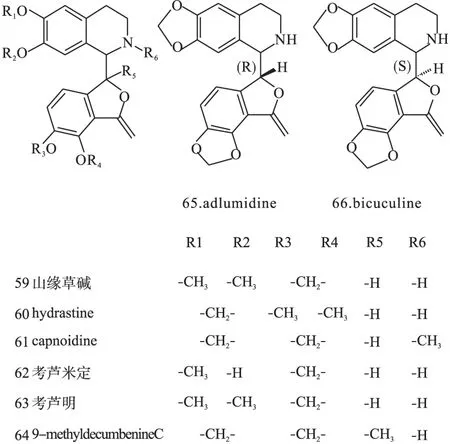
图9 紫堇属中苯肽异喹啉类异喹啉类生物碱化学结构

图10 紫堇属中阿朴菲类异喹啉类生物碱化学结构

图11 紫堇属中阿朴菲类异喹啉类生物碱化学结构
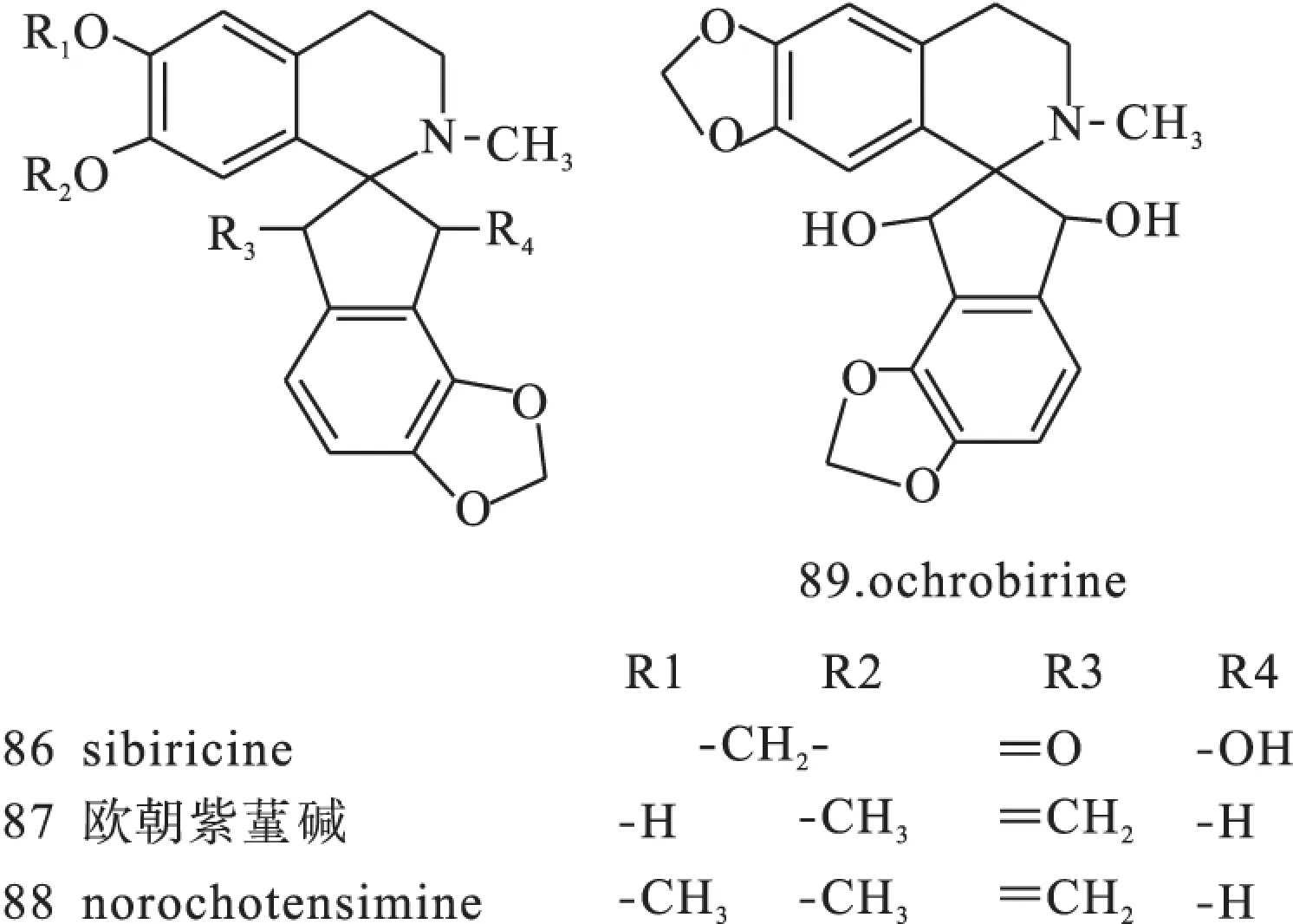
图12 紫堇属中螺卞异喹啉类异喹啉类生物碱化学结构

图13 紫堇属中卞基异喹啉类异喹啉类生物碱化学结构
1.7苯菲啶类苯菲啶类生物碱在多种紫堇属植物中均有分布,如山紫堇C.Capnoides中的紫堇灵(95)、乙酰紫堇灵(96)、11-表紫堇灵,刻叶紫堇C.Incisa中的紫堇洛星碱、luguine、6-氧紫堇醇灵碱、12-hydroxynoloxine,以及C.Flabellata中的6-(2-羟乙基)-5,6-二氢血根碱、6-丙酮基-5,6-二氢血根碱6-acetonyl-5,6-dihydrosanguinarine等,母核结构见图1(Ⅶ)[2],结构见图14。
1.8枯拉灵类枯拉灵类的生物碱分布和数量都比较少,如cularine(104)、枯拉辛cularicine等,母核见图1(Ⅷ)。结构见图15。
2 新化合物
近5年(2010-2015年)在紫堇属植物中发现了16种生物碱类化合物,黄巧琴等在Corydalissaxicola.中发现了11种化合物,其中有2种新的化合物,(-)-2,9-dihydroxyl-3,11-dimethoxy -1,10-dinitrotetrahydroprotoberberine(106)和(+)-4-nitroisoapocavidine(107)。Govaniadine(108)是从Corydalis govaniana中分离出来的一种新的化合物,经研究发现其具有良好的尿素酶抑制作用。Naveed Muhammad还发现,govaniadine(109)具有镇痛的活性[3]。郑小珂等在紫堇属植物Corydalis humosa中发现2种新生物碱;分别为1,1-dimethyl-6-methoxy-7-hydroxyl-1,2,3,4-tetrahydroisoquinoline(110)和(1R)-(4-hydroxybenzyl)-7-hydroxyl-8-O-b-D-glucopyranosyl-1,2,3,4-tetrahydro-isoquinoline(111)。杨志友等在紫堇属植物Corydalis ambigua中发现了7种新的生物碱单体ambidalmines A1/2,B1/2-E(112a/b,113a/b-116)和3种二聚物ambidimerines F1(117a),F2(117b),F3(117c)。新化合物结构见图16和表1。

图14 紫堇属中苯菲啶类异喹啉类生物碱化学结构

图15 紫堇属中枯拉灵类异喹啉类生物碱化学结构
3 生物活性
从该属植物中分离得到的生物碱成分的生物活性丰富多样,主要包括抗炎、抗肿瘤、抗病毒等药理作用。
3.1抗炎活性异喹啉生物碱cavidine(55)能减轻二甲苯引起的小鼠耳部水肿,甲醛引起的小鼠足部水肿,并且明显抑制由冰醋酸引起的腹膜炎小鼠中的白细胞数量和NO水平,这些结果都表明,cavidine是COX-2的一种选择性抑制剂,可以用于对抗炎症[9]。Kubo等[10]从齿瓣延胡索中提取出的0.125 mmol/kg去氢紫堇碱(13),可以缓解由冰醋酸导致的血管通透性增强引起的疼痛;还可以缓解由氨基酸、前列腺素E2、白三烯C4所引起的水肿,血管舒缓激肽所引发的炎症。从heterocarpa中提取出的(2′S,7′S)-O-(2-methylbutanoyl)-columbianetin能减少受激HMC-细胞中组胺和类胰蛋白酶的释放,能够抑制炎症细胞因子mRNA的表达,可作为一种新型、高效的过敏性鼻炎抑制剂[11]。有研究运用双抗体夹心、逆转录聚合酶链反应、丝裂原活化蛋白激酶活化、蛋白印记等方法进行蛋白含量测定,测定四氢巴马亭(44)在脂多糖诱导的人单核细胞系中的白细胞介素8(IL-8)的含量,得出四氢巴马亭(44)抗炎的机制为抑制LPS诱导的IL-8的产生,抑制细胞信号调节激酶并通过这种方式抑制MAPK磷酸化[12]。
3.2抗肿瘤活性从黄堇中提取的黄连素对人类纤维肉瘤细胞和人类胃癌细胞展现出细胞毒性。从延胡索中提取的去氢紫堇碱(13)通过诱导MCF-7细胞凋亡抑制乳腺癌细胞增殖[13]。线粒体跨膜电位等结果表明,去氢紫堇碱通过校正Bax/Bcl-2诱导细胞凋亡,激活凋亡蛋白酶裂解PARP,抑制MCF-7细胞的增殖。从heterocarpa紫堇属植物中分离得到的(2′S)-columbianetin-3′-sulfate和(2′S,7′S)-O-2-methylbutanoylcolumbianetin,对人类肿瘤细胞的增殖也具有抑制作用[14]。
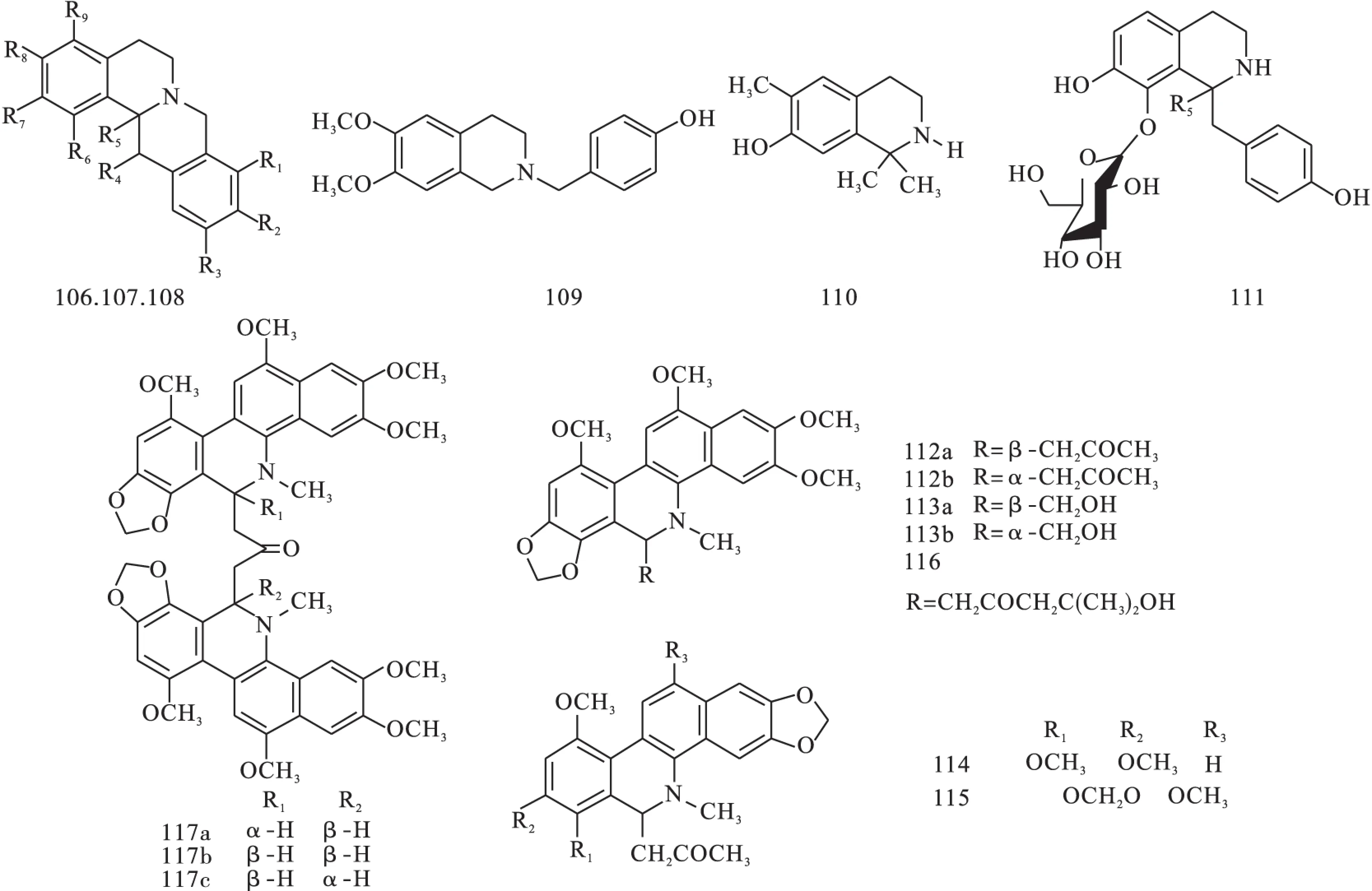
图16 5年内紫堇属植物中发现的新化合物

序号R1R2R3R4R5R6R7R8R9植物来源参考文献106—OH—NO2—OCH3—H—H—NO2—OH—OCH3—HC.saxicolaBunting[4]107—CH2——Hα—CH3β—H—H—OCH3—OH—NO2C.saxicolaBunting[4]108—H—CH2——Hα—H—OH—OCH3—H—HC.govanianaWall[5]109—————————C.dubia[6]110—————————C.humosa[7]111—————————C.humosa[7]112~116—————————Corydayanine,yanhusuineC.yanhusuo[8]
3.3抗病毒活性石生黄堇中的季胺类生物碱去氢碎叶紫堇碱(12)具有抗乙型肝炎病毒的活性,能够抑制乙型肝炎病毒的复制,值得在未来乙型肝炎的治疗中作为参考。去氢碎叶紫堇碱(12)还能够抑制HepG2.2.15细胞中HBsAg和HBeAg的分泌[15]。紫堇属类生物碱对带状疱疹病毒、狂犬病毒也有抑制作用[16]。
3.4镇痛作用扭体法和热板法实验表明,从govanianaWall中分离得到的govaniadine具有镇痛活性,其镇痛活性可能与阿片受体相互作用时COX-2的活性有关[17]。Zhang等[18]发现,dehydrocorybulbine能够有效缓解由热板法引起的小鼠疼痛,其为多巴胺受体拮抗剂,并且其镇痛活性是和D2受体交互作用引起的。dehydrocorybulbine还能够有效缓解炎症疼痛和术后神经性疼痛,并且不会引起耐药性。四氢巴马亭(44)能够缓解由抗肿瘤药物“奥沙利铂”引起的小鼠神经性疼痛,可以用于日后缓解癌症患者服用化学治疗剂时引发的神经性疼痛,减轻患者痛苦[19]。
3.5抗菌作用苦地丁水提物、去氢紫堇碱(13)[20]、黄连碱coptisine、dehydroapocavidine和tetradehy-droscoulerine具有抗菌抗炎功效[21]。从齿瓣延胡索根茎中得到的4种异喹啉类生物碱pseudocop-tisine、glaucine(70)、corydaline(30)和四氢黄连碱tetrahydrocoptisine(49)[22]能够抑制神经氨酸苷酶。产气芽孢梭菌是革兰阳性菌,可以导致食物中毒,而产气芽孢梭菌中的神经氨酸苷酶在细菌增殖中具有重要作用,神经氨酸苷酶也因此被认为是一种新型的药物靶点。
3.6乙酰胆碱酯酶和丁酰胆碱酯酶抑制作用从crispa中得到的13-oxoprotopine(8)、刺罂粟碱stylopine(45)、ochrobirine具有抑制乙酰胆碱酯酶活性[23-24]。从石生黄堇中分离出小檗碱berberine(10)、巴马亭palmatine(14)和sanguinarine等具有较强的抑制乙酰胆碱酯酶活性的作用,构效关系研究表明,生物碱中A环的硝基取代基具有抗乙酰胆碱酯酶的活性[25]。
3.7控制血小板功能异常有研究表明,在该属植物中大量存在的紫堇灵(95)通过减少TNF-α 和TNF-β,在一定的剂量下可以提高坏血病模型小鼠的存活率。因此,紫堇灵有望发展成为一个安全有效的治疗败血症的潜力药物[26]。
3.8心血管方面活性
3.8.1抑制低密度脂蛋白氧化Lee等[27]从turtschaninovii中分离得到的Demethylcorydalmine、isocorydine和刺罂粟碱stylopine(45)能抑制低密度脂蛋白氧化,IC50值分别为2.1、2.4和2.0 μm。该研究表明,一些紫堇属植物可能对于抗LDL氧化具有推动作用,而LDL氧化是动脉粥样硬化和其他心血管疾病形成的一个关键过程。这些生物碱存在抗氧化特性,从而通过直接对ROS和RNS的清除作用来抑制LDL的氧化。
3.8.2抗高血压从小花黄堇中分离出的四氢巴马亭(44)具有抗高血压的活性,通过对自发性高血压小鼠进行静脉注射研究发现,其能使模型小鼠的血浆中肾上腺素减少。可能的机制是通过中枢神经系统来降低自发性高血压小鼠的交感神经紧张[28]。四氢巴马亭(44)具有抗高血压的活性,在大鼠心脏模型中,当四氢巴马亭(44)浓度达到100 μM时,具有降低左心室血压的活性,并且从浓度小于50 μM产生依赖作用。在分离出的心肌细胞中检测到当四氢巴马亭(44)浓度为100 μM时,抑制钙离子内流。有报道,该药物应用于镇痛的过程中有毒副作用,因此,具有潜在心脏病的患者使用紫堇属类药物是不利的[29]。
3.8.3心肌保护作用延胡索具有抗心肌缺血损伤的作用,并且这种作用与其成分四氢巴马亭(44)、脱氢紫堇碱、黄连素和巴马亭(14)有关。其中,四氢巴马亭(44)和脱氢紫堇碱的作用最为显著。前者安全性高,但效能较低;后者安全性低,而效能较高[30]。
3.9其他抗疟原虫作用:Scoulerine具有非常强的抗疟原虫活性,IC50值为5.4 μM[31]。经体外检测,从calliantha中分离出的原阿片碱(1)、tetrahydroprotoberine、cheilanthifoline具有抗疟原虫的活性,可用来抵御野生型(TM4)和多药耐药型(K1)疟原虫、热带疟。cheilanthifoline已经被列为新型抗疟原虫的先导药物[32]。经研究表明,tetrahydroprotoberberine的抗疟原虫活性十分显著,与结构中的甲二氧基有关[33]。
抗惊厥活性:有研究表明,紫堇属类药物苦地丁总碱能明显抑制小鼠的外观行为活动和自发活动;二氢血根碱拮抗去氧麻黄碱的兴奋作用;苦地丁还可致小鼠翻正反射消失;并能加强戊巴比妥钠及水合氯醛对中枢神经系统的抑制作用[34]。四氢巴马亭(44)可以改良由小鼠单次延长应激而引起的焦虑和紧张[35]。
保肝作用:乙酰紫堇灵(96)在降低SGPT同时,还能降低肝脏脂肪蓄积,减轻肝脏病变损害程度,如脂肪变性、肿胀、坏死及炎症浸润[36]。
毒性:小鼠腹腔注射紫堇属类药物苦地丁总生物碱的LD50值为(281.00±27.82)mg/kg[37]。有研究表明,紫堇属类药物苦地丁生物碱达一定剂量时,可导致胎鼠脑露、脑膨出,体重、身长、尾长明显改变,顶骨、顶间骨、枕骨、颈椎骨、肋骨、尾椎骨骨化不全和缺失,活胎数明显降低,死胎数明显增加[38]。
4 构效关系
4.1镇痛活性的构效关系对于镇痛活性的构效关系早有研究,其中原小檗碱型生物碱的镇痛活性最强。结构中C环为芳香环,芳香环上取代羟基的甲氧基、四价氮都能增强原小檗碱型生物碱的镇痛活性。巴马亭(14)和四氢巴马亭(44)具有相似的结构,由于巴马亭(14)中C环为芳香环且具有四价氮,从而降低IC50值,由268 μM降至0.74 μM;而在jatrorrhizine(22)的结构中,2个甲氧基集团取代了dehydrocorydaline(13)中的2个羟基集团,使得jatrorrhizine(22)的IC50为0.62 μm,dehydrocorydaline(13)的IC50为2.08 μm[39]。见图17。
4.2抗菌活性的构效关系原小檗碱型的生物碱的抗菌活性,如疱疹病菌,要强于其他类型的生物碱,而四价氮的存在降低了这种活性,原小檗碱型生物碱C-13上的甲基对其抗菌活性具有重要的影响。如dehydroisoapocavidine(26)和berberine(10)具有相似的化学结构,而相比于berberine(10)而言,dehydroisoapocavidine(26)的C-13具有一个甲基,所以具有潜在的抗菌活性,berberine(10)则不具备这种活性[40]。

图17 抗菌、镇痛、抗癌、抗炎活性构效关系示意图
4.3抗癌活性的构效关系白丽萍等[41]通过对具有抗癌活性的苯菲啶类生物碱血根碱、chelerythrine和nitidine分别与DNA结合的序列特异性研究,得到其抗癌活性构效关系如下:在D环中cheleythrine的9位被甲基取代和nitidine的11位被甲基取代,而血根碱具有亚甲二氧基的结构使其在D环旁形成一个新的环状结构,使血根碱的平面度更高;与CT DNA、poly(dA-dT)等结合度更高,抗癌活性更强。
4.4抗炎活性的构效关系Miyoko等[42]通过X-射线晶体结构分析的方法研究了苦地丁的构象特点:d-苦地丁的环B和环C分别是扭绞半椅式构象和半椅式构象,B环和C环连接方式是反式连接,而dl-苦地丁B环和C环的立体构象是相同的,其B环和C环的顺势连接的方式使得羟基上的氢和N上的孤对电子形成分子内氢键,从而形成了一个6元环结构,d-构型比dl-构型结构更加紧密,抗炎活性更强。
5 临床应用
绝大多数紫堇属类化合物符合先导化合物标准,即如果体内一种紫堇属类化合物具有某种活性,并且没有严重毒性,则证明该化合物在临床上表现相应活性的几率很大,例如:为了收集黄连素体内和体外降血糖、降血脂活性的依据,研究者进行了大量的黄连素在人体中的药动学、安全性和药理学的临床试验[43]。在美国,有关黄连素代谢情况的Ⅱ期、Ⅲ期、Ⅳ期临床试验也在进行。Ⅲ期、Ⅳ期临床试验是在黄连素的脂质相中进行的。黄连素对代谢紊乱、多囊卵巢综合征疗效的Ⅳ期临床试验也在进行。同时,黄连素用于治疗2型糖尿病的Ⅱ期、Ⅲ期临床试验也在进行。还有黄连素治疗非酒精型脂肪肝临床试验也进行到了Ⅱ期。同样,如果其他紫堇属类化合物在体内试验安全可靠、疗效显著也可以进入到临床试验[33]。延胡索甲素是DA-9701质量控制的标志性化合物,是从牵牛子和紫堇属植物配方中提取出的一种促进胃动力的药物,在韩国已经作为一种治疗功能性消化不良的药物进入了临床试验阶段[44]。
6 结语
中药是中华文化的瑰宝,人们从中药中得到很多启发,分离出了很多在临床上疗效显著的天然药物,在亚洲和北美已经发现的紫堇属药物多达400多种。很多紫堇属药物,如延胡索、苦地丁已经广泛应用于人们的日常生活之中。紫堇属植物含有丰富的异喹啉类生物碱,具有抗癌、抗炎、抗菌等多种生物活性。至今为止,多种类型的异喹啉生物碱单体被分离出来,包括原阿片碱、原小檗碱、紫堇灵、四氢黄连碱等。本文对本属植物中异喹啉类生物碱的化学结构、活性成分、药理作用、构效关系、临床应用等方面进行了深入研究,为阐明该属植物的药效物质基础及进一步开发和临床应用提供科学依据。
参考文献:
[1]中国科学院中国植物志编辑委员会.中国植物志[M].北京:科学出版社,1999:106.
[2]郑建芳,秦民坚.紫堇属植物生物碱类化学成分与药理作用[J].国外医药:植物药册,2007,22(2):55-58.
[3]Naveed M,Ram LS,Achyut A.First evidence of the analgesic activity of govaniadine,an alkaloid isolated from Corydalis govaniana Wall[J].Nat Prod Res,2015,29(5):430-437.
[4]Huang QQ,Bi JL,Sun QY.Bioactive Isoquinoline alkaloids from Corydalis saxicola[J].Planta Med,2012,78(1):65-70.
[5]Shrestha RL,Achyut A,Bishnu P,et al.Novel inhibitors of urease from Corydalis govaniana wall[J].Phytochem Letters,2013,6:228-231.
[6]Wangchuk P,Keller PA,Pyne SG,et al.Antimalarial alkaloids from a Bhutanese traditional medicinal plant Corydalis dubia[J].J Ethnopharmacol,2012,143(1):310-313.
[7]Zheng XK,Li DD,Yan H,et al.Two new alkaloids from Corydalis humosa[J].J Asian Nat Prod Res,2013,15(11):1158-1162.
[8]Yang ZY,Liu ZH,Jiang BH,et al.Amb-idalmines AeE and ambidimerine F:bioactive dihydrobenzophenanthridine alkaloids from Corydalis ambiguavar.amurensis[J].Eur J Med Chem,2014,84(12):417-424.
[9]Niu XF,Zhang HL,Li WF.Anti-inflammatory effects of cavidine in vitro and in vivo,a selective cox-2 inhibitor in lps-induced peritoneal macrophages of mouse[J].Inflammation,2014:923-933.
[10]Matsuda H,Tokuoka K,Shiomoto H,et al.Anti-inflammatory activities of dehydrocorydaline isolated from Corydalis tuber[J].Nat Med,1997,51:293-297.
[11]Nam SY,Kim MH,Seo Y,et al.The(2′S,7′S)-O-(2-methylbutanoyl)-columbianetin as a novel allergic rhinitis-control agent[J].Life Sci,2014,98(2):103-112.
[12]OhY C,Choi JG,Lee YS,et al.Tetrahydropalmatine Inhibits pro-inflammatory mediators in lipopolysaccharide-stimulated THP-1 cells[J].J Med Food,2010,13(5):1125-1132.
[13]Xu ZT,Chen XP,Fu S,et al.Dehydrocorydaline inhibits breast cancer cells proliferation by inducing apoptosis in MCF-7 cells[J].Am J Chin Med,2012,40(1):177-185.
[14]Kim YA,Kong CS,Yea SS,et al.Constituents of corydalis heterocarpa and their anti-proliferative effects on human cancer cells[J].Food Chem Toxicol,2010,48(2):722-728.
[15]Zeng FL,Xiang YF,Liang ZR,et al.Anti-hepatitis B virus effects of dehydrocheilanthifoline from Corydalis saxicola[J].Am J Chin Med,2013,41(1):119-130.
[16]Orhana I,Ozcelik B,Karaoqlu T,et al.Antiviral and antimicrobial profiles of selected isoquinoline alkaloids from Fumaria and Corydalis species[J].J Biosci,2007,62(1/2):19-26.
[17]Muhammad N,Shrestha RL,Adhikari A,et al.First evidence of the analgesic activity of govaniadine,an alkaloid isolated from Corydalis govaniana Wall[J].Nat Prod Res,2014,29(5):430-437.
[18]Zhang Y,Wang CR,Wang L.A novel analgesic isolated from a traditional Chinese medicine[J].Curr Biol,2014,24(2):117-123.
[19]Hsu B,Kin KC.Pharmacological study of tetrahydropalmatine and its analogs.A new type of depressant[J].Arch Int Pharmacodyn Therap,1962,139:318-327.
[20]Deng JC,Xiao XH,Li GK,et al.Application of microwave-assisted extraction coupled with high-speed counter-current chromatography for separation and purification of Dehydrocavidine from Corydalis saxicola Bunting[J].Phytochem Anal,2009,20(6):498-502.
[21]Li HL,Zhang WD,Zhang C,et al.Bioavailability and pharmacokinetics of four active alkaloids of traditional Chinese medicine Yanhuanglian in rats following intravenous and oral administration[J].Pharmaceut Biomed Anal,2006,41(4):1342-1346.
[22]Kim JH,Ryu YB,Lee WS,et al.Neuraminidase inhibitory activities of quaternary isoquinoline alkaloids from Corydalis turtschaninovii rhizome[J].Bioorganic Medicinal Chem,2014,22(21):6047-6052.
[23]Yang YY,Liu Q.Virtual screening of novel tetrahydroisoquinoline derivatives as the acetylcholinesterase inhibitor[J].Guangzhou Huagong,2012,140(8):102-105.
[24]Wanqchuk P,Keller PA,Pyne SG,et al.Phytochemical and biological activity studies of the bhutanese medicinal plant Corydalis crispa[J].Nat Prod Commun,2012,7(5):575-580.
[25]Huang QQ,Bi JL,Sun QY,et al.Bioactive isoquinoline alkaloids from Corydalis saxicola[J].Planta Medica,2012,78(1):65-70.
[26]He ZB,Chen P,Peng ZY,et al.Effect of Corynoline Isolated from Corydalis bungeana turcz on Lipopolysaccharides-Induced Sepsis In vivo and In vitro[J].Trop J Pharmaceut Res,2014,13(1):81-86.
[27]Lee JK,Cho JG,Song MC,et al.Isolation of isoquinoline alkaloids from the tuber of Corydalis turtschaninovii and their inhibition activity on low density lipoprotein oxidation[J].Korean Soc Appl Biol Chem,2009,52(6):646-654.
[28]Chu LH,Hsu FL,Chuen FY,et al.Antihypertensive activity of dl-tetrahydropalmatine,an active alkaloid isolated from the tubers of Corydalis racemosa[J].J Chin Chem Soc,1996,43(6):489-492.
[29]Chan P,Chiu WT,Chen YJ,et al.Calcium influx inhibition possible mechanism of the negative effect of tetrahydropalmatine on left ventricular pressure in isolated rat heart[J].Planta Medica,1999,65(4):340-342.
[30]李澎,认钧国,段昌令,等.4种延胡索成分对乳鼠心肌细胞缺氧和过氧化损伤的影响[J].中国中药杂志,2010,1(35):84-87.
[31]Wanqchuk P,Keller PA,Pyne SG,et al.Antimalarial alkaloids from a Bhutanese traditional medicinal plant Corydalis dubia[J].J Ethnopharmacol,2012,143(1):310-313.
[32]Wanqchuk P,Bremner J,Samten B,et al.Antiplasmodial agents from the Bhutanese medicinal plant Corydalis calliantha[J].Phytother Res,2010,24(4):481-485.
[33]Iranshahy M,Quinn RJ,Iranshahi M.Biologically active isoquinoline alkaloids with drug-like properties from the genus Corydalis[J].RSC Advances,2014,4:15900-15913.
[34]杨敬格,袁惠南.苦地丁总生物碱镇静催眠作用的初步观察[J].中药药理与临床,1990,6(2):35-36.
[35]Lee B,Sur B,Yeom M,et al.L-tetrahydropalmatine ameliorates development of anxiety and depression-related symptoms induced by single prolonged stress in rats[J].Biomolec Therapeut,2014,22(3):213-222.
[36]宋修云,俞腾飞,亚文志.蒙药苦地丁的药理作用及临床应用研究概况[J].内蒙古医学院学报,2008,30(6):449-451.
[37]现代中药大辞典[ M ].北京:人民卫生出版社,2005:1289-1290.
[38]于人江,谢根法.苦地丁生物碱对小鼠致畸性的研究[J].癌变·畸变·突变,1997,9(3):159-162.
[39]Xiao HT,Peng J,Liang Y,et al.Acetylcholinesterase inhibitors from corydalis yanhusuo[J].Nat Prod Res,2011,25:1418-1422.
[40]Li HL,Han T,Liu RH,et al.Alkaloids from corydalis saxicola and their anti-hepatitis B virus activity[J].Chem Biodivers,2008,5(5):777-783.
[41]Bai LP,Zhao ZZ,Cai ZW,et al.DNA-binding affinities and sequence selectivity of quaternary benzophenanthridine alkaloids sanguinarinechelerythrine,andnitidine[J].Bioorg Medicinal Chem,2006,(14):5439-5445.
[42]Miyoko K,Yuko N,Jujiro N,et al.Cell adhesion inhibitory activity of (d)-corynoline,ahexahydrobenzo[C] phenanthridine-type alkaloid,and its structure-activity relationship,studied by X-ray crystal structure analysis and molecular docking study[J].Bioorg Medicinal Chem,2015,13:1867-1872.
[43]http://clinicaltrials.gov/ct2/results?term=berberine&Search=Search.
[44]Lee TH,Son MW,Kim SY.Effects of corydaline from corydalis tuber on gastric motor function in an animal model[J].Biol Pharm Bull,2010,33(6):958-962.
收稿日期:2015-09-25
基金项目:国家自然科学基金青年基金项目(81202875)
*通信作者
DOI:10.14053/j.cnki.ppcr.201603030
Research progress on biologically active isoquinoline alkaloids with chemical structures and drug-like properties of genusCorydalis
LIU Lu,WU Li-jun,YANG Chun-juan*
(College of Pharmacy,Harbin Medical University,Harbin 150081,China)
【Abstract】ObjectiveTo summarize the research progress of chemical structures of isoquinoline alkaloids in the genus Corydalis and their bioactivities.MethodsRelated articles of genus Corydalis were analyzed and summarized regarding the chemical structures and bioactivities.ResultsGenus Corydalis was rich in isoquinoline alkaloids.Alkaloids were divided into aporphine,protopine,protoberberine,tetrahydroprotoberberine,benzophenathridine,phthalide-isoquinoline,benzylisoquinoline,spirobenzylisoquinoline,and others according to different chemical structures.Genus Corydalis had various biological properties including anti-inflammatory properties,antiviral activities,antinociceptive activities,antibacterial activities,etc.ConclusionThe article provides theoretical evidence for intensive study and clinical application of genus Corydalis by analyzing their chemical structures and bioactivities.
Key words:Genus Corydalis; Bioactivities; Chemical structures
