正交试验优化霍山米斛总多糖提取工艺
2016-08-15彭代银俞年军汪新宇王飘飘陈卫东何祥林
姚 亮,彭代银,俞年军,汪新宇,王飘飘,陈卫东,何祥林
(1.安徽中医药大学 安徽省中医药科学院中药资源保护与开发研究所,安徽 合肥 230012;2.安徽霍山长冲中药材开发有限公司,安徽 霍山 237266)
正交试验优化霍山米斛总多糖提取工艺
姚亮1,彭代银1,俞年军1,汪新宇1,王飘飘1,陈卫东1,何祥林2
(1.安徽中医药大学安徽省中医药科学院中药资源保护与开发研究所,安徽 合肥230012;2.安徽霍山长冲中药材开发有限公司,安徽 霍山237266)
[摘要]目的建立霍山米斛总多糖的最佳提取工艺。方法依据2015年版《中华人民共和国药典》第一部中铁皮石斛多糖测定方法,通过单因素考察及正交试验研究提取温度、提取次数、提取时间、料液比对霍山米斛总多糖提取率的影响,采用苯酚-硫酸法测定其多糖含量。结果霍山米斛的最佳提取工艺为:提取温度为100 ℃,提取2次,每次提取2 h,料液比为1∶800(g/mL)。结论所优选的工艺简单、方便、准确,适用于霍山米斛总多糖的提取。
[关键词]霍山米斛;总多糖;正交试验;工艺优化
霍山米斛(DendrobiumhuoshanenseenseC. Z. Tang et S. J. Cheng)俗称米斛,为兰科石斛属多年生草本植物,作为安徽省珍稀、名贵、道地中草药,产于大别山区安徽霍山等地。霍山米斛具有益精强阴、生津止渴、补虚羸、除胃中虚火之功效。现有的石斛种类繁多,不同石斛类的总多糖的组成存在差异,不能以相同方法评价不同石斛中总多糖含量。在霍山米斛主要成分中,大家普遍以总多糖含量的高低来评价霍山米斛的优劣。现有研究中,黄森等[1]采用Box-Behnken法优化提取霍山米斛活性多糖,张炜玲等[2]和秦霞等[3]采用响应面法优化霍山米斛多糖提取工艺,魏明等[4]采用超声波协同纤维素酶法提取霍山米斛多糖。以上关于霍山米斛多糖的提取方法比较繁琐,还要进行多糖的纯化,工艺复杂,要求较高,不适合在霍山县当地的农村推广。所以,本研究参照《中华人民共和国药典》中铁皮石斛总多糖的提取方法[5],系统地制定简便、易行的方法来提取霍山米斛的总多糖,采用正交试验方法优化霍山米斛总多糖的提取工艺,为霍山米斛的质量控制提供依据。
1 材料
1.1仪器紫外分光光度计:UV-1600 上海美谱达仪器有限公司;LC-4016型低速离心机:安徽中科中佳科学仪器有限公司;AB135-S型十万分之一天平:梅特勒-托利多仪器(上海)有限公司;BCD-225CHC冰箱:安徽省合肥美菱股份有限公司;KQ-300B型超声波清洗器:江苏省昆山市超声仪器有限公司;双层铁皮电炉:上海日用电炉厂;Milli-Q Gradient A10超纯水系统:密理博(上海)贸易有限公司。
1.2试药霍山米斛于2015年12月采自安徽省霍山县太平畈乡,经安徽中医药大学药学院生药系俞年军教授鉴定为DendrobiumhuoshanenseenseC. Z. Tang et S. J. Cheng。无水葡萄糖(分析级)、苯酚(分析级)、硫酸(分析级)批号分别为20150807、20150603、20141221。其他试剂均为分析级,实验用水均由Milli-Q超纯水机制备。
2 方法与结果
2.1霍山米斛中总多糖含量的测定
2.1.1总多糖含量的测定精密量取供试品溶液1 mL,置10 mL具塞试管中,精密加入5%苯酚溶液1 mL,摇匀,再精密加硫酸5 mL,摇匀,置沸水浴中加热20 min,取出,置冰浴中冷却5 min,以相应试剂为空白,按照紫外-可见分光光度法[5],在488 nm波长处测定吸光度,从标准曲线上读出供试品溶液中无水葡萄糖含量,计算,即得。总多糖提取率=总多糖质量/原药材干品质量×100%。
2.1.2对照品溶液的制备取无水葡萄糖对照品适量,精密称定,加水制成90 μg/mL的溶液,即得。
2.1.3供试品溶液的制备取本品粉末(过3号筛)约0.12 g,精密称定,加水80 mL,加热回流2 h,放冷,转移至100 mL量瓶中,用少量水分次洗涤容器,洗液并入同一量瓶中,加水至刻度,摇匀,滤过,精密量取续滤液2 mL,置15 mL离心管中,精密加入无水乙醇10 mL,摇匀,冷藏1 h,取出,离心20 min,弃去上清液(必要时滤过),沉淀加80%乙醇洗涤2次,每次8 mL,离心,弃去上清液,沉淀加热水溶解,转移至25 mL量瓶中,放冷,加水至刻度,摇匀,即得。
2.1.4检测波长选择分别对未显色霍山米斛总多糖溶液、未显色标准葡萄糖溶液、经苯酚-硫酸法显色后的标准葡萄糖溶液、经苯酚-硫酸法显色后的霍山米斛总多糖溶液,空白溶液在400~800 nm范围内扫描,测定吸收光谱,见图1。参照《中华人民共和国药典》最终确定最佳吸收波长为488 nm。
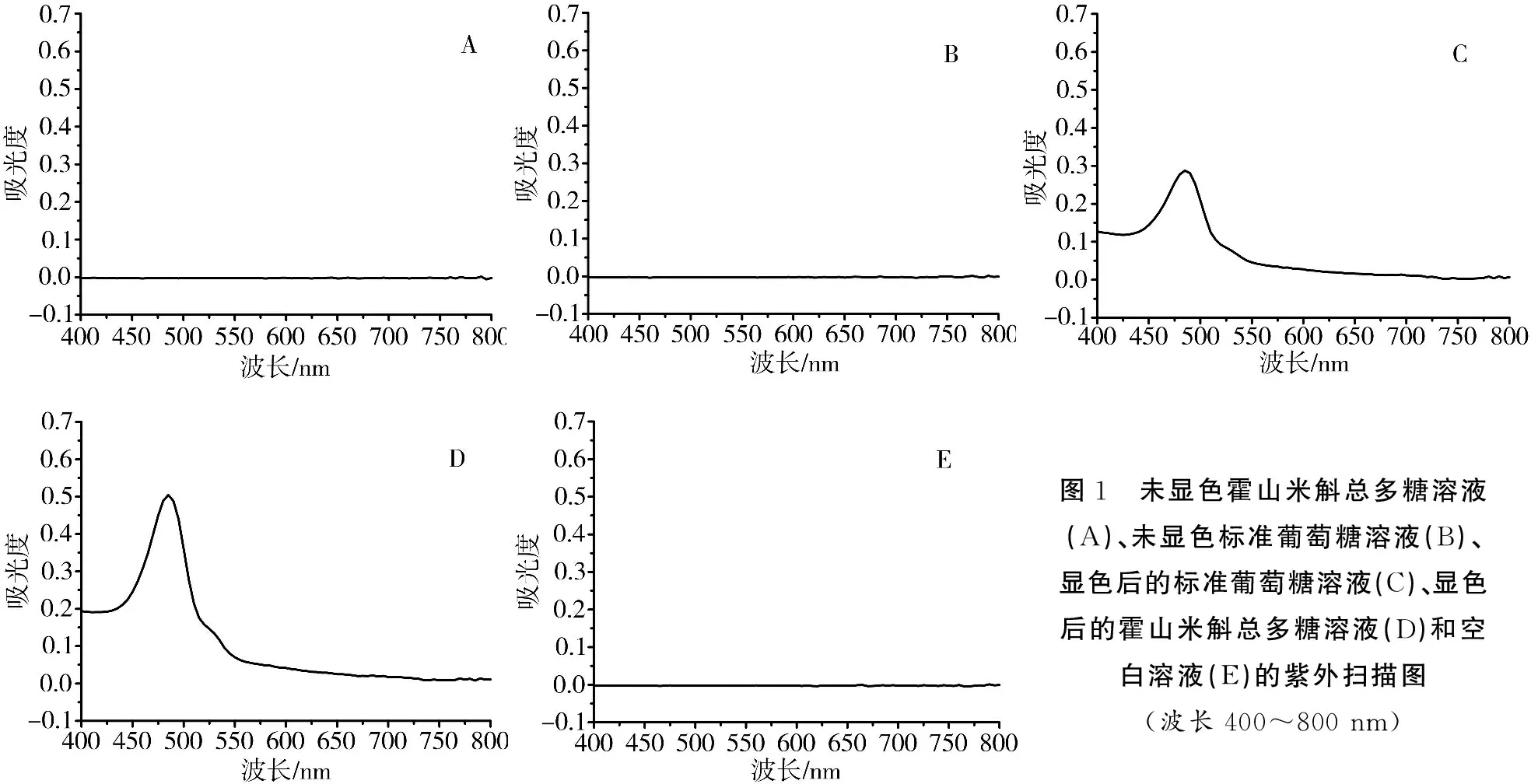
图1 未显色霍山米斛总多糖溶液(A)、未显色标准葡萄糖溶液(B)、显色后的标准葡萄糖溶液(C)、显色后的霍山米斛总多糖溶液(D)和空白溶液(E)的紫外扫描图(波长400~800nm)
2.1.5标准曲线的制备精密量取对照品溶液0.1、0.2、0.4、0.6、0.8、1.0 mL,分别置10 mL具塞试管中,各加水补至1.0 mL,精密加入5%苯酚溶液l mL(临用配制),摇匀,再精密加硫酸5 mL,摇匀,置沸水浴中加热20 min,取出,置冰浴中冷却5 min,以相应试剂为空白,按照紫外-可见分光光度法[5],在488 nm的波长处测定吸光度,以吸光度(A)对葡萄糖浓度(c)进行线性回归,得线性回归方程为:A=0.008 81c+ 0.112 52(R2=0.999 04)。结果表明,葡萄糖浓度在9.106~91.060 μg/mL范围内与吸光度线性范围良好。
2.1.6精密度试验按标准曲线确定的范围内,精密吸取葡萄糖对照品溶液6份,各1 mL,按照“2.1.1”项下操作测定吸光度,计算RSD为2.5%,小于4%,表明精密度良好,符合方法学的要求。
2.1.7稳定性试验在标准曲线确定的范围内,精密吸取“2.1.3”项下制备的供试品1 mL,分别于0、10、20、30、40、50、60 min按照“2.1.1”项下操作测定吸光度,计算其RSD为0.88%,小于4%,表明稳定性良好,符合方法学要求。
2.1.8重复性试验精密称取霍山米斛样品6份,约0.12 g,按“2.1.3”项下制备供试品,按照“2.1.1”项下操作测定含量,计算RSD为0.80%,小于4%,表明重复性良好,符合方法学要求。
2.1.9回收率试验取已知含量的霍山米斛粉末100 mg,精密称定,共6份,按“2.1.3”项下制备的供试品,精密移取1 mL,再加入葡萄糖对照品溶液,含量为25 μg,浓缩定容到1 mL,按照“2.1.1”项下操作测定吸光度,计算加样回收率的范围为88.87%~98.01%,平均加样回收率为93.32%,符合方法学要求。见表1。

表1 加样回收率实验结果(n=6)
2.2霍山米斛提取工艺考察
2.2.1提取温度试验每次取霍山米斛粉末(过三号筛)适量,精密称定,使料液比为1∶667(g/mL),加热回流2 h,提取1次,分别考察在温度70 ℃、80 ℃、90 ℃、100 ℃下总多糖提取率。见表2。结果显示,在提取温度70~100 ℃范围内,多糖提取率随着提取温度的升高而升高,在100 ℃处有最大值,所以单因素考察最佳提取温度为100 ℃。

表2 提取温度对霍山米斛总多糖提取率的影响(n=6)
2.2.2提取时间试验每次取霍山米斛粉末(过3号筛)适量,精密称定,使料液比为1∶667(g/mL),在100 ℃下加热回流,提取1次条件下,分别考察在1、2、3、4 h提取时间下总多糖提取率。见表3。
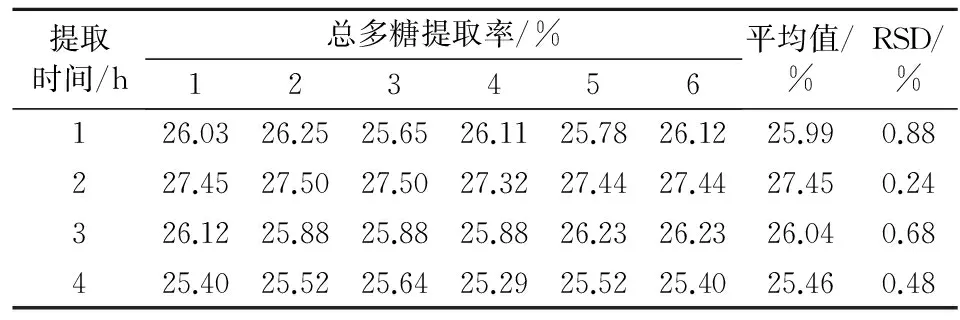
表3 提取时间对霍山米斛总多糖提取率的影响(n=6)
结果显示,提取时间在2 h之内,多糖提取率随着提取时间的增加而显著增加;提取时间在2 h之后,多糖提取率反而随着提取时间的增加而减少;在提取时间为2 h时,多糖提取率达到最大值。所以单因素考察最佳提取时间为2 h。
2.2.3料液比试验每次取霍山米斛粉末(过3号筛)适量,精密称定,在100 ℃下加热回流,提取1次条件下,分别考察料液比为1∶1 000(g/mL)、1∶800(g/mL)、1∶667(g/mL)、1∶571(g/mL)条件下总多糖提取率。见表4。

表4 料液比对霍山米斛总多糖提取率的影响(n=6)
结果显示,当料液比为1∶1 000(g/mL)、1∶800(g/mL)、1∶667(g/mL)时,霍山米斛粉末浸润比较充分,随着霍山米斛粉末增加,多糖提取率逐渐下降,当料液比为1∶571(g/mL)时,总多糖提取率下降最快,可能是由于在2 h内,霍山米斛粉末中浸出的霍山米斛总多糖达到最大值。考虑到总多糖的量便于测定,为减少误差,最终选择1∶800(g/mL)、1∶667(g/mL)、1∶571(g/mL)作为料液比的水平,进行正交试验。
2.2.4提取次数试验每次取霍山米斛粉末(过3号筛)适量,精密称定,使料液比为1∶667(g/mL),在100 ℃下加热回流2 h,分别考察在提取1次、2次、3次、4次条件下总多糖提取率。见表5。
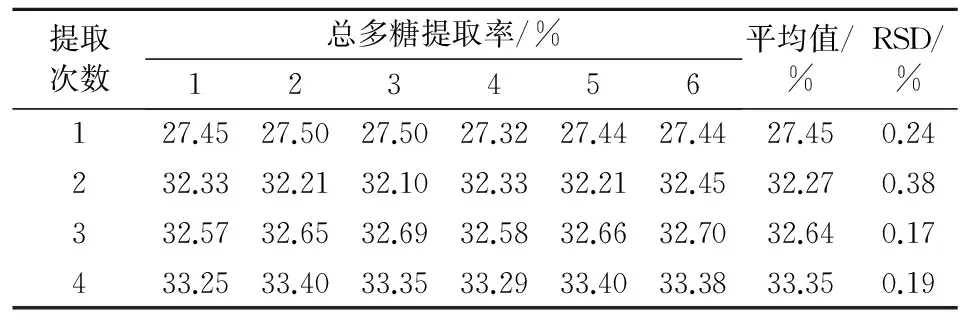
表5 提取次数对霍山米斛总多糖提取率的影响(n=6)
结果显示,多糖提取率随着提取次数的增加而增加,在提取次数大于2次时,多糖提取率增加比较缓慢,可能是霍山米斛中总多糖的量已经接近提取完全,考虑到能源的消耗和产率的关系,在正交表中,最终选择提取1、2、3次作为水平进行正交试验。
2.2.5正交试验依据单因素实验结果,以影响因素较大的料液比(A)、提取温度(B)、提取时间(C)、提取次数(D)为因素,选用L9(34)正交表进行正交实验,进而得到霍山米斛总多糖加热回流提取的最优条件。见表6。
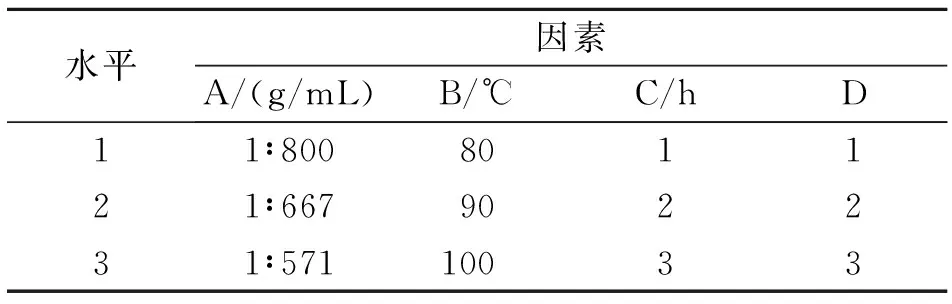
表6 正交试验因素水平表
2.2.6正交试验结果由直观分析可得,影响霍山米斛总多糖提取率的因素从高至低依次是D、C、A、B,最佳工艺的组合为A1B3C2D3。以均方最小的B因素为误差项进行方差分析,结果显示D因素对霍山米斛多糖提取工艺具有显著性影响,结合生产实际与成本考虑,选择提取的最优组合为A1B3C2D2,即料液比为1∶800(g/mL),提取温度为100 ℃,提取时间为2 h,提取次数为2次。见表7、表8。
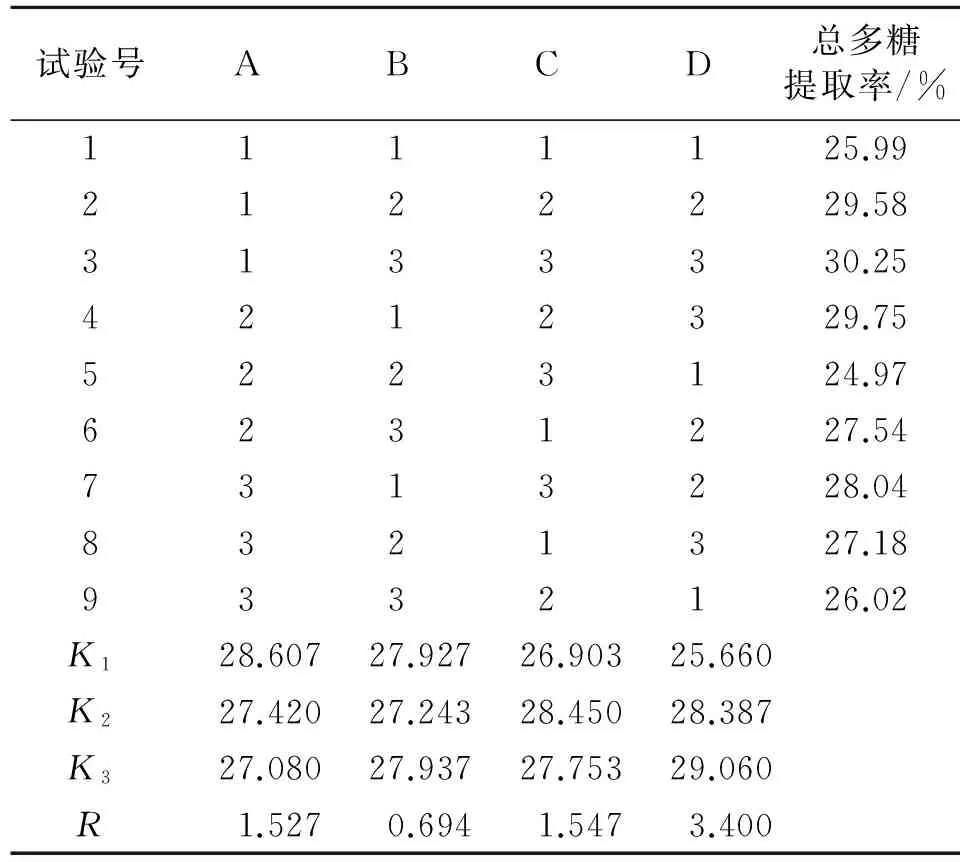
表7 正交试验结果

表8 正交试验的方差分析结果
注:F0.05(2,2)=19。
2.2.7验证试验依照最优条件提取霍山米斛总多糖,并重复平行3次加热回流提取实验,计算最优条件下回流提取得到的霍山米斛总多糖的提取率。结果从100.31、100.21、100.06 mg的霍山米斛粉末测得的米斛总多糖提取率分别为35.88%、36.23%、35.91%,平均提取率为36.01%,表明最佳提取工艺合理、可靠、可行。
3 讨论
多聚糖简称为多糖,常有100个以上甚至几千个单糖基通过糖苷键连接而成。其性质随单糖数目的增多,差别也越来越大。研究[6]表明,植物多糖具有多种药理活性,具有增强免疫功能、抗肿瘤、抗氧化、延缓衰老、降低血糖、降低血脂等作用[6]。作为安徽道地药材,霍山米斛多糖的药理活性已被大量证实。霍山米斛作为安徽霍山县的支柱产业,在评价其优劣时多以石斛中总多糖的含量为指标进行考察。现在多糖提取方法主要有碱提取法、酸提取法,超滤法、超临界流体萃取技术、水提醇沉法等[7-13],大量研究旨在提高霍山米斛的多糖提取率,其提取工艺越来越复杂,仪器越来越特殊,不适合推广,所以本研究选择经典的加热回流法来提取霍山米斛的总多糖。
本研究发现,影响霍山米斛总多糖提取率的因素从大到小依次是提取次数、提取时间、料液比、提取温度,综合其他影响因素,得出最佳的提取工艺,即提取温度为100 ℃,提取2次,每次提取2 h,料液比为1∶800(g/mL)。
霍山米斛经过加热回流法提取,最后采用苯酚-硫酸法测定霍山米斛中总多糖含量。该方法具有简单、易行的特点,适用于霍山米斛质量的评价。
参考文献:
[1]黄森,查学强,罗建平,等.Box-Behnken法优化提取霍山米斛活性多糖的研究[J].中药材,2007,30(5):591-594.
[2]张炜玲,王新生,戴亚峰,等.响应面法优化霍山米斛多糖提取工艺[J].安徽农业科学,2012,40(12):7061-7064.
[3]秦霞,董海丽,刘红.响应面法优化霍山米斛多糖超声提取工艺[J]. 安徽农业科学,2012,40(12):7065-7066.
[4]魏明,邵平,姚红,等.超声波协同纤维素酶法提取霍山米斛多糖的研究[J].食品工业科技,2009,30(3):199-201.
[5]国家药典委员会.中华人民共和国药典:一部[M].北京:中国医药科技出版社,2015:803-804.
[6]张锦雀,黄丽英,苏聪枚.中草药多糖提取分离纯化研究进展[J].中药材,2008,31(11):1760-1765.
[7]王宏云,李铭.石斛多糖提取加工新技术的应用现状[J].中国中医药现代远程教育,2014,12(13):160.
[8]袁清霞,赵龙岩,李子娇,等.酸法提取仙人掌多糖工艺[J].食品研究与开发,2012,33(3):42-46.
[9]齐善厚.樟芝多糖的超滤分离及其免疫活性研究[J].现代食品科技,2012,28(12):1672-1674.
[10]刘鸿铖.人参有效成分超临界萃取法提取与纯化的研究[D].长春:吉林农业大学,2014:1-30.
[11]黄晓君,聂少平,王玉婷,等.铁皮石斛多糖提取工艺优化及其成分分析[J].食品科学,2013,34(22):21-26.
[12]王培培,鲁芹飞,陈建南,等.正交试验法优化铁皮石斛多糖的提取工艺[J].时珍国医国药,2012,23(11):2781-2782.
[13]岑忠用,苏江,梁冠兴.热水浸提法提取铁皮石斛原球茎多糖的工艺[J].湖北农业科学,2011,50(18):3807-3810.
作者简介:姚亮(1990-),男,硕士研究生
通信作者:彭代银,pengdy@ahtcm.edu.cn
[中图分类号]R284.2[DOI]10.3969/j.issn.2095-7246.2016.04.023
基金项目:安徽省科技厅2015年公益性技术应用研究联动计划项目(1501ld04006);安徽高校科研创新平台团队等项目(皖教秘科〔2015〕49号);安徽道地中药材品质提升协同创新中心项目(皖教科〔2013〕2号)
(收稿日期:2016-04-12;编辑:姚实林)
Optimization of Extraction Process for Total Polysaccharides fromDendrobiumhuoshanenseby Orthogonal Test
YAOLiang1,PENGDai-yin1,YUNian-jun1,WANGXin-yu1,WANGPiao-piao1,CHENWei-dong1,HEXiang-lin2
(1.AnhuiUniversityofChineseMedicine&InstituteofTraditionalChineseMedicineResourcesProtectionandDevelopment,AnhuiAcademyofChineseMedicine,AnhuiHefei230012,China; 2.HuoshanChangchongChineseMedicineDevelopmentCo.,Ltd.,AnhuiHuoshan237266,China)
[Abstract]ObjectiveTo investigate the optimal extraction process for total polysaccharides from Dendrobium huoshanense. MethodsBased on the determination of polysaccharides in Dendrobium officinale in the 2015 edition of Pharmacopoeia of The People’s Republic of China, the single-factor study and orthogonal test were performed to investigate the influence of extraction temperature, times of extraction, extraction duration, and solid/liquid ratio on the extraction rate of total polysaccharides from Dendrobium huoshanense. The phenol-sulfuric acid method was used to measure the content of polysaccharides. ResultsThe optimal extraction process was an extraction temperature of 100 ℃, two times of extraction, a duration of 2 hours for each extraction, and a solid/liquid ratio of 1∶800 (g/mL). ConclusionThis process is simple, convenient, accurate, and applicable to the extraction of total polysaccharides from Dendrobium huoshanense.
[Key words]Dendrobium huoshanense; Total polysaccharides; Orthogonal test; Process optimization
