五羟色胺对体外培养山羊黄体细胞增殖的影响
2016-08-15范艳乐马菊红李国红雷琦敬殷玉鹏赵善廷陈树林
杨 焕,张 华,陈 炯,范艳乐,马菊红,李国红,雷琦敬,殷玉鹏,赵善廷, 陈树林*
(1.西北农林科技大学动物医学院,陕西杨凌 712100;2.莱商银行,山东莱芜 271100)
五羟色胺对体外培养山羊黄体细胞增殖的影响
杨焕1,张华2,陈炯1,范艳乐1,马菊红1,李国红1,雷琦敬1,殷玉鹏1,赵善廷1, 陈树林1*
(1.西北农林科技大学动物医学院,陕西杨凌 712100;2.莱商银行,山东莱芜 271100)
摘要:为了探讨5-羟色胺(5-HT)与山羊黄体细胞的生长是否存在密切的关联性,揭示其在黄体发育中的生物学作用,采用胶原酶Ⅱ消化法获得原代山羊黄体细胞并用催产素(OT)染色对细胞进行鉴定,四甲基偶氮唑蓝(MTT)比色法测定不同浓度5-HT对山羊黄体细胞的影响,免疫组织化学染色法(SP法)检测山羊黄体细胞中增殖细胞核抗原(PCNA)蛋白的表达。MTT法结果显示,5-HT对山羊黄体细胞的增殖起到促进作用,促增殖的浓度范围在10-8mol/L~10-4mol/L,浓度越高,促增殖作用越明显。免疫组织化学染色法证实,5-HT能够使山羊黄体细胞中PCNA蛋白的表达增多。结果提示,5-HT可能是通过促进PCNA蛋白的表达来实现对山羊黄体细胞的促增殖作用。5-HT在黄体发生、发展过程中发挥的重要作用及相关分子机制的初步揭示都为生殖内分泌系统的研究奠定了理论基础。
关键词:山羊黄体细胞;5-羟色胺;细胞增殖;增殖细胞核抗原
五羟色胺(5-hydroxytryptamine,5-HT)是一种吲哚衍生物,由色氨酸转化而来,分子式为C10H12N2O。在中枢神经系统中,松果体、下丘脑和中脑附近会产生大量5-HT[1];分布于消化道内的嗜铬细胞主要负责5-HT的合成,此外部分肥大细胞也会产生少量游离的5-HT[2-3]。作为内源性神经递质,它与体温调节、镇痛疼痛、性活动、焦虑睡眠以及精神疾病等相关,借助信号激活传递、神经功能发挥生物学效应[4-7]。
黄体形成于哺乳动物排卵后,由2种不同类型的细胞分化而成,以分泌孕酮为主,也分泌少量雌激素[8],通过调节子宫内膜的变化来适应受精卵的着床和妊娠的早期维持,其生理功能的正常与否对生殖周期的更替起到重要的作用[9-11]。陈树林等通过大量的研究证实黄体组织中存在一定数量的弥散性神经内分泌细胞,并阐述了其共同的细胞标志物在黄体中的分布特点,这些细胞标志物主要有神经特异性烯醇化酶(neuron specific enolase,NSE)、S-100蛋白(S-100 protein)、5-羟色胺(5-hydroxytryptamine,5-HT)和突触素(synaptophysin,SYP)。它们随着黄体的发生、发展和退化而出现规律性的变化。综合分析判断,这些标志物与黄体的发育必定有密切的关系[12-13]。本文拟在细胞培养水平上研究5-HT对山羊黄体细胞增殖的影响,为黄体的发育及成熟后发挥生物学效应的机理提供理论依据。
1 材料与方法
1.1材料
1.1.1试验用动物健康且性成熟的雌性奶山羊10只,购自杨凌姚南养殖场。
1.1.2主要仪器与试剂DMEM-F12培养基,Gibcobrl公司产品;胎牛血清(FBS),Hyclone公司产品;MTT、二甲基亚砜(dimethgl sulphoxide,DMSO)、5-HT,Sigma公司产品;OT单克隆抗体,武汉博士德生物工程有限公司产品;增殖细胞核抗原(proliferating cell nuclear antigen,PCNA)多克隆抗体,Dako公司产品;SP二抗试剂盒,北京康为世纪生物科技有限公司产品;RT-2100C 酶联免疫检测仪,Rayto产品;超净工作室(SW-CT-IF),苏州安泰空气技术有限公司产品;CO2恒温培养箱,日本三洋工业株式会社产品;Moticam5000图像信号采集与分析系统,麦克奥迪实业集团公司产品。
1.2方法
1.2.1山羊黄体细胞的分离、体外培养与鉴定采用颈部放血法处理性成熟雌性奶山羊,并取出卵巢保证无菌,投入预先冷置的PBS液中,将卵巢表面血渍洗涤干净,放入预冷的生理盐水中,用冰瓶带回实验室。于超净工作台内,从冰瓶中取出采集的新鲜卵巢,置于盛有无菌PBS液的培养皿中,用镊子小心钝性分离外层的卵巢膜,分离黄体组织,放入青霉素小瓶中(已事先加入少量PBS液),小心剪碎,移入已灭菌离心管中,加入少量PBS液小心清洗,静置沉淀,弃去上清液,加入2 g/L胶原酶Ⅱ溶液,密封管口,于37 ℃水浴恒温箱中消化40 min,100 mL/L胎牛血清DMEM-F12完全培养液终止消化后细胞计数,调整细胞数目在4×105个/mL~5×105个/mL之间,吸取适量细胞悬液于无菌培养皿中,于37 ℃恒温培养箱中过夜培养,待细胞充分贴壁,传代培养观察,并采用OT染色鉴定细胞。
1.2.25- HT诱导山羊黄体细胞增殖试验用胰酶消化法处理传至第2代的细胞并用血细胞计数板计数,通过添加完全培养基对细胞数目进行调整,将调整好的细胞悬液用移液器移入96孔板,控制接种密度大约为2×103个细胞/100μL/孔,培养24 h后,弃旧培养基后换成DMEM-F12无血清培养基持续培养12 h后,分别用含有10-4mol/L~10-9mol/L递减浓度的5-HT培养液再做更换作为细胞处理组。细胞未处理组加入DMEM-F12无血清培养液,置37 ℃恒温培养箱中持续培养观察4个时间点,分别是24、48、72、96 h。每个待测培养孔移入MTT溶液总量为20μL,于37 ℃恒温培养箱持续孵育4 h,吸弃孔内剩余培养液后,小心避光加入150 μL二甲基亚砜(DMSO),置于摇床缓慢振荡10 min后,立即检测吸光度值。
1.2.3免疫组化试验在24孔培养板中放置盖玻片,并事先在板孔中央滴1滴PBS溶液(通过液体表面张力牢固固定盖玻片)。每孔接种细胞3×104个左右,加入含 mL/L胎牛血清的DMEM-F12完全培养液0.5 mL,置37 ℃恒温培养箱中持续培养24 h后,换成含10-4mol/L~10-6mol/L 3个不同浓度的5-HT培养液,细胞未处理组为DMEM-F12无血清培养液。置37 ℃恒温培养箱中持续培养24、48、72 h后用镊子取出细胞玻片,PBS液充分冲洗后,40 g/L多聚甲醛溶液处理30 min,再用PBS液充分冲洗;1 g/L TritonX-100覆盖细胞浸润20 min,用PBS液冲洗,滴加内源性过氧化物酶封闭液,室温孵育12 min,PBS液冲洗,滴加正常羊血清工作液,室温孵育12 min;滴加1∶400稀释处理过的PCNA一抗,放入湿盒中4 ℃过夜。PBS液冲洗,滴加生物素标记的二抗,室温孵育12 min,PBS液冲洗,滴加HRP标记的链霉亲和素,室温孵育12 min,PBS液冲洗,滴加DAB显色工作液,达到最佳显色时间后用蒸馏水冲洗终止显色。正常兔血清是一抗的替代对照,PBS缓冲液是二抗的空白对照。
1.2.4图像分析于显微镜下观察采集5个~8个视野图,保存图样后载入采集分析系统,计数阳性细胞数,并检测平均灰度值。平均灰度值的高低代表图像透光率的高低,一共分成256级,最亮为256级,最黑为0级。平均灰度值高对应染色浅和蛋白表达量低;反之,平均灰度值低则对应阳性细胞数目多和蛋白阳性表达强。

2 结果
2.1山羊黄体细胞的培养与鉴定
胶原酶Ⅱ消化法培养原代山羊黄体细胞,可见黄体细胞贴壁伸展生长,多呈狭长梭边形、椭圆形,少数出现多边形。采用免疫组织化学染色法鉴定原代培养的细胞类型,结果显示,原代培养细胞的细胞质出现强烈的OT阳性表达,可以确定所培养的细胞为山羊黄体细胞(图1)。

A.阴性对照;B.OT阳性细胞
2.25-HT诱导山羊黄体细胞增殖试验
分别用含有10-4mol/L~10-9mol/L递减浓度的5-HT培养液更换旧培养液培养山羊黄体细胞。细胞处理组和细胞未处理组对比的结果显示,细胞处理组(10-4mol/L~10-8mol/L组)组间OD值差异性显著(P<0.05),表明5-HT对山羊黄体细胞的增殖在效应浓度内起到促进作用,并随着浓度的增加促增殖作用逐渐加强。然而10-4mol/L 与10-5mol/L 两个浓度组间的OD值差异性不显著,10-9mol/L浓度组对山羊黄体细胞的促增殖无明显作用(图2)。
2.35-HT对体外培养黄体细胞PCNA表达的影响
细胞未处理组和细胞处理组均为PCNA蛋白细胞核阳性染色(图3)通过计数阳性细胞,检测平均灰度值得出,细胞处理组的PCNA蛋白表达量显著高于细胞未处理组(P<0.05),表明细胞处理组可能通过促进PCNA蛋白的表达进而影响山羊黄体细胞的增殖(表1)。
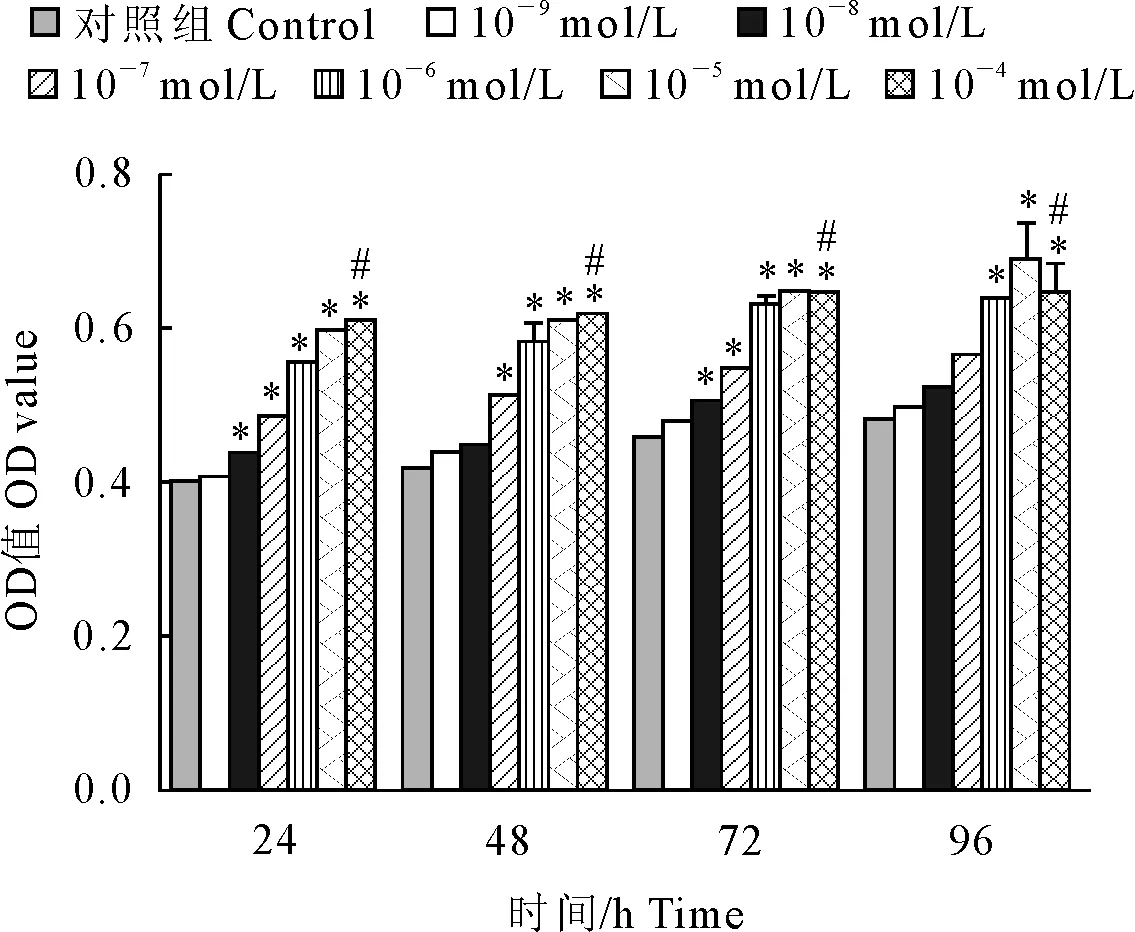
与对照组比较,*P<0.01;10-5mol/L组与10-4mol/L组比较,#P>0.05
Compared with control group,*P<0.01 ;10-5mol/L compared with 10-4mol/L,#P>0.05
图2不同浓度5-HT对山羊黄体细胞增殖的影响
Fig.2The effects of 5-HT concentrations on proliferation of goat corpus luteal cells

A.对照组;B.5-HT组(10-5 mol/L)

组别Groups24h阳性细胞数/mm2Positivecellnumber平均灰度值Averagegrayvalue48h阳性细胞数/mm2Positivecellnumber平均灰度值Averagegrayvalue72h阳性细胞数/mm2Positivecellnumber平均灰度值Averagegrayvalue对照组Control203±37221.2±7.7218±29207.3±10.6246±40195.2±5.810-6mol/L257±31a190.4±6.2a270±48a187.4±5.8a293±22a154.7±4.6a10-5mol/L278±27ab176.1±8.2ab292±29ab165.1±9.3ab313±34ab136.2±8.5ab10-4mol/L286±41abc170±4.3abc290±66abc168.5±6.9abc329±29abc129.8±7.7abc
注:a.与对照组比较,P<0.05;b.与10-6mol/L 组比较,P<0.01;c.与10-5mol/L 组比较,P>0.05。
Note:a.Compared with control group,P<0.05;b.Compared with 10-6mol/L,P<0.01;c.Compared with 10-5mol/L,P>0.05.
3 讨论
5-HT是一种首先从人的血清中发现的活性肽类,也是一种单胺类神经递质。已有研究在大鼠证实[14]5-HT在有效浓度范围内能引起体外培养血管平滑肌细胞和成纤维细胞的增殖,5-HT的促增殖作用表现为随其浓度的升高而加强,但5-HT对于山羊黄体细胞体外生长影响的研究情况尚未报道。陈树林等[12-13]研究证实山羊黄体细胞中存在5-HT的表达。本研究采用体外细胞培养技术,通过添加不同浓度的5-HT来观察其对山羊黄体细胞增殖的影响。
本研究采用MTT法检测细胞增殖情况,初步得出5-HT对于山羊黄体细胞生长增殖的影响规律。细胞处理组与细胞未处理组相比,处理组的OD值明显高于未处理组数值,表明5-HT具有促增殖效应,并随其浓度梯度的升高而增强,在10-8mol/L~10-4mol/L的浓度范围内具有显著性,但10-4mol/L与10-5mol/L 两个浓度组间的OD值差异性不显著,可以推出10-5mol/L浓度组对山羊黄体细胞的促增殖作用产生阻滞效应。
PCNA高表达于快速增殖细胞的细胞核中。参与细胞DNA的合成,并且启动细胞分裂增殖[14-15]。有学者研究表明,PCNA蛋白的表达主要发生在细胞周期的G1期和S期,在M期和静止期其表达水平较低[16]。本研究结果显示,对照组与各试验组中PCNA蛋白均成细胞核阳性染色。与对照组相比,5-HT不同浓度试验组染色结果阳性较强,灰度值分析PCNA蛋白相对表达量较高,提示不同浓度的5-HT组与山羊黄体细胞的PCNA蛋白的表达存在关联。
综合以上研究结果,能够初步证明在离体培养的山羊黄体细胞中加入10-8mol/L~10-4mol/L浓度范围的5-HT后,显著促进细胞增殖,外源性加入10-6mol/L~10-4mol/L的5-HT,能显著增加PCNA蛋白的表达量。此试验结果在一定程度上表明,外源性加入不同浓度5-HT有助于山羊黄体细胞的增殖,这可能是通过与PCNA蛋白的表达进程和水平建立了联系,促使山羊黄体细胞的增殖周期由G1期向S期转化来实现的,但其涉及的分子机制还不明确,需要深入研究。
参考文献:
[1]Devall A J,Santos J M,Fry J P.Elevation of brain all opregnanolone rather than 5-HT release by short term,low dose fluoxetine treatment prevents the estrous cycle-linked increase in stress sensitivity in female rats[J].Science,2015,25(1):113-123.
[2]Bhattarai J P,Roa J,Herbison A E.Serotonin acts through 5-HT1 and 5-HT2 receptors to exert biphasic actions on GnRH neuron excitability in the mouse[J].Endocrinology,2014,155(2):513-524.
[3]Goel N,Innala L,Viau V.Sex differences in serotonin (5-HT) 1A receptor regulation of HPA axis and dorsal raphe responses to acute restraint[J].Science,2014,40(6):232-241.
[4]陈文玉,操高原,欧可群,等.大鼠松果体内含5-羟色胺、血管活性肠多肤及P物质纤维的免疫组化观察[J].解剖学杂志,1996,19(3):213-216.
[5]高振平,宋玉良,阎明鉴,等.成人脑干中缝外区5-羟色胺细胞的分布[J].白求恩医科大学学报,1994,20(1):23.
[6]张华,彭贵成,翁嘉颖.大鼠海马内5-羟色胺免疫组化阳性纤维及终末的分布[J].重庆医科大学学报,1994,19(4):282-286.
[7]陈耀星,滑静,杨佐君,等.5 -羟色胺样神经元在下丘脑的分布-PAP法研究[J].中国兽医学报,1998,18(2):172- 174.
[8]刘杰,顾竹影.5-羟色胺信号系统与肠易激综合征[J].国际消化病杂志,2008,28(5):368-369.
[9]宋清,张晓文,张绒.5-羟色胺受体及亚型的研究现状[J].甘肃医药,2010,29(1):1-4.
[10]景明来,张晓金.黄体分泌孕酮的分子调控机制[J].现代中西医结合杂志,2007,16(7):1005-1008.
[11]卿素珠,陈树林,沈霞芬.发情周期中奶山羊下丘脑-垂体-卵巢轴催产素的免疫组化的定位[J].中国兽医学报,2003,23(3):300-302.
[12]陈树林,蒋田园,雷治海,等.山羊黄体弥散性神经内分泌细胞的分布[J].畜牧兽医学报,2007,39(9):16-19.
[13]陈树林,段会娟,张宝,等.弥散性神经内分泌细胞标志物在妊娠期山羊黄体细胞中的共存[J].西北农林科技大学学报:自然科学版,2009,37(1):22-28.
[14]宋景春,黄国明,涂晓文,等.五羟色胺诱导肺动脉平滑肌细胞增殖的作用与机制研究[J].中国现代医学杂志,2009,19(2):199-202.
[15]Seuwen K,Magnaldo I,Pouyssegyr J.Serotonin stimulates DNA synthesis in fibroblasts acting through 5-HTlB receptors coupled to a Gi.protein[J].Nature,1988,335:254-256.
[16] Liu J,Cui Z S,Luo Y,et al.Experimental research of cyclin G2 inhibitory effect on gastric carcinoma cell[J].Chin J Mod Med,2007,17(1):36-43.
收稿日期:2016-03-09
基金项目:国家自然科学基金项目(30972151)
作者简介:杨焕(1989-),女,新疆乌鲁木齐人,硕士,主要从事动物免疫内分泌调控研究。*通讯作者
中图分类号:Q813.11
文献标识码:A
文章编号:1007-5038(2016)07-0053-05
Effect of Serotonin on Proliferation in Cultured Goat's Luteal Cellsinvitro
YANG Huan1,ZHANG Hua2,CHEN Jiong1,FAN Yan-le1,MA Ju-hong1,LI Guo-hong1,LEI Qi-jing1,YIN Yu-peng1,ZHAO Shan-ting1,CHEN Shu-lin1
(1.CollegeofVeterinaryMedicine,NorthwestA&FUniversity,Yangling,Shaanxi,712100,China;2.LayCommercialBank,Laiwu,Shandong,271100,China)
Abstract:The purpose of this study was to investigate that whether there is a close correlation between serotonin (5-HT) and the growth of goat luteal cells and to reveal the 5-HT in the corpus luteum of the biological effects of developing.In this study,the primary culture goat corpus luteal cells were obtained by collagenaseⅡ digestion and identified with OT immunostaining.The effect was studied using MTT assay and immunohistochemical staining assay-SP to obtain goat luteal cells PCNA protein.MTT assay showed that,5-HT on the proliferation of goat luteal cells play a role in promoting the proliferation in the concentration range of 10-8-10-4mol/L,the higher the concentration,the more obvious proliferation.Immunohistochemical staining confirmed that 5-HT enables goat luteal cells expressing PCNA protein increased.The results showed that 5-HT may be by promoting the expression of PCNA protein to achieve the effect of promoting proliferation of goat luteal cells.5-HT occurs in the corpus luteum,plays an important role in the development process and the initial revealing the molecular mechanisms associated reproductive endocrine system,and provides a theoretical basis.
Key words:goat corpus luteum cell; 5-hydroxytryptamine; proliferation; proliferating cell nuclear antigen
