原发性骨髓纤维化的MRI诊断
2016-08-15张亚杰于泽洋
张亚杰 于泽洋
原发性骨髓纤维化的MRI诊断
张亚杰于泽洋
目的总结原发性骨髓纤维化(PMF)的MRI影像学特点及探讨其临床应用价值。方法对2009年5月至2014年9月25例经骨髓活检确诊的原发性骨髓纤维化患者的MRI影像进行回顾性分析,观察重点是腰椎椎体、髂骨、股骨、肝脏、脾脏等器官的信号改变,归纳影像学表现,同时将骨髓活检纤维化分级与骨骼系统改变对照。结果25例中,15例腰椎、髂骨、股骨段T1WI 、T2WI 表现为明显均匀弥漫的低信号灶;10例表现为等信号背景多发局限性更低信号区。8例股骨上段信号与腰椎呈等强度低信号。脾肿大20例,其中巨脾10例,脾梗死5例;肝脏肿大18例;继发性门脉高压改变10例;腹水8例。肝脏T2WI信号明显降低,铁过载15例,骨髓纤维化分级越高,骨骼系统表现越明显。结论MRI扫描能显示PMF在腹部脏器及骨髓等方面的影像学特点,对临床诊断及鉴别诊断具有明显价值。
原发性,骨髓纤维化;核磁共振
原发性骨髓纤维化(primary myelofibrosis,PMF)是由于骨髓造血干细胞功能紊乱,同时纤维组织在骨髓内大量异常增殖沉积的慢性血液系统疾病,临床出现为贫血、外周血中出现未成熟粒细胞及幼红细胞、门静脉高压、骨硬化等表现[1-4]。既往,临床工作中诊断原发性骨髓纤维化的常用方法是骨髓穿刺及骨髓活检,文献报道多以普通X线研究为主,鲜有MRI研究报道。由于高场强MRI能敏感的反映骨髓的生理性分布及病理学异常,尤其对骨髓病变导致的骨髓化学成分改变十分敏感,无创而全面的显示骨髓病变情况,本文探讨PMF的MRI影像学特点,旨在为临床工作提供有价值的信息。
1 资料与方法
1.1一般资料收集2009年5月至2014年9月开滦总医院血液科住院并确诊的35例PMF患者的影像学资料,具有完善MRI资料25例,其中男17例,女8例;年龄42~79岁,平均年龄69.3岁;病程7 d~12年,病程平均15个月。患者均有头晕、乏力,食欲不振,体重下降等症状。患者入院原因包括贫血原因待查13例,肝、脾肿大7例,上消化道出血5例,5例曾误诊为原发性肝硬化,其中1例误诊时间最长5年。所有25例患者住院期间全部进行骨穿检查,其中干抽14例,未成功11例。择期行骨盆髂前上棘骨髓活检,标本常规石蜡包埋、常规染色及特殊嗜银染色。25例显示骨髓增生度明显降低,各系造血细胞及脂肪细胞明显减少,局部消失,骨小梁异常增粗。网状纤维嗜银染色检查,依据欧洲骨髓纤维化分级共识标准[5]分级。MF-0:散在线性网状纤维,无交叉;MF-1:疏松网状纤维伴有很多交叉,主要在血管周围;MF-2:弥漫且浓密网状纤维增多伴广泛交叉,仅有局灶性胶原纤维或局灶性骨硬化;MF-3:弥漫且浓密网状纤维增多伴广泛交叉,有粗胶原纤维束,伴有显著骨硬化。全部病例经临床会诊排除继发性骨髓纤维化。
1.2检查方法MRI采用美国GE公司Signa HDxt 1.5T超导核磁共振成像系统扫描,常规腹、盆部及脊柱线圈,轴位横断、矢状及冠状扫描,T1WI(TR 400 ms,TE 20 ms);T2WI(TR 3 500 ms,TE 90 ms),256×256,脂肪抑制序列采用STIR序列,层厚5 mm,间距1 mm。以脊髓信号为标准,各椎体信号分为高、等、低信号。回顾性分析患者的MRI影像学资料,观察目标主要包括中轴骨骼系统及腹部脏器。骨骼系统包括腰椎椎体、髂骨、股骨上段骨髓信号改变;腹部器官包括:肝脏、脾脏等脏器改变。所有图像由2名副主任医师独立分析,结果不一致时讨论商榷分析完成。
2 结果
2.1骨髓信号改变以脊髓信号为标准,正常椎体呈T1WI为较高信号,T2WI呈中等或略低信号,脂肪抑制序列呈低信号。(1)腰椎椎体表现为T1WI、T2WI明显均匀弥漫的低信号灶15例;(2)腰椎椎体等信号背景多发点、片状更低信号区10例;(3)腰椎椎体边缘梭形T1WI等信号、T2WI略高信号髓外造血组织5例。髂骨表现:髂骨骨髓腔T1WI、T2WI弥漫低信号16例。股骨上段表现:股骨中上段信号与腰椎呈等强度低信号14例。见图1~4。
2.2MRI表现与骨髓活检纤维化分级对照MRI表
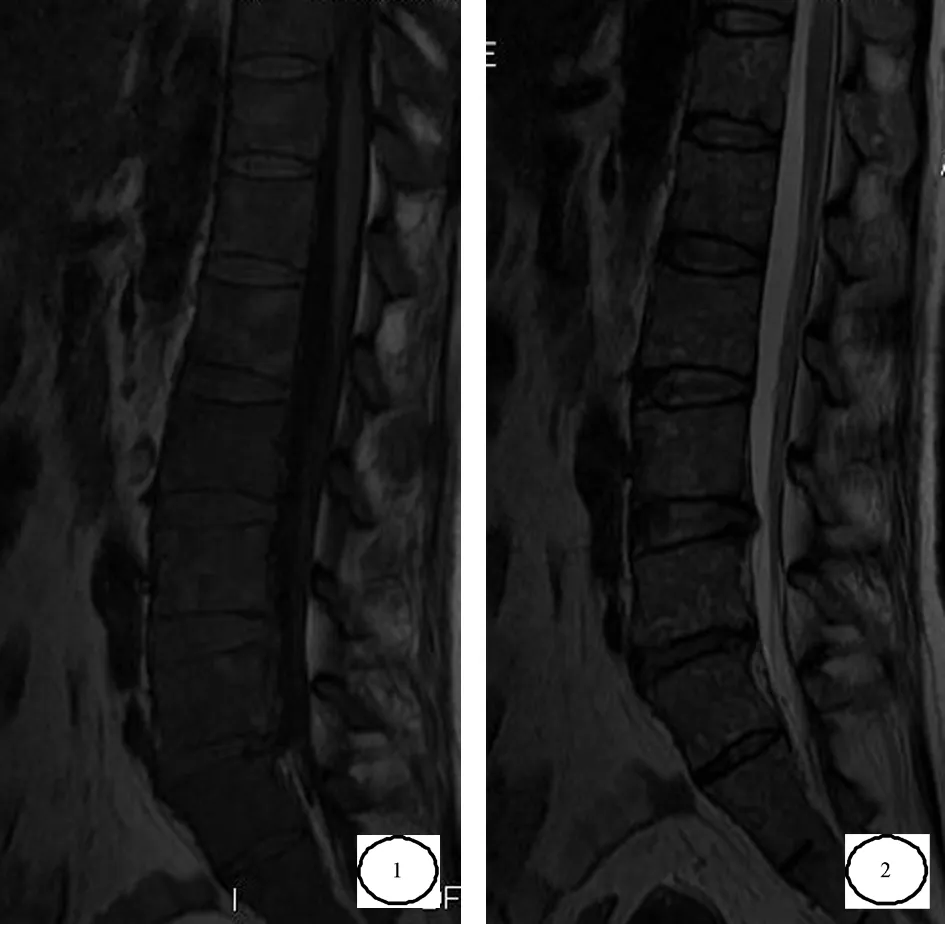

图1 SE序列,腰椎椎体纤维化组织T1WI明显弥漫的低信号灶 图2 SE序列,椎体纤维化组织T2WI均匀弥漫的低信号灶
现与骨髓纤维化分级有明显相关性,骨髓纤维化分级越高,骨骼系统表现越明显,对照关系见表1。


图3 SE序列,双侧股骨上段纤维化T1WI多发局限性低信号灶 图4 SE序列,双侧股骨上段纤维化T2WI明显低信号灶
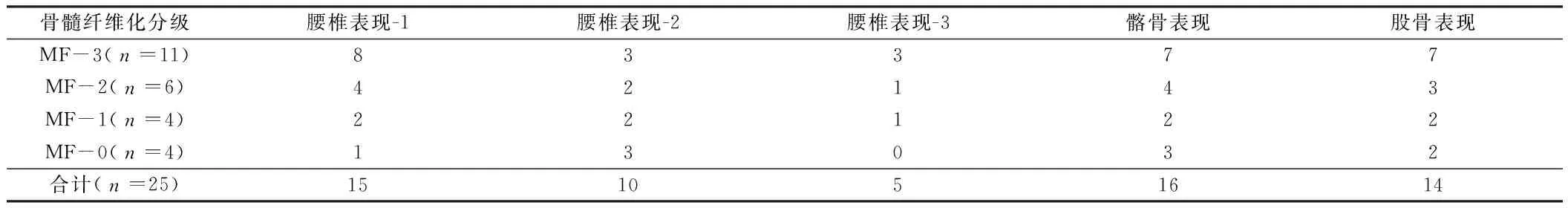
表1 MRI表现与骨髓活检纤维化分级对照 例
2.3腹部脏器改变全部25例病例中,脾肿大23例,其中巨脾15例,并发局限性脾梗死5例;肝肿大18例;继发门脉高压改变(脾静脉增粗,门静脉增粗,食管下段静脉曲张)10例;腹水8例。肝脏铁过载15例。见图5、6。
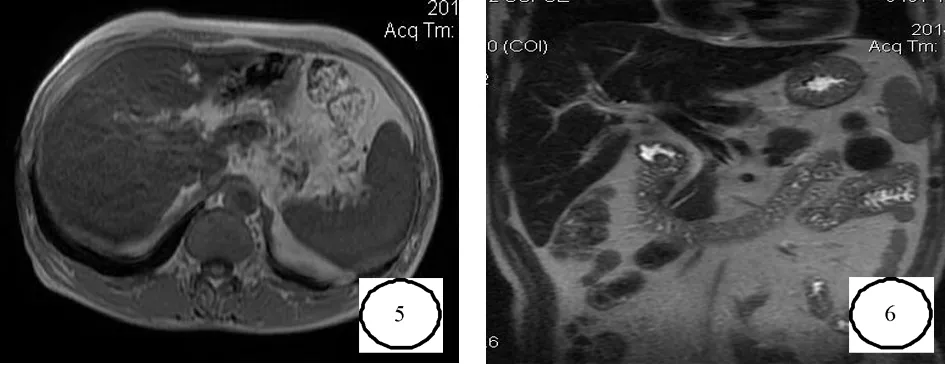

图5 化学位移成像,铁过载:同相位肝脏信号弥漫减低 图6 铁过载:肝脏冠状T2WI信号弥漫明显降低
3 讨论
骨髓纤维化(myelofibrosis,MF)是指骨髓造血组织被纤维组织代替,继而出现造血功能减退等相关临床症状。临床工作中,常分为有明确病因的继发性骨髓纤维化(secondary myelofibrosis,SMF)和病因不明的PMF两类,后者可能与基因突变或是细胞遗传有关。国内外公认的将PMF归类于慢性骨髓克隆增殖性疾病,骨髓过度增殖与纤维组织增生,原纤维细胞的分裂和增殖[6,7]伴随大量成骨细胞增殖,最终导致骨髓纤维化及骨硬化。
PMF分为纤维化前期、纤维化期、骨硬化期3期,各期病程长短不一,界限不明显,纤维化前期临床症状轻微,影像学改变无明显特征。纤维化期及骨硬化期患者出现明显临床症状及相关影像学表现。正常骨髓广泛分布于松质骨内,扁骨、不规则骨及长管近段,如胸腰椎、骨盆及股骨近段等。MRI能清晰且敏感的显示正常骨髓分布及病变情况,正常黄骨髓表现为T1WI高、T2WI等信号;富含造血功能的红骨髓呈T1WI低、T2WI低或中等信号,MRI检查能清晰显示红、黄骨髓转换等骨髓改变[8]。伴随着骨髓纤维化进展,早期纤维化组织代替正常骨髓组织,骨髓内可见T1WI、T2WI弥漫性或灶性减低区,临床骨髓穿刺发生干抽现象。股骨上段及肱骨近段骨髓组织丰富,骨髓内纤维化成分出现略晚于中轴骨,不同部位纤维化程度不同步。晚期骨质硬化阶段,CT能显示松质骨内骨小梁磨玻璃样密度增高,最终阶段,传统X线平片才能显示长管状骨髓腔变窄,脊柱椎体及骨盆等中轴骨骨小梁增粗,广泛骨质密度增高,致密坚硬骨质导致骨穿失败。
PMF病变发生骨髓,髓外系统受累常发生于消化系统。由于正常骨髓造血功能持续降低,机体发生代偿性髓外造血,最常见的部位是脾脏、肝脏,其他少见部位包括肾上腺、脑膜、肠道、胸膜、脊柱旁组织等,淋巴结较少见[9,10]。早期脾脏缓慢肿大,数年后下缘达盆腔呈巨脾,巨脾容易并发脾梗死,患者出现剧烈左侧腹痛,MRI检查表现为T2WI脾脏边缘楔形异常高信号区,尖端指向脾门,增强扫描无强化,梗死范围巨大时,偶尔发生脾破裂。PMF累及肝脏,表现为肝脏增大,肝脏信号不均匀;脾脏肿大的高血流量导致门静脉系统高动力血液循环,门静脉扩张,脾静脉迂曲,发生食管、胃底静脉曲张破裂,临床出现呕血伴随肝功能失代偿表现,临床极易误诊为肝硬化。本组病例首诊误诊肝硬化发生率为20%(5/25),与文献报道PMF患者造成肝脾肿大合并门脉高压者约为17%~35%[11]相符。发生于脊柱旁的髓外造血表现为后纵隔胸腰椎旁梭形软组织肿块,病变边缘光滑,常对称分布,无分叶,MRI呈T1WI等信号、T2WI稍高信号,增强扫描病灶明显均匀强化[12]。PMF患者病史较长,中、重度贫血常常造成心肌损害,表现为心影明显增大。临床治疗期间,依靠反复输血改善患者的贫血状况,外源性红细胞代谢后生成的大量的血红蛋白,血红蛋白降解后,大量外源性铁在体内过度蓄积。肝脏是人体内最大储铁器官,机体内铁元素失衡,发生铁过载,超过70%的铁沉积于肝脏网状内皮细胞内[13]。肝脏内铁以铁蛋白和含铁血黄素的形式存在,两种物质为顺磁性物质,质子纵向弛豫时间明显缩短,MRI表现为T2WI信号明显降低,质子纵向弛豫率(1/T2)与肝脏铁含量呈线性关系,对肝脏铁含量进行量化研究[14,15]作为驱铁治疗的依据及疗效判定的有效手段。
除了PMF以外,多种疾病可以造成SMF,常见于骨髓增生性疾病、急-慢性白血病、恶性肿瘤终末期、骨髓瘤、淋巴瘤及慢性肾功能不全等患者,临床工组中除了密切结合病史及骨髓活检加以鉴别外,MRI也可以在鉴别诊断中提供有价值的参考。正常成人黄骨髓MRI表现为T1WI稍高信号、T2WI等信号。急性白血病、地中海贫血等骨髓增生等疾病表现为T1WI 信号均匀降低,T2WI呈等信号。多发性骨髓瘤是浆细胞异常增生的恶性肿瘤,除骨髓信号改变外,骨骼系统内可见多发灶性溶骨性破坏及软组织肿物,常发生于骨髓组织丰富的扁骨及不规则骨。再生障碍性贫血的是骨髓造血功能低下而引起全血细胞减少,骨髓内脂肪成分增多,表现为T1WI高或混杂信号、T2WI 等信号。肝硬化合并门脉高压与PMF肝脾改变相似,肝硬化影像学表现为肝脏变形,局部萎缩伴有明显的再生结节,PMF累及肝脏少见再生结节;继发明显的门脉高压改变,但脾脏少出现巨脾;临床多有明确的肝硬化病因;肝硬化很少造成髓外造血及骨髓信号改变。
PMF确诊还是以骨髓穿刺及骨髓活检为主,疾病发展的纤维化前期及纤维化期持续数年,纤维化发生的程度不一致,病灶在全身骨髓组织内分布不均匀,特别是纤维化前期患者很难有典型影像学表现,早期肝脏、脾脏等实质器官改变不典型。特征性影像学表现还需在今后工作中不断积累总结。腰椎及骨盆等松质骨出现骨髓信号明显减低伴肝脾改变时,提示临床早期骨髓活检明确诊断。
1Swerdlow SH,Campo E,Harris NL,et al.WHO classification of tumours of haematopoietic and lymphoid tissues.International Agency for Research on Cancer.Lyon,2008,35:1320-1323.
2张桂新,冯四洲.原发性骨髓纤维化的治疗进展.国外医学输血及血液学分册,2004,27: 261-264.
3宋英儒,黄仲奎,龙莉玲,等.原发性骨髓纤维化腰椎和骨盆的MR和X线诊断探索.中华放射学杂志,2002,36:633-636.
4刘爱宁,陈辉树,刘恩彬,等.161例慢性特发性骨髓纤维化临床病例分期的探讨.中华血液学杂志,2006,27:178-182.
5中华医学会血液学分会白血病淋巴瘤学组, 原发性骨髓纤维化诊断与治疗中国专家共识(2015年版).中华血液学杂志,2015,36:721-724.
6陈灏珠主编.内科学.第5版.北京:人民卫生出版社,1996.604-605.
7黄铮人.原发性骨髓纤维化39例临床分析.临床血液学杂志,2008,21:227-229.
8Lewis S,Wainscoat JS,Moore NR,et al.Magnetic resonance imaging in mylodysplastic syndromes.Br J Rodiol,1995,68:121-127.
9于春鹏,王劲,张建,等.骨髓纤维化并肝脾内瘤样髓外造血组织影像学表现(附2例报告并文献复习).实用放射学杂志,2009,25:45-46.
10张雪哲,李子勋,刘钟生.原发性骨髓纤维化9(附5例报告).实用放射学杂志,1989,5:34-35.
11刘玉兰,肖文斌,张国艳,等.骨髓纤维化与门脉高压的研究.北京医学,2000,22:267-269.
12吴伟本,俞同福.胸内脊柱旁髓外造血的影像表现.中国临床医学影像杂志,2013,24:595-597.
13龚旭波,张晓红,卢兴国,等.原发性骨髓纤维化早期患者骨髓形态学特征研究.中华血液学杂志,2012,33:25-30.
14肖志坚.重视骨髓增生异常综合征铁过载的诊断和治疗.中华血液学杂志,2011,32:390-393.
15宋晓丽,赵俊功,程英升.MRI评价肝脏铁过载的应用进展.世界华人消化杂志,2012,20:1933-1938.
2016-04-10)
10.3969/j.issn.1002-7386.2016.15.020
063000河北省唐山市,华北理工大学附属开滦总医院影像科(张亚杰);河北省唐山市第二医院(于泽阳)
R 445.2
A
1002-7386(2016)15-2309-03
项目来源:河北省科技厅计划外项目(编号:2015-9-3-25)
