四种能源草中黄酮类物质的定性研究*
2016-08-13杨立贵孙永明孔晓英李连华刘姝娜董鹏宇袁振宏中国科学院广州能源研究所广州510640中国科学院可再生能源重点实验室广州510640广东省新能源和可再生能源研究开发与应用重点实验室广州510640中国科学院大学北京100049
杨立贵,孙永明,孔晓英,李连华,刘姝娜,董鹏宇,袁振宏(1. 中国科学院广州能源研究所,广州 510640;2. 中国科学院可再生能源重点实验室,广州 510640;3. 广东省新能源和可再生能源研究开发与应用重点实验室,广州 510640;4. 中国科学院大学,北京 100049)
四种能源草中黄酮类物质的定性研究*
杨立贵1,2,3,4,孙永明1,2,3†,孔晓英1,2,3,李连华1,2,3,刘姝娜1,2,3,董鹏宇1,2,3,4,袁振宏1,2,3
(1. 中国科学院广州能源研究所,广州 510640;2. 中国科学院可再生能源重点实验室,广州 510640;3. 广东省新能源和可再生能源研究开发与应用重点实验室,广州 510640;4. 中国科学院大学,北京 100049)
本文对杂交狼尾草、柳枝稷、芦竹及象草这4种能源草的整株、茎和叶中的黄酮类物质总量进行了定量分析,并利用高效液相色谱质谱联用技术对黄酮物质种类进行定性分析。对整株分析的结果表明,柳枝稷的总黄酮含量最高,达到6.84 mg当量槲皮素/g干重,比芦竹、杂交狼尾草和象草分别高出59.8%、20.1%和11.2%。能源草的不同部位黄酮分布存在差异,叶中黄酮含量是茎的2.3 ~ 3.0倍。杂交狼尾草叶中含量最高,为10.55 mg当量槲皮素/g干重。定性分析发现,4种能源草的提取物中共含有14种黄酮苷和2种黄酮醇,包括槲皮苷、异鼠李素和槲皮素。该研究结果可为能源草作为天然产物提取原料提供理论支持。
能源草;液质联用;黄酮苷;黄酮醇;总黄酮含量
0 引 言
能源草因其高生物量、高光合效率等特点,已成为制备生物燃气、液体燃料、成型燃料等生物质能源的重要生产原料[1-4]。为提高能源草能源转化过程中的经济效益,寻找能源草中高附加值产品成为目前的研究热点。草本植物中含有大量天然产物,如普利醇、生育酚、黄酮类化合物[5]、金丝桃苷、槲皮苷[6]、烷基间苯二酚[7]、脂肪酸、豆甾醇等[8]。其中黄酮类化合物在草本植物中存在较为普遍,具有抗菌、抗炎症、抗过敏、抗血栓的作用,能有效预防癌症和心血管疾病[9-12]。在能源作物合欢(Albizia julibrissin)中含有6.1 g/kg干重的金丝桃苷和9.0 g/kg干重的槲皮苷[10]。草本能源植物柳枝稷
1 材料与方法
1.1原料
杂交狼尾草、柳枝稷,2015年5月取于广州增城实验基地。
芦竹,2015年5月取于华南农业大学湿地公园。
象草,2015年5月取于华南理工大学科技园。
1.2实验试剂
槲皮素、槲皮苷、异槲皮素、金丝桃苷、异鼠李素、木犀草素购自阿拉丁生化科技股份有限公司(Aladdin, China);没食子酸、Folin-Ciocalteu试剂购自Sigma(US);甲醇、甲酸为色谱纯, NaNO2、NaOH、AlCl3·6H2O、Na2CO3为分析纯。
1.3样品处理
样品干燥粉碎后过40目筛。称取5 g过筛后样品于 250 mL 圆底烧瓶中,加入 60%甲醇水溶液100 mL,在80℃条件下加热30 min,冷却后真空抽滤。滤渣重复提取3次,合并滤液,减压浓缩并回收溶剂,浸膏经石油醚萃取两次后冷冻干燥得到提取物,在4℃条件下密封保存。
1.4分析检测
1.4.1总酚含量测定(total phenolic content, TPC)
总酚含量根据福林-酚法测定[14]。将10 mg提取物样品溶于1 mL去离子水,取100 μL该溶液加1.0 mL Folin-Ciocatteu 试剂(10%),室温条件下反应5 min后加入1.0 mL 饱和Na2CO3水溶液混合反应90 min,765 nm波长下用酶标仪(Biotek,Eon)测其吸光度。用浓度范围为10 ~ 600 μg/mL的没食子酸作标准曲线,结果换算成mg当量没食子酸/g干重(mg gallic acid equivalent per g dry weight, mg GAE/g)。
1.4.2总黄酮含量测定(total flavonoid content, TFC)
总黄酮含量根据氯化铝比色法测定[14]。将10 mg提取物充分溶于1 mL去离子水,取250 μL 该溶液加1.25 mL 去离子水稀释,之后加入75 μL NaNO2水溶液(5%),反应5 min后加150 μL AlCl3水溶液(10%),5 min 后加入500 μL NaOH水溶液(1 mol/L)和 275 μL去离子水。用酶标仪(Biotek, Eon)测510 nm 波长下的吸光度。用浓度范围在 0.1 ~80 μg/mL的槲皮素作标准曲线,结果换算成mg 当量槲皮素/g干重(mg quercetin equivalent per g dry weight, mg QE/g)。
1.4.3LC-MS 条件
取提取物0.1 g,加入2 mL去离子水充分溶解。离心分离后上清液过0.22 μm滤膜。LC-MS检测:Agilent 1290-6540B,Agilent RRHD SB-C18(2.1 mm × 50 mm,填料粒径1.8 μm),溶剂A为0.1%蚁酸,B为甲醇。梯度洗脱,A∶B从98∶2经10 min到70∶30维持5 min后,再经10 min到40∶60维持5 min,流速0.55 mL/min,进样量5 μL。DAD检测器,210 ~ 800 nm 扫描检测。MS条件为正模式,ESI离子源,300℃的N2干燥,流速10 mL/min,压力2.1 × 105Pa(30 psi)。
2 结果与讨论
2.1总黄酮(TFC)和总酚含量(TPC)
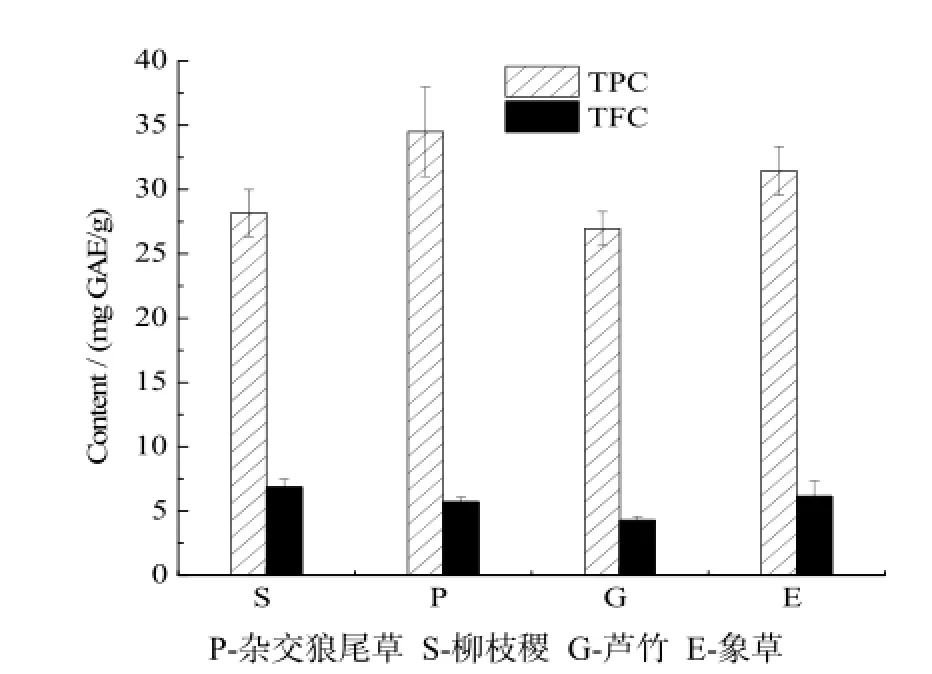
图1 四种能源草整株的总酚和总黄酮含量Fig. 1 TPC and TFC of four energy grasses
杂交狼尾草、柳枝稷、芦竹和象草的TPC和TFC见图1。4种能源草中,杂交狼尾草TPC最高,达到34.50 mg GAE/g,分别比芦竹和柳枝稷高出28.0% 和22.4%。与杂交狼尾草同属的象草TPC为31.44 mg GAE/g,可见,狼尾草属狼尾草拥有较高的TPC。柳枝稷中总TFC最高,达到6.84 mg QE/g,比芦竹高59.8%,象草和杂交狼尾草的TFC分别为6.15 mg QE/g和5.70 mg QE/g。与常见果蔬相比,桑葚中TPC最高为8.3 mg GAE/g,TFC最高为0.9 mg QE/g[15],是柳枝稷TFC的13.2%。芦笋、甘蓝TPC分别为10 ~ 12 mg GAE/g和2 ~ 4 mg GAE/g,为杂交狼尾草的 10% ~ 30%。其中芦笋中黄酮含量为 4 mg QE/g,比芦竹的含量少[16]。综上分析,狼尾草属植物(象草和杂交狼尾草)的TPC要高于稷属和芦竹属。相对芦笋、甘蓝这类蔬菜,能源草中黄酮含量更高,从中提取黄酮具有较好的开发潜力。
杂交狼尾草、象草和芦竹三种草茎叶比大,在使用过程中易于分离,可以对茎和叶分开提取。研究发现,叶比茎中的总黄酮含量高(图 2)。杂交狼尾草叶中的总黄酮含量最高,达到10.55 mg QE/g,比茎中总黄酮含量高 41.9%。芦竹和象草叶比茎中黄酮含量分别高129.6%和201.6%。综合以上数据可知,黄酮类物质一般分布在能源草叶中。相关研究报道指出,黄酮主要分布在植物的叶和果实中[17-20],与本实验结果一致。基于这一结果,在应用中可以对茎和叶分开加工提取,以提高设备效率。
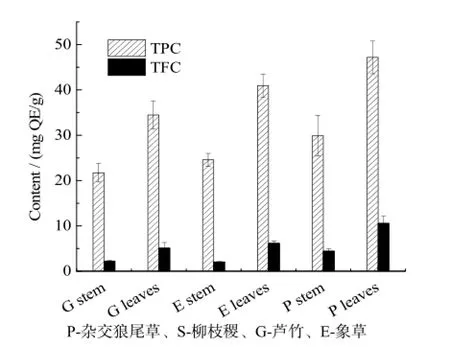
图2 能源草茎和叶中TPC和TFCFig. 2 TPC and TFC in the stems and leaves of grasses
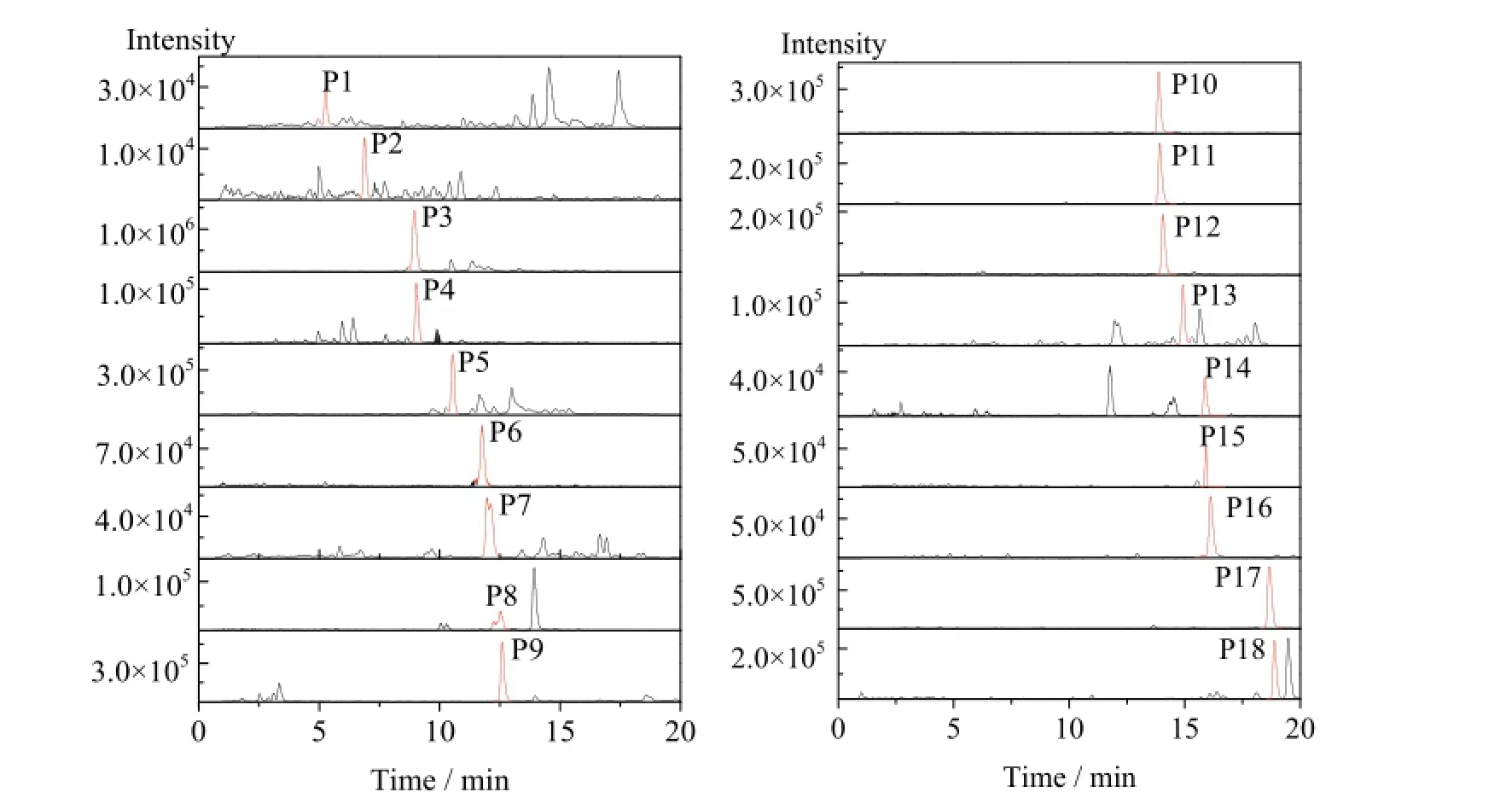
图 3 四种能源草提取物中 [M+H]+单离子流图Fig. 3 Single ion chromatograms of protonated molecules [M+H]+of flavonoids containing in the extract obtained from four energy grasses
2.2黄酮物质的鉴定
在植物中,黄酮一般与单糖或双糖结合,以黄酮苷的形式存在。根据质谱工作的原理,一级质谱用于分析目标成分的分子量,二级质谱会将目标成分解离,根据各个离子的大小和丰度来推断分子的结构。以黄酮糖苷为例,在获得高能离子后,糖苷键最容易发生断裂。在断裂过程中,苷元携带电荷,可以被检测器检测到,因此可以直接推断苷元的成分。而糖分子以中性形式存在,不能根据检测结果直接呈现。但是可以根据目标分子的分子量和苷元离子的质量之间的差异推断糖分子的种类。通常,132是戊糖、146是脱氧己糖、162是己糖、248是丙二酰己糖、308是脱氧二己糖[21-22]。糖分子的个数一般通过特征离子碎片的个数判断。在正离子模式下,利用HPLC-ESI-TOF-MS从杂交狼尾草、柳枝稷、芦竹和象草4种能源草提取物中共检测到18种成分(图 3)。根据样品的MS、MS/MS、紫外吸收等数据,结合标准品对其进行分析,结果如下。
P2、P3、P8、P11、P16在303 m/z处有特征离子峰(图4a)。在低质量区m/z 137、153、165、229、257处都有离子碎片分布。P8在260和370有最大的紫外吸收峰。质谱的图谱和最大紫外吸收波长都与槲皮素标准物质的质谱图吻合(图 4b)。由此可见,m/z 303为质子化的槲皮素。
P11的[M+H]+为449,与苷元离子质量相差146(图4d),故P11分子中有一个脱氧己糖分子。从色谱出峰时间来看,P11和槲皮苷标准品有相同的色谱停留时间。根据上述推论,可以确定P11为槲皮苷(槲皮素-3-O-鼠李糖苷)。P3的分子量为611,主要离子碎片在m/z 465和m/z 303处(图4c),三个离子间的质量差分别为146和162。当碰撞能由10 V增加到20 V,m/z 465离子丰度减少,而m/z 303离子丰度增加。由此可见,P3中含有一个脱氧己糖和一个己糖,且为脱氧己糖在末端的双糖单取代物质。结合文献数据[13],P3初步判定为芦丁(槲皮素-3-O-芸香糖苷)。
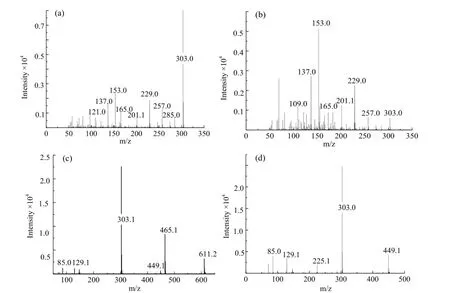
图4 检测到的样品的全扫描质谱图:(a)m/z 303;(b)槲皮素标样;(c)m/z 611;(d)m/z 449Fig. 4 Full scan TOF MS/MS spectrum of several compounds: (a) m/z 303; (b) quercetin; (c) m/z 611; (d) m/z449
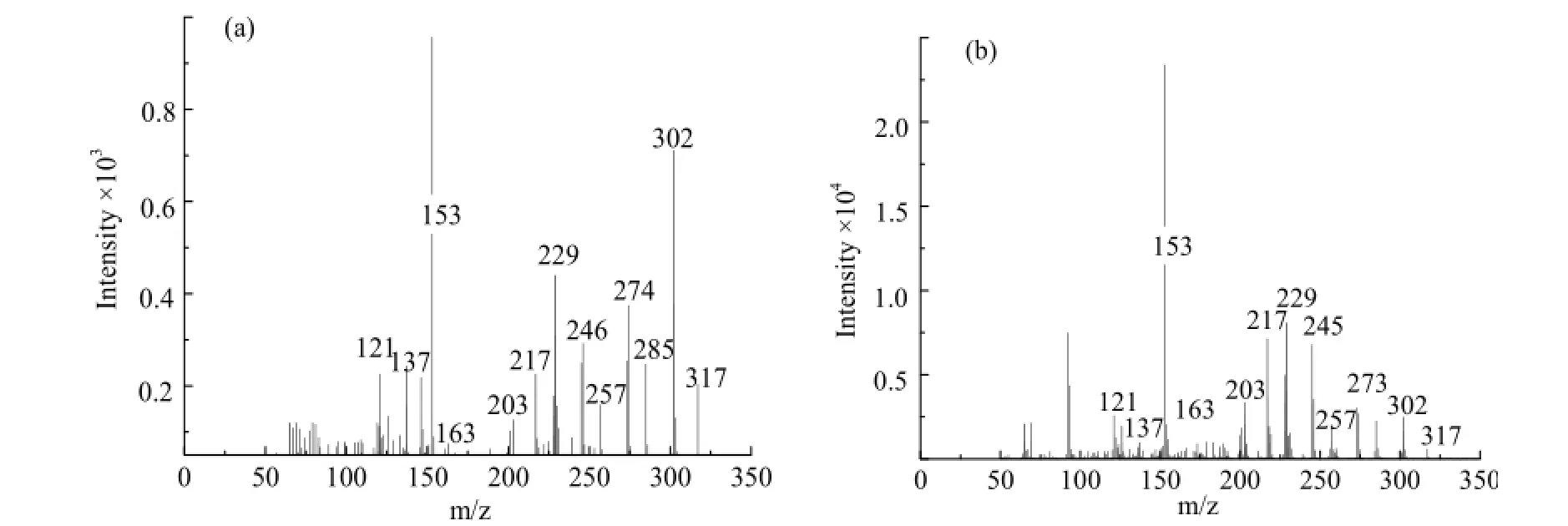
图5 检测到的样品的全扫描质谱图:(a)m/z 317;(b)异鼠李素标样Fig. 5 Full scan TOF MS/MS spectrum of several compounds: (a) m/z 317; (b) isorhamnetin
P4、P5、P6、P9、P14的苷元离子为 317,在m/z 151、153、165、302等位置都有离子碎片峰,302即[M+H+-15],质量损失是由丢失一个甲基造成的。在正离子模式下,RDA(retro-Diels-Alder)反应通常发生在C环的0,2和1,3位置[23]。由此可以推断,m/z 151即0,2B+,m/z 165 即0,2A+,m/z 153 即1,3A+,这种裂解路径与异鼠李素相似(图 6)。将质谱图低质量区的离子图谱(图 5a)与异鼠李素标准物质图谱(图 5b)比对,二者在各质量区域的离子分布基本吻合。最大紫外吸收峰在 255 nm和372 nm处,与标准物质相同。结合文献报道,可以确定此苷元为异鼠李素[23]。

图6 异鼠李素的RDA反应Fig. 6 RDA reaction of isorhamnetin
P1、P10、P12、P13、P15、P17、P18苷元离子为m/z 331,正模式下在m/z 315、287、270等位置有明显的离子峰。强烈的m/z 315离子峰是由失去CH4造成,即[M+H-16]+。与之伴随的还有[M+H-15]+,即失去一个甲基形成的,这一离子在有甲氧基的结构中常见[24-26]。此两个离子同时出现一般预示着C3位置存在—OCH3,而[M+H-16]+的形成是由于C3的—OCH3和C2’之间形成呋喃环而失去一个CH4[23-24]。C3’和C4’两个位置的甲基也可以形成这样的结构,但是m/z 137即0,2B+,可以说明B环上只有两个羟基而不存在甲氧基结构。失去甲基后,极有可能进一步失去H2O+CO而出现 [M+H-61]+,即m/z 270。此离子的形成有两种路径[24, 27],但两种路径都需要有C3和C5位的 —OCH3参与。m/z 165可以证明A环上存在—OCH3。根据上述分析,可初步推断m/z 331为质子化的山核桃黄素(图7)。
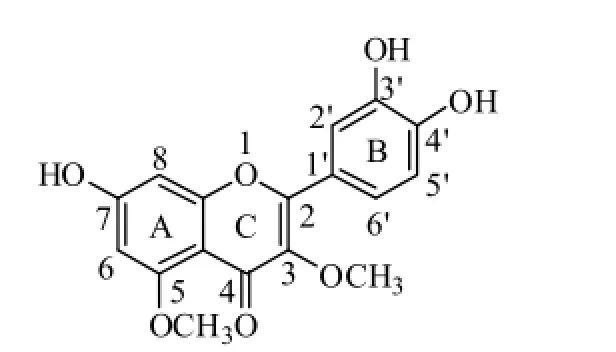
图7 山核桃黄素结构Fig. 7 The structure of caryatin
根据上述分析,表1列举了检测到的18种物质。其中,黄酮苷14种。黄酮醇2种,还有2种物质不能判断其结构。定性的16种成分中,有13种物质在4种能源草中都能检测到。上述分析检测结果使能源草黄酮提取的目标成分更加明确,为提取工艺开发设计奠定了基础。
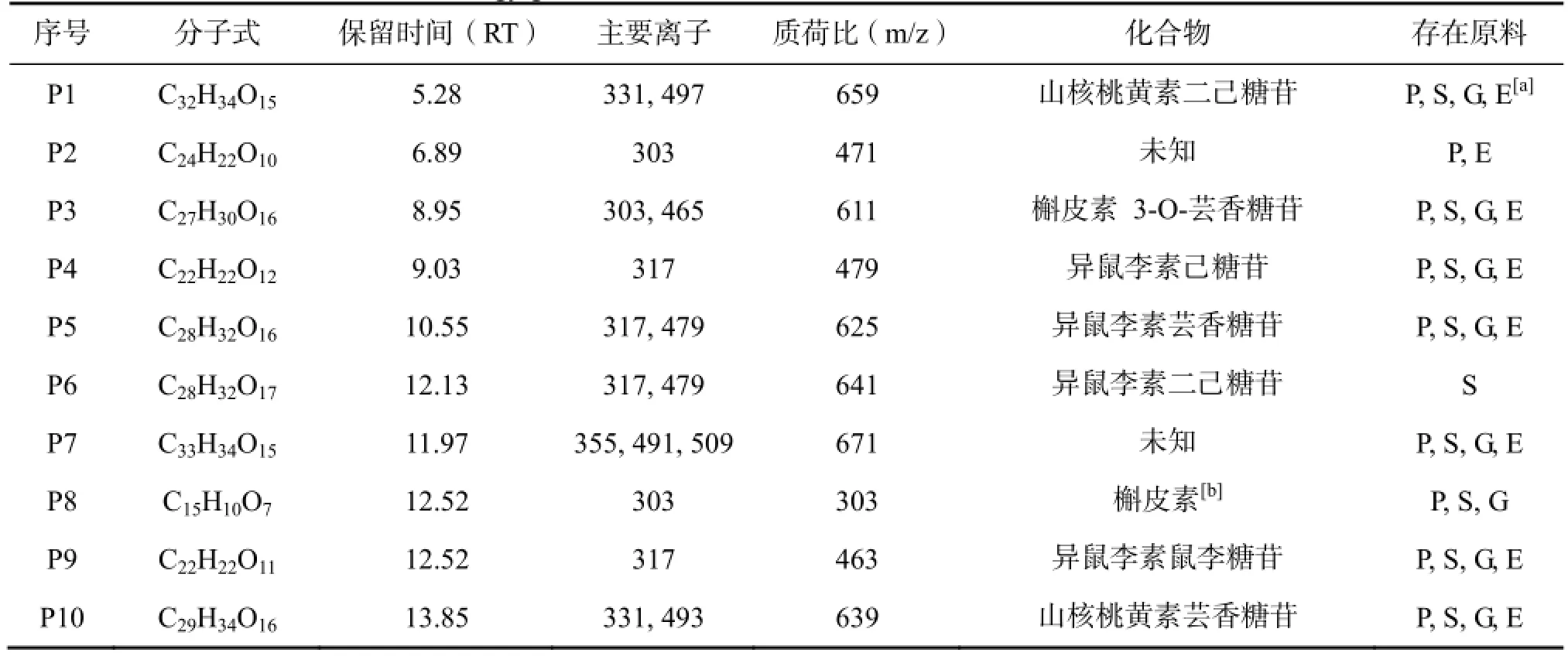
表 1 从4种能源草中鉴定的黄酮类物质Table 1 Flavonoid identified in four energy grasses
注:[a] P-杂交狼尾草、S-柳枝稷、G-芦竹、E-象草;[b] 通过标准物质鉴定。
3 结 论
本研究以4种华南地区常见的能源草为对象,探究了其中的总酚和总黄酮含量,利用HPLC-ESI-TOFMS技术研究了其中的黄酮类物质的组分。4种能源草中,柳枝稷总黄酮含量最高,达到6.84 mg QE/g干重。芦竹含量相对较低,为4.28 mg QE/g干重。茎中黄酮含量相当于叶的33.5% ~ 41.9%,杂交狼尾草叶中的黄酮含量最高,为10.55 mg QE/g。研究结果表明,能源草具有提取黄酮的潜力。
利用液相色谱质谱联用技术从提取物中共鉴定出16种物质,得到黄酮苷类物质14种,包括槲皮素苷、异鼠李苷、山核桃苷等。其中槲皮素、异鼠李素、槲皮苷可以根据标准物质准确定性。该结论使能源草中黄酮成分更加明确具体,为提取工艺的开发提供了数据支持。
[1] LI L H, KONG X Y, YANG F Y, et al. Biogas production potential and kinetics of microwave and conventional thermal pretreatment of grass[J]. Applied biochemistry and biotechnology, 2012, 166(5): 1183-1191. DOI: 10.1007/s12010-011-9503-9.
[2] ZHANG J Z, SONG Y L, WANG B W, et al. Biomass to bio-ethanol: the evaluation of hybrid Pennisetum used as raw material for bio-ethanol production compared with corn stalk by steam explosion joint use of mild chemicals[J]. Renewable energy, 2016, 88: 164-170. DOI: 10.1016/j.renene.2015.11.034.
[3] GE X M, BURNER D M, XU J F, et al. Bioethanol production from dedicated energy crops and residues in Arkansas, USA[J]. Biotechnology journal, 2011, 6(1): 66-73. DOI: 10.1002/biot.201000240.
[4] KARUNANITHY C, WANG Y, MUTHUKUMARAPPAN K, et al. Physiochemical characterization of briquettes made from different feedstocks[J]. Biotechnology research international, 2012, 2012: 165202. DOI: 10.1155/2012/165202.
[5] RAVINDRANATH S V, UPPUGUNDLA N, LAY J O, et al. Policosanol, α-tocopherol, and moisture content as a function of timing of harvest of Switchgrass (Panicum virgatum L.)[J]. Journal of agriculture and food chemistry,2009, 57(9): 3500-3505. DOI: 10.1021/jf803846e.
[6] EKENSEAIR A K, DUAN L J, CARRIER D J, et al. Extraction of hyperoside and quercitrin from mimosa (Albizia julibrissin) foliage[J]. Applied biochemistry and biotechnology, 2006, 130(1/3): 382-391. DOI: 10.1385/ ABAB:130:1:382.
[7] ROSS A B, SHEPHERD M J, SCHÜPPHAUS M, et al. Alkylresorcinols in cereals and cereal products[J]. Journal of agricultural and food chemistry, 2003, 51(14): 4111-4118. DOI: 10.1021/jf0340456.
[8] GUTIÉRREZ A, DEL RÍO J C, GONZÁLEZ-VILA F J,et al. Analysis of lipophilic extractives from wood and pitch deposits by solid-phase extraction and gas chromatography[J]. Journal of chromatography A, 1998,823(1/2): 449-455. DOI: 10.1016/S0021-9673(98)00356-2.
[9] BIESAGA M. Influence of extraction methods on stability of flavonoids[J]. Journal of chromatography A, 2011,1218(18): 2505-2512. DOI: 10.1016/j.chroma.2011.02.059.
[10] LAU C S, CARRIER D J, BEITLE R R, et al. Identification and quantification of glycoside flavonoids in the energy crop Albizia julibrissin[J]. Bioresource technology, 2007, 98(2): 429-435. DOI: 10.1016/j.biortech. 2005.12.011.
[11] TSIMOGIANNIS, SAMIOTAKI M, PANAYOTOU G, et al. Characterization of flavonoid subgroups and hydroxy substitution by HPLC-MS/MS[J]. Molecules, 2007,12(3): 593-606. DOI: 10.3390/12030593.
[12] FABRE N, RUSTAN I, DE HOFFMANN E, et al. Determination of flavone, flavonol, and flavanone aglycones by negative ion liquid chromatography electrospray ion trap mass spectrometry[J]. Journal of the American society for mass spectrometry, 2001, 12(6): 707-715. DOI: 10.1016/S1044-0305(01)00226-4.
[13] UPPUGUNDLA N, ENGELBERTH A, VANDHANA RAVINDRANATH S, et al. Switchgrass water extracts: extraction, separation and biological activity of rutin and quercitrin[J]. Journal of agricultural and food chemistry,2009, 57(17): 7763-7770. DOI: 10.1021/jf900998q.
[14] SIMIRGIOTIS M J, ADACHI S, TO S, et al. Cytotoxic chalcones and antioxidants from the fruits of Syzygium samarangense (Wax Jambu)[J]. Food chemistry, 2008,107(2): 813-819. DOI: 10.1016/j.foodchem.2007.08.086.
[15] BAJPAI P K, WARGHAT A R, DHAR P, et al. Variability and relationship of fruit color and sampling location with antioxidant capacities and bioactive content in Morus alba L. fruit from trans-Himalaya, India[J]. Lwt-food science and technology, 2014, 59(2): 981-988. DOI: 10.1016/j.lwt.2014.07.055.
[16] FAN R, YUAN F, WANG N, et al. Extraction and analysis of antioxidant compounds from the residues of Asparagus officinalis L.[J]. Journal of food science and technology, 2015, 52(5): 2690-2700. DOI: 10.1007/ s13197-014-1360-4.
[17] DAS N, ISLAM M E, JAHAN N, et al. Antioxidant activities of ethanol extracts and fractions of Crescentia cujete leaves and stem bark and the involvement of phenolic compounds[J]. BMC complementary and alternative medicine, 2014, 14(1): 45. DOI: 10.1186/1472-6882-14-45.
[18] MILOŠEVIĆ T, MILOŠEVIĆ N, GLIŠIĆ I. Apricot vegetative growth, tree mortality, productivity, fruit quality and leaf nutrient composition as affected by myrobalan rootstock and blackthorn inter-stem[J]. Erwerbs-obstbau, 2015, 57(2): 77-91. DOI: 10.1007/ s10341-014-0229-z.
[19] ABDENNACER, KARIM M, YASSINE M, et al. Determination of phytochemicals and antioxidant activity of methanol extracts obtained from the fruit and leaves of Tunisian Lycium intricatum Boiss[J]. Food chemistry, 2015,174(1): 577-584. DOI: 10.1016/j.foodchem.2014.11.114.
[20] SULTANA B, HUSSAIN Z, ASIF M, et al. Investigation on the antioxidant activity of leaves, peels, stems bark,and kernel of mango (Mangifera indica L.)[J]. Journal of food science, 2012, 77(8): C849-C852. DOI: 10.1111/j.1750-3841.2012.02807.x.
[21] LIN L Z, HARNLY J M. A screening method for the identification of glycosylated flavonoids and other phenolic compounds using a standard analytical approach for all plant materials[J]. Journal of agricultural and food chemistry, 2007, 55(4): 1084-1096. DOI: 10.1021/jf062431s.
[22] CUYCKENS F, CLAEYS M. Mass spectrometry in the structural analysis of flavonoids[J]. Journal of mass spectrometry, 2004, 39(1): 1-15. DOI: 10.1002/jms.585.
[23] DE RIJKE E, OUT P, NIESSEN W M A, et al. Analytical separation and detection methods for flavonoids[J]. Journal of chromatography A, 2006, 1112(1/2): 31-63. DOI: 10.1016/j.chroma.2006.01.019.
[24] STEVENS J F, WOLLENWEBER E, IVANCIC M, et al. Leaf surface flavonoids of Chrysothamnus[J]. Phytochemistry,1999, 51(6): 771-780. DOI: 10.1016/S0031-9422(99)00110-7.
[25] DE RIJKE E, ZAPPEY H, ARIESE F, et al. Liquid chromatography with atmospheric pressure chemical ionization and electrospray ionization mass spectrometry of flavonoids with triple-quadrupole and ion-trap instruments[J]. Journal of chromatography A, 2003,984(1): 45-58. DOI: 10.1016/S0021-9673(02)01868-X.
[26] GRAYER R J, VEITCH N C, KITE G C, et al. Distribution of 8-oxygenated leaf-surface flavones in the genus Ocimum[J]. Phytochemistry, 2001, 56(6): 559-567. DOI: 10.1016/S0031-9422(00)00439-8.
[27] BOWIE J H, WHITE P Y. Electron impact studies. Part XXXIX. proximity effects in the mass spectra of aromatic carbonyl compounds containing adjacent methoxy-substituents[J]. Journal of the chemical society B-physical organic, 1969: 89-93. DOI: 10.1039/ J29690000089.
Determination of Flavonoids from Four Energy Grasses
YANG Li-gui1,2,3,4, SUN Yong-ming1,2,3, KONG Xiao-ying1,2,3, LI Lian-hua1,2,3,LIU Shu-na1,2,3, DONG Peng-yu1,2,3,4, YUAN Zhen-hong1,2,3
(1. Guangzhou Institute of Energy Conversion, Chinese Academy of Sciences, Guangzhou 510640, China;2. Key Laboratory of Renewable Energy, Chinese Academy of Sciences, Guangzhou 510640, China;3. Guangdong Provincial Key Laboratory of New and Renewable Energy Research and Development, Guangzhou 510640, China;4. University of Chinese Academy of Sciences, Beijing 100049, China)
The total flavonoid contents in four common energy grasses (hybrid Pennisetum, switchgrass, giant reed,elephant grass) including whole strain, stems and leaves were quantified. The flavonoids were detected by LC-MS. For the whole strains, switchgrass has a flavonoids content of 6.84 mg quercetin equivalents/g dry weight, which is 59.8%, 20.1% and 11.2% higher than giant reed, hybrid Pennisetum and elephant grass. The content in leaves is 2.3 ~ 3.0 times to stems,the contents in hybrid Pennisetum leaves is 10.55 mg quercetin equivalents/g dry weight, which is the highest among all these samples. 14 flavonoid glycosides and 2 flavonols were identified in the extracts of four grasses. Quercetin,isorhamnetin and quercitrin are identified positively with standards. This research may provide a theoretical support for the value added phytochemicals extract from energy grass.
energy grass; LC-MS; flavonoid glycosides; flavonol; total flavonoid content
孙永明(1977-),男,博士,研究员,博士生导师,主要研究方向为生物质生化转化研究。
TK6;S543+.9
A
10.3969/j.issn.2095-560X.2016.03.010
2095-560X(2016)03-0225-07
2016-04-26
2016-06-12
国家科技支撑计划项目(2013BAD22B03);广州市科技计划项目(201508020098)
杨立贵(1990-),男,硕士研究生,主要研究方向为生物质生化转化及天然产物提取。
