由扎布耶盐湖粗盐制备高纯碳酸锂新工艺研究*
2016-08-11邓姝皓杨子萱杨佳逸易丹青中南大学材料科学与工程学院湖南长沙40083教育部有色金属重点实验室
邓姝皓,杨子萱,杨佳逸,杨 曦,尹 翀,韩 江,易丹青(.中南大学材料科学与工程学院,湖南长沙40083;2.教育部有色金属重点实验室)
研究与开发
由扎布耶盐湖粗盐制备高纯碳酸锂新工艺研究*
邓姝皓1,2,杨子萱1,2,杨佳逸1,2,杨曦1,尹翀1,2,韩江1,2,易丹青1
(1.中南大学材料科学与工程学院,湖南长沙410083;2.教育部有色金属重点实验室)
根据西藏扎布耶湖的高锂镁比特性,以卤水析出的粗碳酸锂为原料,确定了经济实用的化学分步碱化沉淀,去除杂质元素,最后碳酸化沉淀碳酸锂的提纯工艺。研究了沉淀工艺、不同水体系和沉淀剂对碳酸锂纯度的影响。采用等离子发射光谱、红外光谱、X射线衍射、扫描电镜等对高纯碳酸锂进行表征。结果表明,最佳工艺条件是在纯净水体系中经化学分步碱化沉淀,去除铁、铝、镁、钙等杂质,最后碳酸铵沉锂,可获得纯度为99.90%以上的白色松软的高纯碳酸锂。红外谱图和XRD衍射谱图显示样品为扎布耶型的纯碳酸锂;扫描电镜显示碳酸锂晶体为棒状,长为3~5 μm,直径为0.5 μm以下。
高纯碳酸锂;化学分步沉淀;粗碳酸锂
碳酸锂作为最基础最重要的锂盐,在电池、冶炼、润滑剂、玻璃等重要工业领域应用广泛。随着近期全球石油资源的逐渐枯竭,锂电池作为新能源的研发应用也越来越受到关注。高纯的碳酸锂是生产锂电池正极材料的关键原料,对于它的需求将逐年递增。近年来,世界科学技术前进的脚步加快,使得锂的应用领域进一步地拓宽,锂盐的需求量也在大幅度增长。目前世界上生产锂盐的原料分为固体矿及液体矿两类,由于矿石提锂能耗高、污染大等缺点,已逐步减少使用,而以盐湖卤水为原料提取锂盐由于污染较小、成本低,份额逐年增加[1]。西藏扎布耶盐湖是中国最具有开发价值的盐湖之一,盐湖属碳酸型[2],其卤水中的锂以天然碳酸锂形态存在,镁含量极低,生产碳酸锂相对容易。因此通过扎布耶盐湖卤盐制备高纯碳酸锂,使中国高锂镁比盐湖得到更好的开发利用,对于中国锂业的发展有很重要的意义。目前碳酸锂提纯工艺主要有氢化法、电解法、萃取法、离子交换法、吸附法[3-7]等,其中苛化法采用石灰乳,工艺中渣多,能耗大,但镁杂质含量很低;电解法获得的产品纯度较高,但能耗大,对隔膜和阳极材料等的耐蚀要求很高,成本相对也高;碳化沉淀法应用较广,但依据沉淀剂不同,引入不同的杂质,难以去除;萃取法由于萃取剂的带入和排出,使得成本较高,不利于大规模生产;吸附法的工艺简单,但吸附剂多为粉状,溶损大;离子交换法的纯度和产率都很高,但需要大量使用离子交换树脂,因此成本也很高,目前仅美日在使用。笔者以扎布耶盐湖卤水析出的粗碳酸锂矿为原料,依据一般金属离子的氢氧化物较其碳酸盐难溶特点,首次采用逐步碱化,在不引入杂质的条件下,在特定pH下对杂质元素进行分步沉淀,研究制取高纯度碳酸锂的工艺,为中国卤水制备高纯碳酸锂工艺提供实际参考。
1 实验
1.1实验仪器及药品
HH-1超级恒温水浴;pHs-25型酸度计;78-1A磁力加热搅拌器。
盐酸(优级纯),氨水、碳酸铵、无水碳酸钠、尿素均为分析纯。蒸馏水以高锰酸钾蒸馏自制获得,纯净水为市售。
1.2主要原料及工艺
1.2.1原料
扎布耶盐湖卤水结晶析出的纯度为58%~65%的粗碳酸锂矿,主要成分见表1。
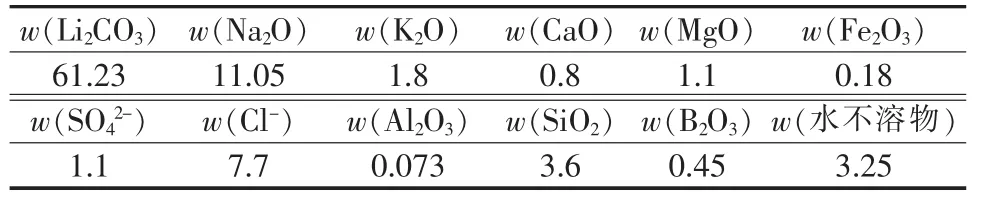
表1 粗碳酸锂的成分 %
1.2.2工艺原理及流程
根据一般金属离子的氢氧化物溶度积比其碳酸盐要小的缘故[8],以及每种氢氧化物的沉淀最大点都有对应的pH,首先用酸溶解碳酸锂原矿,通过逐步碱化将溶液中含有的铁、铝、锌、镁等金属元素杂质,在相应pH下生成氢氧化物完全沉淀,过滤去除;最后通过加入碳酸化沉淀剂,利用碳酸锂难溶于热水,加热过滤得到高纯碳酸锂[9],再以热水多次洗涤去除溶解性高的杂质如钠、钾、Cl-、SO42-等;最后高温灼烧得到高纯度的碳酸锂产品。
1.3成分分析
采用PS-6电感耦合等离子体原子发射光谱仪(ICP)进行全元素(40个元素)分析,测定碳酸锂中所含的杂质及含量。
1.4表征
采用Nicolet-6700型红外光谱仪(FT-IR)分析碳酸锂的组成;采用D/max 2500型X射线衍射仪分析碳酸锂的相组成,扫描度数为10~80°;采用Quanta200型SEM扫描电镜对碳酸锂的微观表面形貌进行分析。
2 实验结果分析讨论
2.1水体系对碳酸锂纯度的影响
首先研究了水体系对碳酸锂纯度的影响,将盐湖卤水结晶的碳酸锂原矿石溶于酸中,均分为2份,一份采用蒸馏水体系进行提纯,另一份采用纯净水,两者的提纯工艺路线均按1.2.2所述。通过表1的成分分析,可见应主要去除钾、钠、铝、铁、镁、钙、硅、硼等杂质,均以碳酸钠作为沉淀剂,从而考察蒸馏水和纯净水体系提纯对于碳酸锂纯度的影响。两种提纯工艺获得的碳酸锂纯度及其主要杂质结果列于表2。

表2 水体系对碳酸锂杂质去除的影响
从表2的结果可以发现,采用纯净水体系,碳酸锂中的主要杂质含量都较用蒸馏水体系的要低,这主要是由于蒸馏水本身也含有一些钠、钾、钙、镁等杂质,因此碳酸锂的纯度较由纯净水体系获得的要低;同时也表明为获得高纯度的碳酸锂,使用的水体系的纯度要尽可能高。从两种体系获得的碳酸锂纯度看,都没有达到99.9%以上,主要的杂质为钠、钙、镁,较其他杂质高出一个数量级,其他的杂质为钾、硅、磷、硼等,这表明碳酸钠并非最适宜的沉淀剂,这是因为采用碳酸钠沉淀时,沉淀温度并不高,但沉淀速度很快,碳酸锂结晶很细且易团聚,大量的Na+被包藏,单纯通过多次水洗涤不仅造成浪费和成本升高,钠离子也很难完全去除。
2.2碱化沉淀工序对碳酸锂纯度的影响
随后研究了碱化工序对碳酸锂纯度的影响,为确定工艺不受其他因素影响,将粗盐溶解后均分为3份,按A、B、C工艺路线提纯,其结果列于表3。其中A代表的提纯工序是沉淀铝、铁、钙、镁杂质后碳酸化的工艺路线;B代表的提纯工序则是沉淀铝、铁、钙、锌、镁等杂质的工艺路线;C代表的提纯工序是沉淀铝、铁、钙、锌、铅、镁等杂质的工艺路线。从表3看出,随着沉淀工序增加,主要金属离子杂质含量都有所降低,这主要是由于金属离子的氢氧化物的溶度积随溶液pH增加而降低所致。但几种无机元素杂质S、Si、P、B含量变化不大,主要是因为它们在体系中以酸根离子存在,溶液碱性增强,反而易溶所致。从结果比较来看,3种工艺获得的碳酸锂纯度提高不大,可见粗矿的主要杂质是铝、铁、钙和镁,而锌、铅等在粗矿中含量非常少,即便没有达到金属离子氢氧化物的沉淀终点,也可随溶液碱性的增加缓慢沉积出来。因此,增加碱化沉淀工序并无太多实际意义,反而造成工序繁杂和粗矿的浪费。因此选用A工序即可。

表3 沉淀工序对碳酸锂杂质去除的影响
2.3沉淀剂对碳酸锂纯度的影响
为优选出好的沉淀剂,研究了沉淀剂对碳酸锂纯度的影响。为确定工艺不受其他因素影响,将矿石溶于酸中,均分为3份,提纯工艺均为前述的A工序,最后分别采用碳酸钠、尿素和碳酸铵进行沉淀,从而比较3种碳酸化沉淀剂对碳酸锂纯度的影响。其主要杂质及纯度结果列于表4。从表4可以看出,采用尿素或碳酸铵作为沉淀剂,碳酸锂中杂质钠的含量下降了一个数量级,杂质钾的含量基本不变,其他主要杂质如镁、硅、硫、磷、硼等都较碳酸钠作为沉淀剂时有明显的下降,可见沉淀剂对于碳酸锂纯度影响很大。以碳酸钠作为沉淀剂时,由于在体系中带入钠离子,却无法完全去除,因此杂质含量较高。而以尿素或碳酸铵作为沉淀剂时,虽然引入铵根离子,但最后一步经过灼烧将铵根离子分解成氨气带出体系,因此杂质中钠的含量大幅度下降,却没有增加新的杂质。其次硼、硅的化合物易溶于碱而在酸性条件下难溶,并且一般金属离子的氢氧化物沉淀较其碳酸盐稳定[8],因此在酸性条件下去除硅、硼,再通过对体系不断碱化,达到各杂质氢氧化物的沉淀终点而逐步除去各种杂质金属离子(如铁离子、镁离子、铝离子、锌离子等)。但钙离子是一个特例,它的碳酸盐溶度积较氢氧化物更小,因此逐步碱化过程不能完全除去钙离子。镁离子因为与锂离子性质较为类似,因此除去也较为困难。由于3种工艺最后都是通过多次洗涤除钠、钾,因此3种工艺的钾杂质含量基本没变,如需继续提高纯度降低杂质含量一个数量级,应降低钙、镁、钠、钾的含量,但它们的去除只能通过离子交换树脂或吸附剂来完成[10]。

表4 沉淀剂对碳酸锂杂质去除的影响
尿素和碳酸铵作为沉淀剂,都使得碳酸锂中杂质的含量显著降低,但碳酸铵获得的结果更优一些,这是因为尿素和碳酸铵沉淀的原理[11]是在80℃以上时,先水解成氨基甲酸铵,再缓慢分解放出CO2与氢氧化锂反应,沉淀出较大颗粒的碳酸锂,由于沉淀表面积小的缘故,因而提高了产品的纯度。
2.4表征分析
2.4.1碳酸锂的ICP分析
表5为最优工艺,即纯净水体系,经逐步碱化,碳酸铵沉淀提纯得到的白色松软的碳酸锂的ICP检测结果。由表5可知,经提纯得到的碳酸锂纯度为99.90%,产率为52%。大部分杂质元素的含量都很低,只有钙元素的含量还是比较高,钠、钾含量也相对较高,另外回收率一般。从结果分析看,一般不引入其他物质的化学除钙方法很难完全去除钙离子,这主要是由于钙离子的氢氧化物的溶度积较碳酸盐要高。另外产物的回收率一般,主要原因则是工序沉淀过滤提纯过程会使得部分碳酸锂损失,要得到纯度与回收率俱佳的产品还有一定的难度。

表5 碳酸锂ICP分析结果
2.4.2碳酸锂的IR分析
图1a、b分别是最佳工艺条件下获得的高纯碳酸锂和文献查阅的碳酸锂的红外光谱谱图[12]。比较两个图可知两图谱基本相同:红外峰简单,即碳酸根在以1450cm-1左右为中心,在1400cm-1和1500cm-1附近有一对展开的对称峰。本研究的红外谱图在1 515 cm-1和1 434 cm-1处也有一对以1 450 cm-1左右为中心的对称峰,说明碳酸根的存在;红外谱图在3 440 cm-1左右的一个宽化的羟基峰,表明样品检测过程由于吸潮而含有少量水;铵根在3 100 cm-1处有峰,而本样品的谱图上没有,说明样品中铵根离子去除很彻底。由于制得的最佳样品的谱图与查阅的标准碳酸锂谱图完全一致,可以确定提纯得到的产品为碳酸锂。

图1 碳酸锂样品红外谱图
2.4.3碳酸锂的XRD分析
图2为碳酸铵沉淀制备的高纯碳酸锂样品的XRD图。通过软件分析比对可以确定所制样品为zabuyelite(扎布耶型)碳酸锂,即PDF卡中22-1141号。通过软件分析可以确定扎布耶型高纯碳酸锂不同于一般的碳酸锂(PDF卡号为01-0996),图2中菱形所标注的峰仅在扎布耶型碳酸锂结构中才存在。从碳酸锂的XRD谱图可以看出,碳酸锂衍射峰窄而尖锐,并且未见到其他杂质相。说明碳酸锂结晶度完整,晶胞结构完整,晶体结构有序性好。经分析软件拟合计算,可以得到碳酸锂的晶粒尺寸为42.5 nm,可见碳酸铵沉锂由于反应温度较高,沉淀结晶速度快,获得的碳酸锂晶粒尺寸均匀细小。
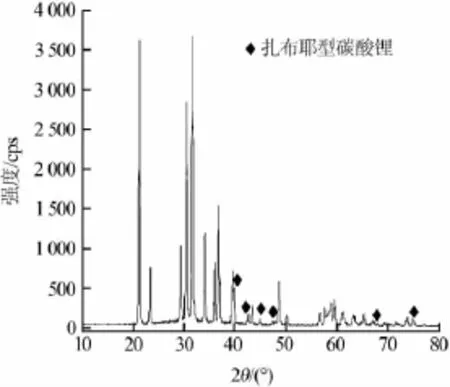
图2 碳酸锂样品的XRD图
2.4.4碳酸锂的SEM分析
图3是最佳工艺条件下获得的高纯碳酸锂样品在不同放大倍数扫描电镜下的微观形貌图。由图3可以看出,碳酸锂分布较为均匀,多个细小晶体聚成一团,部分晶体为片状,多数为棒状碳酸锂样品。说明碳酸锂是由棒状的晶体组成,长为3~5 μm,直径在0.5 μm以下。样品表面比较完整,均匀性和疏松性较好。形成这种棒状结晶的原因主要是沉淀结晶时的温度较高,过饱和度大,各个晶面的生长速率很快,造成晶体的定向生长特征不明显[13]。

图3 碳酸锂样品的SEM图
3 结论
1)高纯碳酸锂提纯的最佳工艺条件是在纯净水体系中先用酸溶解粗盐除去硼和泥沙等杂质,然后经化学分步沉淀去除其中的杂质离子铁、铝、钙、镁等,再用碳酸铵沉锂,最终多次热水洗后灼烧可以获得纯度为99.90%的松软白色的碳酸锂;2)经提纯的碳酸锂为扎布耶型,结晶的碳酸锂为棒状,长为3~5 μm,直径在0.5 μm以下。
[1]祝增虎,朱朝梁,温现明,等.碳酸锂生产工艺的研究进展[J].盐湖研究,2008,16(3):64-72.
[2]罗莎莎,郑绵平.西藏地区盐湖锂资源的开发现状[J].地质与勘探,2004,40(3):11-14.
[3]吴鉴,戴永年,姚耀春.氢化条件对碳酸锂提纯的影响[J].材料导报,2011,25(7):82-85.
[4]李杰,熊小波.铝盐吸附剂盐湖卤水提锂的研究现状及展望[J].无机盐工业,2010,42(10):9-11.
[5]袁小华.论碳酸锂生产的若干工艺问题[J].江西冶金,1998,18(2):25-28.
[6]孙锡良.盐湖含锂卤水萃取锂及制备碳酸锂工艺研究[D].长沙:中南大学,2005.
[7]杨卉芃,李琦,曹跃华,等.离子交换法提纯二次锂[J].中国资源综合利用,2002(5):22-25.
[8]《实用化学手册》编写组.实用化学手册[M].北京:科学出版社,2003.
[9]戴志锋,肖小玲,李法强,等.高纯碳酸锂的制取方法探讨[J].盐湖研究,2005,13(2):53-58.
[10]Yi Wentao,Yan Chunyan,Ma Peihua.Removal of calcium and magnesiumfromLiHCO3solutions for prepa ration of high-purity Li2CO3by ion-exchange resin[J].Desalination,2009,249(2):729-735.
[11]伊文涛,闫春燕,戴志锋,等.高纯碳酸锂的应用与制备方法评述[J].化工矿物与加工,2005(11):5-8.
[12]物竞化学品数据库.碳酸锂红外图谱[EB/OL].[2015-07-07]. http:∥www.basechem.org/chemical/image/57636.
[13]孙玉柱.碳酸锂结晶过程研究[D].上海:华东理工大学,2010.
联系方式:dengweihuadi@sina.com
New process for preparation of high purity lithium carbonate from coarse salt in Zabuye Salt Lake
Deng Shuhao1,2,Yang Zixuan1,2,Yang Jiayi1,2,Yang Xi1,Yin Chong1,2,Han Jiang1,2,Yi Danqing1
(1.School of Materials Science and Engineering,Central South University,Changsha 410083,China;2.Key Laboratory of Nonferrous Metal,Materials Science and Engineering,Ministry of Education)
According to the characteristics of high Li-Mg ratio of the Zabuye Lakes,coarse lithium carbonate separated from the brine was used as the raw material and an economical and practical chemical precipitation method was introduced to eliminate the impurity through fractional alkalization,and then the carbonated precipitation had been applied to get high purity lithium carbonate.The influence of different water systems,process of sedimentation,and carbonation precipitant on the purity of lithium carbonate had also been investigated.High purity lithium carbonate was characterized by plasma emission spectrum(ICP),infrared(IR),X-ray diffraction(XRD),and scanning electron microscopy(SEM).Result indicated that the optimum conditions were as follows:the main impurity of Fe,Al,Mg,and Ca were removed by step-by-step chemical precipitation in the pure water system and then precipitation by ammonium carbonate subsequently.The ICP result showed the lithium carbonate was loose and white and its purity was more than 99.90%.The IR and XRD spectra showed there was zabuyelite type lithium carbonate only,and the lithium carbonate particles were uniform rods with 3~5 μm in length and below 0.5 μm in diameter.
high purity lithium carbonate;fractional chemical precipitation;coarse lithium carbonate
TQ131.11
A
1006-4990(2016)04-0026-05
中南大学自由探索项目。
2015-10-21
邓姝皓(1973—),女,博士,副教授,主要从事电化学方面的研究工作。
