机械力作用对钴酸锂硫酸化焙烧产物的影响*
2016-08-11王大辉陈怀敬王耀军曹笃盟兰州理工大学有色金属先进加工与再利用省部共建国家重点实验室甘肃兰州730050兰州金川科技园有限公司
王大辉,彭 勃,陈怀敬,王耀军,文 豪,曹笃盟(.兰州理工大学,有色金属先进加工与再利用省部共建国家重点实验室,甘肃兰州730050;.兰州金川科技园有限公司)
机械力作用对钴酸锂硫酸化焙烧产物的影响*
王大辉1,彭勃1,陈怀敬1,王耀军1,文豪1,曹笃盟2
(1.兰州理工大学,有色金属先进加工与再利用省部共建国家重点实验室,甘肃兰州730050;2.兰州金川科技园有限公司)
目前,研究者仍然不清楚机械研磨处理对从废锂离子电池中获得的钴酸锂(LiCoO2)的硫酸化焙烧的影响。对钴酸锂与一水合硫酸氢钠(NaHSO4·H2O)混合物球磨前后的产物进行热重-差热-质谱(TG-DSC-MS)分析,结果表明球磨处理使焙烧环节焙烧温度降低。对钴酸锂与一水合硫酸氢钠混合物采用不同球磨时间处理后再进行焙烧,对焙烧产物进行X射线衍射分析发现,球磨0.5 h后的焙烧产物中出现了LiNaSO4、Na6Co(SO4)4和Na2SO4。对焙烧产物进行扫描电镜-能谱(SEM-EDS)分析,结果表明焙烧产物形貌不规则,呈大小不同的块状,而且颗粒有团聚现象,氧、硫、钠、钴在整个焙烧产物中呈弥散状态均匀分布。
废锂离子电池;钴酸锂;回收;机械球磨;酸性焙烧
锂离子电池在移动电话、笔记本电脑、电动汽车、电网储能系统等领域已得到广泛应用[1-2]。商业化锂离子正极材料主要有钴酸锂(LiCoO2)、锰酸锂(LiMn2O4)、磷酸铁锂(LiFePO4)、镍钴锰三元材料(Li[Ni-Co-Mn]O2)和Li3V2(PO4)3[3]。相比其他正极材料LiCoO2是锂离子电池中应用量最大的正极材料。锂离子电池长期使用后会因为容量衰减而报废。随着该类型报废锂离子电池日益增多,其后续合理处理正成为一个日益迫切的问题。
对LiCoO2结构、物理性质、化学性质系统了解,有助于从理论上指导报废LiCoO2再利用工艺设计和工艺参数优化。商业锂离子电池使用的正极材料LiCoO2均为采用高温固相反应合成的LiCoO2(HTLiCoO2)。HT-LiCoO2具有α-NaFeO2型层状结构,属立方晶系,空间群为,晶格常数a=0.281 6(2)nm、c=1.408(1)nm、c/a=4.899。O2-作面心立方最紧密堆积,Li+和Co3+交替占据岩盐结构(111)层面3a和3b位置。O-Co-O层内原子(离子)以强键结合,层间则靠范德华力维持,Li+的存在以静电作用维持层状结构稳定[4]。在Li1-xCoO2中,当锂离子脱出量x=0.07~0.25时,c轴伸长2%,Co-Co间距缩短;当x=0.5左右时,锂离子排列由有序转变为无序,接着由六方相转变为单斜相;当x>0.5时,c轴急剧收缩,晶格尺寸变化加大,进而降低Li1-xCoO2材料的热稳定和循环稳定性能[5]。处于充电状态的LixCoO2(x<1)处于介稳状态,当温度高于200℃时会发生分解,生成LiCoO2、Co3O4和O2[6]。LiCoO2在空气气氛中加热到900℃以上可分解为Li2O、Co3O4并释放出氧气[7]。将固体炭与LiCoO2混合后在500~600℃焙烧,焙烧后产物为LiCoO2、CoO、Co3O4和金属Co的混合物[8-9]。Li-Co-H2O系E-pH图表明[10],LiCoO2在酸性溶液中表现出很强氧化性。采用硫酸[11-12]、盐酸[13-14]、硝酸[15-16]、柠檬酸[17]溶液浸出 LiCoO2时,浸出过程产生O2、Cl2或NOx气体。笔者[18-19]将硫酸氢钠与LiCoO2混合后在500℃酸性焙烧,发现焙烧产物能完全溶解于水中,LiCoO2在酸性焙烧环境中Li、Co元素能够发生迁移。但是焙烧过程耗能比较大,如何降低能耗、优化整个工艺流程,是需要探究的问题。
机械球磨法[20]是把磨球和粉体试样放入罐子中,密封后通过机械振动的方式使粉体颗粒变成纳米级。在机械力作用下,粉体颗粒之间产生严重的撞击以及研磨,粉体颗粒变细小,表面积以及结构发生变化,此外由于强烈机械力作用,容易诱发一些化学反应。机械力作用对LiCoO2在酸性环境中的影响仍然不清楚。笔者将LiCoO2与NaHSO4·H2O按不同物质的量比混合,对混合物进行不同时间球磨处理,然后进行酸性焙烧,研究了机械力作用对LiCoO2硫酸化焙烧的影响。
1 实验方法
将钴酸锂与硫酸氢钠按不同物质的量比混合,置于高速振动球磨机不锈钢罐内球磨不同时间。待冷却至室温,将聚集体取出,置于陶瓷研钵中研磨分散,然后置于陶瓷坩埚中加盖,放入箱式电阻炉中以5℃/min速率升温,达到200℃时保温0.5 h。焙烧结束后冷却至室温,将焙烧产物放入陶瓷研钵中研磨均匀。用STA-449FC型热分析仪研究焙烧过程质量变化与热量变化,测试条件:升温速率为10℃/min,氮气气氛,流量为50 mL/min,温度范围为25~800℃。用ThermostarTM型四极质谱仪对焙烧过程逸出气体组分进行质谱表征,测试条件:四极质谱仪真空度为10-4Pa,测试采用多重离子检测(MID)模式,质量质谱滤波时间为1 s,质量扫描速度为5 000 amu/s,质谱正离子信号用通道电子管(CH-TRON)记录。用X′Pert Pro型X射线衍射仪对产物的物相结构进行分析,测试条件:Cu靶Kα辐射,λ=0.154 05 nm,扫描速度为10(°)/min,扫描范围为10~90°。用JSM-6701F型冷场发射扫描电镜观察产物的形貌,用能谱仪对产物微区成分进行分析。
2 结果与讨论
2.1LiCoO2球磨前后XRD分析
图1为LiCoO2球磨前后XRD谱图。从图1看出,LiCoO2球磨前峰形尖锐、明显、对称,和钴酸锂标准卡片中的特征峰匹配度很高,没有杂峰,说明焙烧产物中钴酸锂结晶度很好、纯度很高,而且焙烧产物物相组成单一,只有钴酸锂单一相,没有其他杂质;LiCoO2球磨0.5 h后衍射峰变化明显,峰强度变低、半高宽变宽、对称性不好,说明球磨机械力破坏了钴酸锂晶体结构,使晶体变小、不规则,结晶度降低。
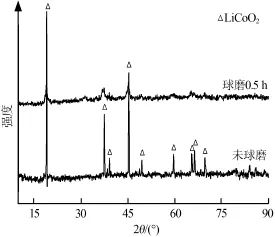
图1 LiCoO2球磨前后XRD谱图
2.2钴酸锂与硫酸氢钠混合物球磨前后TG-DSCMS分析
图2为LiCoO2和NaHSO4·H2O以物质的量比为1∶3混合球磨前后TG-DSC曲线。图3是混合样球磨前MS图。
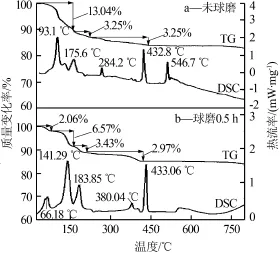
图2 LiCoO2和NaHSO4·H2O按物质的量比为1∶3混合球磨前后TG-DSC曲线
从图2a可以看出,未球磨样品TG曲线有3个质量损失阶段。在60~160℃,TG曲线出现第一个台阶,试样的质量损失为13.04%。在93.1℃,DSC曲线出现第一个吸热峰,硫酸氢钠含有的一个结晶水发生脱附,吸收了热量。由图3a可以看出,在93.1℃有H2O+(m/z=18)出现,与DSC第一个吸热峰对应。在160~250℃,TG曲线出现第二个台阶,试样的质量损失为3.25%。在175.6℃,DSC曲线出现第二个吸热峰,样品中有少量吸附水发生脱附,吸收了热量。由图3a可以看出,在175.6℃时有H2O+(m/z=18)出现,与DSC曲线第二个吸热峰对应。在250~400℃,TG曲线坡度变缓,试样的质量损失速率变慢。在284.2℃,DSC曲线出现第三个吸热峰,在此温度下试样反应完全。在400~500℃,TG曲线比较平缓,试样的质量损失速率变得更慢。在432.8℃,DSC曲线出现第四个吸热峰,在此温度下钴酸锂与硫酸氢钠发生反应释放少量三氧化硫气体,三氧化硫气体在电子轰击下转变成SO2+与O2+。由图3b可以看出,在432.8℃有SO2+(m/z=64)出现,分解出来的氧很少,淹没在背景中分辨不出来,与DSC曲线第四个吸热峰对应。在500~750℃,TG曲线非常平缓,试样质量变化不大。在546.7℃,DSC曲线出现第五个吸热峰,这个吸热峰的成因尚不清楚,需要进一步研究。
由图2b可以看出,混合物球磨0.5 h样品TG曲线有4个质量损失阶段。在25~80℃,TG曲线出现第一个台阶,试样的质量损失为2.06%。在66.18℃,DSC曲线出现第一个吸热峰,试样中的结晶水发生脱附,硫酸氢钠分子失去一个结晶水。
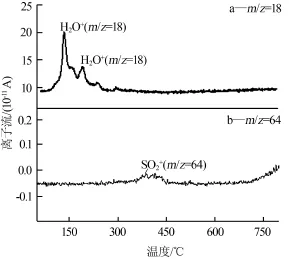
图3 LiCoO2和NaHSO4·H2O按物质的量比为1∶3混合样MS图
在80~160℃,TG曲线出现第二个台阶,试样的质量损失为6.57%。在141.29℃,DSC曲线出现第二个吸热峰,试样中少量的物理吸附溶剂和水发生脱附。在160~200℃,TG曲线出现第三个台阶。在183.85℃,DSC曲线出现第三个吸热峰,在此温度下样品反应完全。在200~410℃,TG曲线比较平缓。在380.04℃,DSC曲线出现第四个吸热峰。在此温度下钴酸锂与硫酸氢钠发生反应释放出少量三氧化硫气体,三氧化硫气体在电子轰击下转变成SO2+与O2+。在410~800℃,TG曲线非常平缓,试样质量变化不大。在433.06℃,DSC曲线出现第五个吸热峰。这个吸热峰的成因尚不清楚,需要进一步研究。
2.3钴酸锂与硫酸氢钠不同配比混合球磨样品XRD分析
图4为LiCoO2和NaHSO4·H2O按不同物质的量比混合球磨0.5 h样品XRD谱图。从图4a可以看出,样品XRD谱图中只出现了LiCoO2的特征峰,说明由于NaHSO4·H2O的量很少,LiCoO2基本没有发生反应,没有其他物质生成。
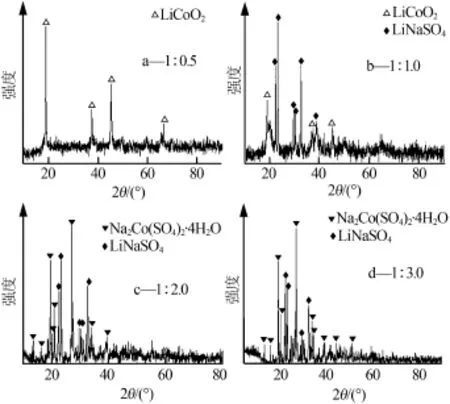
图4 LiCoO2和NaHSO4·H2O按不同物质的量比混合球磨0.5 h样品XRD谱图
从图4b可以看出,样品XRD谱图中出现了LiCoO2和LiNaSO4,其中LiCoO2峰形明显、尖锐、对称,说明还有一部分LiCoO2未发生反应。
从图4c可以看出,样品XRD谱图中出现了LiNaSO4和Na2Co(SO4)2·4H2O,未发现LiCoO2,说明LiCoO2晶体结构完全被破坏,LiCoO2和NaHSO4·H2O发生了反应并且反应完全,生成了非晶产物和含Li、Co、Na的新物相LiNaSO4和Na2Co(SO4)2·4H2O。
从图4d可以看出,样品XRD谱图中出现了LiNaSO4和Na2Co(SO4)2·4H2O,未发现LiCoO2的衍射峰,说明LiCoO2的晶体结构完全被破坏,LiCoO2和NaHSO4·H2O发生了反应并且反应完全,生成了非晶产物和含Li、Co、Na的新物相LiNaSO4和Na2Co(SO4)2·4H2O。与图4c相比,样品特征峰峰形更尖锐、明显、对称,半高宽更小,说明这两种新物质结晶度更好,晶体更大。
2.4钴酸锂与硫酸氢钠不同配比混合球磨后焙烧样品XRD分析
图5为LiCoO2和NaHSO4·H2O按不同物质的量比混合球磨0.5 h再经过焙烧所得产物XRD谱图。从图5a可以看出,样品XRD谱图中只出现LiCoO2的衍射峰,说明 NaHSO4·H2O比例太小,LiCoO2基本没有发生反应。

图5 LiCoO2和NaHSO4·H2O按不同物质的量比混合球磨0.5 h再经焙烧所得样品XRD谱图
从图5b可以看出,样品XRD谱图中仅有少量LiCoO2存在(峰形已经不明显),出现了LiNaSO4和Na2SO4晶体物质,其中LiNaSO4衍射峰尖锐、明显、对称,说明其结晶度很好,晶粒很大,说明LiCoO2和NaHSO4·H2O部分发生了反应。
从图4d得知,LiCoO2和NaHSO4·H2O按物质的量比为1∶3混合球磨0.5 h后生成的产物为LiNaSO4和Na2Co(SO4)2·4H2O。而从图5c可以看出,相同配比、相同球磨时间,焙烧所得产物除 LiNaSO4外,又出现了新物相Na6Co(SO4)4和Na2SO4。其中Na6Co(SO4)4衍射峰尖锐、明显、对称,说明其结晶度好、晶粒大,Na2Co(SO4)2·4H2O衍射峰已经消失。
2.5钴酸锂与硫酸氢钠混合物不同球磨时间焙烧产物XRD分析
图6为LiCoO2和NaHSO4·H2O按物质的量比为1∶3混合球磨不同时间焙烧产物XRD谱图。从图6a可以看出,样品 XRD谱图中出现了 LiNaSO4、Na6Co(SO4)4和 Na2SO4衍射峰,且衍射峰强度大、半高宽小,峰形尖锐、明显、对称,表明这几种物质结晶度好,说明LiCoO2和NaHSO4·H2O反应完全。
从图6b可以看出,样品XRD谱图中出现了LiNaSO4、Na6Co(SO4)4和 Na2SO4,说明 LiCoO2和NaHSO4·H2O反应完全。相比球磨0.5 h焙烧样品(图6a),3种物质衍射峰强度变大、半高宽变小,峰形尖锐、明显、对称,表明这几种物质结晶度好,晶粒变大。
从图6c可以看出,样品XRD谱图中出现了Na6Co(SO4)4和Na2SO4,说明LiCoO2和NaHSO4·H2O反应完全。相比球磨0.5h焙烧样品 (图6a),LiNaSO4衍射峰不太明显,说明其已分解为非晶物质,而Na6Co(SO4)4衍射峰依旧强度大、半高宽小,峰形尖锐、明显、对称,表明这种物质结晶度好,晶粒大。
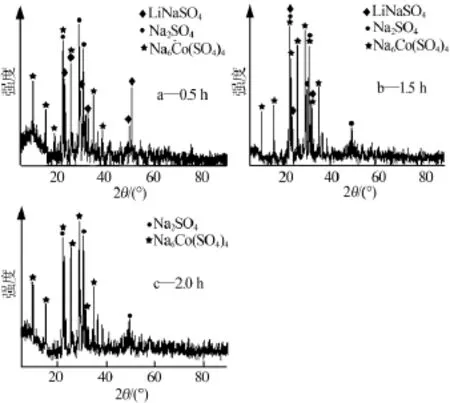
图6 LiCoO2和NaHSO4·H2O按物质的量比为1∶3混合球磨不同时间焙烧产物XRD谱图
2.6球磨对钴酸锂与硫酸氢钠混合物焙烧产物的影响
从以上XRD分析中得出,LiCoO2和NaHSO4· H2O按物质的量比为1∶3混合,球磨0.5 h,在200℃焙烧0.5 h,焙烧产物达到了预期目标。下面进一步研究该条件下焙烧产物微区原位形貌和产物中Na、Co、S、O元素的含量及其分布特征。
图7依次为LiCoO2和NaHSO4·H2O按物质的量比为1∶3混合,球磨0.5 h,在200℃焙烧0.5 h,焙烧产物SEM照片。从图7可以看出,焙烧产物形貌不是很规则,呈大小不同的块状,有小至1~2 μm的颗粒,也有大至20 μm以上的颗粒,而且颗粒有团聚现象。由于焙烧温度低所以没有融化现象。
图8为焙烧产物能谱分析结果。由图8可以看出,焙烧产物中O、S比例较大,Co比例最小。O质量分数为46.73%,Na质量分数为21.11%,S质量分数为22.55%,Co质量分数为9.62%。O、S、Na、Co在整个焙烧产物中的不同位置不同区域呈弥散状态均匀分布。Co以Na6Co(SO4)4的形式存在于焙烧产物中,Na以LiNaSO4和Na2SO4的形式存在于焙烧产物中。

图7 LiCoO2和NaHSO4·H2O按物质的量比为1∶3混合球磨0.5 h焙烧产物SEM照片

图8 LiCoO2和NaHSO4·H2O按物质的量比为1∶3混合球磨0.5 h焙烧产物中Co、Na、O、S元素EDS面扫描分布图
3 总结
1)球磨对LiCoO2晶体结构造成了破坏,并对LiCoO2硫酸化焙烧产生了影响,有效降低了焙烧温度。2)LiCoO2与NaHSO4·H2O按物质的量比为1∶3混合,球磨0.5 h,加热至200℃保温0.5 h,在焙烧过程中LiCoO2与NaHSO4·H2O发生了明显的化学反应。3)焙烧产物致密、形状不规则,O、S、Na、Co在整个产物中呈弥散状态均匀分布。
[1]Etacheri V,Marom R,Elazari R,et al.Challenges in the development of advanced Li-ion batteries:a review[J].Energy Environ.Sci., 2011,4(9):3243-3262.
[2]Scrosati B,Hassoun J,Sun Y K.Lithium-ion batteries.A look into the future[J].Energy Environ.Sci.,2011,4(9):3287-3295.
[3]马璨,吕迎春,李泓.锂离子电池基础科学问题(Ⅶ)——正极材料[J].储能科学与技术,2014,3(1):53-65.
[4]Akimoto J,Gotoh Y,Oosawa Y.Synthesis and structure refinement of LiCoO2single crystals[J].Journal of Solid State Chemistry,1998,141(1):298-302.
[5]Thomas M G S R,Bruce P G,Goodenough J B.Lithium mobility in the layered oxide Li1-xCoO2[J].Solid State Ionics,1985,17(1):13-19.
[6]闫时建,刘鑫,仇卫华,等.脱锂态LixCoO2(0.5<x<1)的晶体结构[J].北京科技大学学报,2007,29(1):45-49.
[7]袁文辉,邱定蕃,王成彦.还原熔炼失效锂离子电池制备Co-Cu-Fe合金[J].材料科学与工艺,2010,18(4):455-458.
[8]李敦钫,王成彦,尹飞,等.废锂离子电池钴酸锂的碳还原和硫酸溶解[J].有色金属,2009,61(3):83-86.
[9]李敦钫,王成彦,尹飞,等.失效锂离子电池焙烧产物物相和浸出分析[J].稀有金属,2009,33(3):382-385.
[10]文士美,赵中伟,霍广生.Li-Co-H2O系热力学分析及E-pH图[J].电源技术,2005,29(7):423-426.
[11]Nan J,Han D,Zuo X.Recovery of metal values from spent lithiumion batteries with chemical deposition and solvent extraction[J].J. Power Sources,2005,152(1):278-284.
[12]Shin S M,Kim N H,Sohn J S,et al.Development of a metal recovery process from Li-ion battery wastes[J].Hydrometallurgy,2005,79:172-181.
[13]Li J,Shi P,Wang Z.A combined recovery process of metals in spentlithium-ionbatteries[J].Chemosphere,2009,77:1132-1136.
[14]Wang R C,Lin Y C,Wu S H,et al.A novel recovery process of metal values from the cathode active materials of the lithium-ion secondarybatteries[J].Hydrometallurgy,2009,99:194-201.
[15]Lee C K,Rhee K I.Reductive leaching of cathodic active materials from lithium ion battery wastes[J].Hydrometallurgy,2003,68:5-10.
[16]Li L,Chen R,Sun F,et al.Preparation of LiCoO2films from spent lithium-ion batteries by a combined recycling process[J].Hydrometallurgy,2011,108:220-225.
[17]Li L,Ge J,Wu F et al.Recovery of cobalt and lithium from spent lithium ion batteries using organic citric acid as leachant[J].J. Hazard.Mater.,2010,176:288-293.
[18]王大辉,张胜全.从废锂离子电池中回收钴和锂的方法:中国,101818251A[P].2010-09-01.
[19]陈怀敬,王大辉,文豪,等.从钴酸锂正极材料的废锂离子电池中回收钴锂金属的方法:中国,104466292A[P].2015-03-25.
[20]张亮.机械球磨法制备纳米氧化锑粉的研究[D].兰州:兰州理工大学,2014.
联系方式:wangdh@lut.cn
Influence of mechanical force on sulphation roasting products of LiCoO2
Wang Dahui1,Peng Bo1,Chen Huaijing1,Wang Yaojun1,Wen Hao1,Cao Dumeng2
(1.State Key Laboratory of Advance Processing and Recycling of Nonferrous Metals,Lanzhou University of Technology,Lanzhou 730050,China;2.Lanzhou Jinchuan Technology Park Co.,Ltd.)
Influence of mechanical ball mill on the sulfating roasting of LiCoO2extracted from spent lithium ion battery is not clear at present.The mixtures of LiCoO2and NaHSO4·H2O with different ratios were milled and roasted.The TG-DSC-MS results showed that ball milling treatment was beneficial to decrease roasting temperature.Roasted product after ball milling 0.5 h was composed of LiNaSO4,Na6Co(SO4)4,and Na2SO4.The SEM and EDS results showed that the roasting product had a dense tissue and irregular shape.Particle agglomeration was also observed.Distribution of O,S,Na,and Co elements was homogeneous in the roasting products.
spent lithium ion batteries;LiCoO2;recycling;mechanical ball mill;sulfating roasting
TQ131.11
A
1006-4990(2016)03-0020-05
国家自然科学基金(51264027);国家重点基础研究发展规划(973计划,2012CB722806);有色金属先进加工与再利用国家重点实验室基金(SKL12003);甘肃省科技重大专项(1502FKDA015)。
2015-09-18
王大辉(1972—),男,博士,教授。
