鱼腥草挥发油对Raji细胞增殖和凋亡的影响*
2016-08-11张壮丽王亚飞赵志鸿张小俊王桂芳
张壮丽,赵 宁,王亚飞,邹 敏,赵志鸿,张小俊,王桂芳
1)河南省医药科学研究院药化室 郑州450052 2)郑州市第六人民医院药务科 郑州 450001 3)郑州大学药学院 郑州 450001 △女,1978年1月生,博士,副研究员,研究方向:中药新药研究,E-mail:zzl7814@163.com
鱼腥草挥发油对Raji细胞增殖和凋亡的影响*
张壮丽1)△,赵宁2),王亚飞3),邹敏1),赵志鸿1),张小俊1),王桂芳1)
1)河南省医药科学研究院药化室 郑州4500522)郑州市第六人民医院药务科 郑州 4500013)郑州大学药学院 郑州 450001△女,1978年1月生,博士,副研究员,研究方向:中药新药研究,E-mail:zzl7814@163.com
摘要目的:研究鱼腥草挥发油对Raji细胞增殖与凋亡的影响。方法:采用MTT法观察不同体积分数的鱼腥草挥发油体外诱导Raji细胞24、48和72 h对细胞增殖的影响;分别采用Annexin V-FITC/PI双染法及PI单染法检测不同体积分数的鱼腥草挥发油处理Raji细胞48 h后细胞凋亡及细胞周期的改变。结果:鱼腥草挥发油诱导Raji细胞24、48和72 h的IC50(V/V)分别为0.125 80×10-3、0.099 58×10-3和0.105 22×10-3,且随鱼腥草挥发油体积分数的增加,细胞增殖抑制率及凋亡率均呈升高的趋势(P<0.05);细胞周期检测结果表明鱼腥草挥发油将细胞阻滞于G0/G1期。结论:鱼腥草挥发油能够显著抑制Raji细胞的增殖,诱导细胞凋亡;其作用机制可能与阻滞细胞G1/M转化有关。
非霍奇金淋巴瘤(non-Hodgkins lymphoma,NHL)是一组起源于淋巴结、骨髓、脾脏等淋巴组织的恶性肿瘤,其侵及范围广,早期复发,预后极差,死亡率高,近些年发病率逐渐上升[1-3]。尽管目前标准化疗对NHL的有效率较高[4],但不良反应大,复发率高,且再治疗缓解率低,缓解时间短,损伤骨髓造血系统与免疫功能。作者所在的课题组前期研究[5]发现,鱼腥草挥发油(volatile oil from houttuyniae herba,HHO)对人Burkitt淋巴瘤Raji细胞有明显的增殖抑制作用。目前对鱼腥草抗肿瘤作用的研究多集中在鱼腥草提取物上[6-8],对HHO抗肿瘤作用的研究较少。该研究以Raji细胞为研究对象,观察HHO对Raji细胞增殖及凋亡的影响,以期为HHO在恶性淋巴瘤治疗方面的研究与应用提供实验依据。
1材料与方法
1.1材料Raji细胞株购自中国科学院上海细胞库,HHO由作者所在的实验室采用水蒸气蒸馏法提取自鱼腥草干品(原药材购自四川江油,并经河南中医药大学药学院生药学科董诚明教授鉴定)。RPMI 1640培养基购自北京索莱宝生物医药科技有限公司,胎牛血清购自杭州四季青生物工程材料有限公司,MTT购自美国Sigma公司,Annexin V-FITC/PI细胞凋亡检测试剂盒和DNA含量检测试剂盒(细胞周期)购自南京凯基生物科技发展有限公司,顺铂注射液购自江苏豪森药业股份有限公司,注射用硫酸长春新碱(简称长春新碱)购自浙江海正药业股份有限公司。
1.2HHO溶液的配制取HHO溶于DMSO制成体积分数50%的母液,加入含体积分数10%胎牛血清的培养基,逐级稀释至目标浓度。
1.3MTT法检测细胞增殖取96孔板,设给药组、阳性对照组和阴性对照组,每孔接种对数生长期的Raji细胞混悬液100 μL,细胞数(9~10)×103/孔;给药组分别加入1.2中配制的HHO溶液100 μL,使HHO最终体积分数(10-3)分别为0.500 00、0.250 00、0.125 00、0.062 50、0.031 25;阳性对照组分别加入顺铂和长春新碱溶液各100 μL,使终质量浓度均为10 mg/L;阴性对照组加入等体积的培养基,每组均设3个复孔。将96孔板置于恒温培养箱中,于37 ℃、体积分数5% CO2条件下培养24、48 和72 h后,每孔加入5 g/L的MTT溶液20 μL,继续培养4 h后取出96孔板,3 000 r/min离心25 min, 吸弃上清,每孔加入DMSO 150 μL,置于气浴恒温振荡器中37 ℃振荡10 min,使结晶物充分溶解。使用酶联免疫检测仪在490 nm波长下检测各孔的吸光度(A)值,计算细胞增殖抑制率(1-给药组或阳性对照组A值/阴性对照组A值×100%)。再以药物浓度为横坐标,以细胞增殖抑制率为纵坐标,作剂量-效应曲线,拟合回归方程,计算药物对细胞的IC50。实验重复3次。
1.4Annexin V-FITC/PI双染法检测细胞凋亡取50 mL细胞培养瓶,设置给药组和阴性对照组,每瓶接种1×106mL-1的细胞混悬液3 mL;给药组分别加入不同体积分数的HHO溶液3 mL,使药物最终体积分数(×10-3)分别为0.05、0.10、0.15、0.20;阴性对照组加入等体积的培养基。混匀后,于37 ℃、体积分数5% CO2条件下培养48 h。将各组细胞1 000 r/min离心5 min后弃去上清,PBS洗2次,收集(1~5)×105个细胞,加入500 μL的Binding Buffer重悬细胞后加入5 μL Annexin V-FITC混匀,最后加入5 μL PI,混匀、室温避光反应5~15 min。在染色后1 h 内采用流式细胞仪检测,激发波长488 nm,发射波长530 nm。计算细胞凋亡率。实验重复3次。
1.5PI单染法检测细胞周期取50 mL细胞培养瓶,设置给药组和阴性对照组,每瓶接种1×106mL-1的细胞混悬液3 mL;给药组分别加入不同体积分数的HHO溶液3 mL,使药物最终体积分数(×10-3)分别为0.05、0.10、0.15;阴性对照组加入等体积的培养基。混匀后于37 ℃、体积分数5% CO2条件下培养48 h。将各组细胞1 000 r/min离心5 min后弃去上清,PBS洗1次,收集并调整细胞密度为1×106mL-1;取1 mL单细胞悬液,离心去上清后,向细胞中加入体积分数为70%的冷乙醇500 μL,4 ℃固定过夜并保存。将固定后的细胞1 000 r/min离心5 min后弃去上清,PBS洗1次,加100 μL的RNase A重悬后,37 ℃水浴30 min,再加入400 μL PI染液混匀,4 ℃避光30 min。将染色后的细胞上机检测,记录激发波长488 nm处的红色荧光,分析细胞周期分布情况。实验重复3次。
1.6统计学处理采用SPSS 21.0处理数据。采用单因素方差分析比较不同组间细胞增殖抑制率、细胞凋亡率以及细胞周期分布的差异,两两比较采用LSD-t检验,检验水准α=0.05。
2结果
2.1HHO对Raji细胞增殖的影响见表1。HHO作用24、48和72 h对Raji细胞的IC50(体积分数/×10-3)分别为0.125 80、0.099 58和0.105 22。作用时间相同时,在一定范围(体积分数≤0.250 00×10-3)内,随HHO体积分数的增加,细胞增殖抑制率呈升高的趋势。

表1 各组Raji细胞的增殖抑制率(n=3) %
2.2HHO对Raji细胞凋亡的影响体积分数(×10-3)分别为0.00(阴性对照组)、0.05、0.10、0.15和0.20的HHO诱导Raji细胞48 h的凋亡率分别为(3.27±0.74)%、(13.10±0.82)%、(33.33±3.50)%、(55.53±0.90)%和(75.23±0.87)%,随着HHO体积分数的增加,细胞凋亡率呈升高的趋势(F=878.629,P<0.001)。
2.3HHO对Raji细胞周期的影响见表2。随HHO体积分数的增加,Raji细胞G0/G1期细胞比例有升高的趋势,S期和G2/M期细胞比例则呈降低的趋势。
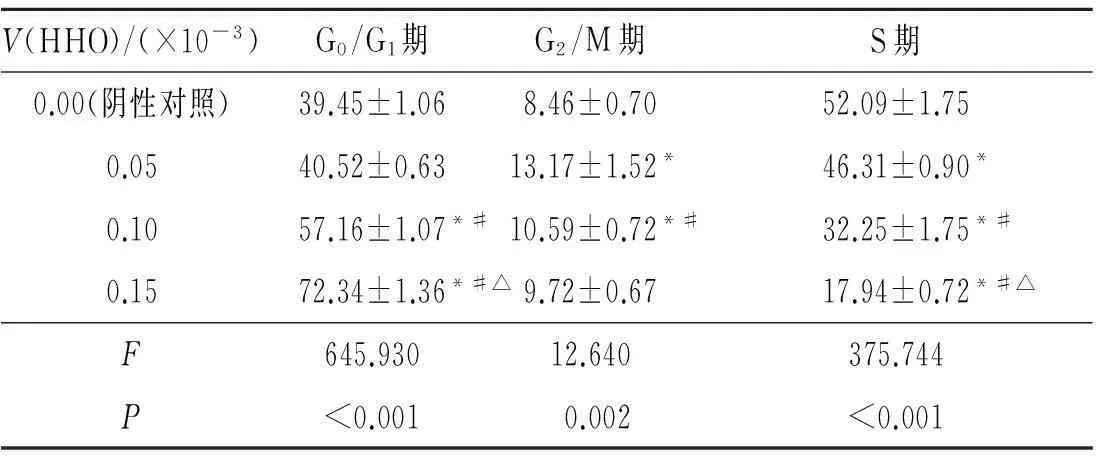
表2 HHO诱导48 h对Raji细胞周期的影响(n=3) %
3讨论
淋巴瘤是我国常见的十大恶性肿瘤之一,每年新发淋巴瘤患者约8.4万,死亡人数超过4.7万,并以每年5%的速度上升,其中约九成患者罹患NHL,其恶性程度更高,预后更差。目前常用的化疗药物虽治疗效果明显,但常伴有严重的不良反应[9-10]。
与普通化疗药相比,中药多成分多靶点,可以作用于肿瘤发病的不同环节[11-12],并且具有毒性低、不易产生耐药、可提高机体免疫力、使患者生存质量更高等特点,近年来在抗肿瘤新药开发领域,具有抗肿瘤作用的中药及其有效成分得到了越来越多的关注。
鱼腥草为三白草科蕺菜属植物蕺菜的新鲜全草或干燥地上部分,味辛,性微寒,归肺经,有清热解毒、消痈排脓、利尿通淋等功效[13]。作者所在的实验组采用水蒸气蒸馏法提取HHO并优化了提取工艺[14],采用气-质联用技术从HHO中分离鉴定出29个主成分,并利用偏最小二乘回归分析法对不同产地HHO GC-MS特征峰与Raji细胞增殖抑制率进行了谱效关系分析,结果表明HHO抗淋巴瘤的有效成分组包括对伞花烃、(-)-4-萜品醇、2,4,6-三甲基苯甲醇、甲基正壬酮、十一醇、正癸酸、乙酸香叶酯、2-十二烷酮和石竹烯,其对Raji细胞的抑制作用应为这些物质协同作用的结果[15]。
该研究结果表明,HHO能够有效抑制Raji细胞的增殖,诱导细胞凋亡,填补了HHO抗肿瘤研究方面的空白,为其在治疗NHL方面的研究及应用提供了参考。细胞周期检测结果显示,Raji细胞经HHO处理后细胞周期被阻滞于G0/G1期,提示HHO诱导Raji细胞凋亡的机制可能与阻滞细胞周期G1/M转化、抑制细胞中DNA合成和有丝分裂有关,然而细胞周期调控机制涉及多个环节[16-18],HHO具体作用于哪些环节,还需进一步探索研究。
参考文献
[1]SIDDIQI T,ROSEN ST.Novel biologic agents for non-Hodgkin lymphoma and chronic lymphocytic leukemia-part 1[J].Oncology(Williston Park),2015,29(3):198
[2]GOLDMAN S,SMITH L,GALARDY P,et al.Rituximab with chemotherapy in children and adolescents with central nervous system and/or bone marrow-positive Burkitt lymphoma/leukaemia: a Children's Oncology Group Report[J].Br J Haematol,2014,167(3):394
[3]孙晓菲,甄子俊,夏奕,等.改良NHL-BFM-90方案治疗儿童及青少年伯基特淋巴瘤和弥漫大B细胞淋巴瘤的远期疗效[J].中华血液学杂志,2013,34(12):1032
[4]贾存东,赵兵,古力克孜·吾守尔,等.大剂量BEAC方案联合自体外周血干细胞移植治疗非霍奇金淋巴瘤临床分析[J].中华肿瘤防治杂志,2013,20(21):1665
[5]张壮丽,郑立运,赵志鸿,等.鱼腥草有效部位及其提取方法和应用:ZL201310045165.6[P].2014-04-24.
[6]刘金娟,杨成流,陈永强,等.鱼腥草地下茎提取物诱导胃癌细胞SGC-7901凋亡机制的研究[J].中国药理学通报,2014,30(2):257
[7]PROMMABAN A,KODCHAKORN K,KONGTAWELERT P,et al.Houttuynia cordata Thunb fraction induces human leukemic Molt-4 cell apoptosis through the endoplasmic reticulum stress pathway[J].Asian Pac J Cancer Prev,2012,13(5):1977
[8]薛兴阳,付腾飞,邵方元,等.鱼腥草总黄酮对人肿瘤细胞的抗肿瘤活性作用[J].现代中西医结合杂志,2013,22(23):2509
[9]陆德珉. 非霍奇金淋巴瘤的临床研究[D].杭州:浙江大学,2015.
[10]张艳,程旭芳,黄刚,等.新型核苷类似物FNC对Raji细胞增殖、凋亡和Bcl-6、PRDM1、C-myc表达的影响[J].郑州大学学报(医学版),2013,48(4):450
[11]王芳,徐勤.中药挥发油诱导肿瘤细胞凋亡作用机制的研究进展[J].中国药房,2014,25(15):1424
[12]刘伟桥,于澎.中药黄酮类化合物的抗肿瘤机制[J].长春中医药大学学报,2015,31(2):254
[13]国家药典委员会.中华人民共和国药典(一部)[M].北京:中国医药科技出版社,2010.
[14]张壮丽,赵宁,赵志鸿,等.鱼腥草挥发油提取工艺优化[J].中国医药科学,2015,5(1):82
[15]张壮丽,赵宁,赵志鸿,等.鱼腥草挥发油抗淋巴瘤细胞谱效关系[J].郑州大学学报(医学版),2015,50(3):378
[16]PISU M,CONCAS A,CAO G. A novel quantitative model of cell cycle progression based on cyclin-dependent kinases activity and population balances[J].Comput Biol Chem,2015,55:1
[17]HE X,XIANG H,ZONG X,et al.CDK2-AP1 inhibits growth of breast cancer cells by regulating cell cycle and increasing docetaxel sensitivity in vivo and in vitro[J].Cancer Cell Int,2014,14(1):130
[18]戴翠萍,张徐宁,薛彩萍,等.羟基喜树碱脂质体与顺铂联用对耐顺铂的人食管癌Eca109细胞周期和凋亡的影响[J].郑州大学学报(医学版),2014,49(3):301
(2015-10-16收稿责任编辑徐春燕)
doi:10.13705/j.issn.1671-6825.2016.04.010
中图分类号R965
关键词鱼腥草挥发油;Raji细胞;凋亡;细胞周期
Effect of volatile oil from houttuyniae herba on proliferation and apoptosis of Raji cells
ZHANG Zhuangli1),ZHAO Ning2),WANG Yafei3),ZOU Min1),ZHAO Zhihong1),ZHANG Xiaojun1),WANG Guifang1)
1)MedicinalChemistrySection,HenanAcademyofMedicalandPharmaceuticalSciences,Zhengzhou4500522)DepartmentofMedicineServices,theSixthPeople′sHospitalofZhengzhou,Zhengzhou4500013)CollegeofPharmaceuticalSciences,ZhengzhouUniversity,Zhengzhou450001
Key wordsvolatile oil from houttuyniae herba;Raji cell;apoptosis;cell cycle
AbstractAim: To investigate the effect of volatile oil from houttuyniae herba(HHO) on the proliferation and apoptosis of Raji cells.Methods: Different volume fraction of HHO was used to treat Raji cells for 24,48 and 72 h;the prolifera tion of Raji cells was determined by MTT assay.Different volume fraction of HHO was used to treat Raji cells for 48 h; the cell apoptosis rate was measured by Annexin V-FITC/PI double staining method,and the cell cycle was observed by PI staining method.Results: The MTT results showed that IC50(V/V) of HHO for 24,48 and 72 h treatment was 0.125 80×10-3,0.099 58×10-3and 0.105 22×10-3;with the increase of volume fraction,the inhibitory effect and apoptosis rate showed a rising trend(P<0.05).The results of cell cycle detection showed that HHO was able to arrest Raji cells in G0/G1 phase.Conclusion: HHO could significantly inhibit the proliferation of Raji cells and induce cell apoptosis,and the mechanism may be related to HHO′s blocking G1/M conversion of Raji cells.
*河南省重点科技攻关计划项目142102310433;河南省自然科学基金资助项目152300410159;河南省省属科研单位社会公益项目预研专项2013,2014
*:与顺铂组和长春新碱组比较,P<0.05;#:不同体积分数的HHO组间除0.250 00×10-3和0.500 00×10-3组外,其他组间两两比较,P均<0.05。
*:与阴性对照组比较,P<0.05;#:与0.05×10-3HHO组相比,P<0.05;△:与0.10×10-3HHO组相比,P<0.05。
