rhMG53蛋白联合hUC-MSCs移植对阿尔茨海默鼠的治疗作用*
2016-08-11宋及时马珊珊王欣欣朱相展关方霞1
宋及时,马珊珊#,孟 楠,王欣欣,姚 宁,朱相展,程 康,杨 波,关方霞1,#
1)郑州大学生命科学学院干细胞研究室 郑州 450001 2)郑州大学第一附属医院干细胞研究室 郑州 450052 3)中美(河南)荷美尔肿瘤研究院 郑州 450000
rhMG53蛋白联合hUC-MSCs移植对阿尔茨海默鼠的治疗作用*
宋及时1),马珊珊1)#,孟楠2),王欣欣2),姚宁3),朱相展3),程康1),杨波2),关方霞1,2)#
1)郑州大学生命科学学院干细胞研究室 郑州 4500012)郑州大学第一附属医院干细胞研究室 郑州 4500523)中美(河南)荷美尔肿瘤研究院 郑州 450000
摘要目的:研究rhMG53蛋白联合人脐带间充质干细胞(hUC-MSCs)移植对阿尔茨海默模型鼠(APP转基因小鼠)的治疗作用。方法:40只APP+小鼠随机分为APP+组、hUC-MSCs组、rhMG53组和rhMG53联合hUC-MSCs组(联合组),分组处理1周后采用免疫组化法检测小鼠脑内hUC-MSCs的迁移率,3周后采用Morris水迷宫测试各组小鼠的学习和记忆能力,同时检测小鼠血清中SOD的活性和MDA的含量,并采用qRT-PCR和Western blot检测小鼠脑组织中衰老相关基因(sirt2、pCNA、p16、p53)的表达。结果:APP+组和rhMG53组未见hUC-MSCs迁移,hUC-MSCs组和联合组存在hUC-MSCs迁移,且联合组迁移细胞更多(P<0.05)。hUC-MSCs移植可以使APP+小鼠的逃避潜伏期缩短,穿越平台次数增加以及平台所在象限停留时间增加(P<0.05);hUC-MSCs移植和rhMG53均可使APP+小鼠血清SOD活性增加,MDA含量下降,且二者联用对MDA的影响有协同作用(P<0.05);hUC-MSCs移植和rhMG53均可使APP+小鼠脑组织sirt2和pCNA mRNA和蛋白的相对表达量升高,且二者联用对多数衰老相关基因表达的影响有交互作用(P<0.05)。结论:外源rhMG53蛋白可以提高小鼠脑内hUC-MSCs的迁移,促进hUC-MSCs对阿尔茨海默鼠的治疗作用。
干细胞移植为脑损伤、脊髓损伤等中枢神经系统损伤疾病的治疗带来了希望,取得了令人鼓舞的结果[1]。但是损伤部位的微环境导致移植后干细胞的存活率低且迁移至损伤组织的数量少,从而影响了治疗效果[2]。因此,增强干细胞的靶向迁移能力、增加到达损伤区的移植细胞的数量是目前亟待解决的问题。研究[3]表明外源的重组人MG53蛋白(recombinant human mitsugumin 53 protein,rhMG53)对于各种肌肉或非肌肉细胞(骨骼肌、心肌、上皮、免疫和神经细胞以及胚胎腭突间充质细胞)损伤均有保护作用,可快速定位到损伤部位,在细胞膜修复中发挥关键作用;此外,rhMG53蛋白对肺、心肌损伤等急性损伤具有损伤保护和修复治疗作用[4-5]。那么rhMG53蛋白在阿尔茨海默病(Alzheimer′s disease,AD)慢性病理环境下对人脐带间充质干细胞(human umbilical cord mesenchymal stem cells,hUC-MSCs)移植治疗是否具有促进作用?该研究观察了rhMG53联合hUC-MSCs移植对AD模型小鼠的治疗作用。
1材料与方法
1.1材料rhMG53由美国俄亥俄州州立大学麻建杰教授提供;hUC-MSCs由课题组前期冻存;DMEM/F12培养基、免疫组化试剂盒购自宝信生物科技有限公司;胎牛血清购自美国Gemini公司;DNA小提试剂盒、Trizol、逆转录试剂盒、qRT-PCR试剂盒购自TaKaRa公司;引物,兔抗人抗体(Sirt2、PCNA、P16、P53),鼠抗人MAB1281单克隆抗体购自生工生物工程(上海)股份有限公司;血清SOD活性测定试剂盒及血清MDA含量测定试剂盒购自南京建成生物公司。
1.2AD模型小鼠的鉴定与分组清洁级C57BL/6 APP转基因小鼠购自中国协和医科大学动物所,合笼繁殖。实验选用4月龄小鼠,采用PCR技术进行鉴定:剪取0.3 cm鼠尾,提取全DNA,PCR扩增APP基因,扩增引物序列为: 5’-CCCTGAACCT GAAACATAAAAT-3’和5’-GCTACGAAAATCCAAC CTACAA-3’,经琼脂糖凝胶电泳共鉴定出40只APP+小鼠,然后按随机数字表法分为APP+组、hUC-MSCs组、rhMG53组和rhMG53联合hUC-MSCs组(联合组),每组10只。APP+组小鼠通过尾静脉注射0.2 mL生理盐水,hUC-MSCs组同法注射0.2 mL细胞密度为5×106mL-1的第3代hUC-MSCs悬液,rhMG53组按2 mg/kg注射0.2 mL rhMG53,联合组小鼠注射含细胞密度为5×106mL-1的第3代hUC-MSCs和含rhMG53(2 mg/kg) 的混合液0.2 mL。1次/d,共3 d。
1.4Morris水迷宫检测小鼠学习记忆能力小鼠注射结束后3周进行适应性训练1周,然后进行空间探索实验。撤去平台,小鼠分别从4个象限的固定位置入水,观察并利用摄像采集器记录小鼠游泳轨迹,统计穿越平台次数、逃避潜伏期和平台所在象限停留时间等参数。
1.5小鼠血清SOD活性和MDA含量检测Morris水迷宫实验结束后,各组分别选取3只小鼠,活体心脏取血,2 000×g离心5 min,收集上清,-80 ℃保存。根据南京建成生物公司试剂盒说明书推荐方法使用酶标仪检测小鼠血清中SOD活性,使用分光光度法检测小鼠血清中MDA含量。
1.6小鼠脑组织衰老相关基因(sirt2、pCNA、p16、p53)mRNA和蛋白表达的检测Morris水迷宫实验结束后,各组分别取3只小鼠,处死后取出脑组织,匀浆后Trizol裂解法提取总RNA,测RNA浓度和完整性后-80 ℃保存。取500 ng总RNA,反转录合成cDNA。以小鼠GAPDH为内参,根据试剂盒说明书配制反应体系,进行qRT-PCR,每个样品设3个复孔。数据分析采用比较Ct法,相对表达量=2-ΔΔCt,重复3次。实验所用相关引物序列参考课题组前期文献[6]报道。
1.7统计学处理采用SPSS 19.0处理数据。应用两独立样本t检验比较hUC-MSCs组和联合组hUC-MSCs迁移数量,应用析因设计的方差分析比较rhMG53和hUC-MSCs移植对水迷宫实验结果、血清中SOD活性及MDA含量、脑组织中衰老相关基因mRNA及蛋白相对表达量的影响,检验水准α=0.05。
2结果
2.1APP转基因小鼠的鉴定经PCR扩增,电泳结果显示在284 bp处有条带(图1),为APP转基因鼠,共获得40只APP+小鼠。
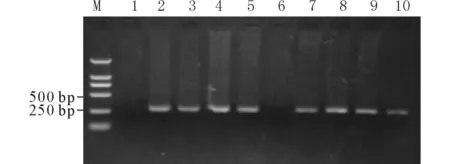
M:100 bp Marker;1和6为APP-小鼠,其余为APP+小鼠。图1 APP转基因小鼠鉴定的PCR产物电泳图
2.24组小鼠脑组织hUC-MSCs的迁移APP+组和rhMG53组未见hUC-MSCs迁移,hUC-MSCs组和联合组小鼠脑组织中hUC-MSCs的迁移数分别为(54.66±3.53)和(129.33±4.97) mm-2,且联合组高于hUC-MSCs组(t=12.238,P<0.001)。
2.34组小鼠学习记忆能力的检测Morris水迷宫测试结果见表1。hUC-MSCs移植可使APP+小鼠的逃避潜伏期缩短,穿越平台次数以及平台所在象限停留时间增加。

表1 4组小鼠水迷宫测试结果
2.44组小鼠血清SOD活性及MDA含量的比较见表2。hUC-MSCs移植和rhMG53均可使APP+小鼠血清中SOD活性增加,MDA含量下降,二者联用对MDA的影响具有协同效应。

表2 4组小鼠血清SOD活性及MDA含量的变化
2.54组小鼠脑组织中衰老相关基因mRNA和蛋白表达量的变化结果见图2,表3、4。
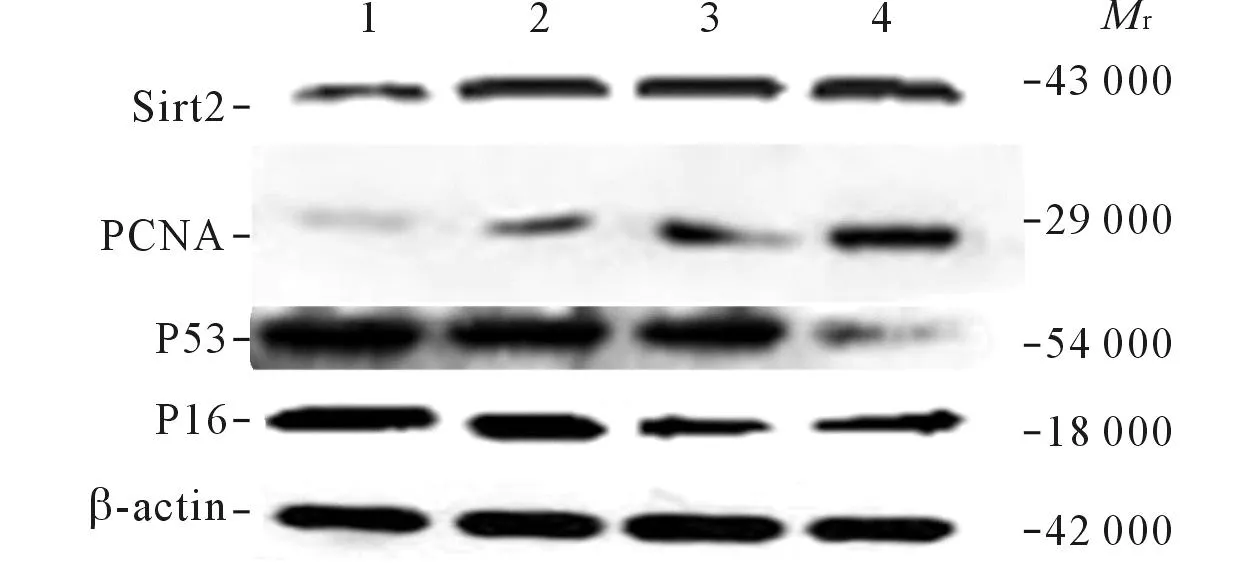
1~4:分别为APP+组、hUC-MSCs组、rhMG53组和联合组。图2 4组小鼠脑组织中衰老相关蛋白的表达
hUC-MSCs移植和rhMG53均可使小鼠脑组织中sirt2和pCNA基因mRNA和蛋白的相对表达量升高,p16、p53 mRNA和蛋白的相对表达量下降;hUC-MSCs与rhMG53联用对多数衰老基因mRNA和蛋白表达的影响有协同作用。
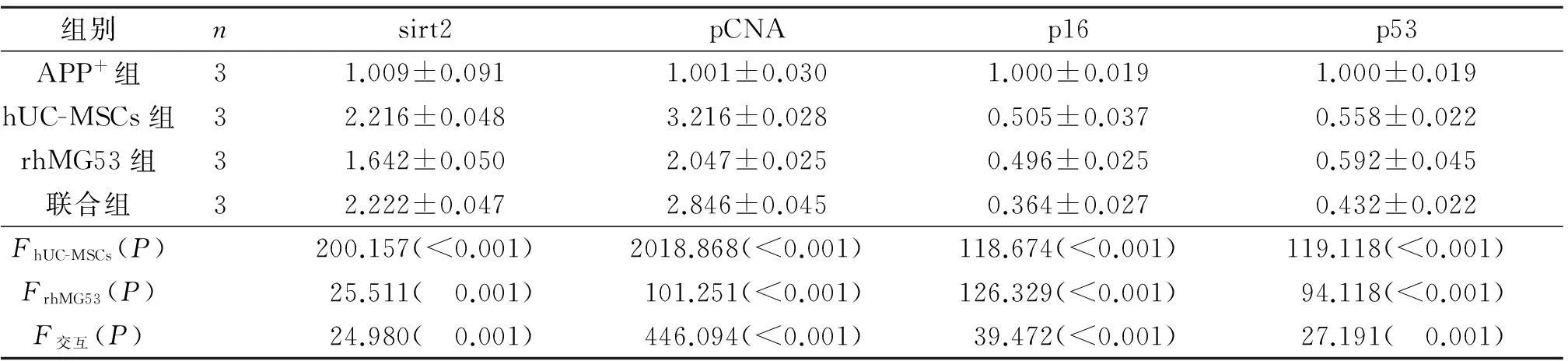
表3 4组小鼠脑组织中衰老相关基因mRNA的表达变化
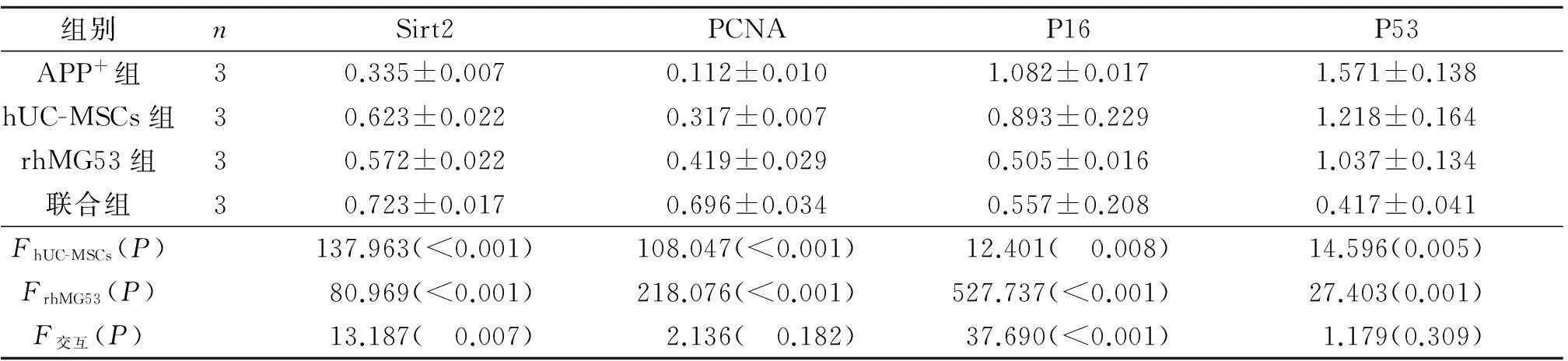
表4 4组小鼠脑组织中衰老相关基因蛋白水平的表达变化
3讨论
AD是一种神经系统退行性疾病,主要表现为认知功能障碍和行为异常[7]。干细胞通过替代受损神经元或者分泌营养因子对AD起到治疗作用[8]。提高外源性干细胞在脑内的存活和迁移效率是提高干细胞治疗效果亟待解决的问题[9]。
MG53蛋白在脑组织中不表达[10],但能够保护体外培养的神经细胞,参与神经细胞的损伤修复[3];而且rhMG53能够保护体外培养的骨髓间充质干细胞免受氧化损伤[11]。该研究以外源rhMG53蛋白为切入点,研究rhMG53对hUC-MSCs治疗APP+鼠的影响。作者首先采用Morris水迷宫测试了各组小鼠行为学变化,结果发现hUC-MSCs移植可使AD小鼠逃避潜伏期缩短、穿越平台次数增多、平台所在象限停留时间增加,与已有文献[12-13]报道一致,但未发现hUC-MSCs和rhMG53有协同作用。MAB1281是人细胞核的特异性抗体,用MAB1281作为指示能够鉴定外源的hUC-MSCs在小鼠组织中的迁移。该研究发现rhMG53联合hUC-MSCs治疗组较单用hUC-MSCs组hUC-MSCs的迁移明显增多,说明rhMG53对体内hUC-MSCs的损伤发挥保护作用,并促进其存活和迁移。生化水平上,SOD活性直接反映机体清除自由基的能力,而MDA含量反映了机体内自由基积累程度和脂质过氧化损伤程度,二者可反映体内的氧化水平。该研究结果显示hUC-MSCs移植可使小鼠血清SOD活性升高,MDA含量降低,说明机体的抗氧化水平提高,降低了氧化应激的损害,且联合组血清MDA含量较hUC-MSCs组更低。分子水平上,作者检测了脑组织中衰老相关基因的表达,结果发现rhMG53和hUC-MSCs移植均可使增殖活力相关基因sirt2、pCNA的表达增加,而衰老相关基因p16、p53的表达降低,说明rhMG53和hUC-MSCs移植能够不同程度提高脑组织细胞的活力,延缓AD小鼠的衰老,并且二者联用对多数衰老相关基因有协同作用。
综上所述,hUC-MSCs可以改善AD鼠的学习和记忆能力,提高小鼠体内的抗氧化水平、延缓AD的衰老进程;rhMG53可促进hUC-MSCs的迁移和存活,二者联合较hUC-MSCs单一治疗效果更加明显,可能在AD治疗中具有潜在的应用价值。
参考文献
[1]SARNOWSKA A,JABLONSKA A,JURGA M,et al.Encapsulation of mesenchymal stem cells by bioscaffolds protects cell survival and attenuates neuroinflammatory reaction in injured brain tissue after transplantation[J].Cell Transplant,2013,22(Suppl 1):S67
[2]STEINBECK JA,STUDER L.Moving stem cells to the clinic: potential and limitations for brain repair[J].Neuron,2015,86(1):187
[3]WEISLEDER N,TAKIZAWA N,LIN P,et al.Recombinant MG53 protein modulates therapeutic cell membrane repair in treatment of muscular dystrophy[J].Sci Transl Med,2012,4(139):139ra85
[4]LIU J,ZHU H,ZHENG Y,et al.Cardioprotection of recombinant human MG53 protein in a porcine model of ischemia and reperfusion injury[J].J Mol Cell Cardiol,2015,80:10
[5]JIA Y,CHEN K,LIN P,et al.Treatment of acute lung injury by targeting MG53-mediated cell membrane repair[J].Nat Commun,2014,5:4387
[6]崔渊博,马珊珊,姚宁,等.人脐带间充质干细胞移植对老年痴呆小鼠脑、肝组织中衰老相关基因表达的影响[J].郑州大学学报(医学版),2015,50(1):25
[7]GREIG NH,LAHIRI DK.Advances in understanding Alzheimer′s disease,and the contributions of current Alzheimer research:ten years on and beyond[J].Curr Alzheimer Res,2014,11(2):107
[8]LEE IS,JUNG K,KIM IS,et al.Human neural stem cells alleviate Alzheimer-like pathology in a mouse model[J].Mol Neurodegener,2015,10:38
[9]TONG LM,FONG H,HUANG Y. Stem cell therapy for Alzheimer′s disease and related disorders: current status and future perspectives[J].Exp Mol Med,2015,47:e151
[10]CAI C,MASUMIYA H,WEISLEDER N,et al.MG53 nucleates assembly of cell membrane repair machinery[J].Nat Cell Biol,2009,11(1):56
[11]LI X,XIAO Y,CUI Y,et al.Cell membrane damage is involved in the impaired survival of bone marrow stem cells by oxidized low-density lipoprotein[J].J Cell Mol Med,2014,18(12):2445
[12]D′HOOGE R,De Deyn PP.Applications of the Morris water maze in the study of learning and memory[J].Brain Res Brain Res Rev,2001,36(1):60
[13]崔渊博.高表达Sirt2人脐带间充质干细胞移植对APP+鼠的抗衰老作用及机制研究[D].郑州:郑州大学,2014.
(2015-10-29收稿责任编辑徐春燕)
doi:10.13705/j.issn.1671-6825.2016.04.002
#通信作者:关方霞,女,1969年2月生,博士,教授,研究方向:干细胞与再生医学, E-mail: guanfangxia@126.com;马珊珊,女,1984年5月生,博士,副教授,研究方向:干细胞生物学特性分析,E-mail: mashanshan84@163.com
中图分类号R592
关键词rhMG53;阿尔茨海默病;间充质干细胞;干细胞移植;小鼠
Therapeutic effects of rhMG53 combination with hUC-MSCs transplantation on Alzheimer′s disease mice
SONG Jishi1), MA Shanshan1), MENG Nan2), WANG Xinxin2), YAO Ning3), ZHU Xiangzhan3), CHENG Kang1), YANG Bo2), GUAN Fangxia1,2)
1)StemCellLaboratory,SchoolofLifeSciences,ZhengzhouUniversity,Zhengzhou4500012)StemCellLaboratory,theFirstAffiliatedHospital,ZhengzhouUniversity,Zhengzhou4500523)China-US(Henan)HormelCancerInstitute,Zhengzhou450000
Key wordsrhMG53;Alzheimer′s disease;mesenchymal stem cell;stem cell transplantation;mouse
AbstractAim: To research the effects of rhMG53 combination with hUC-MSCs transplantation on Alzheimer′s disease mice. Methods: Forty APP+ mice were randomly allocated into four groups: APP+ group, hUC-MSCs group, rhMG53 group and rhMG53 combined with hUC-MSCs group. The migration of hUC-MSCs was quantified by immunohistochemistry at one week after transplantation. And the learning and memory ability was measured by Morris water maze test at three weeks after transplantation. The activity of superoxide dismutase(SOD) and the concentration of malonaldehyde(MDA) in the serum were also quantified. qRT-PCR and Western blot were used to detect the expressions of senescence related factors(sirt2,pCNA,p16,p53). Results: No migration of hUC-MSCs was found in APP+ group or rhMG53 group, while it was observed in the hUC-MSCs group and the combined group, and the amount of migration cells was higher in the combined group(P<0.05). hUC-MSCs transplantation decreased the escaping latency, increased the times of crossing platform and the time spent in the platform quadrant(P<0.05). hUC-MSCs transplantation and rhMG53 could both increase the activity of SOD and decrease the content of MDA in the serum of APP+ mice, and rhMG53 combined with hUC-MSCs transplantation had synergistic effect on MDA(P<0.05). hUC-MSCs transplantation and rhMG53 could both increase the expressions of sirt2 and pCNA mRNA and protein in the brain tissue of APP+ mice, and rhMG53 combined with hUC-MSCs transplantation had synergistic effect on the expression of most aging genes(P<0.05).Conclusion: rhMG53 can improve the migration of hUC-MSCs in brain tissue of APP+ mice, and promote the therapeutic effect of hUC-MSCs on APP+ mice.
*国家自然科学基金资助项目81471306,U1404313;河南省科技创新人才计划154200510008;河南省高校科技创新团队支持计划15IRTSTHN022;河南省产学研合作项目142107000008