β-胡萝卜素对食管鳞癌EC1细胞增殖、凋亡、迁移及细胞周期的影响*
2016-08-11朱相展张彦婷张楠楠李庆华马珊珊关方霞1
朱相展,张彦婷,杨 露,张楠楠,李庆华,马珊珊,张,关方霞1,#
1)郑州大学生命科学学院 郑州 450001 2)郑州大学第一附属医院干细胞实验室 郑州 450052
β-胡萝卜素对食管鳞癌EC1细胞增殖、凋亡、迁移及细胞周期的影响*

1)郑州大学生命科学学院 郑州 4500012)郑州大学第一附属医院干细胞实验室 郑州 450052
摘要目的:观察β-胡萝卜素对食管鳞癌EC1细胞增殖、凋亡、迁移及细胞周期的影响。方法:用不同浓度(1、5、10、20、30、50 μmol/L)β-胡萝卜素分别处理EC1细胞12、24、36、48、60、72 h后,CCK-8法检测β-胡萝卜素对EC1细胞增殖率的影响,筛选β-胡萝卜素的最佳处理时间及浓度;随后,在此条件下将EC1细胞分为3组(阴性对照组、空白对照组和实验组),采用Annexin V-FITC/PI双染法检测细胞凋亡,流式细胞仪检测细胞周期的变化,Transwell迁移实验检测细胞迁移能力的变化,Western blot检测小窝蛋白1(Cav-1)、p-Akt、p-NF-κB、Bcl-2、Caspase-3、E-cadherin蛋白表达水平的变化。结果:经筛选,选用50 μmol/L β-胡萝卜素作用EC1细胞48 h进行后续实验。与阴性对照组和空白对照组相比,实验组EC1细胞凋亡率显著提高(P<0.001),G0/G1期细胞比例增加(P<0.001),而S期细胞比例降低(P<0.001),发生迁移的细胞数量减少(P<0.001),且细胞黏附因子E-cadherin的表达显著增加(P<0.001),Cav-1及AKT信号通路关键蛋白p-Akt、p-NF-κB、Bcl-2表达量明显下调,而Caspase-3的表达被激活(P<0.001)。结论:β-胡萝卜素能够有效促进EC1细胞的凋亡,推测可能是通过抑制Cav-1介导的AKT/NF-κB信号通路发挥作用。
食管癌是一种上消化道高发性恶性肿瘤,其发病率和病死率均位于恶性肿瘤的前列。β-胡萝卜素是一种多烯烃类化合物,具有清除氧自由基的能力,是维护人体健康不可缺少的营养物质,在抗癌、预防心血管疾病、白内障及抗氧化方面具有显著的作用。王尤丽等[1]发现,膳食维生素A及β-胡萝卜素含量低可增加食管癌发生率。研究[2-4]表明β-胡萝卜素可以抑制胃癌、结肠癌、乳腺癌、脑垂体瘤等多种肿瘤细胞的增殖,并诱导细胞凋亡。此外,β-胡萝卜素能够抑制食管鳞癌EC9706细胞增殖,但其相关分子机制尚不明确[5]。实验研究[6]表明,β-胡萝卜素可以通过多种机制抑制肿瘤细胞的增殖。Palozza等[7]研究发现,小窝蛋白-1(Cav-1)能够调节结肠癌细胞和前列腺癌细胞对β-胡萝卜素的敏感性。Cav-1是细胞质膜微囊主要结构蛋白,作为小窝的主要部分能够参与许多重要的细胞过程,如胆固醇体内平衡、膜泡运输、细胞迁移、细胞周期和信号转导等。Cav-1在肿瘤发生中的作用仍然存在争议,虽然多数研究认为Cav-1的编码基因是一种肿瘤抑制基因[8],但部分研究发现Cav-1在一些肿瘤细胞中呈高表达[9-11]。Ando等[12]研究发现,在15株食管鳞癌TE1-15细胞中,Cav-1呈现高表达,而在正常食管上皮细胞Het-1A中不表达;因此,Cav-1可能促进食管鳞癌的发生。由此,作者推测β-胡萝卜素可能通过抑制Cav-1的表达,影响食管鳞癌EC1细胞内的信号调控,进而抑制细胞增殖并促进凋亡。研究[9-10,13]发现,Cav-1参与调节AKT信号通路活性,进而抑制膀胱癌等多种肿瘤细胞的增殖与促凋亡过程。因此,该研究通过观察β-胡萝卜素对食管鳞癌EC1细胞增殖、凋亡、迁移及细胞周期的影响,并分析Cav-1介导的AKT/NF-κB信号通路在这一过程中发挥的作用,探讨β-胡萝卜素诱导食管鳞癌EC1细胞凋亡的分子机制。
1材料与方法
1.1材料食管鳞癌EC1细胞株由郑州大学第一附属医院细胞生物学实验室保存,β-胡萝卜素、四氢呋喃(美国Sigma公司),RPMI 1640培养基及胰蛋白酶(美国HyClone公司),标准胎牛血清(FBS)(美国Gibco公司),Transwell小室(美国Corning公司),结晶紫染色液(北京碧云天公司),Cav-1、p-Akt、p-NF-κB单克隆抗体(美国CST公司),GAPDH、Bcl-2多克隆抗体和细胞全蛋白提取试剂盒(上海生工生物工程有限公司),E-cadherin、Caspase-3多克隆抗体(武汉三鹰生物技术有限公司),Annexin V-FITC/PI双染细胞凋亡检测试剂盒、细胞周期检测试剂盒(美国BD公司)。β-胡萝卜素溶解于四氢呋喃配制成10 mmol/L母液。
1.2细胞培养使用含体积分数10%FBS的RPMI 1640培养基于37 ℃、体积分数5% CO2培养箱内培养EC1细胞,2 d传代1次。实验时将EC1细胞接种于培养板中,待细胞生长至对数生长期后用于后续实验。
1.3细胞增殖的CCK-8检测收集对数生长期的EC1细胞,调整细胞密度至5×104mL-1,接种于96孔板中,每孔加入100 μL细胞悬液。细胞贴壁24 h后,分别加入1、5、10、20、30、50 μmol/L的β-胡萝卜素作为实验组,同时加入相同剂量四氢呋喃作为阴性对照,以不含细胞的完全培养基作为空白对照,每组设置3个平行复孔;分别处理12、24、36、48、60、72 h后,弃去培养基,每孔加入100 μL无血清培养基和10 μL的CCK-8溶液反应2 h,随后用酶标仪450 nm波长处读取各孔的吸光度值(OD),并计算细胞增殖抑制率。抑制率=[(OD阴性对照孔-OD实验孔)/(OD阴性对照孔-OD空白对照孔)]×100%。
1.4细胞凋亡的检测取对数生长期的EC1细胞,实验组加入50 μmol/L的β-胡萝卜素,阴性对照组加入相同剂量的四氢呋喃,以正常培养基培养的细胞作为空白对照组。继续培养48 h后,用不含EDTA的胰蛋白酶消化细胞,离心收集并调整细胞密度为1×106mL-1,用PBS洗2次,分别加入100 μL 1×binding buffer、5 μL Annexin V-FITC和PI,混匀后,置于室温避光反应15 min,随后加入500 μL 1×binding buffer,在1 h内避光上机检测细胞凋亡率。每组设置3个复孔。
1.5各组细胞细胞周期的流式细胞术检测离心收集不同处理组的EC1细胞(处理方法同1.4部分),调整细胞密度为1×106mL-1,PBS清洗1~2遍,加入450 μL PBS将细胞重悬,随后加入到1 mL预冷的体积分数70%乙醇中,置于4 ℃过夜固定;离心弃去乙醇,PBS清洗1~3次;加入500 μL 50 mg/L RNase A/PI孵育液,室温避光放置15 min后利用流式细胞仪检测细胞周期。每组设置3个复孔。
1.6各组细胞迁移能力的检测离心收集不同处理组的EC1细胞(处理方法同1.4部分),调整细胞密度为1×106mL-1;24孔培养板中加入600 μL含体积分数5% FBS以及体积分数0.5% BSA的培养基,小室中加入300 μL上述制备的细胞悬液,置于CO2培养箱中培养12 h;取出装有Transwell小室的24孔培养板,弃去小室中剩余培养基,甲醇室温固定30 min;PBS清洗小室中残留甲醇溶液,加入10 g/L的结晶紫,室温染色30 min;PBS清洗3遍,将多余的染料洗掉,用脱脂棉球轻轻擦拭小室上层未迁移的细胞,在倒置显微镜下观察并拍照分析。
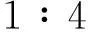
1.8统计学处理采用SPSS 19.0进行分析,应用析因设计的方差分析选择β-胡萝卜素的最佳作用浓度及时间,应用单因素方差分析和LSD-t检验比较各组细胞的细胞周期、迁移、黏附能力的差异以及各组细胞中AKT/NF-κB信号通路关键因子Cav-1、p-AKT、p-NF-κB、Bcl-2、Caspase-3蛋白表达的影响。检验水准α=0.05。
2结果
2.1β-胡萝卜素最佳作用浓度及时间的筛选结果见表1。由表1可知, 50 μmol/L β-胡萝卜素作用EC1细胞48 h时细胞增殖的抑制率接近50%,因此可作为最佳作用浓度及作用时间,用于后续实验。

表1 β-胡萝卜素对EC1细胞增殖的抑制率(n=3) %
F时间=407.382,F浓度=1 021.861,F交互=89.012,P均<0.001。
2.2β-胡萝卜素对EC1细胞凋亡的影响50 μmol/L β-胡萝卜素作用细胞48 h后,与阴性对照组(0.49%±0.23%)和空白对照组(0.41%±0.21%)相比,实验组细胞凋亡细胞比例(7.50%±0.43%)显著增加(F=496.224,P<0.001)。
2.3β-胡萝卜素对EC1细胞周期的影响见表2。结果表明,实验组细胞被阻滞在G0/G1期。
2.4β-胡萝卜素对EC1细胞迁移和黏附能力的影响结果见表3、图1。由结果可知,β-胡萝卜素能够抑制EC1细胞迁移,提高细胞中黏附因子E-cadherin的表达。
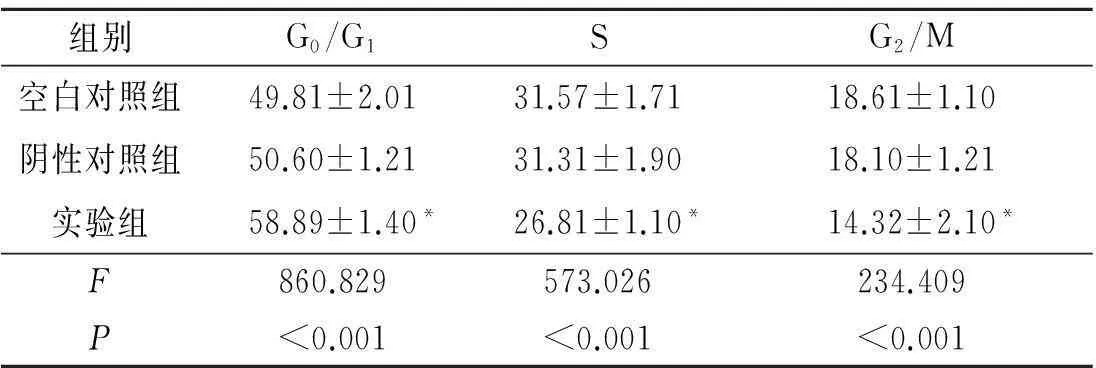
表2 β-胡萝卜素对EC1细胞周期的影响(n=3) %

表3 β-胡萝卜素对EC1细胞迁移和黏附能力的影响(n=3) %
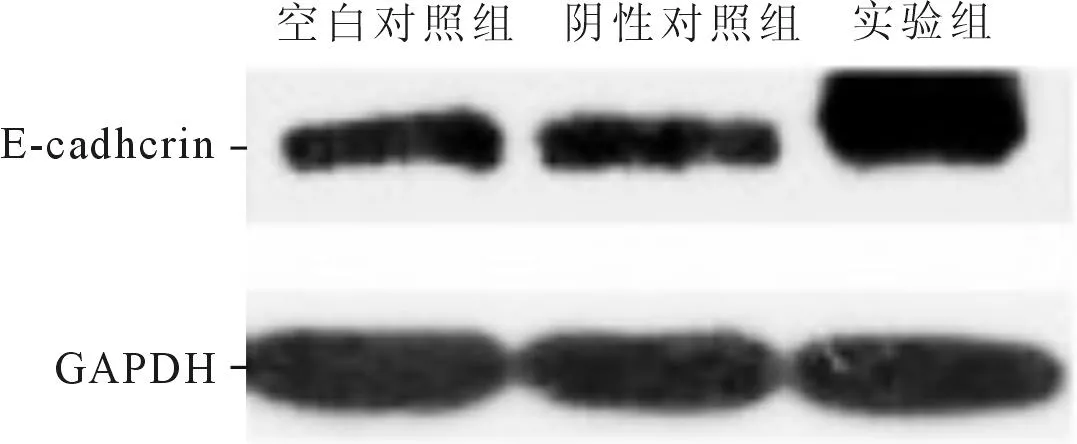
图1 β-胡萝卜素对EC1细胞E-cadherin蛋白表达的影响
2.5β-胡萝卜素对AKT/NF-κB信号通路关键因子表达的影响见图2、表4。结果表明,经过50 μmol/L β-胡萝卜素处理后,EC1细胞中Cav-1表达下调,p-AKT、p-NF-κB蛋白表达量显著降低。此外,Bcl-2蛋白表达量降低,Caspase-3蛋白活性增强。
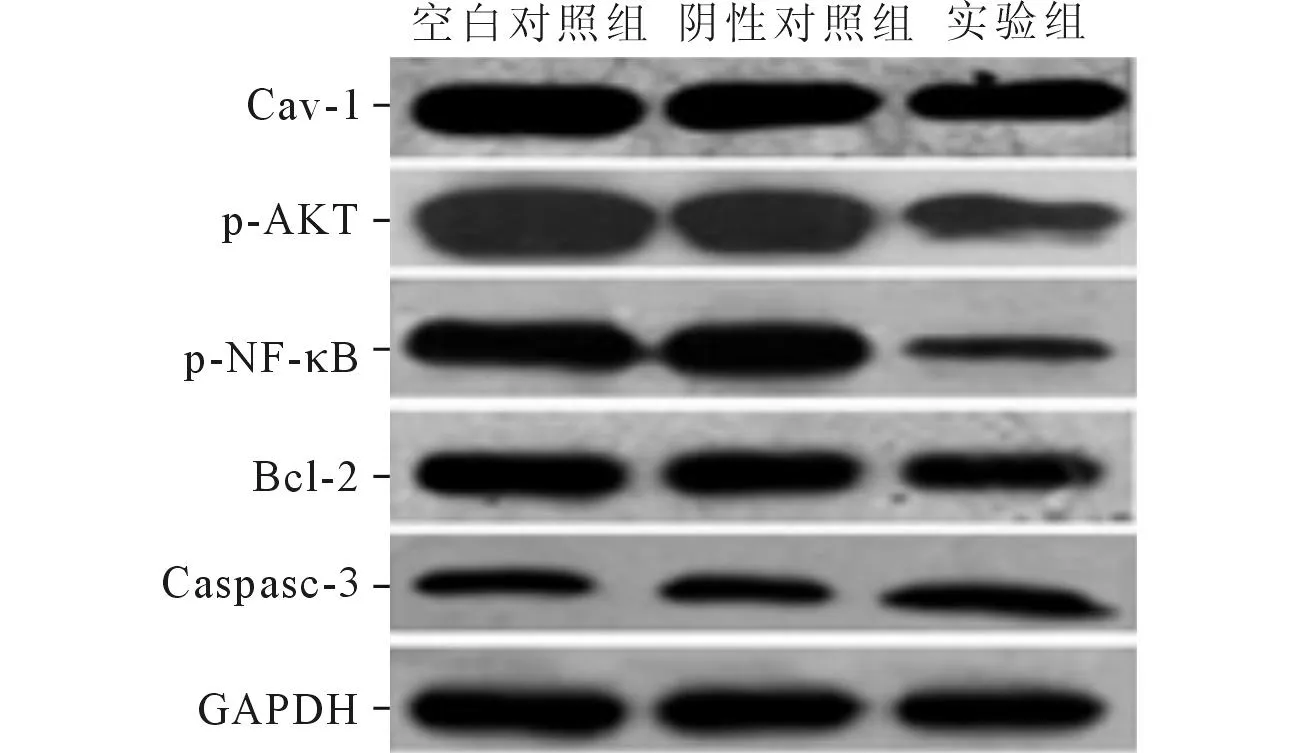
图2 50 μmol/L β-胡萝卜素作用48 h后EC1细胞内Cav-1、p-AKT、p-NF-κB 、Bcl-2、Caspase-3蛋白表达的变化
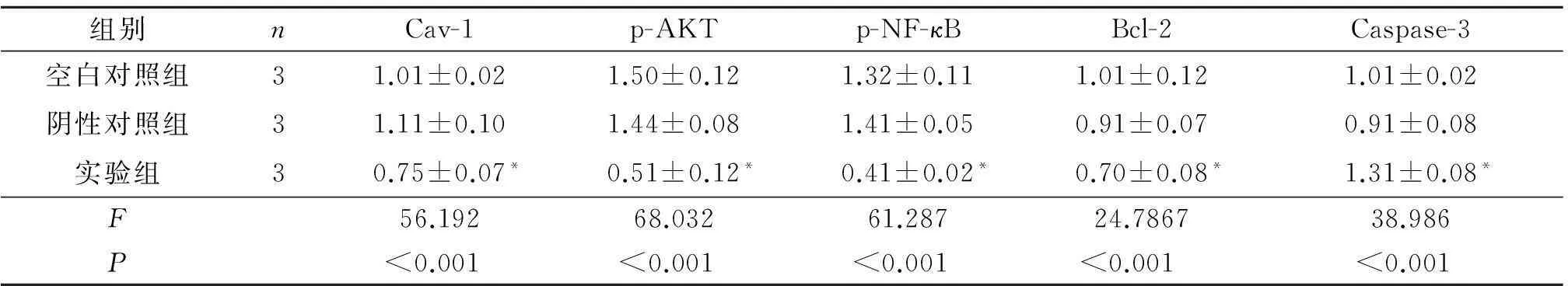
组别nCav-1p-AKTp-NF-κBBcl-2Caspase-3空白对照组31.01±0.021.50±0.121.32±0.111.01±0.121.01±0.02阴性对照组31.11±0.101.44±0.081.41±0.050.91±0.070.91±0.08实验组30.75±0.07*0.51±0.12*0.41±0.02*0.70±0.08*1.31±0.08*F56.19268.03261.28724.786738.986P<0.001<0.001<0.001<0.001<0.001
3讨论
β-胡萝卜素是一种共轭双烯烃化合物,广泛存在于绿色植物、真菌和藻类中。作为抗氧化剂,β-胡萝卜素具有增强免疫力,补充维生素A原以及抗辐射等作用。研究[14]表明,β-胡萝卜素不仅能够抑制脑垂体瘤细胞株AtT20的增殖,而且促进其细胞凋亡。Wang等[5]研究发现,β-胡萝卜素能够有效抑制食管鳞癌EC9706细胞增殖。作者的研究结果表明β-胡萝卜素对食管鳞癌EC1细胞增殖同样具有明显的抑制效果,且能够促进细胞凋亡的发生,将细胞阻滞在G0/G1期。
近年来,上皮细胞间质转化在肿瘤转移方面的作用及其相关机制的研究逐渐成为热点。肿瘤细胞发生上皮细胞间质转化时除了细胞形态、细胞极性、抗凋亡能力等形态学及生物学行为改变外,同时通常伴有细胞表面蛋白表达异常,如上皮性-钙黏蛋白[15]。近期研究[16]显示,通过调节NF-κB、AKT、JNK等蛋白的磷酸化水平能够增加E-cadherin的表达,进而降低肿瘤细胞的迁移能力。另外,研究[3]发现,β-胡萝卜素能够抑制神经母细胞瘤细胞的侵袭和迁移。该实验证实β-胡萝卜素作用于食管鳞癌EC1细胞后,细胞迁移数量显著减少,并且黏附因子E-cadherin表达量明显升高,说明β-胡萝卜素能够抑制食管鳞癌EC1细胞的迁移能力,且提高细胞黏附能力。
大量实验研究[2,6,17]表明,β-胡萝卜素可以通过多种机制抑制肿瘤细胞的增殖,包括激活Caspases、释放细胞色素C、上调PPAR-γ、调节细胞内ROS水平等。有研究[7]发现,Cav-1在β-胡萝卜素促进结肠癌细胞和前列腺癌细胞凋亡的过程中发挥关键的调节作用。Cav-1是一种膜整合蛋白,相对分子质量为21 000~24 000,能够与多种信号分子结合形成复合体,进而调控细胞内信号转导,参与多种生命活动,如分化、增殖、肿瘤发生等[11]。一项临床病例分析[18]表明Cav-1在食管鳞癌细胞株TE1-15中高表达,而正常食管上皮细胞Het-1A中不表达。因此,作者推测Cav-1可能参与β-胡萝卜素诱导食管鳞癌EC1细胞凋亡的过程。此外,还有研究[13,19]表明Cav-1在PI3K/AKT信号通路中发挥重要的调节作用。因此,作者检测了β-胡萝卜素作用食管鳞癌EC1细胞后细胞中Cav-1及AKT信号通路关键因子表达变化情况,结果表明,β-胡萝卜素能够显著降低Cav-1的表达,并且抑制AKT活性。作为AKT下游靶蛋白,核转录因子NF-κB在多种肿瘤细胞中呈高表达,并且受AKT磷酸化调节。此外,研究[2,6]发现β-胡萝卜素可以通过不同的作用机制激活Caspase活性并抑制抗凋亡蛋白Bcl-2,从而促进细胞凋亡。而该实验研究结果证实β-胡萝卜素能够通过抑制AKT磷酸化水平,进而降低NF-κB的活性,下调Bcl-2的表达,并激活Caspase-3,从而发挥其促进食管鳞癌EC1细胞凋亡的作用。
综上所述,β-胡萝卜素能够有效抑制细胞增殖并促进细胞凋亡,将细胞阻滞在G0/G1期,同时降低细胞的迁移能力,且Cav-1介导的AKT/NF-κB信号通路参与了β-胡萝卜素对食管鳞癌EC1细胞的促凋亡作用。
参考文献
[1]王尤丽,刘艳华,时松和,等.不同发展阶段食管癌人群膳食模式及维生素A、E和β-胡萝卜素摄入量的比较[J].郑州大学学报(医学版),2011,46(4):511
[2]PARK Y,CHOI J,LIM JW,et al.β-Carotene-induced apoptosis is mediated with loss of Ku proteins in gastric cancer AGS cells[J].Genes Nutr,2015,10(4):467
[3]KIM YS,LEE HA,LIM JY,et al.β-Carotene inhibits neuroblastoma cell invasion and metastasis in vitro and in vivo by decreasing level of hypoxia-inducible factor-1α[J].J Nutr Biochem,2014,25(6):655
[4]GLORIA NF,SOARES N,BRAND C,et al.Lycopene and beta-carotene induce cell-cycle arrest and apoptosis in human breast cancer cell lines[J].Anticancer Res,2014,34(3):1377
[5]WANG SK,YANG L,WANG TT,et al.Inhibition of proliferation and induction of apoptosis by the combination of β-carotene and 1,25-dihydroxyvitamin D3 in human esophageal cancer EC9706 cells[J].Asian Pac J Cancer Prev,2012,13(12):6327
[6]王景川,庞广昌.β-胡萝卜素的抗肿瘤作用及其分子机制研究进展[J].食品科学,2008,29(10):665
[7]PALOZZA P,SESTITO R,PICCI N,et al.The sensitivity to beta-carotene growth-inhibitory and proapoptotic effects is regulated by caveolin-1 expression in human colon and prostate cancer cells[J].Carcinogenesis,2008,29(11):2153
[8]GOETZ JG,LAJOIE P,WISEMAN SM,et al.Caveolin-1 in tumor progression: the good, the bad and the ugly[J].Cancer Metastasis Rev,2008,27(4):715
[9]MARTINEZ-OUTSCHOORN UE,SOTGIA F,LISANTI MP.Caveolae and signalling in cancer[J].Nat Rev Cancer,2015,15(4):225
[10]LIANG W,HAO Z,HAN JL,et al.CAV-1 contributes to bladder cancer progression by inducing epithelial-to-mesenchymal transition[J].Urol Oncol,2014,32(6):855
[11]PARTON RG,DEL POZO MA.Caveolae as plasma membrane sensors, protectors and organizers[J].Nat Rev Mol Cell Biol,2013,14(2):98
[12]ANDO T,ISHIGURO H,KIMURA M,et al.The overexpression of caveolin-1 and caveolin-2 correlates with a poor prognosis and tumor progression in esophageal squamous cell carcinoma[J].Oncol Rep,2007,18(3):601
[13]MA W,WANG DD,LI L,et al.Caveolin-1 plays a key role in the oleanolic acid-induced apoptosis of HL-60 cells[J].Oncol Rep,2014,32(1):293
[14]HADDAD NF,TEODORO AJ,LEITE DE OLIVEIRA F,et al.Lycopene and beta-carotene induce growth inhibition and proapoptotic effects on ACTH-secreting pituitary adenoma cells[J].PLoS One,2013,8(5):e62773
[15]周庚寅,蔡永萍.上皮间叶转化的研究进展[J].郑州大学学报(医学版),2010,45(3):353
[16]HUANG YL,CHU YL,HO CT,et al.Antcin K,an active triterpenoid from the fruiting bodies of basswood-cultivated antrodia cinnamomea,inhibits metastasis via suppression of integrin-mediated adhesion,migration,and invasion in human hepatoma cells[J].J Agric Food Chem,2015,63(18):4561
[17]FIEDOR J,BURDA K.Potential role of carotenoids as antioxidants in human health and disease[J].Nutrients,2014,6(2):466
[18]KATO K,HIDA Y,MIYAMOTO M,et al.Overexpression of caveolin-1 in esophageal squamous cell carcinoma correlates with lymph node metastasis and pathologic stage[J].Cancer,2002,94(4):929
[19]WANG YP,LIN CF,TSAI SC,et al.Upregulation of Caveolin-1 correlate with Akt expression and poor prognosis in NPC patients[J].Laryngoscope,2015,125(7):E231
(2015-05-04收稿责任编辑赵秋民)
doi:10.13705/j.issn.1671-6825.2016.04.001
#通信作者,女,1969年2月生,博士,教授,研究方向:生物医学,E-mail:guanfangxia@126.com
中图分类号R735.1
关键词β-胡萝卜素;食管鳞癌;Cav-1/AKT/NF-κB;凋亡
Effects of β-carotene on proliferation, apoptosis, migration and cell cycle of EC1 cells
1)CollegeofLifeSciences,ZhengzhouUniversity,Zhengzhou4500012)StemCellLaboratory,theFirstAffiliatedHospital,ZhengzhouUniversity,Zhengzhou450052
Key wordsβ-carotene;esophageal squamous cell carcinoma;Cav-1/AKT/NF-κB;apoptosis
AbstractAim: To investigate the effects of β-carotene on the proliferation, apoptosis, migration and cell cycle of human esophageal cancer EC1 cells and to study its related molecular mechanism.Methods: After treatment with different concentrations (1, 5, 10, 20, 30 and 50 μmol/L) of β-carotene for 12, 24, 36, 48, 60 and 72 h, the proliferation rate was tested by CCK-8 assay to determine the optimal time and concentration,EC1 cells were allocated into 3 groups: negative control group, blank control group and treatment group. Then the cell cycle and apoptosis were detected by FCM and Annexin V-FITC/PI staining respectively; the cell migration was measured by Transwell assay; effects of the β-carotene on protein expressions of Cav-1, p-Akt, p-NF-κB, Bcl-2, Caspase-3 and E-cadherin were detected by Western blot. Results: After screening, the optimal dose of β-carotene and treatment time for EC1 cells were determined as 50 μmol/L and 48 h. After treatment with β-carotene,compared with negative control group and blank control group,EC1 cells in treatment group had a higher apoptosis rate(P<0.001),the cell cycle changed significantly with an increase in G0/G1 phase cells (P<0.001) and a decrease in S phase cells (P<0.001),and the number of migrating cells was significantly less(P<0.001). Meanwhile, the expression of E-cadherin in the treatment group was increased significantly(P<0.001),p-Akt, p-NF-κB and Bcl-2 decreased,and Caspase-3 was activated(P<0.001).Conclusion: β-carotene can effectively induce apoptosis of EC1 cells, which may be mediated by Cav-1 via AKT/NF-κB signaling pathway.
*国家自然科学基金资助项目81071008,81471306,U1404313;河南省科技创新人才计划154200510008;河南省高校科技创新团队支持计划15IRTSTHN022;河南省产学研合作项目142107000008
*:与阴性对照组相比,P<0.05。
*:与阴性对照组相比,P<0.05。
*:与阴性对照组相比,P<0.05。
