锦鲫幼鱼标准代谢率与生长性能的关联
2016-08-10李秀明付世建曾令清
刘 欢 李秀明 付世建 曾令清
锦鲫幼鱼标准代谢率与生长性能的关联
刘 欢 李秀明 付世建 曾令清
(重庆师范大学进化生理与行为学实验室, 动物生物学重庆市重点实验室, 重庆 401331)
为考察温水性鲤科鱼类在不同食物资源条件下标准代谢率(Standard metabolic rate, SMR)与其生长性能的关系, 研究在(25.0±0.5)℃条件下测定体重相近的30尾锦鲫(Carassius auratus)幼鱼的SMR, 将所有实验鱼置于多单元格水槽进行实验处理(摄食与饥饿)。实验时间为4周(0、7d、14d、21d和28d), 包括两周的生长实验(0—14d)和两周的饥饿实验(15—28d)。摄食期间, 于每天上午9: 00和下午21: 00用商业饲料对每尾鱼饱足投喂并记录投喂量。单尾鱼的体重和体长每隔1周测定一次, 而SMR仅在第0、第14和第28天测定。结果显示:(1)锦鲫幼鱼在摄食期间的体重、体长以及SMR均明显上升, 饥饿期间体重和SMR显著降低(P<0.05), 但体长变化不明显; SMR不论摄食期间还是饥饿期间呈现较好的稳定性(二者P<0.05)。(2)锦鲫幼鱼在摄食期间开始时的SMR (测定Ⅰ)与摄食率(FR)、摄食转化率(FE)以及特定体重生长率(SGRBM)均无相关性, 摄食期间结束时的SMR (测定Ⅱ)仅与FR呈正相关(P<0.05), 但与FE以及SGRBM不相关。(3)摄食期间(饥饿期间)实验鱼的第一周日均体重增(减)量与第二周日均体重增(减)量呈正相关, 其体重的增率与减率无显著差异(P>0.05)。(4)实验鱼在摄食期间的特定体重增长率(SGRBM)与饥饿期间的不相关(P>0.05), 但摄食期间的特定SMR增长率(SGRSMR)与饥饿期间的呈负相关(P<0.05)。研究表明在实验室环境中锦鲫幼鱼的SMR具有稳定性, 该种鱼的日均体重变化量保持相近, 此形态变化特征与SMR不相关, 并且该种鱼在实验起始时的SMR的个体差异未能预测其在实验室食物资源变动下生长性能的适应特征。
标准代谢率; 生长性能; 摄食转化率; 摄食率; 锦鲫
近年来, 鱼类种内个体差异的研究已成为鱼类生态学和进化生物学的热点领域, 并且多以鱼类标准代谢率(Standard metabolic rate, SMR)的个体差异作为研究起点[1]。SMR是指鱼类满足机体基本生理功能维持的最小能量代谢强度, 也是其生活史重要的能量代谢参数之一, 它影响鱼类个体对自身各种生理功能(如生长、运动、繁殖)的能量分配[1, 2]。因此, 不同生理功能(或表型特征)与行为之间的能量分配权衡可能导致动物种内个体的生活史对策和适合度在时空上出现差异, 相关研究具有重要的理论意义和研究价值。
现有研究不仅关注鱼类SMR的个体差异及其稳定性, 而且还考察SMR与其他生理特征(如生长)的内在关联。研究发现, 在实验室饱足摄食条件下大西洋鲑(Salmo salar)、马苏大麻哈鱼(Oncorhynchus masou)和鳟(Salmo trutta)的高SMR个体具有较高的生长率[3—5], 即食物资源丰富条件下SMR与生长率呈正相关; 大西洋鲑SMR的稳定个体变异的程度与种群密度呈正相关[6]。在自然界中, 环境变化、季节更替和人为活动等因素易导致食物资源产生时空异质性, 鱼类常面临食物资源的短缺而受到饥饿胁迫[7]。面对食物资源的限制, 鱼类机体的能量状态和生理功能等内部环境发生明显变化。因此, 过往研究发现的鱼类SMR与生长性能呈正相关的关系可能因饥饿胁迫而发生改变。基于上述背景, 研究提出如下假设: 在食物资源充足条件下,鲤科鱼类个体的生长率与其SMR有关, 高SMR个体生长更快; 而在食物资源匮乏条件下, 由于高SMR个体具有较高的能量“空转成本”而表现出SMR的下降比例和体重更为明显。
锦鲫(Carassius auratus)是一种人工广泛饲养的观赏性鱼类, 对生存环境具有较强的适应能力,也是众多研究的实验对象[8—10]。为验证上述假说,本研究以锦鲫幼鱼为实验对象, 考察该种鱼的SMR与其生长性能的关系, 并研究此关系在不同食物资源(饱足投喂和饥饿)环境下的变动规律, 为鱼类生理生态学相关研究累积基础资料, 同时也为经济鱼类的生态养殖和科学实践提供有益帮助。
1 材料与方法
1.1 实验鱼来源及其驯化
于2015年3月在重庆市沙坪坝区花鸟市场购买锦鲫幼鱼, 将其放入实验室循环控温水槽(1.2 m× 0.55 m×0.55 m, 约250 L)驯化2周。水槽更换水体为曝气3d后的自来水, 每日换水约10%, 用充气泵不断向水体充入空气使溶氧水平接近饱和。驯化水温为(25.0±0.5)℃, 光周期为14 L∶10 D。驯养期间以通威公司商业颗粒浮性饲料[饵料成分:(41.2±0.9)%蛋白质、(8.5±0.5)%脂肪、(25.7± 1.2)%的碳水化合物和(12.3±0.4)%灰分]于每天早晚(9:00, 21:00)饱足投喂两次, 投喂前5min关闭充气泵以减少环境干扰, 投喂30min后清除残饵和粪便以维持养殖水体质量。
1.2 实验设计
驯化结束后挑选鱼体健康、体重相近的锦鲫幼鱼[(9.31±1.66) g、体长(6.3±0.4) cm、n=30]作为实验对象, 分别将单尾鱼移入多单元格循环水槽中已编号的单个养殖单元格, 以便于区分实验鱼及记录每尾鱼的摄食量。本研究共设定2周的摄食实验(0—14d)和2周的饥饿实验(15—28d)。分别在0、7d、14d、21d和28d测定所有实验鱼的体重(精度0.01 g)和体长(精度0.1 cm), 每一指标均重复测定3次以提高准确性。分别在0、14d和28d测定所有实验鱼的SMR (测定方法见1.3)。测定之前, 对鱼过夜禁食以使消化道内食物消化吸收完毕, 同时代谢强度恢复摄食前水平[9], 不影响第2天指标测定。在实验期间多单元格循环水槽的所有养殖条件(温度、溶氧水平和光周期)与驯养期间保持一致。
在摄食期间, 于每天早晚(9:00和21:00)对所有实验鱼饱足投喂两次, 同时记录单尾鱼的摄食量。饵料仍用中国通威公司的浮性饲料。投喂5min前关掉充气泵, 投喂30min后清除残饵和粪便, 以维持养殖水体的理化性质。实验鱼的生长参数包括摄食率(Feeding rate, FR)、摄食效率(Feeding efficiency, FE)、日均体重变化量(Daily change rate in body mass, DCR)和特定体重生长率(Specific growth rate of body mass, SGRBM), 其计算公式分别如下:
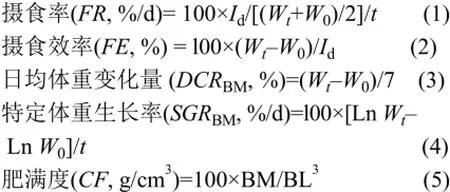
其中W0为初始体重(g), Wt为终末体重(g), t为实验喂养时间(d), Id为单尾鱼摄入饲料干重(g)。BM和BL分别为体重(Body mass, g)和体长(Body length, cm)。
在2周摄食生长实验之后, 对所有实验鱼进行2周的饥饿处理。在实验期间的第21和第28天分别测量所有实验鱼的体重和体长, 每一指标重复测定3次。在第28天, 将实验鱼装入代谢仪的呼吸室内过夜适应, 于第2天用溶氧测定仪(HQ30d, 美国哈希公司)测定单尾鱼的SMR, 将重复测定的耗氧率的平均值作为单尾鱼的SMR。
1.3 SMR的测定
SMR采用流水式鱼类呼吸代谢仪进行测定, 实验时间为第0 (测定Ⅰ)、第14 (测定Ⅱ)和第28天(测定Ⅲ)。测定时, 对每尾实验鱼的体重(精度为0.01 g)和体长(精度为0.1 cm), 两形态参数均重复测定3次。将单尾鱼装入呼吸室过夜适应, 适应结束后分别在第二天的9:00、11: 00、13:00、15: 00、17: 00和19: 00采用溶氧测定仪(HQ30d, 美国哈希公司)测定每尾实验鱼的耗氧率, 将重复测定的耗氧率的平均值表征单尾鱼的SMR。测定过程中保持实验室环境安静以减少噪声和人为活动对实验鱼的影响。与0和28d一样, 在第13天晚上投喂完后将实验鱼装入代谢仪的呼吸室并过夜禁食, 于第2天(第14天)进行SMR和体长、体重的测定, 测定后将实验鱼放回单元格并饱足投喂一次。实验鱼标准代谢率SMR [mg O2/(kg·h)]的计算公式如下:
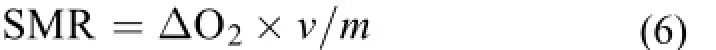
式中, ΔO2是实验呼吸室(有鱼)出水口与空白对照溶氧的差值(mg/L), v是呼吸室的流速(L/h), 由测定呼吸室出水口装满50 mL容量瓶的所需时间并计算得到相应流量, m为单尾实验鱼的体重(kg)。由于实验鱼的体重十分相近, 本研究并未进行单位体重耗氧率的校正。
对于评估SMR在摄食期间以及饥饿期间的变化程度, 本研究采用特定SMR增长率评价, 其计%算公式如下:
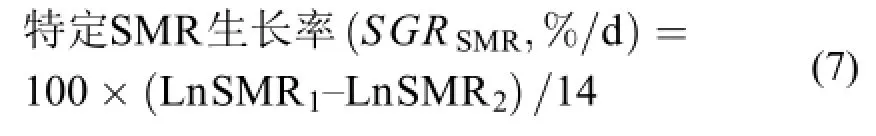
其中SMR1为测定ⅠSMR (或测定ⅡSMR)[mg O2/(kg·h)], SMR2为测定ⅡSMR (或测定ⅢSMR)[mg O2/(kg·h)], 14为某一特定实验时间(摄食或饥饿)(d)。
1.4 数据分析与统计
用Excel 2003对所有实验数据作常规计算, 然后采用SPSS19.0软件进行统计分析。SMR和形态参数(体重、体长和肥满度)在不同时间上的差异用单因素重复方差(Repeated one-way ANOVA)分析,如组间存在差异再采用Bonferroni多重比较。用Pearson相关分析考察SMR的稳定性及SMR与生长参数的相关性。此外, 仍采用Pearson相关分析考察实验鱼在摄食期间(或饥饿期间)的第1周和第2周生长参数是否具有相同的变化趋势。所有实验数据均以“平均值±标准误”(Mean ± SE)表示, 显著水平为P<0.05。
2 结果
2.1 形态参数和SMR及其稳定性
摄食期间实验鱼的体重(F=63.515, P<0.001)和体长(F=100.30, P<0.001)均随时间延长而显著增加, 饥饿期间随饥饿时间延长体重下降显著, 而体长变化不显著(表 1); 摄食期间实验鱼的肥满度变化不明显, 但在饥饿期间的肥满度均随时间的增加而显著下降(F=17.669, P<0.001)。

表 1 实验期间锦鲫幼鱼的SMR和形态参数Tab. 1 The standard metabolic rates and morphological parameters of the juvenile gold fish
锦鲫幼鱼的SMR在摄食期间显著增加了(101.8±15.3)%, 而两周的饥饿导致实验鱼的SMR明显下降了(34.8±4.6)%, 与实验开始时的SMR无显著差异(表 1)。该种鱼的SMR不论在摄食期间(图1A)还是饥饿期间(图 1B)或整个实验起止(图 1C)均保持较好的稳定性(所有P<0.05)。
2.2 生长参数与标准代谢率的相关性
本研究中在摄食实验开始时和结束时均测定所有鱼的SMR, 将两次测定的SMR与生长参数进行相关分析。结果发现, 锦鲫幼鱼在摄食期间开始时的SMR (测定ⅠSMR)与摄食率FR、摄食转化率FE以及特定生长率SGR均不相关(表 2), 而摄食期间结束时的SMR (测定ⅡSMR)仅与摄食率FR呈正相关, 而与FE以及SGR不相关(表 2)。
本研究对摄食期间和饥饿期间锦鲫幼鱼的生长参数进行重复性分析。摄食期间, 实验鱼的第1周日均体重增量与第2周日均体重增量呈正相关(图 2A); 饥饿期间实验鱼的第一周日均体重增量与第2周日均体重增量也呈正相关(图 2B)。协方差分析发现, 锦鲫幼鱼在摄食期间的日均体重增量与饥饿期间保持相近, 即图 2A拟合方程的斜率与图2B无显著差异(F<0.001, P=0.992)。摄食期间实验鱼的特定体重增长率的重复性差(图 2C, P>0.05),而饥饿期间锦鲫幼鱼的特定体重增长率的重复性较好(图 2D, P=0.001)。
2.3 特定体重增长率和特定SMR增长率的重复性
本研究中锦鲫幼鱼在摄食期间的特定体重增长率(SGRBM)与饥饿期间的重复性低(图 3A, P>0.05)。然而, 实验鱼在摄食期间的特定SMR增长率(SGRSMR)与饥饿期间的重复性较好(图 3B, P<0.05)。
3 讨论
3.1 锦鲫幼鱼SMR的稳定性
有关鱼类能量代谢(如SMR)的种内个体差异已引起国内外研究者广泛关注, 常以稳定期或相关系数r等评估表型特征的稳定性[2, 4, 11—13]。稳定性是指在不同时空或环境条件下实验动物的可量表型性状测定结果在数值大小上的排序问题, 可通过相关性分析评价排序结果的优劣[14], 即相关系数r值越高表型特征的稳定性越好[2, 11]。不同研究的实验对象的SMR在不同时间间隔内的r值差异明显。研究显示, 间隔5周鳟的SMR的相关系数r介于0.52—0.58, 10周间隔导致SMR的r介于0.16—0.42,而15周的间隔导致SMR无相关性[2]。间隔8周大西洋鲑的r值分别为0.40[15]和0.51[16], 间隔16周时该种鱼SMR的r值仍可达到0.68[4], 间隔5个月的花鳅(Cobitis taenia)的r值介于为0.68—0.73[17]; 而饥饿组和对照组南方鲇幼鱼(Silurus meridionalis)静止代谢率在2周内的r值介于0.037—0.250[18]。本研究锦鲫幼鱼的SMR在摄食期间(r=0.492)和饥饿期间(r=0.576)以及整个实验起止(r=0.584)均呈现明显的稳定性, 其r值介于上述研究结果范围, 表明在本实验中锦鲫幼鱼SMR不仅具有较好的重复性, 而且其稳定期至少为4周或可能更长。相比较于大西洋鲑和鳟, 在相当r值时本研究锦鲫幼鱼的SMR稳定期短于这些鱼类的研究结果[2, 4, 15]。有研究者认为随SMR测定间隔的增加, 鱼类表型特征如SMR的r值将逐渐减小[12]; 此外, 饥饿也会导致鱼类能量代谢特征r值显著降低[18]。前者观点已在鳟[2]和大西洋鲑[15]得以验证, 后者观点已在南方鲇幼鱼得以验证[18]。然而, 本研究锦鲫幼鱼SMR的r值不但不随时间延长而降低, 而且也不受饥饿影响而减小, 相比较其他鱼类在短期内锦鲫幼鱼SMR的稳定性更优, 表明在不同实验条件下不同鱼类SMR的r值具有种的属性。

图 1 锦鲫幼鱼标准代谢率的稳定性Fig. 1 The repeatability of standard metabolic rate of the juvenile gold fish

表 2 锦鲫幼鱼生长参数与标准代谢率相关性的统计结果Tab. 2 Statistics analysis of correlations between growthperformance parameters and standard metabolic rate in juvenile gold fish
3.2 锦鲫幼鱼SMR与生长性能的关系
研究认为SMR在不同环境条件下可重复测量[11, 12],但现有研究显示SMR可依据环境食物丰度而表现出弹性(Flexibility)[7]。当环境食物丰度增加时SMR上升, 当食物丰度降低时SMR降低, 这种现象存在于不同动物之中, 如昆虫[19]、两栖类[20]、爬行类[21]、鸟类[22]和哺乳类[23]。研究发现, 高食物丰度导致鳟和银大麻哈鱼(Oncorhynchus kisutch)的SMR明显提高, 而饥饿(即零食物丰度)降低该两种鱼的SMR[15, 24, 25]。本研究也发现, 饱足摄食导致锦鲫幼鱼的SMR明显上升, 而饥饿导致实验鱼的SMR下降, 这种现象与鳟和银大麻哈鱼的研究结果相似, 支持上述研究观点。高食物丰度导致个体SMR上升的现象主要与同化代谢途径的活化与上调有关[25]。已有研究数据证明该观点的合理性,SMR的组分包括正常细胞功能的能量消耗和新细胞生成的能量支出。随年龄增长个体SMR与体重呈非线性增加, 当个体是幼体时SMR主要是由后者构成的, 而个体接近成体时SMR主要是细胞代谢和繁殖相关的能量消耗占主导[26]。因此, 不难发现高丰度食物环境易导致体重的增加, 即大量新细胞的生成引起动物SMR的明显上升。
种内不同个体SMR对食物丰度变化的弹性存在明显差异, 可能影响种内不同个体在变动环境中的适合度, 特别是幼体阶段体重的增长[27], 即SMR与个体生长发育(如体重增长)可能存在某种内在关联。有关数种鲑鳟鱼类的研究发现, 在高食物丰度环境中高SMR个体的生长速率明显高于低SMR个体, 而在低食物丰度环境中低SMR个体的生长速率显著快于高SMR个体[24, 25, 28, 29], 不仅说明不同SMR个体在环境食物丰度变动条件下呈现相应的优势, 而且表明SMR是导致生长性能存在环境食物丰度依赖性的原因, 非生长性能的个体变异造成的[24, 30]。然而, 不同研究发现生长性能与鱼类个体SMR关联存在一定差异, 如在较高食物资源环境中鳟SMR的变化量与其体长呈正相关, 而实验起始测定的SMR并不与生长参数相关[25]。本研究也发现,生长实验起始的SMR与摄食率、摄食转化率、特定体重生长率不相关, 而生长实验结束的SMR仅与摄食率呈正相关。从另外角度分析, 不论饱足摄食期间还是饥饿环境锦鲫幼鱼的第一周日均体重变化量与第二周的呈正相关, 并且在摄食期间的日均体重变化量与饥饿期间的无显著差异。本研究结果表明锦鲫幼鱼个体体重的变化量不论饱足摄食环境还是饥饿环境中均保持相等, 但这种生长性能的非环境依赖特征却与锦鲫幼鱼的SMR不相关。

图 2 摄食和饥饿期间锦鲫幼鱼生长参数的重复性Fig. 2 Repeatability of growth performance parameters in the gold fish during both the feeding and fasting period

图 3 锦鲫幼鱼摄食期间特定生长率与饥饿期间特定生长率的重复性Fig. 3 Repeatability of specific growth rates in both body mass and standard metabolic rate in the juvenile gold fish during the feeding and fasting period
在本研究中饥饿不仅导致锦鲫幼鱼的体重、肥满度均随时间的延长而显著下降, 而且相比较于测定ⅡSMR, 该种鱼的测定ⅢSMR也因饥饿而明显降低。研究发现, 高SMR的鱼类个体在食物资源匮乏时体重和SMR下降更为明显[5, 28], 这与本研究结果相似。本研究还发现, 锦鲫幼鱼在摄食期间的特定SMR变化率与饥饿期间的呈负相关, 说明在摄食期间SMR增长快的锦鲫个体在饥饿期间SMR下降也快, 可能与高SMR个体具有高能量消耗的特点有关; 另外, 这种SMR变化特征也暗示特定SMR变化率较快的锦鲫幼鱼个体在食物资源变化环境中呈现较高的SMR弹性, 可能也有利于锦鲫幼鱼对环境因素变化做出反应, 从而获取由自身代谢弹性以提高个体适合度的优势与益处。
总之, 本研究发现锦鲫幼鱼的SMR不论在食物丰富还是在食物匮乏条件下均呈现较好的稳定性,其SMR的稳定期至少保持4周或可能更长。虽然摄食开始时的SMR与摄食期间的生长性能参数并不相关, 但摄食结束时的SMR与摄食率呈正相关。两个不同食物丰度时期(摄食和饥饿)第一周的日均体重变化量与第二周的均呈正相关。摄食导致SMR的变化量与饥饿诱导的呈负相关, 说明在摄食期间SMR增长较快的锦鲫幼鱼在饥饿期间呈现SMR下降较快的趋势。本研究结果表明在实验室环境条件下锦鲫幼鱼的实验数据部分支持本研究原先提出的假设。
[1]Biro P A, Stamps J A. Do consistent individual differences in metabolic rate promote consistent individual differences in behavior [J]. Trends in Ecology and Evolution, 2010, 25(11): 653—659
[2]Norin T, Malte H. Repeatability of standard metabolic rate, active metabolic rate and aerobic scope in young brown trout during a period of moderate food availability [J]. The Journal of Experimental Biology, 2011, 214(10):1668—1675
[3]Yamamoto T, Ueda1 H, Higashi S. Correlation among dominance status, metabolic rate and otolith size in masu salmon [J]. Journal of Fish Biology, 1998, 52(2):281—290
[4]McCarthy I D. Temporal repeatability of relative standard metabolic rate in juvenile Atlantic salmon and its relation to life history variation [J]. Journal of Fish Biology,2000, 57(1): 224—238
[5]Álvarez D, Nicieza A G. Is metabolic rate a reliable predictor of growth and survival of brown trout (Salmotrutta) in the wild [J]. Canadian Journal of Fisheries and Aquatic Sciences, 2005, 62(3): 643—649
[6]Reid D, Armstrong J D, Metcalfe1 N B. The performance advantage of a high resting metabolic rate in juvenile salmon is habitat dependent [J]. Journal of Animal Ecology,2012, 81(4): 868—875
[7]McCue M D. Starvation physiology: Reviewing the different strategies animals use to survive a common challenge [J]. Comparative Biochemistry and Physiology A,2010, 156(1): 1—18
[8]Chen Y P, Cao Z D, Fu S J. Social status of juvenile Carassius auratus and its relationship with stand metabolic rate, critical swimming speed and blood glucose concentration [J]. Acta Ecologica Sinica, 2010, 30(7):1940—1945 [陈永鹏, 曹振东, 付世建. 锦鲫幼鱼的社群等级地位及其与标准代谢率、血糖和临界游泳能力的关系. 生态学报, 2010, 30(7): 1940—1945]
[9]Pang X, Cao Z D, Fu S J. Effect of meal size on specific dynamic action in juvenile curcian carp [J]. Journal of Chongqing Normal University (Natural Science), 2009,26(1): 22—25, 56 [庞旭, 曹振东, 付世建. 摄食水平对锦鲫幼鱼特殊动力作用的影响. 重庆师范大学学报(自然科学版), 2009, 26(1): 22—25, 56]
[10]Fu S J, Li X M, Zhao W W, et al. The locomotive and metabolic strategies of goldfish under different dissolved oxygen level [J]. Journal of Chongqing Normal University (Natural Science), 2010, 27(3): 14—18 [付世建,李秀明, 赵文文, 等. 不同溶氧水平下锦鲫的运动和代谢适应对策. 重庆师范大学学报(自然科学版), 2010,27(3): 14—18]
[11]Nespolo R F, Franco M. Whole-animal metabolic rate is a repeatable trait: a meta-analysis [J]. The Journal of Experimental Biology, 2007, 210(11): 2000—2005
[12]White C R, Schimpf N G, Cassey P. The repeatability of metabolic rate declines with time [J]. The Journal of Experimental Biology, 2012, 216(10): 1763—1765
[13]Cutts C J, Adams C E, Campbell A. Stability of physiological and behavioural determinants of performance in Arctic char (Salvelinus alpinus) [J]. Canadian Journal of Fisheries and Aquatic Sciences, 2001, 58(5): 961—968
[14]Zeng L Q, Penghan L Y, Wang J W, et al. The effects of food deprivation on individual variation and repeatability in swimming performance of juvenile southern catfish (Silurus meridionalis Chen) [J]. Acta Hydrobiologica Sinica, 2014, 38(5): 883—890 [曾令清, 彭韩柳依, 王健伟,等. 饥饿对南方鲇幼鱼游泳能力的个体变异和重复性的影响. 水生生物学报, 2014, 38(5): 883—890]
[15]O'Connor K I, Taylor A C, Metcalfe N B. The stability of standard metabolic rate during a period of food deprivation in juvenile Atlantic salmon [J]. Journal of Fish Biology, 2000, 57(1): 41—51
[16]Seppänen E, Piironen J. Huuskonen H. Consistency of standard metabolic rate in relation to life history strategy of juvenile Atlantic salmon Salmo salar [J]. Comparative Biochemistry and Physiology A, 2010, 156(2): 278—284
[17]Maciak S. Konarzewski M. Repeatability of standard metabolic rate (SMR) in a small fish, the spined loach (Cobitis taenia) [J]. Comparative Biochemistry and Physiology A, 2010, 157(2): 136—141
[18]Zeng L Q, Penghan L Y, Wang J W, et al. Repeatability and variation in locomotion metabolism of the juvenile southern catfish during starvation [J]. Journal of Fisheries of China, 2015, 39(1): 52—64 [曾令清, 彭韩柳依,王健伟, 等. 南方鲇幼鱼运动代谢的个体变异和重复性及其饥饿响应. 水产学报, 2015, 39(1): 52—64]
[19]Roark A M, Bjorndal K A. Metabolic rate depression is induced by caloric restriction and correlates with rate of development and lifespan in a parthenogenetic insect [J]. Experimental Gerontology, 2009, 44(6—7): 413—419
[20]Hervant F, Mathieu J, Durand J. Behavioural, physiological and metabolic responses to long-term starvation and refeeding in a blind cave-dwelling (Proteus anguinus) and a surface -dwelling (Eupro ctusasper) salamander [J]. The Journal of Experimental Biology, 2001, 204(2): 269—281
[21]McCue M D. Snakes survive starvation by employ in g supply and demand-side economic strategies [J]. Zoology,2007, 110(4): 318—327
[22]Wiersma P, Salomons H M. Verhulst S. Metabolic adjustments to increasing foraging costs of starlings in a closed economy [J]. The Journal of Experimental Biology, 2005,208(21): 4099—4108
[23]Ostrowski S, Mesochina P, Williams J B. Physiological adjustments of sand gazelles (Gazella subgutturosa) to a boom-or-bust economy: standard fasting metabolic rate,total evaporative water loss, and changes in the sizes of organs during food and water restriction [J]. Physiological and Biochemical Zoology, 2006, 79(4): 810—819
[24]VanLeeuwen T E, Rosenfeld J S, Richards J G. Effects of food ration on SMR: influence of food consumption on individual variation in metabolic rate in juvenile salmon (Oncorhynchus kisutch) [J]. Journal of Animal Ecology,2012, 81(2): 395—402
[25]Auer S K, Salin K, Rudolf A M, et al. Flexibility in metabolic rate confers a growth advantage under changing food availability [J]. Journal of Animal Ecology, 2015,84(5): 1405—1411
[26]West G B, Brown J H, Enquist B J. A general model for ontogenetic growth [J]. Nature, 2001, 413(6856):628—631
[27]Blanckenhorn W U. Behavioral causes and consequences of sexual size dimorphism [J]. Ethology, 2006, 111(11):977—1016
[28]Killen S S, Marras S, McKenzie D J. Fuel, fasting, fear:routine metabolic rate and food deprivation exert synergistic effects on risk-taking in individual juvenile European sea bass [J]. Journal of Animal Ecology, 2011,80(5): 1024—1033
[29]Reid D, Armstrong J D, Metcalfe N B. Estimated standard metabolic rate interacts with territory quality and density to determine the growth rates of juvenile Atlantic salmon [J]. Functional Ecology, 2011, 25(6): 1360—1367
[30]Rosenfeld J, Van Leeuwen T, Richards J, et al. Relationship between growth and standard metabolic rate: measurement artefacts and implications for habitat use and life-history adaptation in salmonids [J]. Journal of Animal Ecology, 2014, 84(1): 4—20
THE CORRELATIONS BETWEEN STANDARD METABOLIC RATE AND GROWTH PERFORMANCE IN JUVENILE GOLD FISH
LIU Huan, LI Xiu-Ming, FU Shi-Jian and ZENG Ling-Qing
(Key Laboratory of Animal Biology of Chongqing, Laboratory of Evolutionary Physiology and Behavior, Chongqing Normal University, Chongqing 401331, China)
The current study investigated the relationship between standard metabolic rate (SMR) and growth performance using 30 gold fish (Carassius auratus) under the laboratory conditions at (25.0±0.5). All individuals were raised in a man-made laboratory experimental tank for the whole experiment with a 2 weeks feeding and followed by 2 weeks fasting. During feeding stage, each fish was fed twice daily (9:00 and 15:00) and food cunsumption by fish was recorded. Two week feeding greatly increased the body mass, body length and SMR, whereas starvation decreased the body mass and SMR without impacting body length (P<0.05). This fish species had similar and stable SMR in feeding period and starvation period (both P<0.05). The SMR1(at the beginning of feeding experiment) was not correlated with the feeding rate (FR), feeding efficiency (FE) and specific growth rate (SGRBM) of the body mass (P>0.05). SMR2at the end of feeding experiment was associated with the FR but not FE and SGRBM. Feeding increased body mass and fasting decreased the body mass. The theoretic rate of daily increased body mass during the feeding period was not significantly differ from that of daily decreased body mass during the starvation period (P>0.05) based on the analysis of covariance. The specific growth rate in SMR (SGRSMR) during the feeding experiment, not SGRBM, was correlated negatively with that of the starvation experiment. These results suggest the stable SMR and absolute growth rate of individuals of the juvenile gold fish under the laboratory conditions, but, the SMR of this fish species acclimated at the labora tory surrounding could not predict the adaptive characteristics of growth performance and hence their fitness.
Standard metabolic rate; Growth Performance; Feeding rate; Food efficiency; Carassius auratus
Q493.9
A
1000-3207(2016)04-0836-07
10.7541/2016.108
2015-07-08;
2016-01-23
国家自然科学基金项目(31300341); 重庆市自然科学基金项目(cstc2014jcyjA00018); 重庆市教委科技项目(KJ130619)资助 [Supported by the National Science Foundation of China (NSFC 31300341); the Project of the Natural Science Foundation of Chongqing (cstc2014jcyjA00018); the Science and Technology Project of Chongqing Education Commission (KJ130619)]
刘欢(1994—), 女, 重庆人; 本科生; 研究方向为鱼类比较生理学。E-mail: 407799306@qq.com
曾令清, E-mail: lingqingzeng@hotmail.com
