凡纳滨对虾饲料中酵母水解物替代鱼粉适宜比例的研究
2016-08-10迟淑艳聂琴黄吴文揭雨谭北平杨凡胡骏鹏董晓慧杨奇慧刘泓宇章
迟淑艳聂 琴黄吴文揭 雨谭北平杨 凡胡骏鹏董晓慧杨奇慧刘泓宇章 双
(1. 广东海洋大学水产学院, 湛江 524088; 2. 安琪酵母股份有限公司, 宜昌 443003)
凡纳滨对虾饲料中酵母水解物替代鱼粉适宜比例的研究
迟淑艳1聂 琴2黄吴文1揭 雨1谭北平1杨 凡2胡骏鹏2董晓慧1杨奇慧1刘泓宇1章 双1
(1. 广东海洋大学水产学院, 湛江 524088; 2. 安琪酵母股份有限公司, 宜昌 443003)
试验添加酵母水解物替代不同比例鱼粉, 添加量分别为0(对照组)、2.5%、5.0%、7.5%、10%和12.5%,替代鱼粉的比例分别为0、8%、16%、24%、32%和40%, 通过评估生长性能、消化酶和免疫相关酶活性等指标评价酵母水解物替代鱼粉对凡纳滨对虾健康生长的影响。选择健康凡纳滨对虾[初重(0.63±0.01) g]随机分为6组, 每组3个重复, 养殖8周。结果表明, Y2.5和Y5.0处理组对虾增重率和特定生长率与Y0相比差异不显著(P>0.05), 但是显著高于其余各组(P<0.05), Y2.5组饲料系数和Y0组相比差异不显著, 显著低于其余各组(P<0.05); Y5.0组肝胰腺糜蛋白酶和Y0组相比差异不显著(P>0.05), 显著高于其余各组(P<0.05); Y2.5和Y7.5组胰蛋白酶和Y0组相比差异不显著, 但是显著高于其余各组(P<0.05); Y2.5组与Y5.0酚氧化酶活性显著高于其余各组(P<0.05), Y2.5组与Y7.5组和Y0组总一氧化氮合酶活性显著高于其余各组(P<0.05), Y5.0组和Y7.5组血清溶菌酶活性显著高于其余各组(P<0.05)。以增重率为判据, 经二次曲线拟合得出, 获得最大增重率时酵母水解物添加量为1.62%, 替代鱼粉比例为5.19%; 酵母水解物替代鱼粉比例达24%时不会对增重率产生显著影响。
酵母水解物; 凡纳滨对虾; 生长性能; 消化酶; 免疫酶
目前, 凡纳滨对虾(Litopenaeus vannamei)养殖规模大, 密度高, 养殖水域海水超负荷运转, 导致虾体抗病力日趋下降, 疾病频发。抗生素等化学品滥用, 不仅存在抗生素在虾体内残留的问题, 而且还导致微生物环境生态系统失调。2007年美国食品和药品管理局(FDA)以“中国输美水产品多次被查出潜在危害性残留物质”为由, 对我国包括对虾产品在内的5种水产品实行自动查验制, 导致我国输美对虾产品成本严重增加, 降低了我国对虾产品的市场竞争力。
酵母类产品有很多种[1], 由于酵母含有β-葡聚糖、核酸、甘露寡糖和几丁质等免疫刺激物, 能够通过刺激免疫系统和维持有益的肠道内环境来改善奶牛[2]、仔猪[3]、鲤(Cyprinus carpio)[4]、虹鳟(Oncorhynchus mykiss)[5, 6]、杂交罗非鱼(Oreochromis nileoticus♀×Oreochromis aureus♂)[7]、凡纳滨对虾(Litopenaeus vannamei)[8]和斑节对虾(Penaeus monodon)[9]等养殖动物的生产性能和健康。我国农业部第2038号公告增补酵母水解物等酵母类原料进入《饲料原料目录》。本实验旨在研究酵母水解物作为饲料原料部分替代鱼粉对凡纳滨对虾生长性能和抗病力的影响, 以期为凡纳滨对虾人工配合饲料鱼粉替代技术的研究提供基础数据。
1 材料与方法
1.1 饲料配方与制作
添加0、2.5%、5%、7.5%、10%和12.5%酵母水解物分别替代鱼粉0、8%、16%、24%、32%和40%, 配制等氮等脂的6组实验饲料(Y0、Y2.5、Y5、Y7.5、Y10、Y12.5)。其中Y0为对照组, 鱼粉用量为24%, 不添加酵母水解物(酵母水解物NX100, 安琪酵母股份有限公司, 粗蛋白49%, 粗脂肪0.5%)。同时, 添加三氧化二钇测定凡纳滨对虾对各组饲料营养物质的消化率。饲料原料经粉碎后过60目筛, 按配方称重, 逐级混合均匀, 用双螺杆挤压机(华南理工大学科技实业总厂, F-75)加工制粒成1.0和1.5 mm的颗粒状饲料, 晾干后于-20℃冰箱中储存备用。饲料配方及成分分析见表 1。
1.2 实验动物养殖管理
凡纳滨对虾虾苗购自广东粤海饲料有限公司东海岛育苗基地, 根据生长阶段分别投喂虾片和对虾商业饲料0号料, 在水泥池中标粗至实验用规格。正式实验前24h停止投料, 挑选规格一致的健康对虾, 初始体重为(0.63±0.01) g, 实验共设置6个处理, 每个处理3个重复, 每个养殖桶饲养30尾对虾,养殖实验在广东海洋大学东海岛海洋科技园养殖系统中进行, 养殖桶的规格为300 L。分别在7: 00、11: 00、17: 00 和21: 00饱食投喂, 并根据当日对虾的进食情况和天气情况调整具体投喂量。实验期间水温27—31℃, pH 8.0—8.2, 盐度28—32。
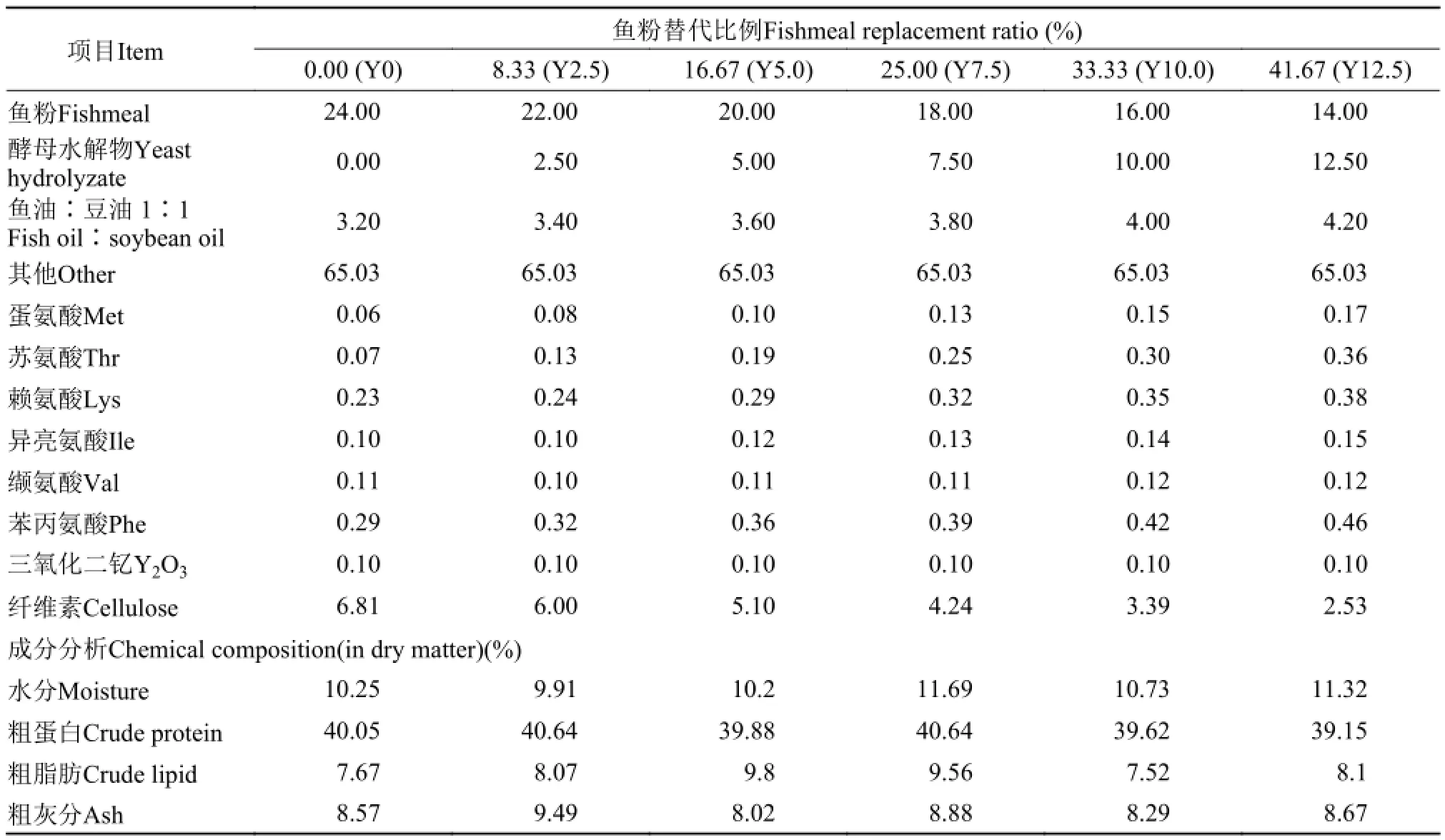
表 1 实验饲料配方(%干重)Tab. 1 Formulation and proximate composition of the experimental diets (% dry matter)
1.3 样品收集与分析
在养殖第6周开始, 7:00投喂后1h虹吸法收集对虾粪便用于测定各组饲料营养物质消化率。饲料及粪便中的元素钇用原子发射光谱法(Thermo Fisher, ICP6300)测定。在8周养殖实验结束后饥饿24h, 对每个桶的对虾进行计数、称重, 并取样分析。每桶取样10尾(肌肉)用于常规养分分析, 测定水分(烘箱干燥法, 105℃烘干恒重)、粗蛋白质(凯氏定氮法, Kjeltec 8400凯氏定氮仪)、粗脂肪(索式抽提法)、粗灰分(550℃马弗炉灼烧法)[10]。每桶取样3尾称体重、量体长、取肝胰腺称重后放入冻存管, 液氮保存, 用于消化酶活性分析。每桶取5尾抽取血清用于血清非特异性免疫酶活性分析。对虾肝胰腺淀粉酶(Amylase)、糜蛋白酶(Chymotrypsin)、胰蛋白酶(Trypsin)、血清酚氧化酶(PO)、一氧化氮合成酶(T-NOS)、溶菌酶(LZM)的活性采用南京建成生物工程研究所的试剂盒经全波长酶标仪(Thermo,Multiskan GO 1510)测定。
在养殖实验结束后, 进行攻毒试验, 每个处理组选择10尾进行攻毒, 每尾对虾注射1.2×1010cfu/ mL的副溶血弧菌(V. parahaemolyticus)50 μL。连续观察7d, 每隔12h统计一次。统计累计死亡率, 并计算相对免疫保护力。
1.4 计算方法
对虾成活率、增重率、特定生长率、饲料系数、饲料营养物质消化率和相对免疫保护率的计算公式如下:
成活率(Survival rate, SR, %)=100×(终末对虾尾数/初始对虾尾数)
增重率(Weight gain, WG, %)=100×[终末体重(g)-初始体重(g)]/初始体重(g)
特定生长率(Special growth rate, SGR %/d)= 100×[Ln 终末体重(g)-Ln初始体重(g)]/饲养天数
积温生长系数(Temperature growth coefficient,TGC)=[终末体重1/3(g)-初始体重1/3(g)]/Σ(水温×实验天数)×100
饲料系数(Feed coefficient rate , FCR)=摄入饲料量(g)/体重增加量(g)
肠体比(Viserosomatic index, VI, %)=100×肠道质量(g)/虾体质量(g)
肝体比(Hepatosomatic indices, HSI, %)=100×肝脏质量(g)/虾体质量(g)
肥满度(Condition factor, CF, %)=100×体重(g)/体长(cm)3
饲料营养物质消化率(Apparent digestive ratio,ADR, %)=100×[1-(饲料中指示剂含量/粪中指示剂含量)×(粪中养分含量/饲料中养分含量)]
相对免疫保护率(Relative percent survival,RPS, %)=100×[1-(免疫组死亡率/对照组死亡率)]
1.5 数据统计与分析
试验数据以平均值±标准差(X±SD)表示, 试验结果用SPSS17.0 软件进行单因素方差分析(ANOVA)分析, 当差异显著时(P<0.05), 进行Turkey多重比较。
2 结果
2.1 酵母水解物替代鱼粉对凡纳滨对虾生长性能的影响
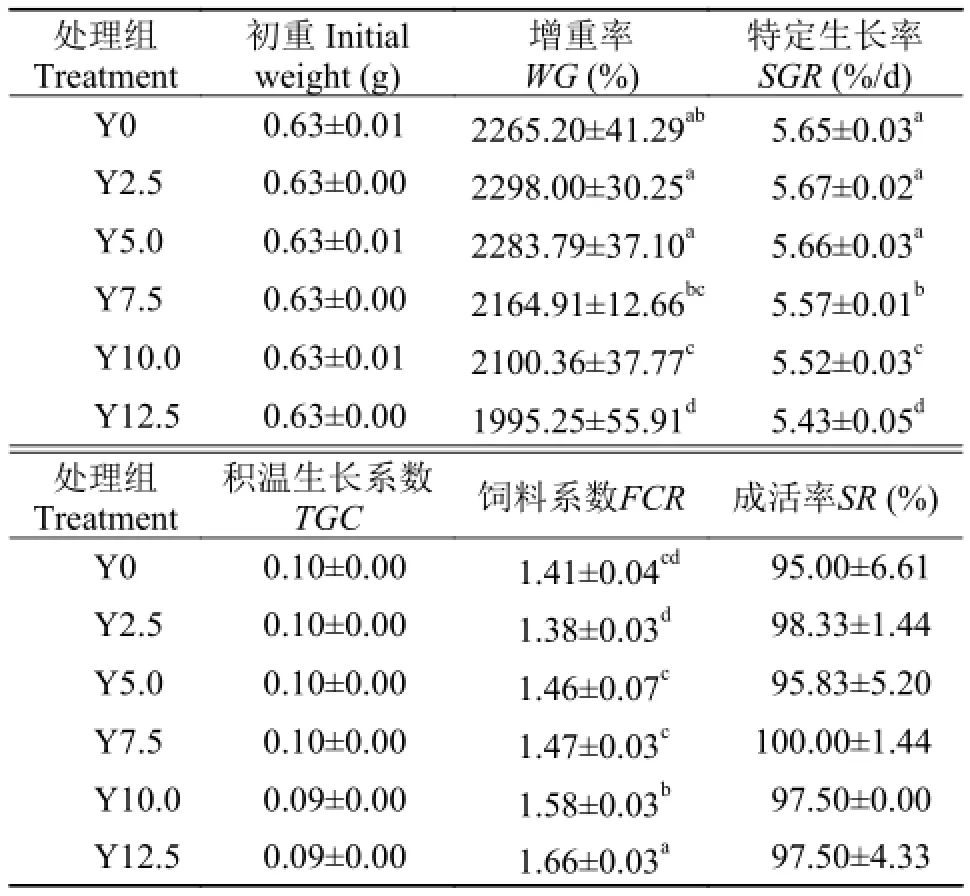
表 2 酵母水解物替代鱼粉对凡纳滨对虾生长性能的影响Tab. 2 Effects of replacing fishmeal with yeast hydrolyzate on growth performance of shrimps
由表 2数据可知, 各处理组间成活率没有显著差异(P>0.05)。Y2.5和Y5.0处理组的对虾增重率和特定生长率与对照组相比, 差异均不显著(P>0.05),并且增重率和特定生长率从数值上略高于鱼粉对照组。各组间积温生长系数差异不显著(P>0.05)。Y2.5和Y5.0处理组的饲料系数和鱼粉对照组相比差异不显著(P>0.05), 且Y2.5处理组的饲料系数最低。
以增重率为参考依据, 根据酵母水解物添加量,经二元曲线拟合得出, 回归方程y=-2.5454x2+ 8.2575x+2278.8(R2=0.9673), 获得最大增重率时, 对虾饲料中酵母水解物的添加量是1.62%(图 1)。
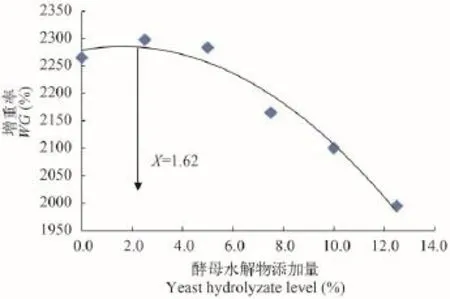
图 1 凡纳滨对虾增重率与酵母水解物添加量的二次曲线模型Fig. 1 Relationship between hydrolyzed yeast with weight gain of juvenile shrimp
2.2 酵母水解物替代鱼粉对凡纳滨对虾形态学指标的影响
表 3数据表明, 酵母水解物添加组对虾VI和对照组Y0相比差异不显著(P>0.05); 2.5%和5.0%添加组HSI显著高于Y0对照组(P<0.05), Y7.5组HSI和Y0组相比差异不显著(P>0.05); 酵母水解物添加组虾体CF均显著高于Y0组(P<0.05)。
2.3 酵母水解物替代鱼粉对凡纳滨对虾肌肉养分含量的影响
酵母水解物替代鱼粉对各实验组凡纳滨对虾肌肉水分和粗脂肪含量未见显著性影响(P>0.05)。Y5.0和Y10.0组对虾肌肉粗蛋白含量显著高于对照组(P<0.05), 其余添加组虽未见显著性差异, 但是数值上均高于对照组(表 4)。Y10.0组肌肉粗灰分含量和Y7.5组相比差异不显著(P>0.05), 但是显著高于其余各组(P<0.05)。
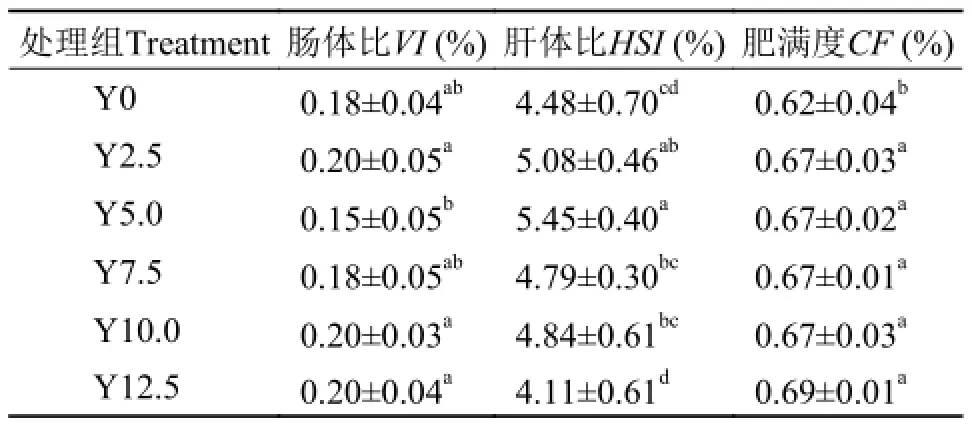
表 3 酵母水解物替代鱼粉对凡纳滨对虾形态学指标的影响Tab. 3 Effects of replacing fishmeal with yeast hydrolyzate on morphology of shrimps
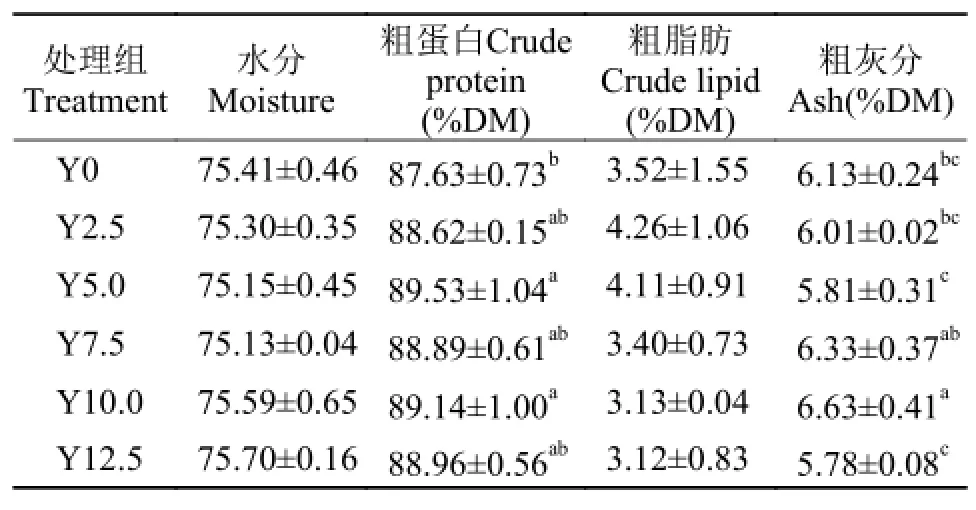
表 4 酵母水解物替代鱼粉对凡纳滨对虾肌肉养分含量的影响Tab. 4 Effects of replacing fishmeal with yeast hydrolyzate on nutrition contents of shrimps muscle
2.4 酵母水解物替代鱼粉对凡纳滨对虾饲料消化率和肝胰腺消化酶活性的影响
表 5数据表明降低鱼粉, 添加酵母水解物, 凡纳滨对虾对饲料干物质的消化率有所改善。Y2.5、Y7.5和Y10.0都显著高于Y0组(P<0.05)。Y2.5—Y12.5五组对虾对饲料粗蛋白的消化率显著高于未添加组(P<0.05), Y2.5—Y10.0四组对虾对饲料粗脂肪的消化率显著高于其余各组(P<0.05)。
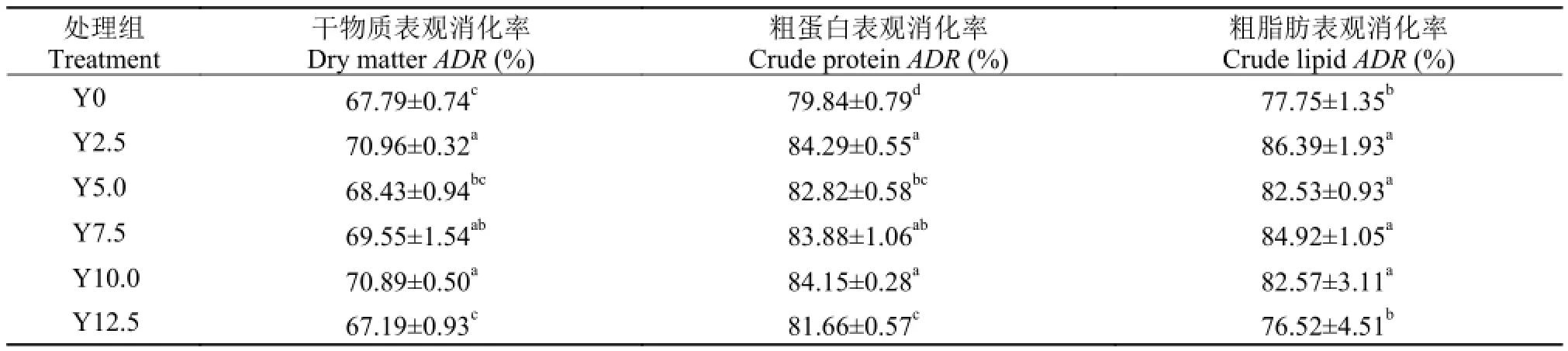
表 5 酵母水解物替代鱼粉对凡纳滨对虾对饲料营养物质消化率的影响Tab. 5 Effects of replacing fishmeal with yeast hydrolyzate on dietary ADR of shrimps
由数据可知, 添加酵母水解物显著降低了对虾淀粉酶活性(P<0.05, 图 2A)。对照组与添加酵母水解物处理组的糜蛋白酶活性无显著差异(P>0.05),Y5.0和Y12.5处理组的糜蛋白酶活性显著高于Y2.5、Y7.5和Y10处理组(P<0.05)(图 2B)。对照组与Y2.5、Y7.5处理组的胰蛋白酶活性显著高于Y10和Y12.5处理组(图 2C)。
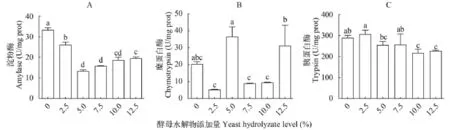
图 2 酵母水解物对凡纳滨对虾肝胰腺消化酶活性的影响Fig. 2 Effects of replacing fishmeal with yeast hydrolyzate on digestive enzyme activities of shrimps hepatopancreas
2.5 酵母水解物替代鱼粉对凡纳滨对虾血清免疫相关酶活性的影响
在本实验中, 在酵母水解物的作用下, 对虾血清中酚氧化酶活性呈先增加后降低趋势, 在Y2.5处理组显著高于对照组(P<0.05), 其他处理组与对照组显著低于与无显著差异(P>0.05)(图 3A)。一氧化氮合成酶活性变化不明显, 在对照组与Y2.5、Y5.0与Y7.5处理组间无显著差异(P>0.05), 在Y10.0、Y12.5处理组显著降低(P<0.05)(图 3B)。对虾血清中溶菌酶活性也呈先增加后降低趋势, 在Y7.5处理组为最大值, 显著高于对照组、Y2.5、Y10和Y12.5处理组(P<0.05)(图 3C)。
2.6 酵母水解物替代鱼粉对凡纳滨对虾攻毒后累计死亡率和免疫保护力的影响
由图 4A可知, 经副溶血弧菌攻毒处理后, 添加Y5.0酵母水解物组对虾的累计死亡率最低, 显著低于Y7.5、Y10、Y12.5处理组(P<0.05)。Y2.5的相对免疫保护率与鱼粉对照组相当, Y5.0处理组相对免疫保护力最高(图 4B)。
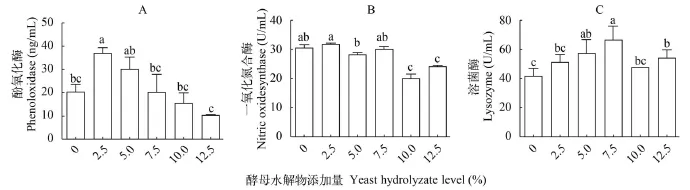
图 3 酵母水解物对凡纳滨对虾血清免疫酶活性的影响Fig. 3 Effects of replacing fishmeal with yeast hydrolyzate on immune enzyme activities of shrimps serum
3 讨论
我国《饲料原料目录》中定义酵母水解物是以酿酒酵母(Saccharomyces cerevisiae)为菌种, 经液体发酵得到的菌体, 再经自溶或外源酶催化水解后,浓缩或干燥获得的产品, 酵母可溶物未经提取, 粗蛋白含量不低于35%。酵母中相关功能性成分的作用在陆生动物中的研究较多, 能够提高猪、鸡等的生长、应激适应能力和抗病力[11—13]。酿酒酵母可以提高鱼类如虹鳟[14]、金头鲷(Sparus aurata L.)[15]和杂交条纹鲈(Morone chrysops×M. saxatilis)[16, 17]的生长性能、免疫效应和抗病力。本实验数据表明,饲料中鱼粉含量为20%时, 添加5%酵母水解物, 不会对凡纳滨对虾的增重率和特定生长率产生显著影响, 表明酵母水解物替代16%的鱼粉后并不会降低对虾的生长性能。酵母水解物中富含核酸和小肽等功效成分, 有利于机体蛋白质沉积[18], 曾本和等[19]得出适量的酵母水解物可以提高草鱼(Tenopharyngodon idellus)的生长性能和肌肉粗蛋白的含量。在本实验中各添加组肌肉粗蛋白含量均高于对照组, 也证明了这一点。虽然添加酵母水解物的处理组虾体肥满度和肌肉粗蛋白质含量均显著优于鱼粉对照组, 但是, 当酵母水解物添加量超过5.0%时, 随着酵母水解物添加水平上升, 饲料系数上升并且增重效果下降, 表明酵母水解物不适宜添加过高水平。
酵母细胞壁占细胞质量的50%, 导致动物对酵母这种饲料原料的消化率较低。然而, 通过酶解或自溶的工艺可提高酵母在动物肠道的消化率。酵母水解物部分替代鱼粉后可以改善对虾肠道对实验饲料干物质的表观消化率。添加酵母水解物降低了对虾机体的淀粉酶活性, 可能对饲料中淀粉的消化吸收有影响, 5.0%组糜蛋白酶活性最高,2.5%组胰蛋白酶活性最高, 结合表观消化率和生长数据可知, 添加酵母水解物后凡纳滨对虾对饲料中干物质的表观消化率有所改善, 进而提高了对虾对营养物质的消化, 促进生长。
对虾的非特异性免疫指标中, 酚氧化酶(PO)、一氧化氮合成酶(NOS)、溶菌酶(LZM)活力在一定程度上反应了机体的免疫防御状态, 在对虾的体液免疫中占有非常重要的地位。甲壳动物酚氧化酶原激活系统(proPO系统)是一种类似于脊椎动物的补体级联系统, 在免疫识别和防御中起着关键作用;由NOS催化产生一氧化氮, 它不仅可以非特异性杀伤细菌、真菌、寄生虫及病毒, 还可以调节多种免疫活性介质, 广泛地影响机体的免疫功能; LZM广泛存在于甲壳动物体内多种组织和体液中, 其活性是衡量其机体免疫状态的重要指标之一。酵母提取物替代饲料中15%的鱼粉可显著提高凡纳滨对虾血清LZM活性[20]。酵母水解物因含有酵母细胞壁, 能够提供甘露聚糖、葡聚糖、几丁质[21]和核酸[22]等成分有益于动物的抗应激和抗病力。有研究表明核苷酸可提高大西洋鲑的免疫力, 增强其对各种致病性细菌的抗感染能力[23]。许第新等[24]采用腹腔注射酵母细胞壁给克氏原螯虾(Procamgbarus clarkii), 24h、48h和72h 取样结果表明酵母多糖能显著地提高虾类肝胰腺和血清中ACP 和ALP 的活性。在本实验中, 饲料中2.5%—7.5%的酵母水解物可以使对虾的非特异性免疫性能在一定程度上有所提升, PO、NOS和LZM的活性均高于鱼粉对照组。提示相对于鱼粉对照组, 摄食一定量的酵母水解物可以使机体处于较高的防御水平。酵母水解物与商业饲料组相比, 饲料中添加酵母水解物可以降低虹鳟感染鲁氏耶尔森氏菌(Yersinia ruckeri)的死亡率[25]。王武刚[20]研究表明, 用酵母提取物替代饲料中45%的鱼粉不会对凡纳滨对虾抗弧菌能力产生负面影响。本实验结果表明, 添加5%酵母水解物可有效提高凡纳滨对虾抗副溶血弧菌感染的能力, 这可能与酵母水解物内所含的多糖和核苷酸等有关。食物或饲料中过多的核酸会对人类和单胃动物产生毒性[26], 而在鱼类中却无此现象[27], 但也有研究指出饲料中高含量的核酸会不利于鱼类的生长[28, 29]。Sajeevan等[30]指出核苷酸可作为水产动物的免疫增强剂, 但核苷酸在鱼类和甲壳类体内的合成及代谢机制尚不清楚。联合国粮农组织2013年5月3日发布报告称, 一种被称为“对虾早期死亡综合症”的神秘疾病致使亚洲多国的养殖虾大量死亡, 经美国亚利桑那大学的研究人员证实, 其元凶是普遍存在于世界各地沿海半咸水水域中的副溶血弧菌[31]。近几年来, 凡纳滨对虾早期死亡综合症的病原主要是副溶血弧菌。饲料中含有适宜比例的酵母水解物可以很好地提高凡纳滨对虾抗副溶血弧菌感染的能力。
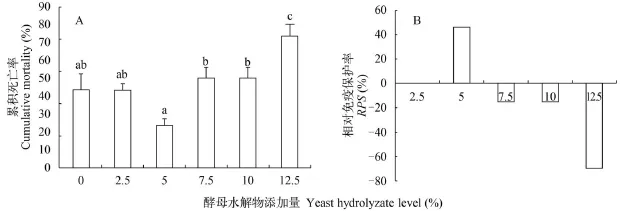
图 4 酵母水解物对凡纳滨对虾副溶血弧菌攻毒后累计死亡率和免疫保护力的影响Fig. 4 Effects of replacing fishmeal with yeast hydrolyzate on cumulative mortality and RPS of shrimps after V. parahaemolyticus challenge
本实验结果表明, 添加5%酵母水解物(替代鱼粉比例达16.67%)时, 可以改善凡纳滨对虾对饲料营养物质的表观消化率, 不会对凡纳滨对虾的增重率和特定生长率产生负面影响; 并且可有效提高凡纳滨对虾抗副溶血弧菌感染的能力。以增重率为参考依据, 经二次曲线拟合得出, 满足对虾获得最大增重率时, 酵母水解物添加量的1.62%, 替代鱼粉比例为5.19%。酵母水解物对凡纳滨对虾生长、免疫和抗病力的具体机制还需深入探讨。
[1]Ferreira I M P L V O, Pinho O, Vieira E, et al. Brewer's Saccharomyces yeast biomass: characteristics and potential applications [J]. Trends in Food Science & Technology, 2010, 21(2): 77—84
[2]Nocek J E, Holt M G, Oppy J. Effects of supplementation with yeast culture and enzymatically hydrolyzed yeast on performance of early lactation dairy cattle [J]. Journal of Dairy Science, 2011, 94(8):4046—4056
[3]Heugten van E, Funderburke D W, Dorton K L. Growth performance, nutrient digestibility, and fecal microflora in weanling pigs fed live yeast [J]. Journal of Animal Science, 2003, 81(4): 1004—1012
[4]Gopalakannan A, Arul V. Enhancement of the innate immune system and disease-resistant activity in Cyprinus carpio by oral administration of β-glucan and whole cell yeast [J]. Aquaculture Research, 2010, 41(6): 884—892
[5]Tukmechia A, Andanib H R R, Manaffarc R, et al. Dietary administration of beta-mercapto-ethanol treated Saccharomyces cerevisiae enhanced the growth, innate immune response and disease resistance of the rainbow trout, Oncorhynchus mykiss [J]. Fish & Shellfish Immunology, 2011, 30(3): 923—928
[6]Sheikhzadeh N, Heidarieh M, Pashaki A K, et al. Hilyses®, fermented Saccharomyces cerevisiae, enhances the growth performance and skin non-specific immune parameters in rainbow trout (Oncorhynchus mykiss) [J]. Fish & Shellfish Immunology, 2012, 32(6): 1083—1087
[7]He S, Zhou Z, Liu Y, et al. Effects of dietary Saccharomyces cerevisiae fermentation product (DVAQUA®) on growth performance, intestinal autochthonous bacterial community and non-specific immunity of hybrid tilapia(Oreochromis nileoticus♀×Oreochromis aureus♂) cultured in cages [J]. Aquaculture, 2009, 294(1—2):99—107
[8]Burgents J E, Burnett K G, Burnett L E. Disease resistance of pacific white shrimp, Litopenaeus vannamei, following the dietary administration of yeast culture food supplement [J]. Aquaculture, 2004, 231(1—4): 1—8
[9]Subramanian M, Alikunhi N M, Kandasamy K. Immunostimulatory effect of mangrove-derived marine yeasts in Penaeus monodon [J]. Aquaculture Research, 2012,45(3): 389—396
[10]Helric K. AOAC Association of Official Analytical Chemists [A]. In: Official Methods of Analysis of AOAC,15th edn [C]. Association of Official Analytical Chemists Inc., Arlington, VA, USA. 1990
[11]Pan S D, Li X J, Bian L Q. Study the effects of yeast nucleic on the performance and intestinal flora of weanling pigs [J]. Chinese Journal of Animal Science, 2008, 44(5):37—40 [潘树德, 李学俭, 边连全. 酵母核酸对断奶仔猪生产性能及肠道菌群影响的研究. 中国畜牧杂志, 2008,44(5): 37—40]
[12]Carlson M S, Veum T L, Turk J R. Effects of yeast extract versus animal plasma in weanling pig diets on growth performance and intestinal morphology [J]. Journal of Swine Health and Production, 2005, 13(4):204—209
[13]Frankič T, Pajk T, Rezar V, et al. The role of dietary nucleotides in reduction of DNA damage induced by T-2 toxin and deoxynivalenol in chicken leukocytes [J]. Food and Chemical Toxicology, 2006, 44(11): 1838—1844
[14]Siwicki A K, Anderson D P, Rumsey G L. Dietary intake of immunostimulants by rainbow trout affects nonspecific immunity and protection against furunculosis [J]. Veterinary Immunology and Immunopathology, 1994,41(1—2): 125—139
[15]Ortuño J, Cuesta A, Rodríguez A, et al. Oral administration of yeast, Saccharomyces cerevisiae, enhances the cellular innate immune response of gilthead sea bream (Sparus aurata L.) [J]. Veterinary Immunology and Immunopathology, 2002, 85(1—2):41—50
[16]Li P, Gatlin D M Ш. Evaluation of brewer's yeast (Saccharomyces cerevisiae) as a feed supplement for hybrid striped bass (Morone chrysops×M. saxatilis) [J]. Aquaculture, 2003, 219(1—4): 681—692
[17]Li P, Gatlin D M Ш. Dietary brewer's yeast and the prebiotic GroBiotickTMAE influence growth performance,immune responses and resistance of hybrid striped bass (Morone chrysops×M. saxatilis) to Streptococcus iniae infection [J]. Aquaculture, 2004, 231: 445—456
[18]He M, Huang X, Chen Z P, et al. Digestion, absorption and nutrition physiological role of yeast hydrolyzate [J]. China Feed, 2014, (9): 38—41 [贺淼, 黄鑫, 陈中平, 等.酵母水解物的消化吸收及营养作用. 中国饲料, 2014, 9:38—41]
[19]Zeng B H, Xiang X, Yang W J, et al. Effects of yeast hydrolyzate on growth and body composition of juvenile Ctenopharyngodon idellus [J]. Chinese Journal of Feed Industry, 2015, 36(16): 16—19 [曾本和, 向枭, 杨文娇,等. 酵母水解物对草鱼生长性能和体成分的影响. 饲料工业, 2015, 36(16): 16—19]
[20]Wang W G. The study on replacement of fish meal by yeast extract in diet of Litopenaeus vannamei [D]. Thesis for Master of Science. Shanghai Ocean University. Shanghai. 2012 [王武刚. 酵母提取物替代鱼粉在凡纳滨对虾饲料中的应用研究. 硕士学位论文, 上海海洋大学.上海. 2012]
[21]Cabib E, Roberts R, Bowers B. Synthesis of the yeast cell wall and its regulation [J]. Annual Review of Biochemistry, 1982, 51: 763—793
[22]Burrells C, William P D, Forno P F. Dietary nucleotides:a novel supplement in fish feeds:1. Effects on resistance to diseases in salmonids [J]. Aquaculture, 2001,199(s1—2): 159—169
[23]Tukmechi1 A, Bandboni M. Effects of Saccharomyces cerevisiae supplementation on immune response, hematological parameters, body composition and disease resistance in rainbowtrout, Oncorhynchus mykiss (Walbaum,1792) [J]. Journal of Applied Ichthyology, 2014, 30(1):55—61
[24]Xu D X, Yao J, Chen C F. Effects of injection immunopolysaccharide (yeast cell wall) on immune related enzyme activity of Procamgbarus clarkii [J]. Chinese Journal of Freshwater Fisheries, 2004, 34(5): 55—58 [许第新, 姚娟, 陈昌福. 注射免疫多糖(酵母细胞壁)对克氏原螯虾几种免疫相关酶活性的影响. 淡水渔业, 2004,34(5): 55—58]
[25]Rumsey G L, Winfree R A, Hughes S G. Nutritional values of dietary nucleic acids and purine bases to rainbow trout (Oncorhynchus mykiss) [J]. Aquaculture, 1992,108(1—2): 97—110
[26]Schulz E, Oslage H J. Composition and nutritive value of single-cell protein (SCP) [J]. Animal Feed Science and Technology, 1976, 1(1): 9—24
[27]Huiguera M de la, Sánchez-Muniz F J, Mataix F J, et al. Nitrogen utilization by rainbow trout (Salmo gairdneri)fed on the yeast Hansenula anomala [J]. Comparative Biochemistry & Physiology, Part A Physiology, 1981,69(3): 583—586
[28]Tacon A G J, Cooke D J. Nutritional value of dietary nucleic acids to trout [J]. Nutrition Reports International,1980, 22(5): 631—640
[29]Davies S J, Wareham H. A preliminary evaluation of anindustrial single cell protein in practical diets for tilapis (Oreochromis mossambicus Peters) [J]. Aquaculture,1988, 73(1—4): 189—199
[30]Sajeevan T P, Philip R, Singh B. Immunostimulatory effect of a marine yeast Candida sake S165 in Fenneropenaeus indicus [J]. Aquaculture, 2006, 257(s1—4):150—155
[31]Prevention and control of Vibrio parahaemolyticus. http://www.fishfirst.cn/article-22924—1.html [中国水产频道. 副溶血弧菌的预防与控制]
STUDY ON SUITABLE PROPORTION OF YEAST HYDROLYZATE REPLACEMENT OF FISHMEAL IN FEED OF LITOPENAEUS VANNAMEI
CHI Shu-Yan1, NIE Qin2, HUANG Wu-Wen1, JIE Yu1, TAN Bei-Ping1, YANG Fan2, HU Jun-Peng2,DONG Xiao-Hui1, YANG Qi-Hui1, LIU Hong-Yu1and ZHANG Shuang1
(1. Laboratory of Aquatic Economic Animal Nutrition and Feed, College of Fisheries, Guangdong Ocean University,Zhanjiang 524088, China; 2. Angel Yeast Co., Ltd, Yichang 443003, China)
A series of 8 weeks feeding experiment was conducted to estimate the suitable proportion of yeast hydrolyzate (YH) suitable for fishmeal in feed of Litopenaeus vannamei. Supplementation of YH were 0, 2.5%, 5.0%, 7.5%,10% and 12.5%, respectively. The substitution proportions for fishmeal were 0, 8%, 16%, 24%, 32% and 40%, respectively. The effects of yeast hydrolyzate instead of part fishmeal on the healthy growth of juvenile shrimp were evaluated by assessing the growth performance, digestive enzymes and immune enzymes activities. Each diet was fed to triplicate groups with shrimp [initial body weight of (0.63±0.01) g] in a fresh water rearing system. The weight gain rate and specific growth rate of shrimps of Y2.5 and Y5.0 treatments showed no significant differences with the shrimp of Y0 treatment (P>0.05), which were significantly higher than that of the other treatments (P<0.05). No differences were found between the Y2.5 treatment and Y0 treatment in feed coefficient (P>0.05). Feed coefficient of Y2.5 treatment was lower than that of the other substitution treatments (P<0.05). Chymotrypsin activities of hepatopancreas in treatments Y5.0 and Y0 were not significant (P>0.05), but significantly higher than that of the rest treatments (P<0.05). Trypsin activities of hepatopancreas in treatments Y2.5, Y7.5 and Y0 were not significant (P>0.05), but significantly higher than that of the rest treatments (P<0.05). Polyphenol oxidase activities of shrimp of Y2.5 and Y5.0 were higher than the others (P<0.05). Total nitric oxide synthase activities of shrimp of Y0, Y2.5 and Y7.5 were higher than that of the others (P<0.05). Serum lysozyme activities of shrimp of Y5.0 and Y7.5 treatment were higher than that of the other treatments (P<0.05). Quadratic regression analysis of weight gain against YH replacement ratio of fishmeal indicated that the optimum additive amount was 1.62% and replacement ratio was 5.19% for the maximum weight gain of juvenile shrimp. There was no difference on weight gain of shrimp while the replacement ratio of hydrolyzed yeast to fishmeal to 24%.
Yeast hydrolyzate; Litopenaeus vannamei; Growth performance; Digestive enzyme; Immune enzyme
S965.9
A
1000-3207(2016)04-0728-08
10.7541/2016.96
2015-12-19;
2016-02-14
国家自然科学基金(No. 31402310); 公益性行业(农业)科研专项(No. 201003020); 地方高校国家级大学生创新创业训练计划项目(No. 201510566002)资助 [Supported by the National Natural Science Foundation of China (No. 31402310); Special Fund for Agroscientific Research in the Public Interest (No. 201003020); National Training Program of Innovation and Entrepreneurship for Undergraduates (No. 201510566002)]
迟淑艳(1977—), 女, 内蒙古赤峰人; 博士; 主要从事水产动物营养与饲料学科研和教学工作。E-mail: chishuyan77@163.com
谭北平(1967—), 男, 湖北巴东人; 博士; 主要从事水产动物营养与饲料学科研和教学工作。E-mail: bptan@126.com
