金黄色葡萄球菌新型肠毒素sek基因在3 株食品分离菌株中的表达
2016-08-10唐俊妮蔡自建西南民族大学生命科学与技术学院四川成都610041
王 琼,唐俊妮*,汤 承,陈 娟,刘 骥,蔡自建(西南民族大学生命科学与技术学院,四川 成都 610041)
金黄色葡萄球菌新型肠毒素sek基因在3 株食品分离菌株中的表达
王 琼,唐俊妮*,汤 承,陈 娟,刘 骥,蔡自建
(西南民族大学生命科学与技术学院,四川 成都 610041)
摘 要:目的:肠毒素sek基因在临床分离的耐甲氧西林金黄色葡萄球菌菌株中较为流行,研究新型肠毒素sek基因的时序性表达可为食物中毒预防和疾病控制补充新的基础数据。方法:本研究针对实验室保存的食源性金黄色葡萄球菌菌株进行21 种肠毒素基因检测,筛选出3 株含sek基因的菌株SA005、SA008和SAB0,针对3 株菌株进行生长曲线测定,随后在培养不同时间段收集菌体提取RNA,利用实时荧光定量聚合酶链式反应(real time-polymerase chain reaction,real time-PCR)检测肠毒素sek基因在12~120 h的相对表达水平。结果:基因检测结果显示,菌株SA005含有16S、nuc、mecA、seb、sec、sek、sex基因,SA008含有16S、nuc、mecA、sea、sek、sex基因,SAB0含有16S、nuc、sek、sex基因。3 株菌株在胰酪胨大豆肉汤培养基中的生长曲线趋势较相似,18 h左右出现折点,之后细菌进入生长稳定期。3 株菌株的sek基因在12~120 h全程表达,SA005的sek基因在48 h时相对表达量最高,在84 h相对表达量最低;SA008在24 h时的相对表达量最高,在48 h相对表达量最低,在60~120 h表达量相对比较稳定;SAB0在12~120 h之间相对表达量呈现抛物线趋势,在60 h和72 h的表达量相对较高且差异不显著(P>0.05)。结论:3 株菌株sek表达水平存在明显差异,相同菌株sek基因不同时间点表达也存在差异性,菌株基因背景的影响可能是造成sek基因表达差异性的关键。
关键词:金黄色葡萄球菌;新型肠毒素;sek基因;实时荧光定量聚合酶链式反应;时序性表达
引文格式:
王琼, 唐俊妮, 汤承, 等.金黄色葡萄球菌新型肠毒素sek基因在3 株食品分离菌株中的表达[J].食品科学, 2016, 37(13): 140-146.DOI:10.7506/spkx1002-6630-201613025. http://www.spkx.net.cn
WANG Qiong, TANG Junni, TANG Cheng, et al.Temporal expression of staphylococcal enterotoxin k (sek) gene in three isolates from food samples[J].Food Science, 2016, 37(13): 140-146.(in Chinese with English abstract) DOI:10.7506/ spkx1002-6630-201613025. http://www.spkx.net.cn
金黄色葡萄球菌(Staphylococcus aureus)是一种常见的食源性病原菌,能产生多种致病因子,如溶血素、杀白细胞素、血浆凝固酶、耐热核酸酶以及肠毒素(staphylococcal enterotoxins,SEs)等。其中肠毒素蛋白对热、低pH值、蛋白酶均具有一定的抵抗力。当摄取了污染金黄色葡萄球菌的食物后,其产生的肠毒素仍可以在消化道内保持一定的活性,从而引起食物中毒。中毒发生比较迅速(进食后约2~8 h),其症状包括恶心、剧烈呕吐,有时会伴随腹泻[1]。迄今人们已发现多种肠毒素血清型,通常分为经典肠毒素(classic enterotoxins,SEA-SEE)和新型肠毒素(newly identified enterotoxins,SEG-SEX)[2-3]。
SEK是Orwin等[4]于2001年发现的一种新型肠毒素,由移动基因元件前噬菌体[5]和葡萄球菌基因岛[6]编码。分子质量约为26 kD,等电点pI值在7.0~7.5之间,重组的葡萄球菌肠毒素K(staphylococcal enterotoxin K,SEK)蛋白能够刺激CD4+和CD8+T细胞的Vβ-5.1、5.2以及6.7区域位点大量增殖[4],并引起灵长目动物的呕吐反应[7]。流行病学研究还发现,sek基因在临床分离菌株中较为流行,如卫沛楠等[8]检测了144 株食源性金黄色葡萄球菌,sek基因的检出率为20.14%,认为食源性菌株中seu、seg、sem和sek检出率较高。岳丽琴等[9]采用聚合酶链式反应(polymerase chain reaction,PCR)方法对分离自肺炎患儿的60 株金黄色葡萄球菌进行检测,结果发现sek的检出率为最高,达到50%,他们认为分离自肺炎患儿的金黄色葡萄球菌sek基因有较高的流行性。最新的研究发现,sek基因与社区获得性耐甲氧西林金黄色葡萄球菌(community-acquired methicillin-resistant S.aureus,CAMRSA)USA300、USA400密切相关[10]。Wu Dejing等[11]对99 株CA-MRSA的基因背景进行调查分析发现,约88.9%的CA-MRSA中存在肠毒素基因,其中以sek基因所占比例最多,大约为62.6%,其次是seq基因(61.6%)和seb基因(60.6%)。Varshney等[12]从血液和伤口分离的金黄色葡萄球菌中发现,sek基因在耐甲氧西林金黄色葡萄球菌(methicillin-resistant S.aureus,MRSA)中的携带率明显高于甲氧西林敏感的金黄色葡萄球菌(methicillinsensitive S.aureus,MSSA)。Aguilar等[10]测序20 株临床分离菌株的金黄色葡萄球菌肠毒素K(staphylococcal enterotoxin-like K gene,selk)基因,并与14 条已经发表的selk基因进行序列比对分析,发现sek基因至少存在6 种变体,其中一种变体在所测USA300菌株中都为保守,推测携带肠毒素sek基因的金黄色葡萄球菌引起的食物中毒可能比其他肠毒素更加难以治疗,因此,对于肠毒素sek的研究也显得尤为重要。
由于金黄色葡萄球菌食品源分离菌株的特异性和毒素基因存在形式的多样性,针对不同分离菌株肠毒素基因的表达及相互影响还需要开展更多的研究。因此,本研究针对实验室保存的食源性金黄色葡萄球菌分离菌株进行肠毒素基因及相关基因的背景检测,选出3 株含有sek基因的菌株作为研究对象。采用实时荧光定量PCR (real time-PCR)技术,以ftsz为内标基因[13-14],探索在细菌生长不同时间段sek基因在mRNA水平上的相对表达情况以及不同菌株的表达差异,为将来进一步寻求降低或抑制肠毒素表达的抑制剂奠定基础,从而降低金黄色葡萄球菌肠毒素引起的食物中毒。
1 材料与方法
1.1 菌株、培养基与试剂
西南民族大学微生物实验室-70 ℃冻存的食品源金黄色葡萄球菌分离菌株SA005、SA008和SAB0。
胰蛋白胨大豆肉汤培养基(trypticase soy broth,TSB)、胰酪胨大豆琼脂培养基(tryptose soya agar,TSA)、Baird-Parker(BP)琼脂基础 青岛海博生物技术有限公司。
1×(三羟甲基氨基甲烷-乙二胺四乙酸(tris(hydroxymethyl) aminomethane-ethylene diamine tetraacetic acid tris,TE)缓冲液(10 mmol/L Tris-HCl,1 mmol/L pH 8.0乙二胺四乙酸);PCR扩增试剂、DL2000 Marker 日本TaKaRa公司;细菌总RNA提取试剂盒、溶菌酶 天根生化科技(北京)有限公司;RevertAid First Strand cDNA Synthesis Kit 美国Thermo Scientific公司;SsoAdvancedTMSYBR®Green Supermix美国Bio-Rad公司;焦碳酸二乙酯 美国Amresco公司。
1.2 仪器与设备
HZQ-F160全温振荡培养箱 上海齐欣科学仪器有限公司;Eppendorf 5804R型冷冻离心机、PHS-4C+酸度计 成都世纪方舟科技有限公司;Galanz WD800B型微波炉、DYY-6C型电泳仪 北京六一仪器厂;TSNENEN031445 PCR仪、BioSpec-nano230V核酸测定仪、CFX96荧光定量PCR仪 美国Bio-Rad公司。
1.3 方法
1.3.1 细菌DNA提取
取冻存的3 株金黄色葡萄球菌菌液50 μL接种于5 mL TSB营养肉汤中,置于37 ℃摇床过夜复苏,于金黄色葡萄球菌选择性BP平板上纯化,挑取单菌落转接于LB培养基中培养12~16 h,取1 mL培养后的菌液,4 ℃、12 000 r/min离心2 min,收集菌体。参照微波加热方法提取分离细菌基因组DNA[15]。
1.3.2 常规PCR基因引物
金黄色葡萄球菌1 6 S r D N A以及耐热核酸酶基因n u c基因引物序列及P C R扩增条件参考文献[16];耐甲氧西林mecA基因的引物序列及PCR扩增条件参考文献[17]。具体引物序列如下:16S-F-5′-GTGCACATCTTGACGGTACC-3′,16S-R-5′-CGAAGGGGAAGGCTCTATC-3′;nuc-F-5′-ATCATTATTGTAGGTGTATTAGC-3′,nuc-R-5′-CAGGCGTATTCGGTTTC-3′;mecA-F-5′-TGGCTCAGGTACTGCTATCC-3′,mecA-R-5′-CACCTTGTCCGTAACCTGAA-3′。
21 种不同肠毒素基因以及毒性休克综合征毒素(toxic shock syndrom toxin,TSST)基因的常规PCR扩增引物序列见表1,其中由本实验设计的所有引物均参照GenBank(http://www.ncbi.nlm.nih.gov/genbank/)上报道的不同肠毒素基因序列,采用Primer 6.0软件自行设计,所有引物采用BLAST进行特异性比对。引物序列由生工生物工程(上海)股份有限公司合成。

表 1 用于常规PCR的引物序列Table 1 Primer sequences for conventional PCR基因 引物序列(5′→3′) 理论长度/bp退火温度/℃参考文献SEA-F ATTAACCGAAGGTTCTGTAGA 582 55 SEA-R TTGCGTAAAAAGTCTGAATT SEB-F CCTAAACCAGATGAGTTGCAC 592 55 [18]SEB-R CAGGCATCATGTCATACCAAA SEC-F AGATGAAGTAGTTGATGTGTATGG 454 55 [18]SEC-R CTTCACACTTTTAGAATCAACCG SED-F GCTTGTACATATGGAGGTGTCA 263 60 [18]SED-R GACCCATCAGAAGAATCAAACT

续表1
1.3.3 肠毒素基因PCR检测
采用常规PCR对3 株金黄色葡萄球菌存在的毒素基因型进行调查。PCR扩增反应体系为:10×PCR Buffer (Mg2+free)2 μL,25 mmol/L MgCl21.6 μL,dNTP Mixture(2.5 mmol/L each)1.2 μL,Taq DNA聚合酶(5 U/μL)0.2 μL,20 μmol/L的上下游引物各0.5 μL,模板1 μL,灭菌超纯水补足20 μL体系。PCR扩增时,95 ℃预变性5 min;进入PCR循环,95 ℃变性40 s,退火50 s(各肠毒素退火温度详见表1),72 ℃延伸40 s,35 个循环;72 ℃延伸7 min,4 ℃保存。
PCR产物琼脂糖电泳检测:配制1%琼脂糖凝胶,取5 μL PCR扩增产物上样,80 V电泳45 min,凝胶成像系统观察与贮存电泳图片。各基因进行PCR检测时设有阳性对照和阴性对照,PCR扩增获得的阳性条带送生工生物工程(上海)股份有限公司测序并进行比对验证,以确保序列的正确性。
1.3.4 3 株细菌的生长曲线测定
基于文献报道多数肠毒素合成于细菌生长的对数期或是向稳定期转化的过程[13,21-23],本实验为了研究金黄色葡萄球菌SA005、SA008以及SAB0菌株在TSB中的时序性表达规律,进行了120 h的生长监测和取样。首先取50 μL保存于甘油中的3 株目标菌株的菌液,解冻后分别接种到5 mL的TSB 培养基中,37 ℃、150 r/min培养12 h,取增菌后的菌液500 μL,于4.5 mL灭菌生理盐水中进行10 倍梯度稀释,取合适稀释度的菌液进行平板计数,每个梯度做3 次平行。根据平板计数结果,在装有500 mL的TSB培养基的三角瓶中接入金黄色葡萄球菌,为了模拟实际污染情况,初始接菌量约为100~101CFU,混匀,37 ℃培养。在开始培养的0~12 h中每隔1 h取一次样,12~24 h每隔2 h取样一次,24~48 h每隔4 h取样一次,48~120 h每隔12 h取样一次,进行菌落计数,每个测定时间点均做3 次平行。
1.3.5 RNA提取
收集SA005、SA008以及SAB0生长的12、24、36、48、60、72、84、96、108 h及120 h共10 个取样点的培养菌液,4 ℃、12 000 r/min离心2 min,弃上清,收集菌体,-70 ℃冰箱保存备用。RNA提取时,取500 μL 1×TE重悬菌体,加入溶菌酶在37 ℃条件下过夜,然后根据细菌总RNA提取及纯化试剂盒操作方法提取总RNA,所有试剂和耗材均用焦碳酸二乙酯处理,提取的RNA采用DNase I处理以去除残留的DNA。
1.3.6 反转录以及荧光定量PCR
用于荧光定量PCR扩增的sek引物序列见表2。肠毒素sek引物参照GenBank(http://www.ncbi.nlm.nih.gov/ genbank/)上报道的基因序列,采用Primer 6.0软件进行设计,引物采用BLAST进行特异性比对,内参基因ftsz参考文献[13-14]。所有引物的合成由生工生物工程(上海)股份有限公司完成。

表 2 用于荧光定量PCR的引物序列Table 2 Primer sequencesforreal-timePCR analysis基因 引物序列(5′→3′) 理论扩增长度/bp 参考文献sek-F TATATGGCGGAGTCACAGCTA 188 sek-R TTTTTAGTGCCGTTATGTCC ftsz-F TGAAGATGCAATCCAAGGTG 116 [14]ftsz-R GTTAATGCGCCCATTTCTTT
以不同时间点提取的3 株目标菌株总RNA为模板,应用RevertAid First Strand cDNA合成试剂盒将RNA反转录为cDNA。具体操作按照试剂盒说明书,反应体系20 µL,反应条件为42 ℃,60 min;70 ℃,5 min。得到的cDNA产物采用BioSpec-nano230V核酸测定仪测定核酸浓度。
荧光定量PCR反应采用SYBR荧光定量试剂盒在CFX96 PCR仪上进行,每个样品各做3 次平行。荧光定量PCR的反应体系为10 µL,包括SYBR Green Supermix 5 µL,肠毒素sek与ftsz基因正、反向引物(10 µmol/L)各0.5 µL,cDNA模板1 µL,RNase free water 3 µL。
荧光定量PCR退火温度的探索:将上述反应体系按照95 ℃,2 min;95 ℃,30 s、55~65 ℃(共设置8 个温度梯度),30 s,39 个循环进行荧光定量PCR。反应结束后,选择熔解曲线尖锐且Ct值较小的体系所对应的温度为该肠毒素的最佳退火温度T*。然后取该T*对应的扩增产物作为模板,采用BioSpec-nano230V核酸测定仪测定核酸浓度,10 倍稀释成8 个梯度,反应条件为95 ℃,2 min;之后进入循环,首先95 ℃解链10 s,然后退火温度T*条件下退火30 s,一共进行39 个循环;分别获得肠毒素基因sek和内参基因ftsz的荧光定量PCR标准曲线。针对3 株目标菌株各取样点反转录cDNA的扩增同样按照上述条件进行,从而得到不同取样点对应的Ct值。
1.3.7 肠毒素基因sek的相对定量分析
sek基因在不同时间点的相对定量分析采用改良的2-Δ ΔCt法[21],以肠毒素sek为目标基因和ftsz为内参基因,得到公式:

式中:R为目标基因在样本中的表达相对于对照组的相对表达量;Esek、Eftsz分别为荧光定量PCR扩增效率的E+1。E值根据E=10-1/slope-1计算,slope为标准曲线斜率;ΔCtsek为校准样本中目的基因Ct值与测试样本中目的基因的Ct值的差值;ΔCtftsz为校准样本中内标基因Ct值与测试样本中内标基因的Ct值的差值。
计算不同时间点sek基因的相对表达量时,先对3 株菌株的内参基因ftsz与目标基因sek的表达进行标准化,以3 株目标菌株在12 h时各基因的表达作为校准样本,24~120 h各时间点基因的表达作为测试样本,利用上述公式计算出3 株菌株的sek基因在不同取样时间点的相对表达量。
1.4 数据分析
生长过程中不同取样点测定的平板计数所获得的3 个平行数据,均采用Excel软件处理。3 株目标菌株肠毒素基因sek和内参基因ftsz在不同时间点的Ct值,应用Excel软件进行初步整理后使用SPSS 18.0数据分析软件处理,计量以±s表示,采用单因素方差分析(analysis of variance,ANOVA)分析组间差异性,组内计量资料比较采用Duncan's方法,以P<0.05为差异具有统计意义的标准。
2 结果与分析
2.1 金黄色葡萄球菌SA005、SA008和SAB0相关基因背景的检测结果
对3 株金黄色葡萄球菌SA005、SA008和SAB0进行16S、nuc、mecA、tsst-1基因以及21 种肠毒素基因的检测结果,如表3所示。SA005、SA008和SAB0均检测出16S、nuc、sek和sex 4 个共同的基因。其中,SA005携带肠毒素基因类型是seb、sec、sek和sex;SA008除携带sek基因外还携带传统肠毒素sea和新型肠毒素sex,而SAB0只携带sek和sex两种新型肠毒素基因。另外SA005和SA008菌株均检测出耐甲氧西林的mecA基因。

表 3 SA005、SA008和SAB0菌株的相关基因检测结果Table 3 Relatedgenotypes ofS.aureusisolatesSA005, SA008and SAB0菌株名称 基因类型SA005 16S、nuc、mecA、seb、sec、sek、sex SA008 16S、nuc、mecA、sea、sek、sex SAB0 16S、nuc、sek、sex
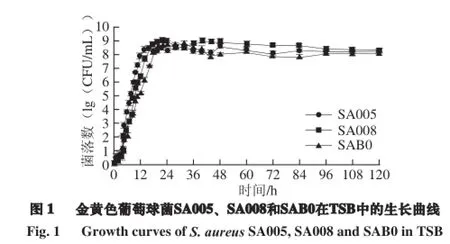
2.2 金黄色葡萄球菌SA005、SA008和SAB0在TSB中的生长曲线
对SA005、SA008和SAB0 3株细菌在TSB中的生长过程进行动态取样计数,以菌落总数的对数值为纵坐标,时间为横坐标绘制3 株菌株在TSB中的生长曲线。由图1可知,3 株菌株的变化趋势较相似。基本是在18 h左右出现折点,之后细菌进入生长的稳定期。
2.3 内参基因ftsz和肠毒素基因sek荧光定量PCR的标准曲线
根据ftsz和sek基因荧光定量PCR温度优化结果,选择熔解曲线尖锐只产生特异性单峰且Ct值较小的体系所对应的温度为最佳退火温度T*,ftsz和sek基因荧光扩增的T*分别为61.4 ℃和63.3 ℃。将模板10 倍稀释成8 个梯度,进行荧光定量PCR扩增,系统自动生成标准曲线,以核酸浓度的对数值为x轴,对应的Ct值为y轴,得到ftsz基因标准曲线方程为y=-3.399x+6.854,扩增效率为E=96.9%,回归相关系数r2=0.999;sek基因标准曲线方程为y=-3.679x+5.005,扩增效率为E=87%,回归相关系数r2=0.998。
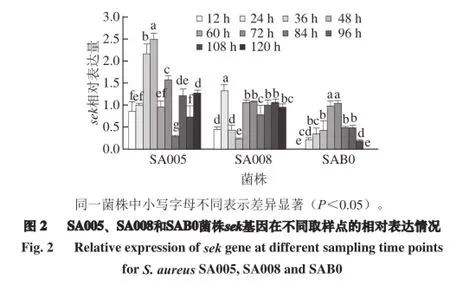
2.4 肠毒素sek基因在mRNA水平的动态变化监测
在金黄色葡萄球菌SA005、SA008和SAB0菌株的生长过程中,收集12、24、36、48、60、72、84、96、108、120 h共10 个时间点的菌体,分别提取各取样点细菌的总RNA,采用反转录-荧光定量PCR获得不同时间点不同菌株的sek基因和ftsz基因扩增的Ct值,结果见表4。

表 4 金黄色葡萄球菌SA005、SA008和SAB0不同取样点sek基因与ftsz基因Ct值Table4 Ct values ofsekgene andftszgene atdifferent samplingtimepoints for SA005, SA008 and SAB0时间/h SA005 SA008 SAB0 sek ftsz sek ftsz sek ftsz 12 13.8±0.25 12.13±0.15 19.82±0.06 16.83±0.15 36.24±0.14 16.24±0.07 24 17.44±0.01 15.74±0.05 22.34±0.13 20.77±0.03 26.23±0.31 19.43±0.02 36 14.54±0.01 14.2±0.14 25.78±0.27 22.31±0.14 20.86±0.59 15.15±0.13 48 16.18±0.01 15.92±0.1 29.83±0.11 25.1±0.03 20.44±0.6 15.12±0.12 60 14.37±0.04 12.85±0.17 20.08±0.03 18.37±0.03 19.45±0.07 15.45±0.09 72 14.05±0.03 13.27±0.06 19.28±0.01 17.66±0.02 19.74±0.05 15.77±0.05 84 17.66±0.08 14.06±0.06 16.82±0.3 14.89±0.14 22.43±0.06 17.11±0.07 96 13.47±0.12 12.36±0.09 17.07±0.06 15.49±0.11 22.12±0.01 16.89±0.06 108 14.93±0.3 12.94±0.24 16.72±0.06 15.26±0.06 27.12±0.24 20.01±0.05 120 15.08±0.06 13.92±0.03 19.06±0.01 17.25±0.12 28.97±0.63 15.73±0.05
根据表4中列举的Ct值,选择合适内参基因Ct值作为基准,对目标基因表达进行标准化,采用改良的2-ΔΔCt法,分析目标基因各时间点相对于内参基因的相对表达水平。得到金黄色葡萄球菌SA005、SA008和SAB0菌株sek基因在不同取样时间点的相对表达量(图2)。通过单因素ANOVA分析可知,sek基因在不同菌株中表达差异极显著(P<0.01);采用Duncan's分析同一菌株不同时间点mRNA的相对表达水平时,发现金黄色葡萄球菌SA005在48 h时相对表达量显著高于其他时间点的相对表达量(P<0.05),在84 h相对表达量最低;金黄色葡萄球菌SA008在24 h时的相对表达量显著高于其他时间点的相对表达量(P<0.05),在48 h相对表达量最低,而在60~120 h的表达量相对比较稳定;而SAB0在12~120 h之间相对表达量呈现抛物线趋势,两头低,而在60 h和72 h的表达量相对较高,且差异不显著(P>0.05),但与其他时间点的表达量差异显著(P<0.05)。不同菌株之间比较时,SA005的sek基因相对表达量比其他两株菌的表达量相对要高。
3 讨 论
本研究对实验室保存的食源性金黄色葡萄球菌分离菌株的肠毒素sek基因进行PCR扩增,筛选出3 株含有sek基因的菌株SA005、SA008和SAB0,并对3 株菌株的tsst-1基因、耐甲氧西林mecA基因以及21 种不同肠毒素基因进行PCR检测,获得了SA005、SA008和SAB0 3株菌株的相关基因背景信息。从结果来看,筛选的3 株菌株基因背景具有一定的代表性,SA005含有传统的肠毒素基因seb和sec,以及新型肠毒素基因sek和sex;SA008含有传统的肠毒素基因sea,以及新型肠毒素基因sek和sex;SAB0只含有新型肠毒素基因sek和sex。另外SA005 和SA008菌株中同时检测出mecA基因,这一点也吻合了前面提及的耐甲氧西林金黄色葡萄球菌中sek基因携带率比较高的观点[10-12]。值得一提的是,3 株菌中同时都携带sek和sex基因。至于sek和sex基因是否存在关联还需要在未来的研究工作中进一步进行证实。
在内标基因的选取上,本研究参照其他学者的研究结果选取ftsz基因作为内参基因[13-14],在表达的定量相对分析时,采用改良的2-ΔΔCt法对实验结果进行分析,分别利用荧光定量得到每种引物标准曲线以及对应的扩增效率值,该方法对比于传统的2-ΔΔCt法,增加了对不同引物扩增效率的校正,从而提高了分析结果的准确性。
针对sek基因的相对表达分析发现,在相同培养条件下,菌株自身的差异性会导致sek在mRNA水平表达差异性。菌株SA005和SA008除携带sek基因外,还携带有其他传统的肠毒素基因(seb、sec或sea),这两株菌株sek的表达量要高于不含任何传统肠毒素基因的菌株SAB0。猜测传统肠毒素基因对新型肠毒素基因的表达可能起着促进作用。本课题组研究结果与Aguilar等[10]结果有类似之处,他们发现同时携带seb和sek基因的菌株,SEK蛋白的表达水平显著高于其他不含seb基因的菌株。本研究中,SA005同时携带肠毒素seb和sek基因,结果发现SA005菌株的sek基因相对表达量确实要高于SA008和 SAB0。此外,Aguilar等[10]还采用酶联免疫方法对培养液上清以及生物流体中的SEK蛋白进行特异性检测,发现所有含有sek基因的受试菌株均检测出不同程度的SEK分泌量,且分泌量最高的MRSA菌株同时也表达SEB蛋白。在本研究中,3 株菌株的sek基因在12~120 h也是全程转录表达,只是相对表达量存在明显差异。
本研究存在的缺点是只针对3 株细菌生长后期(12~120 h)进行取样监测,而前12 h细菌sek基因的表达情况没有反映出来。当初的设计是基于文献报道多数肠毒素合成是在细菌生长的对数后期或稳定期[2,13,22-24],为了模拟食物污染较低菌量的情形,取样时间相对延长至120 h。本课题组未来的研究工作将进一步丰富实验数据,并且重点关联各不同肠毒素基因之间对表达的相互影响。
综上,肠毒素sek基因在临床分离的金黄色葡萄球菌菌株中较为流行,菌株基因背景的影响可能是造成sek基因表达差异性的关键。鉴于sek基因可能与耐甲氧西林金黄色葡萄球菌以及其他肠毒素基因关系密切,也许携带肠毒素sek基因的金黄色葡萄球菌引起的疾病可能比其他金黄色葡萄球菌更加难以治疗。这就需要更加深入了解肠毒素sek基因以及其他新型肠毒素基因的表达规律,为将来进一步寻求降低或抑制肠毒素表达的抑制剂奠定基础,从而降低金黄色葡萄球菌肠毒素食物中毒。
参考文献:
[1] BALABAN N, RASOOLY A.Staphylococcal enterotoxins[J].International Journal of Food Microbiology, 2000, 61(1): 1-10.DOI:10.1016/s0168-1605(00)00377-9.
[2] ARGUDIN M A, MENDOZA M C, RODICIO M R.Food poisoning and Staphylococcus aureus enterotoxins[J].Toxins, 2010, 2(7): 1751-1773.DOI:10.3390/toxins2071751.
[3] WILSON G J, SEO K S, CARTWRIGHT R A, et al.A novel core genome-encoded superantigen contributes to lethality of communityassociated MRSA necrotizing pneumonia[J].PLoS Pathogens, 2011,7(10): e1002271.DOI:10.1371/journal.ppat.1002271.
[4] ORWIN P M, LEUNG D Y, DONAHUE H L, et al.Biochemical and biological properties of staphylococcal enterotoxin K[J].Infection and Immunity, 2001, 69(1): 360-366.DOI:10.1128/IAI.69.1.360-366.2001.
[5] SUMBY P, WALDOR M K.Transcription of the toxin genes present within the Staphylococcal phage phiSa3ms is intimately linked with the phage's life cycle[J].Journal of Bacteriology, 2003, 185(23): 6841-6851.DOI:10.1128/JB.185.23.6841-6851.2003.
[6] NOVICK R.Mobile genetic elements and bacterial toxinoses: the superantigen-encoding pathogenicity islands of Staphylococcus aureus[J].Plasmid, 2003, 49(2): 93-105.DOI:10.1016/S0147-619X(02)00157-9.
[7] OMOE K, HU D L, ONO H K, et al.Emetic potentials of newly identified staphylococcal enterotoxin-like toxins[J].Infection and Immunity, 2013, 81(10): 3627-3631.DOI:10.1128/IAI.00550-13.
[8] 卫沛楠, 吕国平, 徐保红.食源性金黄色葡萄球菌9种肠毒素基因的多重PCR检测[J].现代预防医学, 2013, 40(17): 3269-3272.
[9] 岳丽琴, 王俊怡, 徐小静.金黄色葡萄球菌分离株致病基因研究[J].临床儿科杂志, 2013, 31(4): 347-350.DOI:10.3969/ j.issn.1000-3606.2013.04.013.
[10] AGUILAR J L, VARSHNEY A K, WANG X, et al.Detection and measurement of staphylococcal enterotoxin-like K (Sel-K) secretion by Staphylococcus aureus clinical isolates[J].Journal of Clinical Microbiology, 2014, 52(7): 2536-2543.DOI:10.1128/JCM.00387-14.
[11] WU D J, LI X M, YANG Y H, et al.Superantigen gene profiles and presence of exfoliative toxin genes in community-acquired meticillinresistant Staphylococcus aureus isolated from Chinese children[J].Journal of Medical Microbiology, 2011, 60(1): 35-45.DOI:10.1099/ jmm.0.023465-0.
[12] VARSHNEY A K, MEDIAVILLA J R, ROBIOU N, et al.Diverse enterotoxin gene profiles among clonal complexes of Staphylococcus aureus isolates from the Bronx, New York[J].Applied and Environmental Microbiology, 2009, 75(21): 6839-6849.DOI:10.1128/ AEM.00272-09.
[13] DERZELLE S, DILASSER F, DUQUENNE M, et al.Differential temporal expression of the staphylococcal enterotoxins genes during cell growth[J].Food Microbiology, 2009, 26(8): 896-904.DOI:10.1016/j.fm.2009.06.007.
[14] 杨静, 杨军, 黄继超, 等.食源性金黄色葡萄球菌肠毒素基因的分布与时序性表达[J].中国农业科学, 2012, 45(19): 4057-4066.DOI:10.3864/j.issn.0578-1752.2012.19.018.
[15] 王琼, 唐俊妮, 汤承, 等.一种采用微波炉加热快速提取细菌DNA用于PCR扩增的方法[J].西南民族大学学报(自然科学版), 2015,41(2): 150-155.DOI:10.11920/xnmdzk.2015.02.004.
[16] TANG J N, SHI X M, SHI C L, et al.Characterization of a duplex PCR assay for the detection of enterotoxigenic strains of Staphylococcus aureus[J].Journal of Rapid Methods and Automation in Microbiology,2006, 14(3): 201-217.DOI:10.1111/j.1745-4581.2006.00047.x.
[17] XU J, SHI C L, SONG M H, et al.Phenotypic and genotypic antimicrobial resistance traits of foodborne Staphylococcus aureus isolates from Shanghai[J].Journal of Food Science, 2014, 79(4): M635-M642.DOI:10.1111/1750-3841.12405.
[18] WONGBOOT W, CHOMVARIN C, ENGCHANIL C, et al.Multiplex PCR for detection of superantigenic toxin genes in methicillin-sensitive and methicillin-resistant Staphylococcus aureus isolated from patients and carriers of a hospital in northeast Thailand[J].The Southeast Asian Journal of Tropical Medicine and Public Health, 2013, 44(4): 660-671.[19] JARRAUD S, MOUGEL C, THIOULOUSE J, et al.Relationships between Staphylococcus aureus genetic background, virulence factors,agr groups (alleles), and human disease[J].Infection and Immunity,2002, 70(2): 631-641.DOI:10.1128/IAI.70.2.631-641.2002.
[20] SRINIVASAN V, SAWANT A A, GILLESPIE B E, et al.Prevalence of enterotoxin and toxic shock syndrome toxin genes in Staphylococcus aureus isolated from milk of cows with mastitis[J].Foodborne Pathogens and Disease, 2006, 3(3): 274-283.DOI:10.1089/ fpd.2006.3.274.
[21] PFAFFL M W.A new mathematical model for relative quantification in real-time RT-PCR[J].Nucleic Acids Research, 2001, 29(9): e45.DOI:10.1093/nar/29.9.e45.
[22] CZOP J K, BERGDOLL M S.Staphylococcal enterotoxin synthesis during the exponential, transitional, and stationary growth phases[J].Infection and Immunity, 1974, 9(2): 229-235.
[23] TSENG C W, ZHANG S, STEWART G C.Accessory gene regulator control of staphyloccoccal enterotoxin d gene expression[J].Journal of Bacteriology, 2004, 186(6): 1793-1801.DOI:10.1128/JB.186.6.1793-1801.2004.
[24] OTERO A, GARCÍA M C, GARCÍA M L, et al.Production of staphylococcal enterotoxins C1 and C2 and thermonuclease in ewe's milk[J].Food Microbiology, 1987, 4(4): 339-345.DOI:10.1016/ S0740-0020(87)80008-4.
教育部“新世纪优秀人才支持计划”项目(NCET-11-0847)
DOI:10.7506/spkx1002-6630-201613025
中图分类号:TS207.4
文献标志码:A
文章编号:1002-6630(2016)13-0140-07
收稿日期:2015-07-21
基金项目:国家自然科学基金面上项目(31371781);四川省应用基础研究计划项目(14JC0702);
作者简介:王琼(1990—),女,硕士研究生,研究方向为畜产品加工与安全。E-mail:wangqiong528@163.com
*通信作者:唐俊妮(1971—),女,教授,博士,研究方向为食品安全与食品微生物。E-mail:junneytang@aliyun.com
Temporal Expression of Staphylococcal Enterotoxin K (sek) Gene in Three Isolates from Food Samples
WANG Qiong, TANG Junni*, TANG Cheng, CHEN Juan, LIU Ji, CAI Zijian
(College of Life Science and Technology, Southwest University for Nationalities, Chengdu 610041, China)
Abstract:Objective: The newly identified staphylococcal enterotoxin sek gene is found to be very popular in clinical methicillin-resistant S.aureus isolates.The study of sek gene temporal expression would provide some valuable information and new data for food poisoning prevention and disease control linked to this bacterium.Methods: Three strains (SA005,SA008 and SAB0) with sek gene from foodborne isolates in our lab were selected by PCR detection of 21 different SEs genes.The growth curves of three strains were monitored during the growth phase in TSB.Total RNAs from three strains were extracted at different growth periods, and a quantitative real time-PCR was developed to monitor the relative expression of sek gene.Results: The results of virulence gene detection showed that SA005 harbored 16S, nuc, mecA, seb, sec, sek and sex genes, SA008 harbored 16S, nuc, mecA, sea, sek and sex genes, and SAB0 harbored 16S, nuc, sek and sex genes.The characteristics of growth curves for three strains had similarity, which exhibited a turning point around 18 h, and then entered the stationary growth phase.mRNA expression levels were shown during all the growth phases (12-120 h); however, there were very obvious differences among three strains and among different sampling points.The relative expression of sek gene was very high at 48 h and very low at 84 h for SA005.For SA008, it was very high at 24 h, very low at 48 h, and was stable between 60-120 h.The relative expression of sek gene in SAB0 presented a parabolic trend, with a high level at 60 h and 72 h (P > 0.05).Conclusion: The relative expression of sek gene among three strains had a significant difference.Even in the same strain, the relative expression of sek gene was different at different time points.Strain-to-strain variations with different background genes may be the key points for different expression patterns of sek gene.
Key words:Staphylococcus aureus; newly identified enterotoxins; sek gene; real time-polymerase chain reaction (real time-PCR); temporal expression
