白鲢鱼背侧肌焦磷酸酶的纯化及酶学特性
2016-08-10张雅玮马志方王复龙彭增起南京农业大学食品科技学院食品安全与营养协同创新中心江苏南京210095
刘 玮,徐 萌,张雅玮,周 黎,马志方,王复龙,彭增起*(南京农业大学食品科技学院,食品安全与营养协同创新中心,江苏 南京 210095)
白鲢鱼背侧肌焦磷酸酶的纯化及酶学特性
刘 玮,徐 萌,张雅玮,周 黎,马志方,王复龙,彭增起*
(南京农业大学食品科技学院,食品安全与营养协同创新中心,江苏 南京 210095)
摘 要:通过粗分离、50%~80%饱和度硫酸铵分级沉降、DE-52阴离子交换柱层析等步骤,从白鲢鱼背侧肌中分离纯化出焦磷酸酶。通过变性凝胶电泳分析,该酶在十二烷基硫酸钠-聚丙烯酰胺凝胶电泳图谱中仅有一个分子质量为40 kD的条带。酶学特性研究表明,白鲢鱼背侧肌焦磷酸酶可专一性地水解焦磷酸盐,反应初速率时间范围为0~15 min,最适反应温度为45 ℃,最适反应pH值为7.5。Mg2+对该酶有明显的激活作用,在Mg2+浓度为5 mmol/L时酶活力最高。5 mmol/L的Ca2+、Zn2+、乙二胺四乙酸(ethylenediaminetetraacetic acid,EDTA)-Na2、EDTA-Na4、KIO3和1 mmol/L的NaF均对该酶有强烈的抑制作用。该酶水解焦磷酸四钠的最大反应速率为0.051 U/mg,米氏常数为0.54 mmol/L。
关键词:焦磷酸酶;纯化;酶学特性;背侧肌;白鲢鱼
引文格式:
刘玮, 徐萌, 张雅玮, 等.白鲢鱼背侧肌焦磷酸酶的纯化及酶学特性[J].食品科学, 2016, 37(13): 130-135.DOI:10.7506/ spkx1002-6630-201613023. http://www.spkx.net.cn
LIU Wei, XU Meng, ZHANG Yawei, et al.Purification and characterization of pyrophosphatase from dorsal muscle in silver carp (Hypophthalmichthys molitrix)[J].Food Science, 2016, 37(13): 130-135.(in Chinese with English abstract)DOI:10.7506/spkx1002-6630-201613023. http://www.spkx.net.cn
焦磷酸盐是鱼糜制品加工中常用的一种添加剂,通常与其他多聚磷酸盐复配使用,具有提高产品保水性的功能[1-4]。其作用机理类似于三磷酸腺苷(adenosine triphosphate,ATP)的作用,能够将肌动球蛋白解离成肌动蛋白和肌球蛋白,从而提高肌肉蛋白质的保水性[5-7]。然而,添加到肌肉中的焦磷酸盐会被内源水解酶降解,弱化了焦磷酸盐的功能与作用[8-11]。研究发现,这种内源水解酶是焦磷酸酶(pyrophosphatase,PPase)[12-13]。
Nakamura等[14]首次从兔骨骼肌中提取焦磷酸酶粗酶液,并发现有酸性焦磷酸酶和中性焦磷酸酶之分,最适pH值分别为5.2和7.4,但没有将酶进行分离纯化。随后,Morita等[15]纯化了兔肉中的中性焦磷酸酶,并进行酶学特性研究。目前,国内已有报道分别从鸡肉、鳙鱼、牛肉和猪肉中分离纯化了焦磷酸酶,并研究其生化特性[16-19]。虽然肌肉焦磷酸酶的生化特性有一定的相似性,但是不同的物种之间仍存在较大差异,这将直接导致焦磷酸盐在不同物种的肌肉中水解情况不同[20]。
白鲢鱼是我国的一种大宗经济型淡水鱼类[21-22],由于白鲢鱼肉土腥味较重[23],作为鲜鱼销售的商业价值不高,但白鲢鱼肉颜色白嫩,因此常被用作加工鱼糜制品的原料[24-25]。目前,对于白鲢鱼中的焦磷酸盐水解酶的分离纯化及特性的研究未见报道。本研究以白鲢鱼背侧肌肉为原料对焦磷酸酶进行分离纯化,并研究其酶学特性,对有效调控多聚磷酸盐的水解,优化多聚磷酸盐在鱼糜制品加工中的功能效用有着理论意义和实际应用价值。
1 材料与方法
1.1 材料与试剂
约1.5 kg新鲜白鲢鱼7 条 南京卫岗农贸市场。白鲢鱼宰后立即去内脏,取出背侧肌,并剔除明显的鱼刺,冰浴中冷却0.5 h待用。
焦磷酸四钠(tetrasodium pyrophosphate,TSPP)、三聚磷酸钠(sodium tripolyphosphate,STPP)、六偏磷酸钠(sodium hexametaphosphate,HMP) 美国Sigma公司;阴离子交换层析填料DE-52纤维素英国Whatman公司;Bradford蛋白浓度测定试剂盒 江苏碧云天生物技术研究所;宽范围的蛋白质Marker (10~250 kD) 美国Bio-Rad公司;三羟甲基氨基甲烷(tris(hydroxymethyl)aminomethane,Tris)、甘氨酸、十二烷基硫酸钠(sodium dodecyl sulfate,SDS)、二硫苏糖醇(dithiothreito,DTT)、考马斯亮蓝R250 北京索莱宝科技有限公司;其他试剂均为国产分析纯。
1.2 仪器与设备
Waring Blender 8010ES高速度组织匀浆机 美国Waring公司;Allegra 64R高速冷冻离心机 美国Beckman Coulter公司;AKTA Prime Plus蛋白低压层析系统 美国GE Healthcare公司;SpectraMax M2多功能酶标仪 美国Molecular Devices公司;蛋白电泳仪及凝胶成像系统 美国Bio-Rad公司。
1.3 方法
1.3.1 焦磷酸酶(pyrophosphatase,PPase)的分离纯化
焦磷酸酶的分离纯化参考Gao Ruichang等[17]的方法并稍作修改。取400 g预冷的白鲢鱼背侧肌切成约0.3 cm×0.3 cm×0.3 cm的块状物,加入4 倍体积25 mmol/L pH 7.0的Tris-HCl缓冲提取液(含5 mmol/L MgCl2)匀浆1 min,10 000×g离心30 min得上清即为粗酶液。向粗酶液中缓慢搅拌加入研磨后的硫酸铵至50%饱和度,静置4 h后,10 000×g离心30 min,留取上清并弃去沉淀。向上清液中继续搅拌加入硫酸铵至80%饱和度,静置4 h后,10 000×g离心30 min并取沉淀。用Tris-HCl缓冲提取液溶解后,用提取液充分透析(透析袋的截留分子质量为8 000~14 000 kD)24 h,更换5 次透析液。随后,用DE-52阴离子交换柱(20 cm×1.6 cm)对酶进行纯化,填料DE-52用提取缓冲液浸泡后装柱,用pH 7.0 A液(25 mmol/L Tris-HCl,5 mmol/L MgCl2,1 mmol/L DTT)平衡,上样5 mL,在穿刺峰出现后,以0~1 mol/L NaCl梯度浓度的B液(1 mol/L NaCl,25 mmol/L Tris-HCl,5 mmol/L MgCl2,1 mmol/L DTT)进行洗脱,洗脱体积200 mL,收集主要的洗脱峰。测定蛋白质含量和酶活性后,收集纯化的酶液,用超滤浓缩管(amicon YM-10超滤膜,截留分子质量为10 kD)5 000×g离心浓缩,于-80 ℃保存待用。以上操作在4 ℃条件下进行。
实验采用十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate-polyacrylamide gel electrophoresis,SDS-PAGE)。12.5%分离胶,4%浓缩胶,样品进入分离胶前电压为80 V,进入分离胶后电压为100 V,用考马斯亮蓝R250染色。
1.3.2 蛋白质浓度测定
DE-52阴离子交换柱层析后的蛋白浓度用Bradford方法[26]测定,其余步骤的蛋白质浓度均用双缩脲方法[27]测定。
1.3.3 焦磷酸酶活力测定
焦磷酸酶活力测定按照Yamazaki等[28]的方法并稍作修改。向50 μL焦磷酸酶中加入50 μL底物TSPP(含10 mmol/L MgCl2),于45 ℃反应15 min后,立即加入35 μL pH 7.0终止液(1.33 g/L SDS、0.12 mol/L EDTA),再加入265 μL显色剂(0.05 g/L硫酸亚铁、0.05 g/L钼酸铵、0.5 mol/L硫酸)显色,25 ℃水浴15 min,用酶标仪在640 nm波长处比色。对照组在添加底物TSPP前先加入终止液使酶变性,结束反应后与其他处理组同时加入底物TSPP和显色剂。
一个酶活力单位定义为在pH 7.5、45 ℃条件下,每分钟得到1 μmol产物Pi所需酶量。
1.3.4 焦磷酸酶的酶学特性
1.3.4.1 焦磷酸酶的酶促反应进程曲线
在pH 7.5、45 ℃条件下,测定每隔5 min反应时间时生成的产物Pi的量,以焦磷酸酶酶促反应时间为横坐标,产物生成量为纵坐标制作反应进程曲线。
1.3.4.2 焦磷酸酶的底物专一性
分别以TSPP、STPP和HMP为底物,在pH 7.5、45 ℃条件下,按照上述方法测定焦磷酸酶活力并绘制酶促反应进程曲线。
1.3.4.3 底物浓度对焦磷酸酶活力的测定
在pH 7.5、45 ℃条件下,测定焦磷酸酶与不同浓度的TSPP(0.5、1、2、3、4、5 mmol/L)反应时的酶活力,将测得的最大值定为100%。
1.3.4.4 最适反应温度及温度的稳定性
在pH 7.5条件下,分别测定焦磷酸酶在不同反应温度下(25、35、40、45、55、65 ℃)的酶活力,将测得的最大值定为100%。此外,将焦磷酸酶在不同温度下(25、35、40、45、55、65 ℃)水浴1 h,冷却至4 ℃后,测定酶活力,将4 ℃放置的焦磷酸酶的活力定为100%。
1.3.4.5 最适反应pH值及pH值的稳定性
在45 ℃条件下,分别测定焦磷酸酶在不同pH值的缓冲体系中(柠檬酸-柠檬酸钠pH 4.0、5.0、6.0、6.5;Tris-HCl pH 7.0、7.5、8.0;甘氨酸-氢氧化钠 pH 9.0)的酶活力,将测得的最大值定为100%。此外,4 ℃条件下将焦磷酸酶在不同pH值(4.0、5.0、6.0、6.5、7.0、7.5、8.0、9.0)条件下放置1 h,回调pH值至7.0后,测定酶活力,将测得的最大值定为100%。
1.3.4.6 Mg2+、Ca2+、Zn2+对焦磷酸酶活力的影响
在pH 7.5、45 ℃条件下,测定添加不同浓度的Mg2+、Ca2+和Zn2+(0、1、5、10、15、20 mmol/L,其中Ca2+和Zn2+中含有最适浓度的Mg2+)对焦磷酸酶活力的影响,将测得的最大值定为100%。
1.3.4.7 抑制剂对焦磷酸酶活力的影响
在pH 7.5、45 ℃条件下,测定添加不同浓度的EDTA-Na2、EDTA-Na4、KIO3、NaF对焦磷酸酶活力的影响,将未经抑制剂处理的酶活力定为100%。
1.3.4.8 焦磷酸酶反应动力学常数测定
测定当反应体系中TSPP终浓度分别为0.2、0.4、0.6、0.8、1.0、2.0 mmol/L时焦磷酸酶的反应初速率。按照Lineweaver-Burk Plot双倒数法作图,得出最大反应速率vmax和米氏常数Km。
1.4 数据分析
实验重复3 次,每个重复测定3 次。采用Origin 8.0软件分析作图。
2 结果与分析
2.1 白鲢鱼背侧肌焦磷酸酶的分离纯化
从白鲢鱼背侧肌中提取的焦磷酸酶粗酶液,经初步分离、50%~80%硫酸铵分级沉降、DE-52阴离子交换柱层析等步骤得到纯化,纯化结果见表1。其中,层析洗脱曲线见图1,在用NaCl溶液梯度洗脱之前,出现了一个蛋白穿刺峰(峰Ⅰ),这是一些没有与柱子结合的蛋白组分。开始梯度洗脱后,在NaCl浓度约为0.18~0.40 mol/L的范围和0.40~0.60 mol/L的范围中出现了两个洗脱峰(峰Ⅱ、Ⅲ),对相应的收集管内的蛋白组分进行酶活力测定后,发现第22、23、24、25、26管的酶活力较高,其余管的酶活力较低,峰Ⅲ中的蛋白组分几乎没有焦磷酸酶活力。因此,焦磷酸酶的活力成分主要为0.24~0.37 mol/L的NaCl洗脱出来的蛋白质组分。
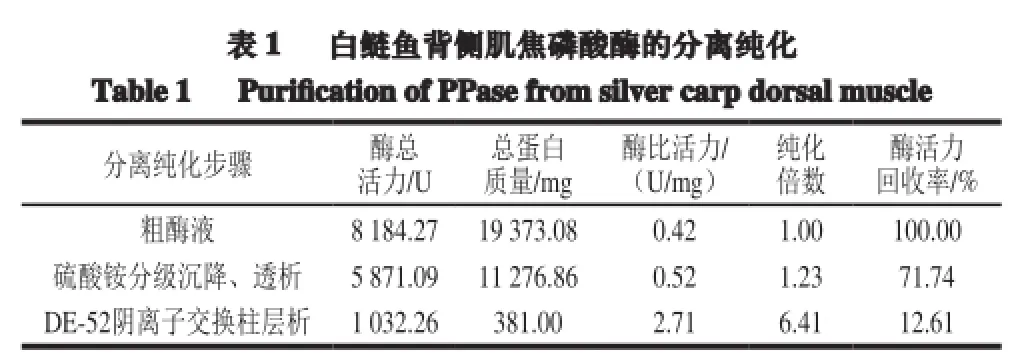
表 1 白鲢鱼背侧肌焦磷酸酶的分离纯化Table 1 Purification of PPasefrom silver carpdorsalmuscle分离纯化步骤 酶总活力/U总蛋白质量/mg酶比活力/ (U/mg)纯化倍数酶活力回收率/%粗酶液 8 184.27 19 373.08 0.42 1.00 100.00硫酸铵分级沉降、透析 5 871.09 11 276.86 0.52 1.23 71.74 DE-52阴离子交换柱层析 1 032.26 381.00 2.71 6.41 12.61

将粗分离、硫酸铵分级沉降和层析等主要纯化步骤分别得到的焦磷酸酶样品用SDS-PAGE测定,从图2 SDS-PAGE图谱中可见,经层析纯化后的焦磷酸酶只在40 kD有一个条带。该结果表明,分离纯化后的焦磷酸酶不含杂质蛋白。
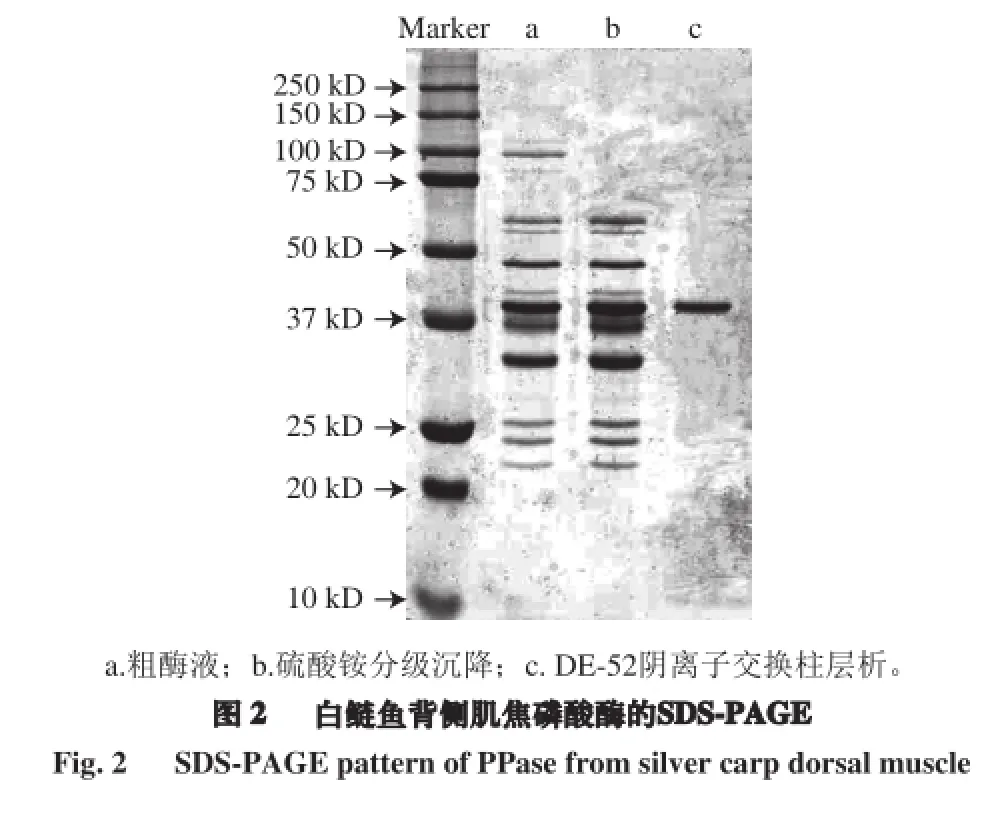
2.2 焦磷酸酶的酶学特性
2.2.1 焦磷酸酶的酶促反应进程曲线
在酶活力测定中,合理地选择酶促反应时间是研究酶动力学性质的必要前提[16]。由图3可知,在15 min时间范围内,焦磷酸酶酶促反应产生的产物Pi含量与反应时间几乎成正比。当时间延长至20 min,酶促反应进程曲线虽呈上升趋势,但曲线的斜率不断降低,说明反应的速率逐渐变慢。当反应时间继续延长,不再有更多的Pi生成,反应趋于平稳。因此,本实验选择在0~15 min的初速率时间范围内测定白鲢鱼焦磷酸酶活力,这短于鸡肉和牛肉的焦磷酸酶的初速率时间范围(0~25 min)[16,18]。

2.2.2 焦磷酸酶的底物专一性

由图4可知,以STPP和HMP为反应底物时,在30 min的反应时间内,二者被水解生成的产物Pi的含量很少。而白鲢鱼背侧肌焦磷酸酶对底物TSPP有着较强的水解能力,使得反应产物Pi大量生成。因此,白鲢鱼背侧肌焦磷酸酶对TSPP的底物专一性较强,这与前人的研究结果一致,鸡胸大肌、牛半腱肌、猪背最长肌中的焦磷酸酶都能专一性地水解底物焦磷酸盐[16,18,29]。
2.2.3 底物浓度对焦磷酸酶活性的影响
由图5可知,在底物TSPP浓度较低的条件下(0.5~2 mmol/L),随着底物浓度的增加,白鲢鱼背侧肌焦磷酸酶的活力不断增加,在TSPP浓度为2~3 mmol/L时,焦磷酸酶的活力最高,而鳙鱼背侧肌焦磷酸酶的活力在底物浓度为5 mmol/L达到最大[17]。当TSPP浓度超过3 mmol/L时,白鲢鱼背侧肌焦磷酸酶的活力开始降低,当TSPP浓度为5 mmol/L时,焦磷酸酶活力仅为最高酶活力的67%左右,可见高浓度的底物可以抑制酶活力,这一趋势与靳红果等[29]的关于猪肉焦磷酸酶的研究一致。其原因可能是大量的TSPP与Mg2+结合[17],导致Mg2+激活焦磷酸酶的能力下降。
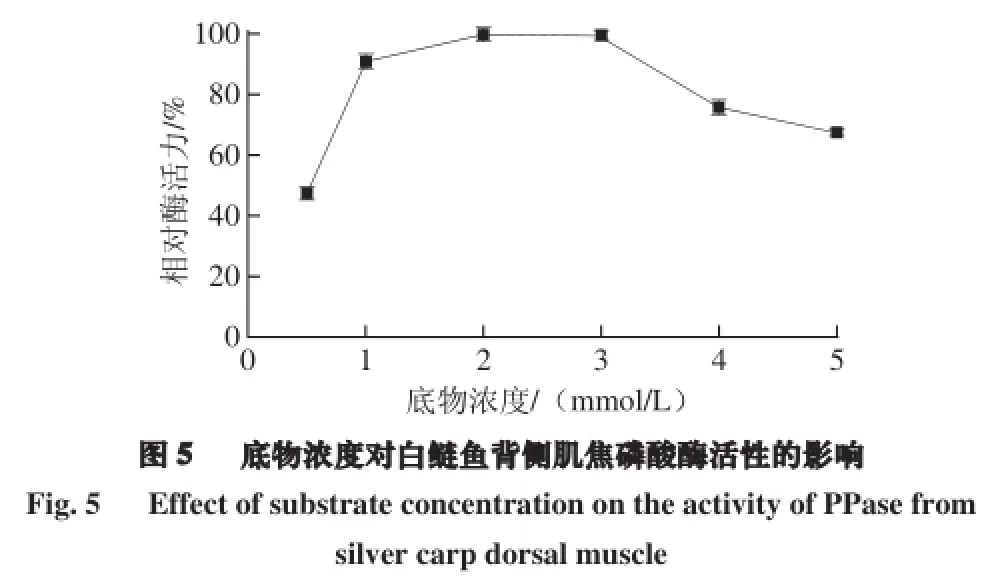
2.2.4 最适反应温度及热稳定性

由图6可知,白鲢鱼背侧肌焦磷酸酶的最适温度为45 ℃左右,低于猪肉、鳙鱼背侧肌焦磷酸酶(50 ℃)和牛肉焦磷酸酶(47 ℃),高于鸡肉焦磷酸酶(40 ℃)[16-19]。25 ℃条件下,焦磷酸酶的相对酶活力为55.4%。在25~45 ℃的温度范围内,焦磷酸酶的活力随着温度的升高而不断变大,单位时间内反应物与酶的有效碰撞次数增加[30]。当温度高于45 ℃时,焦磷酸酶活力又逐渐下降。在65 ℃时,焦磷酸酶活力仅剩余42.9%。该酶的热稳定性随处理温度的升高呈剧烈下降的趋势,45 ℃时其活力降至58.7%,当温度达到55 ℃以上,焦磷酸酶几乎完全失活,这说明高温会使酶发生热变性,对酶活力有强烈的抑制作用。
2.2.5 最适反应pH值及pH值稳定性
由图7可知,白鲢鱼背侧肌焦磷酸酶最适反应pH值为7.5,稍低于鳙鱼的焦磷酸酶(pH 8.0)[17]。该酶在pH 4.0~6.0的范围内几乎没有水解活性,在pH 6.5~9.0范围内酶活力呈先上升后下降的趋势。焦磷酸酶对pH值的依赖性比较强。在中性范围内(pH 7.0左右)保持较高的稳定性,在pH 4.0~6.5的范围内几乎完全失活。在强酸或强碱的条件下,由于电荷的排斥作用和离子键的减少会导致酶的结构发生变化,进而使酶失去活力[30]。由此可见该酶为中性焦磷酸酶,在肌肉中起主要水解焦磷酸盐作用的酶也是中性焦磷酸酶[14]。
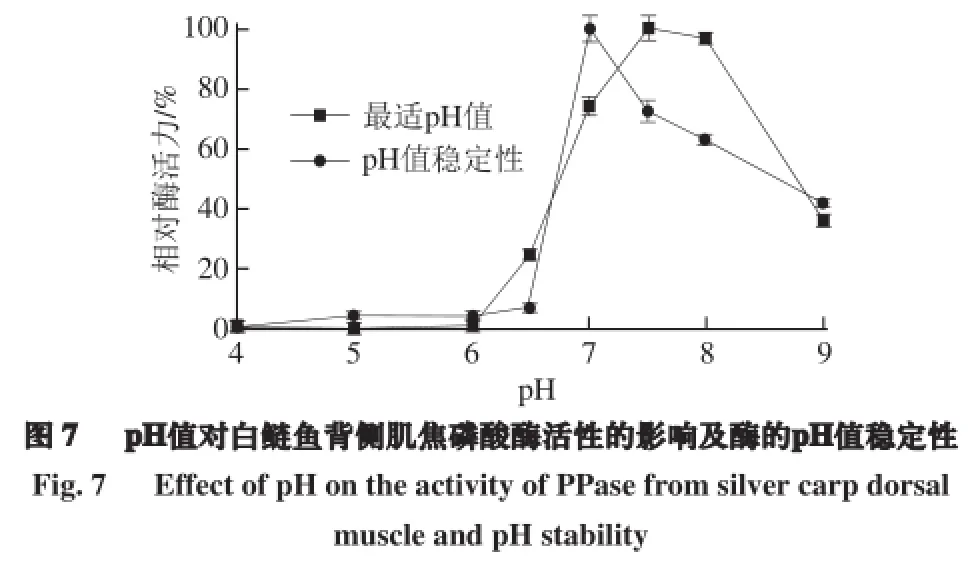
2.2.6 Mg2+、Ca2+、Zn2+对焦磷酸酶活性的影响
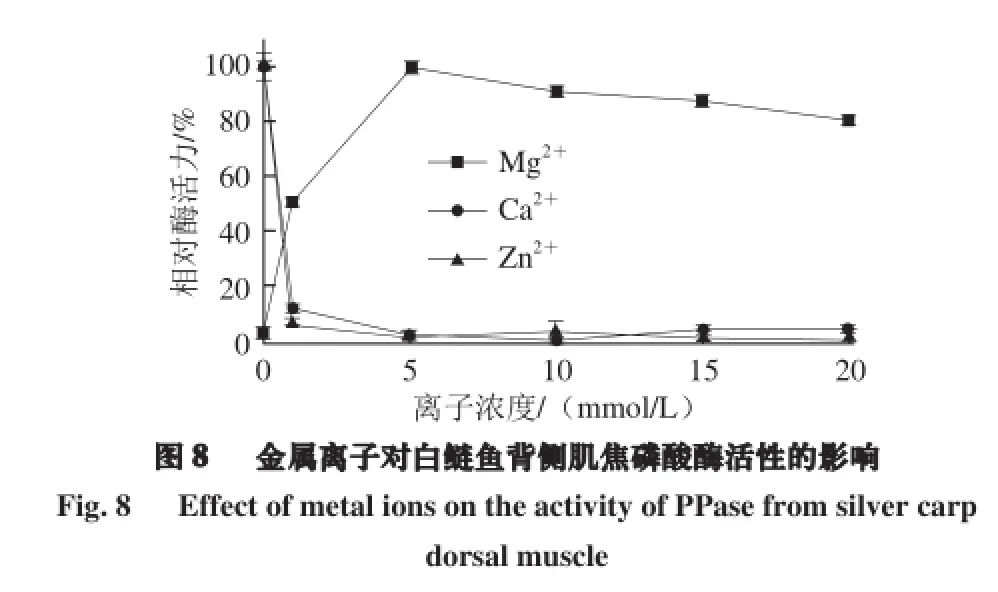
由图8可知,适当浓度的Mg2+对焦磷酸酶有较强的激活作用,这与前人研究一致[16-19]。Leone等[31]报道,这一激活作用可能是由于Mg2+引发焦磷酸酶的构象发生改变,提高了酶的活力。当未添加Mg2+时,焦磷酸酶相对活力很低(2.0%左右)。而随着Mg2+浓度不断增加,焦磷酸酶的活力迅速提高,当Mg2+浓度达到5 mmol/L时酶活力最高。在Mg2+浓度高于5 mmol/L后,酶活力有所下降,但基本保持在80%以上,因此5 mmol/L为最适Mg2+浓度。而Ca2+和Zn2+则对焦磷酸酶有着强烈的抑制作用。当分别添加1 mmol/L的Ca2+和Zn2+后,焦磷酸酶的酶活力迅速下降,其相对酶活力分别为11.4%和5.4%。而当Ca2+和Zn2+浓度继续增加,该酶几乎完全失活。
2.2.7 抑制剂对焦磷酸酶活性的影响
抑制剂对白鲢鱼背侧肌焦磷酸酶活性的影响如表2所示,EDTA-Na2和EDTA-Na4对焦磷酸酶有强烈的抑制作用,分别向反应体系添加1 mmol/L的EDTA-Na2和EDTA-Na4后,焦磷酸酶的残留活力仅为14.5%和7.9%,而当5 mmol/L的EDTA-Na2和EDTA-Na4存在时,该酶几乎完全失去活性。Li Rongrong等[9]将100 g/kg的EDTA-Na2与鸡胸肉斩拌匀浆发现,TSPP的含量在48 h内没有发生变化,说明适当浓度的EDTA-Na2可以有效地抑制TSPP被焦磷酸酶水解。此外,KIO3和NaF也对焦磷酸酶的活力有抑制作用。5 mmol/L的KIO3存在时,焦磷酸酶相对酶活力仅为9.2%,低浓度(1 mmol/L)的NaF几乎完全抑制该酶的活力,这与靳红果等[29]的研究结果一致。
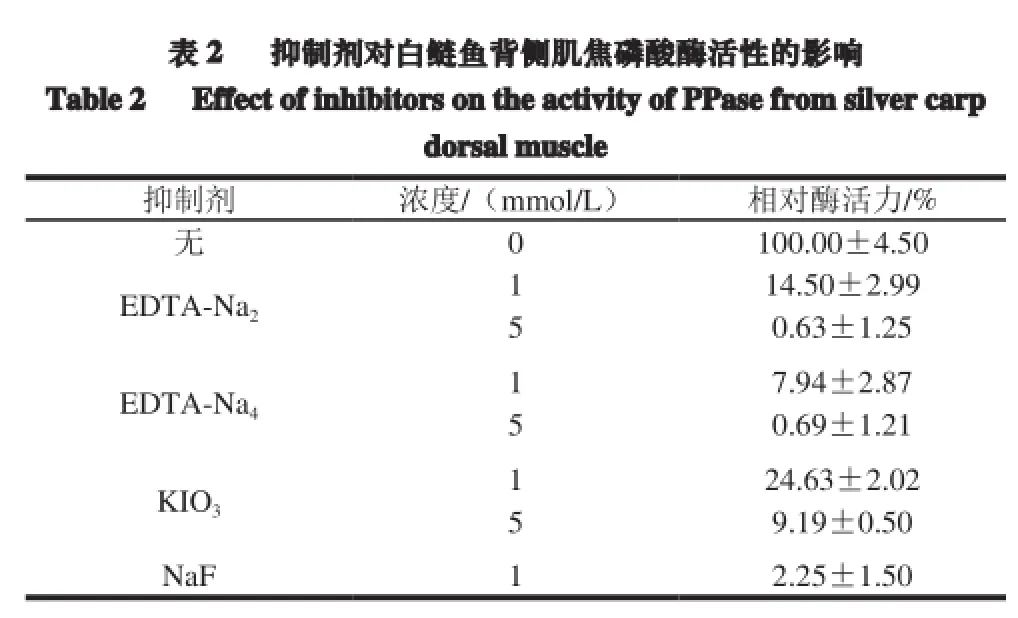
表 2 抑制剂对白鲢鱼背侧肌焦磷酸酶活性的影响Table 2 Effect ofinhibitorson the activityof PPase from silvercarpdorsalmuscle抑制剂 浓度/(mmol/L) 相对酶活力/% 无0 100.00±4.50 EDTA-Na21 14.50±2.99 5 0.63±1.25 EDTA-Na41 7.94±2.87 5 0.69±1.21 KIO31 24.63±2.02 5 9.19±0.50 NaF 1 2.25±1.50
2.2.8 焦磷酸酶的动力学常数

由图9可知,白鲢鱼背侧肌焦磷酸酶的最大反应速率vmax为0.051 U/mg,米氏常数Km值为0.54 mmol/L。猪肉焦磷酸酶的Km值为0.36 mmol/L,鳙鱼背侧肌焦磷酸酶的Km值为1.98 mmol/L,这表明白鲢鱼背侧肌焦磷酸酶有较强的底物亲和力。
3 结 论
纯化的白鲢鱼背侧肌焦磷酸酶的SDS-PAGE图谱中只有一个40 kD的条带。白鲢鱼背侧肌焦磷酸酶专一性水解焦磷酸盐,vmax为0.051 U/mg,Km为0.54 mmol/L,不能水解三聚磷酸盐和六偏磷酸盐;其反应初速率时间范围为0~15 min。该酶的最适反应温度为45 ℃,最适反应pH值为7.5,且在25~40 ℃之间及中性范围(pH 7.0左右)保持较高的稳定性。Mg2+能明显激活白鲢鱼背侧肌焦磷酸酶的活力,在5 mmol/L时酶活力达到最大值;而5 mmol/L的Ca2+、Zn2+、EDTA-Na2、EDTA-Na4、KIO3和1 mmol/L的NaF均会强烈的抑制该酶的活力。因此,当多聚磷酸盐应用于鱼糜及鱼糜制品加工时,维持低温、非中性条件,或添加一定量的Ca2+、Zn2+、EDTA-Na2等物质,可以有效地抑制焦磷酸酶活性、减缓焦磷酸盐的水解,使多聚磷酸盐发挥持久高效的作用。
参考文献:
[1] LEE C M, TOLEDO R T.Factors affecting textural characteristics of cooked comminuted fish muscle[J].Journal of Food Science, 1976,41(2): 391-397.DOI:10.1111/j.1365-2621.1976.tb00627.x.
[2] JOHNSEN S O, JØRGENSEN K B, BIRKELAND S, et al.Effects of phosphates and salt in ground raw and cooked farmed cod (Gadus morhua) muscle studied by the water holding capacity (WHC), and supported by31P-NMR measurements[J].Journal of Food Science,2009, 74(3): C211-C220.DOI:10.1111/j.1750-3841.2009.01086.x.
[3] WEISS J, GIBIS M, SCHUH V, et al.Advances in ingredient and processing systems for meat and meat products[J].Meat Science,2010, 86(1): 196-213.DOI:10.1016/j.meatsci.2010.05.008.
[4] KULAKOVSKAYA T V, VAGABOV V M, KULAEV I S.Inorganic polyphosphate in industry, agriculture and medicine: modern state and outlook[J].Process Biochemistry, 2012, 47(1): 1-10.DOI:10.1016/ j.procbio.2011.10.028.
[5] NAUSS K M, KITAGAWA S, GERGELY J.Pyrophosphate binding to and adenosine triphosphatase activity of myosin and its proteolytic fragments implications for the substructure of myosin[J].Journal of Biological Chemistry, 1969, 244(3): 755-765.
[6] XIONG Y L, LOU X, WANG C, et al.Protein extraction from chicken myofibrils irrigated with various polyphosphate and NaCl solutions[J].Journal of Food Science, 2000, 65(1): 96-100.DOI:10.1111/j.1365-2621.2000.tb15962.x.
[7] XIONG Y L.Role of myofibrillar proteins in water-binding in brineenhanced meats[J].Food Research International, 2005, 38(3): 281-287.DOI:10.1016/j.foodres.2004.03.013.
[8] BELTON P S, PACKER K J, SOUTHON T E.31P NMR studies of the hydrolysis of added phosphates in chicken meat[J].Journal of the Science of Food and Agriculture, 1987, 40(3): 283-291.DOI:10.1002/ jsfa.2740400311.
[9] LI R R, KERR W L, TOLEDO R T, et al.31P NMR analysis of chicken breast meat vacuum tumbled with NaCl and various phosphates[J].Journal of the Science of Food and Agriculture, 2001, 81(6): 576-582.DOI:10.1002/jsfa.846.
[10] 彭增起, 周光宏, 徐幸莲, 等.四种多聚磷酸钠在鸡胸肉中水解的31P核磁共振研究[J].食品科学, 2005, 26(8): 61-65.DOI:10.3321/ j.issn:1002-6630.2005.08.008.
[11] PARK J W.Surimi and surimi seafood[M].3rd ed.Boca Raton: CRC Press, 2013: 485-487.
[12] YASUI T, FUKAZAWA T, TAKAHASHI K, et al.Phosphate effects on meat, specific interaction of inorganic polyphosphates with myosin B[J].Journal of Agricultural and Food Chemistry, 1964, 12(5): 399-404.DOI:10.1021/jf60135a003.
[13] SUTTON A H.The hydrolysis of sodium triphosphate in cod and beef muscle[J].International Journal of Food Science and Technology,1973, 8(2): 185-195.DOI:10.1111/j.1365-2621.1973.tb01705.x.
[14] NAKAMURA S, YAMAGUCHI M.Muscle pyrophosphatases[J].Journal of Agricultural and Food Chemistry, 1969, 17(3): 633-638.DOI:10.1021/jf60163a018.
[15] MORITA J, YASUI T.Purification and some properties of a neutral muscle pyrophosphatase[J].Journal of Biochemistry, 1978, 83(3): 719-726.
[16] 姚蕊, 彭增起, 周光宏, 等.鸡胸大肌中焦磷酸酶的分离纯化及特性研究[J].食品科学, 2007, 28(7): 299-304.DOI:10.3321/ j.issn:1002-6630.2007.07.070.
[17] GAO R C, XUE C H, YUAN L, et al.Purification and characterization of pyrophosphatase from bighead carp (Aristichthys nobilis)[J].LWTFood Science and Technology, 2008, 41(2): 254-261.DOI:10.1016/ j.lwt.2007.02.006.
[18] 孙珍珍, 彭增起, 靳红果, 等.牛肉半腱肌中焦磷酸酶的分离纯化及特性研究[J].食品科学, 2010, 31(5): 160-164.
[19] 靳红果, 万可慧, 田锐花, 等.猪背最长肌焦磷酸酶的分离纯化与酶学特性[J].食品科学, 2012, 33(3): 168-173.
[20] 石金明, 靳红果, 彭增起, 等.肌肉焦磷酸酶和三聚磷酸酶的特性与应用[J].肉类研究, 2011, 25(11): 47-49.DOI:10.3969/ j.issn.1001-8123.2011.11.012.
[21] FAN W J, SUN J X, CHEN Y C, et al.Effects of chitosan coating on quality and shelf life of silver carp during frozen storage[J].Food Chemistry, 2009, 115(1): 66-70.DOI:10.1016/j.foodchem.2008.11.060.
[22] GUO W J, TONG J G, YU X M, et al.A second generation genetic linkage map for silver carp (Hypophthalmichethys molitrix) using microsatellite markers[J].Aquaculture, 2013, 412(6): 97-106.DOI:10.1016/j.aquaculture.2013.06.027.
[23] YUAN C, FUKUDA Y, KANENIWA M, et al.Comparison of gelforming properties of silver carp (Hypophthalmichthys molitrix) surimi prepared in different seasons[J].Journal of Food Science, 2005, 70(5): C326-C331.DOI:10.1111/j.1365-2621.2005.tb09961.x.
[24] BARRERA A M, RAMIREZ J A, GONZÁLEZ-CABRIALES J J,et al.Effect of pectins on the gelling properties of surimi from silver carp[J].Food Hydrocolloids, 2002, 16(5): 441-447.DOI:10.1016/ S0268-005X(01)00121-7.
[25] LUO Y K, SHEN H X, PAN D D, et al.Gel properties of surimi from silver carp (Hypophthalmichthys molitrix) as affected by heat treatment and soy protein isolate[J].Food Hydrocolloids, 2008, 22(8): 1513-1519.DOI:10.1016/j.foodhyd.2007.10.003.
[26] BRADFORD M M.A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of proteindye binding[J].Analytical Biochemistry, 1976, 72(72): 248-254.DOI:10.1006/abio.1976.9999.
[27] GORNALL A G, BARDAWILL C J, DAVID M M.Determination of serum proteins by means of the biuret reaction[J].Journal of Biological Chemistry, 1949, 177(2): 751-766.
[28] YAMAZAKI M, SHEN Q W, SWARTZ D R.Tripolyphosphate hydrolysis by bovine fast and slow myosin subfragment 1 isoforms[J].Meat Science, 2010, 85(3): 446-452.DOI:10.1016/ j.meatsci.2010.02.014.
[29] 靳红果.猪肉多聚磷酸酶调控肌肉蛋白质凝胶特性的研究[D].南京: 南京农业大学, 2011: 31-51.
[30] 高瑞昌.鳙中多聚磷酸盐水解机理及无磷保水剂的研究[D].青岛:中国海洋大学, 2007: 73-85.DOI:10.7666/d.y1112232.
[31] LEONE F A, REZENDE L A, CIANCAGLINI P, et al.Allosteric modulation of pyrophosphatase activity of rat osseous plate alkaline phosphatase by magnesium ions[J].International Journal of Biochemistry and Cell Biology, 1998, 30(1): 89-97.DOI:10.1016/ S1357-2725(97)00077-0.
DOI:10.7506/spkx1002-6630-201613023
中图分类号:TS201.2
文献标志码:A
文章编号:1002-6630(2016)13-0130-06
收稿日期:2015-10-09
基金项目:国家自然科学基金面上项目(31271898)
作者简介:刘玮(1990—),女,硕士研究生,研究方向为肉制品加工与质量控制。E-mail:2013108012@njau.edu.cn
*通信作者:彭增起(1956—),男,教授,博士,研究方向为畜产品加工与质量控制。E-mail:zqpeng@njau.edu.cn
Purification and Characterization of Pyrophosphatase from Dorsal Muscle in Silver Carp (Hypophthalmichthys molitrix)
LIU Wei, XU Meng, ZHANG Yawei, ZHOU Li, MA Zhifang, WANG Fulong, PENG Zengqi*
(Synergetic Innovation Center of Food Safety and Nutrition, College of Food Science and Technology,Nanjing Agricultural University, Nanjing 210095, China)
Abstract:Pyrophosphatase (PPase) was extracted and purified from silver carp (Hypophthalmichthys molitrix) dorsal muscle by crude extraction, 50%-80% saturated ammonium sulfate precipitation and DE-52 anion exchange column chromatography.The purified enzyme migrated as a single band with a molecular mass of 40 kD on SDS-polyacrylamide gel electrophoresis (SDS-PAGE).The enzymatic characterization showed that the purified enzyme could hydrolyze pyrophosphates, and the time range for its initial velocity was 0-15 min.The optimum temperature for the purified PPase was 45 ℃ and the optimum pH was 7.5.Mg2+was necessary for PPase activation and the activity reached up to the maximum value at Mg2+concentration of 5 mmol/L.The activity of PPase was strongly inhibited by 5 mmol/L Ca2+, Zn2+,EDTA-Na2, EDTA-Na4, KIO3or 1 mmol/L NaF.The kinetic constants vmaxand Kmof the purified PPase for tetrasodium pyrophosphate as substrate were 0.051 U/mg and 0.54 mmol/L, respectively.
Key words:pyrophosphatase; purification; enzymatic characterization; dorsal muscle; silver carp
