活性电泳切胶法分离白腐菌(Trametes sp.B1)2种漆酶同工酶及其性质研究
2015-10-20刘友勋等
刘友勋等

摘要:对白腐菌(Trametes sp.)菌株B1的固体发酵粗酶液进行活性电泳后发现含有5种漆酶同工酶。硫酸铵沉淀、离子交换柱层析和Sephadex G100柱层析的收集液中包含有2种带电荷和分子量接近的漆酶同工酶,进一步利用活性电泳切胶法纯化出这2种同工酶,用SDS-PAGE证明为单一漆酶,它们的分子量分别为64 ku(Lac1)和62 ku(Lac2),并对其理化性质进行了研究。Lac1漆酶反应的最适pH值为2.2,最适温度为50 ℃,氧化ABTS 的Km值为1.952 mmol/L;Lac2漆酶反应的最适pH值为2.2,最适温度为40 ℃,氧化ABTS的Km值为0.255 mmol/L。
关键词:白腐菌;漆酶同工酶;纯化;活性电泳;酶学性质
中图分类号: Q78文献标志码: A文章编号:1002-1302(2015)09-0054-04
收稿日期:2014-11-03
基金项目:国家自然科学基金(编号:U1304302);河南省教育厅科学技术研究重点项目(编号:12B180030)。
作者简介:刘友勋(1976—),男,湖北鄂州人,博士,副教授,主要从事酶工程及生物转化研究。E-mail:liuyouxun@126.com。漆酶(laccase,E.C.1.10.3.2)是一种多酚氧化还原酶,属于铜离子氧化酶家族,该家族还包含抗坏血酸氧化酶、血浆铜蓝蛋白等,这类酶都含有多个铜离子且在结构和功能上存在许多相似之处[1-3]。漆酶以分子氧作为电子受体,能催化多种底物发生氧化反应,氧分子在反应中被还原成水。漆酶蛋白通常以单体形式存在,很少以聚合体形式存在,其分子量一般在52~110 ku之间,目前还没有发现分子量低于50 ku的,但已发现分子量大于110 ku的漆酶蛋白[2-4]。在漆酶分子中,由于光谱和磁性特征的不同,可将4个铜离子分成3类:Ⅰ型Cu2+(1个)、Ⅱ型Cu2+(1个)、Ⅲ型Cu4+2(2个)。利用顺磁共振检测,发现前2种铜离子是单电子受体,呈顺磁性,而Ⅲ型铜离子是反磁性的双电子受体[4]。漆酶催化底物范围广,已报道有200种以上,包括酚类和非酚类,而且其催化性能也很特殊,对环境友好,因此在多个领域具有潜在的应用价值。近年来,漆酶已经成为环境保护、药物合成、生物传感器等多个领域的研究热点[5-6]。
漆酶最先在漆树这种植物中被发现,后来研究表明在昆虫、细菌和高等真菌中也广泛存在,甚至有一些漆酶被发现存在于动物的器官和血清中[4]。由于真菌漆酶的催化性能独特,在过去几十年,对其漆酶进行了广泛的研究,而其中作为真菌漆酶的代表,担子菌亚门的白腐真菌漆酶研究报道最多[1-6]。来自于不同真菌的漆酶,生化特性具有很大的不同,甚至在同一种真菌中也可以产生多种不同的同工酶,这些漆酶同工酶的生化特性也会有很大的差异。目前,这些同工酶之间的作用和意义还知之甚少。对于漆酶同工酶特性的研究,有利于了解漆酶在真菌生理活动中的作用,同时为进一步应用漆酶打下基础。蛋白质分离纯化主要采取柱层析法,该法适合于较大样品量的蛋白分离,且需要多步设计和条件优化,操作也较复杂。对于一些漆酶同工酶通过柱层析法,并不能很好地将它们分离开,需要结合其他方法进行分离。本试验对1株白腐真菌(Trametes sp.B1)的2种漆酶同工酶通过柱层析后,进一步通过活性电泳切胶纯化法将它们分离,并研究了它们的部分生化特性。
1材料与方法
1.1供试菌株
白腐菌Trametes sp.B1(简称B1菌株)由笔者所在实验室筛选和鉴定。
1.2试剂和仪器
1.2.1试剂2,2′-联氮-双-(3-乙基苯并噻吡咯啉-6-磺酸) (ABTS),Sigma公司,美国;DEAE-Sepharose Fast Flow和Sephadex-G100 填料,GE Healthcare Bioscience,美国;牛血清蛋白,北京鼎国产品;低分子量蛋白质marker为北京康为世纪生物科技产品,其他试剂均为国产分析纯。
1.2.2主要仪器核酸蛋白检测仪为江苏省兴化市分析仪器厂产品,冷冻干燥机为上海比朗仪器有限公司产品。
1.3产酶培养基
21 g稻草粉、3 g麸皮、0.12 g CaCl2、0.36 g MnSO4和60 mL蒸馏水混匀装入500 mL摇瓶中。
1.4漆酶活力测定[7]
3 mL 反应混合液中,含5 mmol/L ABTS 0.2 mL,醋酸缓冲液(pH值4.0)2.7 mL,粗酶液0.1 mL,以1 min 内催化氧化1 μmol/L ABTS 的酶量为1个酶活单位(U),已知420 nm 处ABTS 的摩尔消光系数为3.6×104 mol/(L·cm)。
1.5蛋白浓度的测定
参照文献[8]进行蛋白浓度测定,以牛血清蛋白作为标准蛋白质。
1.6电泳
SDS-PAGE参照文献[9]进行,分离胶浓度均为10%,SDS-PAGE用考马斯亮蓝R250摇床染色2 h;PAGE 活性染色参照文献[10]略加修改,使用底物分别为ABTS和愈创木酚。
1.7酶的分离与纯化
1.7.1粗酶液的制备收集培养15 d的固体培养物,在固体培养物中加入蒸馏水,每500 mL摇瓶中加200 mL,浸泡 24 h 后用双层滤纸过滤,收集滤液,4 ℃ 10 000 g离心 30 min,收集上清液即粗酶液备用。
1.7.2硫酸铵盐析、透析80%饱和度硫酸铵沉淀,4 ℃静置过夜。10 000 r/min离心20 min,弃去上清,沉淀溶解于蒸馏水中,透析过夜。
1.7.3DEAE-Sepharose Fast Flow 柱层析将上述所得酶液加到已用0. 01 mol/L 磷酸钠缓冲液(PBS 7.0 )平衡过的DEAE-Sepharose Fast Flow柱(1.8 cm×20 cm),先用PBS洗柱,后改用含0~0.5 mol/L NaCl 的PBS梯度洗脱,合并有酶活组分,将所得溶液冷冻干燥成粉。
1.7.4Sephadex G-100 柱层析将上述所得活力组分的冻干粉溶解于3 ml蒸馏水中,所得酶液加到平衡好的层析柱(2.0 cm×80 cm) 上,用上述缓冲液洗脱。将在280 nm 处有吸收峰的管子收集起来,用ABTS法测量其酶活,将有漆酶活性部分分步收集起来,超滤浓缩至5 mL。
1.7.5活性电泳切胶[10-12]在凝胶两侧中部各切出1 cm×6 cm规格的凝胶条,在漆酶活性染色液(愈创木酚)中进行显色,出现清晰的显色带时立即将其放回原凝胶上所在位置。以两侧凝胶条上对应的显色带为标记,用锋利的刀片切下凝胶上相应的漆酶电泳区带。将切下的凝胶条放入1.5 mL EP管中,用玻璃棒碾碎后加入1 mL去离子水,4 ℃静置浸提过夜,13 000 r/min离心10 min,收集上清液。
1.8酶学性质
1.8.1表观分子量测定SDS-PAGE法测定漆酶的分子量,根据已知分子量的标准蛋白在SDS-PAGE中的相对迁移率Rf,作Rf-lgMr图,求得其分子量。
1.8.2pH值对漆酶活性的影响在pH值2.2~5.0的Na2HPO4-柠檬酸缓冲液中加入ABTS来测定酶活力。
1.8.3温度对漆酶活性的影响在不同温度(25~60 ℃)范围下测定漆酶活力。
1.8.4动力学常数测定在pH值4.0缓冲液中,加不同浓度的ABTS进行反应,以计算酶反应的初速度,作出Lineweaver-Burk双倒数图。
2结果与分析
2.1B1菌株漆酶同工酶
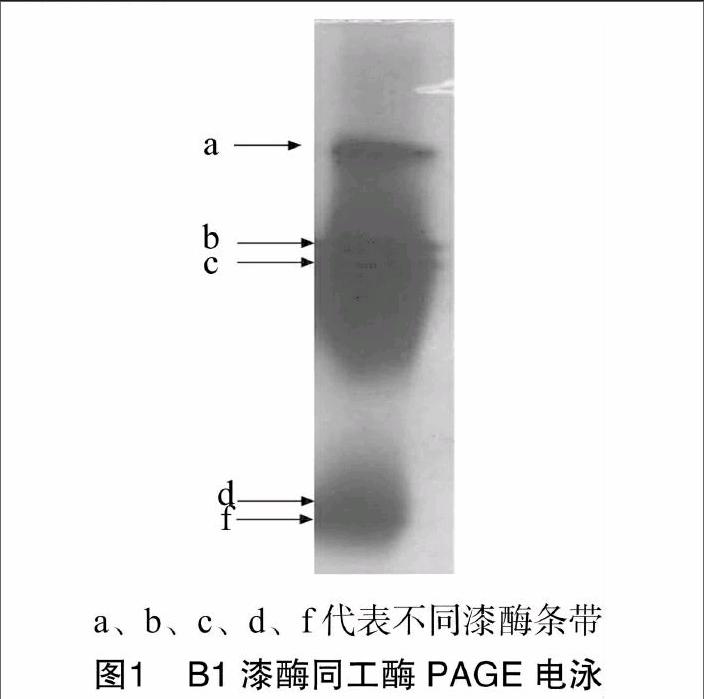
白腐菌B1菌株固体培养15 d后,将其培养物用蒸馏水浸泡,然后过滤收集粗酶液,进行Native-PAGE,然后通过底物ABTS进行活性染色,获得漆酶同工酶酶谱(图1)。在PAGE胶上,B1菌株产生的漆酶同工酶和ABTS发生反应而显现出绿色条带,根据谱带显色速度和条带绿色深浅,可看出条带a的漆酶含量最多(显色速度快,绿色深),而条带d的漆酶含量最少(显色速度慢,绿色浅);图中有5条清晰的同工酶条带,表明该菌株能合成至少5种不同分子量大小的漆酶同工酶,也可能还有其他同工酶由于表达量较少而用ABTS方法不能显现出来。
2.2漆酶的分离纯化
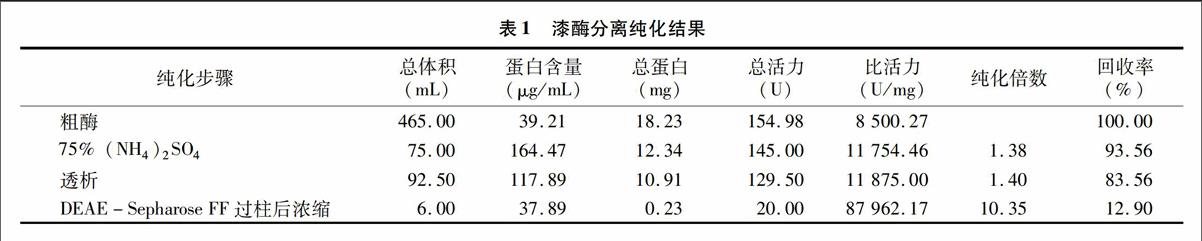
2.2.1离子交换柱层析和凝胶过滤粗酶液经硫酸铵沉淀、透析、DEAE-Sepharose Fast Flow离子交换柱层析后所得样品比活力为87 962.17 U/mg,纯化倍数为10.35倍,活力回收率为12.90%(表1)。将所得的活性最大的58号、59号和60号收集管中的酶液合并进行回收(图2),经SDS-PAGE电泳检测(图3-a)显示,发现有2条靠得很近的蛋白带,但未见到其他的蛋白条带,表明绝大部分杂质已被除去。将所得样品进行活性电泳显示,这2条蛋白条带分别是B1漆酶的2种同工酶,为获得单一条带,须进一步进行分离。这2种同工酶在同一个峰值收到,且该峰值活力最大,表明这2种同工酶所带的电荷量比较接近。而其他漆酶同工酶由于电荷量不一样,已经被分离开了,但在收集管中酶含量低,故对其他几种漆酶同工酶没有进一步分离纯化。
将粗酶液过离子交换柱后酶活性峰值收集液进行冻干,再进行SephadexG-100凝胶过滤,酶活性峰值出现在第23个收集管中,将其峰值酶液收集,然后用SDS-PAGE检测收集液中漆酶的纯度,Native-PAGE检测蛋白活性,电泳结果(图3-b)显示,峰值收集液仍然存在有2条蛋白条带,且这2条带都显示漆酶的活性,和离子交换柱层析后酶活性峰值收集液的电泳结果一样,这表明该步骤中凝胶过滤的分子筛作用并没有将2种同工酶完全分开,说明B1漆酶的这2种同工酶分子量相差很小。
2.2.2活性电泳切胶为了进一步将这2种同工酶分离开,本研究应用了活性电泳切胶法。将经过SephadexG-100凝胶过滤后峰值收集液冻干后进行活性电泳,用底物(愈创木酚)活性显色后显示出漆酶的同工酶条带,然后用切割凝胶的方法得到漆酶的2个同工酶:Lac1和Lac2。通过SDS-PAGE检测切胶回收后的蛋白,能够检测到单一蛋白条带,表明2种漆酶同工酶已被分离开(图4-A)。其中Lac1的分子量大约为64 ku,而Lac2分子量大约为62 ku,这一结果证明了这2种同工酶的分子量比较接近。活性电泳进一步显示出,2条分离条带都显示出漆酶的活性。从条带的颜色深浅可以看出,Lac1的蛋白浓度比Lac2的高,酶活性要比Lac2高(图4-B和C)。本试验证明通过活性电泳切胶法能将这2种同工酶分离。
2.3漆酶Lac1和Lac2的酶学性质
2.3.1最适pH值以ABTS作底物,在Na2HPO4-柠檬酸作缓冲液的反应体系下,分别检测不同pH值下的酶活性,得到2种同工酶Lac1和Lac2的最适pH值均为2.2左右(图5),由于Na2HPO4-柠檬酸缓冲液的最小pH值为2.2,因此未能比较pH值小于2.2的情况。
2.3.2最适温度由图6可见,Lac1在温度为50 ℃时酶活最高,而Lac2在温度为40 ℃时酶活最高,在20~60 ℃范围内均显示较高的酶活,大于60 ℃时,酶活力下降很快。
2.3.3动力学常数测定采用ABTS作为漆酶反应底物,在30 ℃、pH值 4.0 条件下取不同浓度的ABTS,测定其反应速度(v),用Linewear-Burk作图法,得到1/v与1/[S]的关系曲线见图7,Lac1的Km值为1.952 mmol/L,vmax为3.035 mmol/(L·min),Lac2的Km值为0.255 mmol/L,vmax为0.856 mmol/(L·min),Lac2的Km值要小于Lac1的Km值,表明Lac2对ABTS底物的亲和力比Lac1高。
3结论与讨论
漆酶是一类多酚氧化酶,也是一种含有铜原子的糖蛋白,漆酶广泛分布于以担子菌为主的白腐真菌中,参与木质素的生物降解。多数白腐菌具有2种以上的漆酶同工酶,其同工酶的产生与真菌的遗传因素以及生理发育状况有关,不同的白腐菌产生的同工酶数量会不一样。本试验中的白腐菌Trametes sp.B1在固体培养条件中能产生5条明显的同工酶条带。刘尚旭等报道了糙皮侧耳属不同菌株能产生4~9条同工酶[13];杨建明等发现毛木耳AP菌株至少产生3种漆酶同工酶[14];郭伟云等发现云芝菌能产生2种同工酶[15];同一种属不同菌株中漆酶同工酶谱的变化可以为分类学提供一定的借鉴,方自若等深入研究了侧耳种群不同菌株的漆酶同工酶谱特征,发现这些菌株之间的差异,对于种的分类是很有价值的[16]。漆酶同工酶出现在次生代谢阶段,属于一类诱导酶,在培养条件和营养成分发生变化时,也会影响到同工酶数量的变化。本试验中发现在木质素类固体培养条件下,该菌能产生5条同工酶,而在液体合成培养基中只产生2种同工酶,可能是木质素类对酶的诱导作用而产生的。另外,刘尚旭等认为漆酶活性的高低可能和漆酶同工酶之间存在密切的联系,同时漆酶活性高的条带也许是这个基因易于表达[13]。
很多文献已经报道了多种真菌的漆酶分离纯化,利用蛋白分子量和所带电荷的差异,主要采用2~3步柱层析的方式分离得到。郭伟云等采用DEAE-Sepharose Fast Flow和SephadexG-100凝胶过滤两步柱层析,从云芝菌中得到2种漆酶同工酶,分子量分别是64 ku和60 ku[15];杨建明等利用硫酸铵分级沉淀和离子交换柱层析,对毛木耳AP菌株的漆酶粗酶液进行纯化,获得了3种分子量不同的漆酶[14];王方忠从香菇所发酵的粗酶液中,经过丙酮分级沉淀、DEAE-纤维素离子柱层析和Sephadex G-100柱层析,获得了2种漆酶同工酶[17]。这些能分离开的漆酶同工酶,彼此间的蛋白分子量和所带电荷有明显的差异,而在本试验中采用DEAE-Sepharose Fast Flow和SephadexG-100凝胶过滤方式并未能将漆酶的2种同工酶分开,这一结果表明Trametes sp.B1产生的这2种同工酶蛋白分子量和所带电荷差异很小。
切胶纯化法是利用各种蛋白组分在凝胶电泳中由于迁移率不同而彼此分开,然后染色后使目标蛋白在凝胶上显示出来,再将其所处位置的蛋白条带切割下来,并回收凝胶中的目标蛋白,从而达到纯化分离的目的[10]。本研究采用简单的活性电泳切胶法,进一步将这2种同工酶分开,从而避免了复杂的柱层析分离,既快速有效又节省时间。将割下来的胶带用超纯水浸泡,回收的2种浸泡液在SDS-PAGE电泳图中都只显示1条条带,这说明采用此法分离这2种同工酶切实可行。这种方法已经有了很多成功的应用,陈敏等报道了切胶纯化法分离了木质素降解酶[10]。当然这种方法的使用具有一定的局限性,首先需要样品中大量的杂蛋白已被去掉,否则在切胶纯化时得到的蛋白不纯;其次切胶纯化法分离出来的蛋白量较少,回收率不高。本研究中SDS-PAGE染色显示出分离的2条蛋白条带的颜色都比较浅,这表明从凝胶内溶解到水里的只是其中的一部分酶蛋白,有很大部分仍留在原来的凝胶内。检测2种同工酶的回收率,分别为1.82%和2.28%,证明样品回收率较低。如果在以后的研究中能找到一种办法增大凝胶中酶的浸出率,那将对漆酶同工酶的分离纯化带来极大的意义。
多数真菌漆酶最适pH值在3~5之间,而细菌漆酶最适pH值会高一些,甚至可以在pH值5以上,王方忠等分离的漆酶同工酶最适pH值为4左右[17]。本研究分离的2种漆酶同工酶在以ABTS为底物时,最适pH值都在2.2,表明这2种漆酶同工酶可以在偏酸的体系下应用。这2种同工酶最适pH值差异较小,表明在同一种缓冲体系中所带电荷量相似,并且分离的2种漆酶同工酶分子量分别是64 ku左右和 62 ku 左右,也比较接近,这一结果也进一步解释了为什么采用DEAE-Sepharose fast flow和SephadexG-100凝胶过滤方式并不能将其分开。尽管这2种同工酶在最适pH值和分子量上差异较小,但其最适温度和Km值不同,表明2种同工酶本质上有一定的差异。漆酶同工酶的差异主要由2种原因造成,一方面是编码漆酶的基因差异,另一方面是由于基因表达翻译后的糖蛋白修饰。漆酶同工酶在不同的物种和同一种内之间的差异性,表明了漆酶的多样性,这有利于漆酶应用范围的扩大。
参考文献:
[1]Karhunen E,Niku-Paavola M L,Viikari L,et al. A novel combination of prosthetic groups in a fungal laccase:PQQ and two copper atoms[J]. FEBS Letters,1990,267(1):6-8.
[2]季立才,胡培植. 漆酶的结构、功能及其应用[J]. 氨基酸和生物资源,1996,18(1):25-29.
[3]钞亚鹏,钱世钧. 真菌漆酶及其应用[J]. 生物工程进展,2001,21(5):23-28.
[4]Sakurai T,Takahashi J. EPR spectra of type 3 Copper centers in Rhus vernicifera laccase and Cucumis sativus ascorbate oxidase[J]. Biochimica et Biophysica acta,1995,1248(2):143-148.
[5]缪静,姜竹茂. 漆酶的最新研究进展[J]. 烟台师范学院学报:自然科学版,2001,17(2):146-150.
[6]王佳玲,余惠生. 白腐菌漆酶的研究进展[J]. 微生物学通报,1998,25(4):233-236.
[7]Bourbonnais R,Paice M G. Demethylation and delignificaion of kraft pulp by Trametes versicolor in the presence of 2,2′-azinobis(3-ethylbenthiazoline-6-sulfonate)[J]. Applied and Environmental Microbiology,1992,36:823-827.
[8]Edens W A,Goins T Q,Dooley D,et al. Purification and characterization of a secreted laccase of Gaeumannomyces graminis var. tritici[J]. Applied and Environmental Microbiology,1999,65(7):3071-3074.
[9]刘友勋,马富英,熊征,等. 露湿漆斑菌胆红素氧化酶的分离纯化及其性质[J]. 食品与生物技术学报,2008(3):104-108.
[10]陈敏,郭倩,蒋予箭. 1种提高Native-PAGE中活性目标蛋白回收率的方法[J]. 中国食品学报,2012,12(7):228-234.
[11]康彬,童哲. 一种利于蛋白质回收的快速SDS-聚丙烯酰胺凝胶电泳染色-脱色方法[J]. 生物化学与生物物理进展,2000,27(2):210-211.
[12]Pupo E,Aguila A,Santana H,et al. Mice immunization with gel electrophoresis-micropurified bacterial lipopolysaccharides[J]. Electrophoresis,1999,20(3):458-461.
[13]刘尚旭,董佳里,张义正. 糙皮侧耳Ax3产漆酶条件及部分酶学性质研究[J]. 四川大学学报:自然科学版,2004,41(1):160-163.
[14]杨建明,张小敏,邢增涛,等. 毛木耳漆酶纯化及其部分漆酶特性的研究[J]. 菌物学报,2005,24(1):61-70.
[15]郭伟云,汤祥忠,姚朝阳,等. 云芝漆酶同工酶的分离纯化及酶学性质[J]. 河北师范大学学报:自然科学版,2007,31(6):806-809.
[16]方自若,侯文英,郑美媛. 几种担子菌胞外漆酶同工酶谱的研究[J]. 真菌学报,1985,4(3):174-179.
[17]王方忠,朱启忠,董学卫,等. 香菇漆酶的纯化及部分性质研究[J]. 北方园艺,2008(6):36-38.
