冬枣多糖的分离纯化及抗氧化活性研究
2016-08-10许经伟滨州职业学院生物工程系山东滨州56603滨州学院资源环境系山东滨州56603
潘 莹,许经伟(.滨州职业学院生物工程系,山东 滨州 56603;.滨州学院资源环境系,山东 滨州 56603)
冬枣多糖的分离纯化及抗氧化活性研究
潘 莹1,许经伟2
(1.滨州职业学院生物工程系,山东 滨州 256603;2.滨州学院资源环境系,山东 滨州 256603)
摘 要:目的:分离纯化冬枣多糖,并研究其组分、结构特征和抗氧化活性。方法:采用水提醇沉、脱蛋白脱色、DEAE-52纤维素柱和Sephadex G-100凝胶色谱柱分离纯化冬枣多糖;利用Sephadex G-100凝胶色谱柱进行纯度鉴定和分子质量的测定;通过紫外光谱、红外光谱、气相色谱法进行了初步结构分析;采用邻二氮菲法和1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)体系对纯化多糖进行抗氧化活性的研究。结果:冬枣多糖经DEAE-52分离和Sephadex G-100纯化得到2 个组分DPA和DPB,经Sephadex G-100鉴定均为均一组分,DPA和DPB分子质量分别为1.04×104、3.02×105D,不含蛋白质和核酸,为吡喃型糖苷环骨架,DPA的单糖组成为阿拉伯糖、甘露糖、葡萄糖、半乳糖,其物质的量比为6.66∶1.00∶6.75∶2.09;DPB的单糖组成为鼠李糖、阿拉伯糖、甘露糖、葡萄糖、半乳糖,其物质的量比为4.33∶10.90∶1.00∶3.25∶4.78;DPA和DPB均具有一定的抗氧化活性,随着多糖质量浓度的增加,其抗氧化活性增强,在质量浓度为8 mg/mL时对羟自由基清除率分别为28.52%、78.79%,在质量浓度为0.4 mg/mL时对DPPH自由基清除率分别为9.97%、24.54%。结论:DPA和DPB均具有一定的抗氧化活性。
关键词:冬枣;多糖;分离纯化;结构鉴定;抗氧化活性
引文格式:
潘莹, 许经伟.冬枣多糖的分离纯化及抗氧化活性研究[J].食品科学, 2016, 37(13): 89-94.DOI:10.7506/spkx1002-6630-201613016. http://www.spkx.net.cn
PAN Ying, XU Jingwei.Isolation, purification and antioxidant activity of polysaccharides from Zizyphus jujube cv.Dongzao[J].Food Science, 2016, 37(13): 89-94.(in Chinese with English abstract) DOI:10.7506/spkx1002-6630-201613016. http://www.spkx.net.cn
冬枣(Zizyphus jujube cv.Dongzao)为鼠李科枣属植物,为我国特有的一种晚熟鲜食枣。由于冬枣果肉脆嫩多汁,富含人体所需的氨基酸、维生素和微量元素,备受人们喜爱[1]。
近年来植物多糖成了人们研究的热点,关于多糖的分离纯化[2-4]及活性如抗肿瘤、抗衰老、免疫调节、抗氧化等[5]研究较多,有文献报道冬枣中糖分含量很高,且随着成熟度的增加,多糖含量也有所增加[1],冬枣多糖物质已逐渐引起了人们的关注。
目前国内外有关冬枣的研究报道,主要集中在枣树的栽培管理、果实的贮藏与加工、病虫害防治等方面[6-7],本研究在前期提取工艺[8]和脱蛋白工艺[9]优化的基础上,进一步对冬枣多糖进行脱色,采用DEAE-52分离和Sephadex G-100纯化得到2 个组分,并对其采用凝胶色谱法、紫外光谱法、红外光谱法、气相色谱法进行了纯度鉴定、分子质量测定、光谱特征、单糖组成等基本特征研究,还测定纯化多糖的抗氧化活性,以期为开发天然抗氧剂和冬枣多糖的综合利用提供参考。
1 材料与方法
1.1 材料与试剂
冬枣 山东省沾化县市售。
DEAE-52、葡聚糖T10、T20、T40、T70、T500、蓝色葡聚糖2000 瑞典Phamacia公司;木瓜蛋白酶(3×107U/g)、L-阿拉伯糖 美国Sigma公司;Sephadex G-100、L-鼠李糖、葡萄糖、D-甘露糖、D-半乳糖、透析袋(截留分子质量3 500 D) 上海蓝季生物科技有限公司;D-半乳糖醛酸 上海源叶生物科技有限公司;1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH) 上海伊卡生物技术有限公司;粉末状活性炭 巩义市元亨净水材料厂;LS-850树脂 陕西蓝深特种树脂有限公司;AB-8型树脂、D-101型树脂 安徽三星树脂科技有限公司;无水乙醇、丙酮、浓硫酸、苯酚、氯化钠、氢氧化钠、盐酸、三氟乙酸、盐酸羟胺、乙酸酐、肌醇、磷酸二氢钾、抗坏血酸(VC)、邻二氮菲、硫酸亚铁、过氧化氢(H2O2)均为国产分析纯。
1.2 仪器与设备
FR224CN 电子分析天平 奥豪斯仪器有限公司;ZD-85气浴恒温振荡器 金坛市国旺实验仪器厂;TH-500A梯度混合器、BT1-100恒流泵、SBS-100-LCD数控计滴自动部分收集器 上海琪特分析仪器有限公司;TU-1810紫外-可见分光光度计 北京普析通用仪器有限公司;RE-52AAA型旋转蒸发器 上海嘉鹏科技有限公司;FL9720气相色谱仪 浙江福立分析仪器有限公司;Nicolet 380傅里叶红外光谱仪 美国Nicolet公司;MD200氮吹仪 金坛市盛蓝仪器制造有限公司。
1.3 方法
1.3.1 冬枣多糖的提取和脱蛋白
冬枣60 ℃烘干后粉碎过60 目筛,在100 ℃按料液比1∶25(m/V)提取4 h,离心后减压浓缩,并用无水乙醇于4 ℃静置过夜,所得沉淀依次用无水乙醇和丙酮洗涤,并经真空干燥得冬枣粗多糖。
将冬枣粗多糖配成1 g/100 mL溶液,先在40 ℃条件下用450 U/mL木瓜蛋白酶酶解1.5 h后,采用9 g/100 mL三氯乙酸脱蛋白,再用1 g/100 mL氢氧化钠调pH值至7.0,得脱蛋白冬枣多糖。
1.3.2 冬枣多糖的脱色
脱蛋白冬枣多糖液为橙黄色,在400~780 nm波长范围内扫描发现其无最大吸收峰,根据溶液的互补色,选择在420 nm波长处测定其吸光度,并按公式(1)计算脱色率。多糖含量采用苯酚-硫酸法[15]测定,其多糖保留率的计算见公式(2)。

1.3.2.1 活性炭脱色[10]
取步骤1.3.1节中脱蛋白冬枣多糖液,按照1 g/100 mL的量向其中加入活性炭,于40 ℃、125 r/min条件下恒温振荡40 min,过滤,取滤液稀释后测定多糖脱色率和多糖保留率。
1.3.2.2 树脂脱色[11]
采用静态吸附法,将预处理好的AB-8、D-101、LS-850树脂,树脂与脱蛋白多糖液按0.75∶10(m/V)的比例在125 r/min常温条件下振荡2.5 h,过滤后取滤液稀释定容到25 mL后测定多糖脱色率和多糖保留率。
1.3.3 冬枣多糖的分离和纯化
将脱蛋白脱色多糖液配成100 mg/3 mL的溶液,取3 mL上样于预先平衡好的DEAE-52纤维素柱(2.6 cm×30 cm),依次用蒸馏水、0.2、0.3、0.5、1 mol/L的NaCl溶液洗脱[12-13],流速为1 mL/min,以每管5 mL收集洗脱液,用苯酚-硫酸法[14]于490 nm波长处隔管检测,合并各吸收的洗脱液,经减压浓缩装入透析袋,在流动水和蒸馏水中分别透析48 h和24 h后上样于Sephadex G-100凝胶色谱柱(1.6 cm×40 cm),用蒸馏水洗脱,以每管1.5 mL收集洗脱液,用苯酚-硫酸法逐管检测,合并各吸收的洗脱液,经减压浓缩和真空干燥得2 种冬枣纯化后多糖,分别记为DPA和DPB。
1.3.4 冬枣多糖组分的纯度及分子质量
采用凝胶色谱法测定冬枣多糖的纯度及分子质量[15]。将标准葡聚糖T10、T20、T40、T70、T500、冬枣多糖DPA和DPB分别上样于Sephadex G-100凝胶色谱柱,用蒸馏水洗脱,流速为0.3 mL/min,以每管1.5 mL收集洗脱液,用苯酚-硫酸法逐管检测,记录不同相对分子质量的多糖经过凝胶柱的洗脱体积(Ve)和用蓝色葡聚糖-2000上柱求得柱的外水体积(V0),以Ve/V0为纵坐标,lgMw为横坐标,计算曲线方程,并绘制冬枣多糖洗脱曲线,根据洗脱曲线判断多糖纯度是否均一。
1.3.5 光谱分析
1.3.5.1 紫外光谱分析
将冬枣多糖DPA和DPB粉末分别配制成1 mg/mL的溶液,在200~700 nm波长范围内扫描,观察其在260、280 nm波长处有无吸收峰。
1.3.5.2 红外光谱分析[16]
将1 mg干燥的冬枣多糖DPA和DPB粉末分别与100 mg KBr固体粉末在玛瑙研钵中研磨均匀,用压片机压成薄片,在4 000~400 cm-1范围内进行红外光谱扫描。
1.3.6 理化性质分析
1.3.6.1 显色反应[16]
将2 种冬枣多糖分别配制成1 mg/mL溶液,分别进行苯酚-硫酸反应、茚三酮反应、双缩脲反应、碘-碘化钾反应、斐林试剂反应、三氯化铁反应。
1.3.6.2 比旋度测定
将2 种冬枣多糖分别配制成10 mg/mL溶液,20 ℃条件下用1 dm的旋光管测定其旋光度。
1.3.6.3 糖醛酸含量测定
将冬枣多糖DPB配制成1 mg/mL溶液,以半乳糖醛酸为对照,采用硫酸-咔唑法[17],在523 nm波长处测定吸光度,绘制标准曲线并计算多糖DPB中糖醛酸的含量。
1.3.7 单糖组成分析
参照文献[15]的方法,分别称取10 mg多糖样品DPA、DPB和标准单糖(鼠李糖、L-阿拉伯糖、D-甘露糖、葡萄糖、D-半乳糖)各加入3 mL 2 mol/L的三氟乙酸,封管后110 ℃条件下水解4 h,待水解产物冷却至室温,加入3 mL甲醇,50 ℃氮吹浓缩至干,重复3 次,尽量除尽三氟乙酸,得多糖水解产物。水解产物中分别加入10 mg盐酸羟胺、5 mg肌醇、0.5 mL无水吡啶,混匀后,90 ℃水浴加热30 min,取出,冷却至室温,加入0.5 mL无水乙酐,90 ℃水浴加热30 min,制得多糖样品糖腈乙酸化产物。产物在氮吹仪上浓缩至干,加入1.0 mL氯仿复溶,溶液经0.45 μm滤膜过滤后进气相色谱(gas chromatography,GC)仪分析。气相色谱条件为:SE-30毛细管柱(30 m×0.25 mm,0.25 μm),氢火焰离子化检测器(hydrogen flame ionization detector,FID)检测器;氢气、空气、氮气体积流量分别为16、150、20 mL/min;进样口温度230 ℃,检测器温度240 ℃;色谱柱采用程序升温,起始温度130 ℃,以5 ℃/min速率升至180 ℃/min,保持2 min,再以5 ℃/min速率升至220 ℃,保持10 min。
1.3.8 抗氧化活性研究
1.3.8.1 羟自由基(·OH)清除率的测定
将纯化后DPA和DPB分别配制成0.2、0.4、0.8、1.2、2.4、3.2、4、4.8、6.4、8.0 mg/mL的溶液,按照文献[18],采用邻二氮菲法进行·OH清除率的测定,以VC为对照。
1.3.8.2 DPPH自由基清除率的测定
采用DPPH体系[19]测定纯化后DPA和DPB质量浓度分别为0.005、0.01、0.02、0.04、0.05、0.1、0.2、0.4 mg/mL时的DPPH自由基清除率,并以VC为对照。
2 结果与分析
2.1 冬枣多糖的提取和脱蛋白
冬枣多糖经水提醇沉,无水乙醇和丙酮洗涤,真空干燥后得冬枣粗多糖;再将粗多糖用木瓜蛋白酶-三氯乙酸法脱蛋白,得脱蛋白冬枣多糖。
2.2 冬枣多糖的脱色
以多糖脱色率和多糖保留率为指标,比较几种脱色工艺,结果见表1,活性炭脱色效果最好,其多糖脱色率为78.71%,多糖保留率为90.22%。之后将脱蛋白多糖用活性炭脱色后经减压浓缩、真空干燥得冬枣多糖DPI。

表 1 冬枣多糖不同脱色方法的结果Table 1 Pigment removal and polysaccharide retention with differentsorbents指标 活性炭 树脂LS-850 树脂AB-8 树脂D-101多糖脱色率/% 78.71 20.77 14.75 46.08多糖保留率/% 90.22 80.05 90.12 83.00
2.3 冬枣多糖的分离和纯化
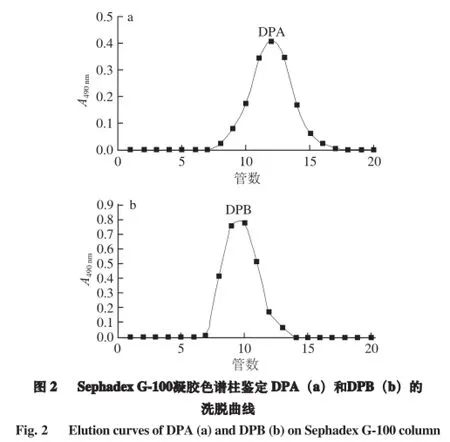
DPI经洗脱,并用苯酚-硫酸法隔管检测后,由图1可知,用蒸馏水和0.2 mol/L NaCl洗脱时,各出现1 个洗脱峰,再经减压浓缩、透析后分别上Sephadex G-100凝胶色谱柱,由图2可知,用蒸馏水洗脱,均为单一洗脱峰。收集洗脱峰,经减压浓缩和真空干燥后获得2 种冬枣多糖DPA和DPB,其总糖含量分别为92.47%、84.99%,其得率分别为脱蛋白脱色多糖的11.49%、10.41%。

2.4 冬枣多糖组分的纯度及分子质量
由标准葡聚糖的洗脱体积(Ve)和蓝色葡聚糖2000外水体积(V0)及其分子质量,得标准曲线方程为Ve/V0=-0.597 8 lgMw+6.901 2(R2=0.997 3),DPA和DPB的分子质量分别为1.04×104、3.02×105D。由图2可知,DPA和DPB峰形尖锐,对称性好,说明其纯度较高,分子质量分布较为均一。
2.5 光谱分析
2.5.1 紫外光谱分析
由图3可知,将DPA和DPB分别在200~700 nm波长范围内扫描后,发现在波长200 nm附近有一个较强的吸收峰,而在260、280 nm波长处均无吸收,表明其不含核酸和蛋白质[20]。

2.5.2 红外光谱分析
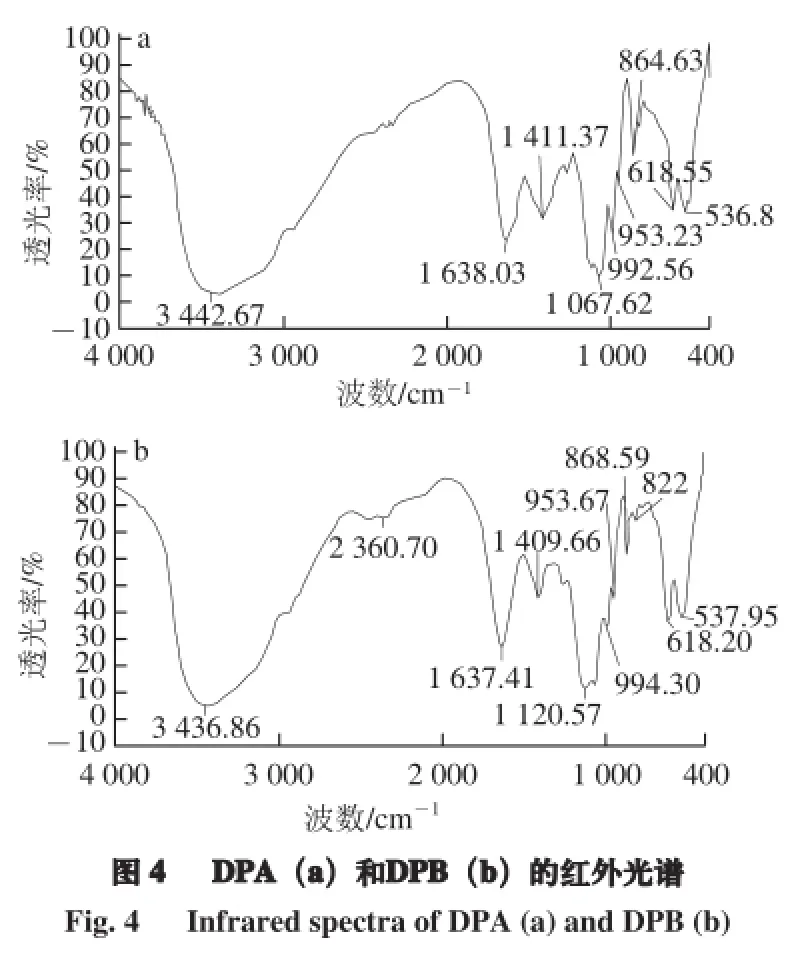
由图4可知,DPA和DPB的红外光谱在3 400 cm-1附近均有1 个强的吸收峰,是多糖分子间或分子内的O—H的伸缩振动引起的;在1 638.03、1 637.41 cm-1处有强的吸收峰,为C=O不对称伸缩振动峰;在1 410 cm-1附近的峰是糖类C—H变角振动吸收峰;在1 150~1 050 cm-1的峰是吡喃型糖苷环骨架C—O变角振动吸收峰,说明分子中存在C—O—H和糖环C—O—C结构[21];2 种多糖中分别在864.63、868.59 cm-1处有吸收峰,说明其可能含有β-D-葡萄吡喃糖吸收峰[16],其他结构有待进一步研究确证。
2.6 理化性质分析
2.6.1 显色反应
DPA和DPB进行苯酚-硫酸反应为阳性,茚三酮反应为阴性,双缩脲反应为阴性,碘-碘化钾反应为阴性,三氯化铁反应为阴性,DPA、DPB斐林试剂反应分别为阳性和阴性,说明2 种多糖都为糖类化合物,不含氨基酸、蛋白质、淀粉,无酚羟基,其中DPA为还原多糖。
2.6.2 比旋度
DPA和DPB在20 ℃条件下测得的比旋度分别为+20.55˚、+68.01˚。
2.6.3 糖醛酸含量
一系列糖醛酸含量按照硫酸-咔唑法所绘制的标准曲线为A523 nm=0.005 8ρ+0.03,式中A523 nm为吸光度,ρ为糖醛酸质量浓度。说明在糖醛酸10.7~107 μg/mL质量浓度范围内,线性关系保持良好(R2=0.993),DPB中糖醛酸的含量分别为5.56%。
2.7 单糖组成分析
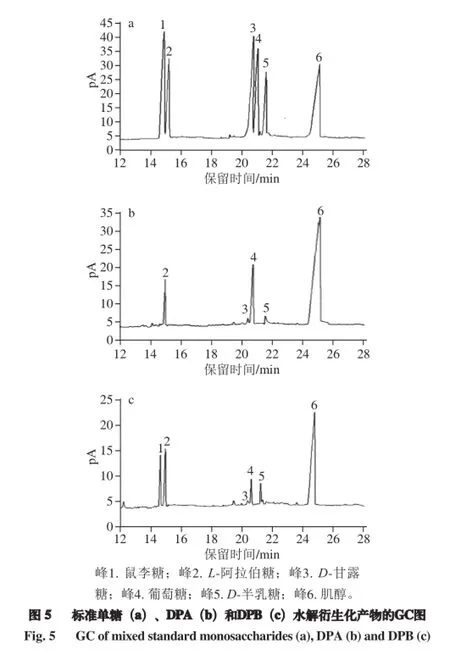
将5 种标准单糖、混合标准品及待测的2 种冬枣多糖样品分别进GC,根据保留时间确定单糖组成,根据峰面积确定单糖组成物质的量比。由图5可知,DPA的单糖组成为阿拉伯糖、甘露糖、葡萄糖、半乳糖,其物质的量比为6.66∶1.00∶6.75∶2.09;DPB的单糖组成为鼠李糖、阿拉伯糖、甘露糖、葡萄糖、半乳糖,其物质的量比为4.33∶10.90∶1.00∶3.25∶4.78。DPA的组成主要为阿拉伯糖和葡萄糖,DPB主要组成为阿拉伯糖、半乳糖和鼠李糖。
2.8 抗氧化活性
2.8.1 ·OH清除能力
由图6可知,在一定质量浓度范围内,随着多糖质量浓度的增加,·OH清除率逐渐增加,DPA、DPB 的·OH清除率均低于VC。DPA质量浓度从0.2 mg/mL上升至8 mg/mL,其·OH清除率幅度变化较小,在8 mg/mL时,其·OH清除率为28.52%;DPB质量浓度从3.2 mg/mL上升至8 mg/mL,其·OH清除率幅度增加较大,在8 mg/mL时,其·OH清除率为78.79%。

2.8.2 DPPH自由基清除能力

由图7可知,随着DPA、DPB质量浓度的增加,DPPH自由基清除率逐渐增加,当质量浓度为0.4 mg/mL时,VC、DPA、DPB的DPPH自由基清除率分别为96.21%、9.97%、24.54%,在质量浓度在0.005~0.4 mg/mL间,DPA和DPB的DPPH自由基清除率增加缓慢,其DPPH自由基清除率均不高。
3 结 论
本实验以冬枣为原材料,经过水提醇沉干燥得冬枣粗多糖,再经木瓜蛋白酶-三氯乙酸法脱蛋白,以多糖脱色率和多糖保留率为指标,比较了活性炭和3 种树脂脱色效果,结果表明活性炭脱色效果最好,其脱色工艺条件为向脱蛋白多糖液中加入1%活性炭在40 ℃、125 r/min条件下室温振荡40 min,其多糖脱色率为78.71%,多糖保留率为90.22%。
将脱蛋白脱色多糖液经干燥,配成一定溶液上DEAE-52纤维素柱和Sephadex G-100纯化得到2 个组分DPA和DPB,采用凝胶色谱法分别对DPA和DPB进行了纯度鉴定和分子质量测定,结果表明峰形尖锐,对称性好,纯度高,其分子质量分别为1.04×104、3.02×105D。
光谱分析表明DPA和DPB不含核酸和蛋白质,具有多糖特征吸收,理化实验表明2 种多糖不含氨基酸和蛋白质,不含淀粉,无酚羟基,其中DPA为还原糖。DPA和DPB的比旋度分别为+20.55 ˚、+68.01 ˚;DPB中糖醛酸含量为5.56%。
采用糖腈乙酸酯化衍生法对DPA、DPB进行单糖组成分析,结果表明DPA的单糖组成为阿拉伯糖、甘露糖、葡萄糖、半乳糖,其物质的量比为6.66∶1.00∶6.75∶2.09;DPB的单糖组成为鼠李糖、阿拉伯糖、甘露糖、葡萄糖、半乳糖,其物质的量比为4.33∶10.90∶1.00∶3.25∶4.78。
多糖的抗氧化活性与多糖的结构、分子质量及单糖的种类和连接方式有关[22]。对纯化的DPA和DPB进行·OH清除率和DPPH自由基清除率的测定,结果表明DPA和DPB两种多糖都具有一定的抗氧化活性,随着多糖质量浓度增加,其抗氧化活性逐渐增强,DPB具有较高的·OH清除率,而DPA和DPB的DPPH自由基清除率均不高。在一定质量浓度范围内,DPB的·OH清除率和DPPH自由基清除率均高于DPA,可能与DPB为酸性多糖含带负电荷的糖醛酸或分子质量大小有关,究其原因有待进一步研究。
参考文献:
[1] 王百千, 宋利霞.枣果实主要营养成分分析[J].河北果树, 2012(1): 51-52.DOI:10.3969/j.issn.1006-9402.2012.01.047.
[2] 宾宇波, 王亚芸, 安欣, 等.铁皮石斛多糖分离纯化及单糖组成测定[J].食品工业科技, 2014, 35(4): 122-125.DOI:10.13386/ j.issn1002-0306.2014.04.054.
[3] 林志超, 余金富, 潘裕添.香蕉皮多糖提取分离纯化及分子质量测定[J].食品科学, 2013, 34(8): 104-106.DOI:10.7506/spkx1002-6630-201308021.
[4] REN A N, LU Y, ZOU Y F,et al.Separation, purification and preliminary structure analysisof acidic polysaccharides from safflower[J].European Food Research and Technology, 2013, 237(3): 449-455.DOI:10.1007/s00217-013-2009-7.
[5] 申利红, 王建森, 李雅, 等.植物多糖的研究及应用进展[J].中国农学通报, 2011(2): 349-352.
[6] 李守勇, 续九如, 张华丽, 等.冬枣研究进展[J].中国果树, 2004(1): 49-53.DOI:10.16626/j.cnki.issn1000-8047.2004.01.027.
[7] 陈爱香.中国冬枣文献分析[J].北方园艺, 2011(23): 218-220.
[8] 潘莹.冬枣多糖水提醇沉工艺研究[J].食品工业, 2015, 36(1): 124-126.
[9] 潘莹.冬枣多糖脱蛋白工艺研究[J].食品工业, 2015, 36(9): 100-103.
[10] 谢建华, 申明月, 聂少平, 等.青钱柳多糖活性炭脱色工艺[J].南昌大学学报(理科版), 2013, 37(4): 382-385.DOI:10.3969/ j.issn.1006-0464.2013.04.016.
[11] 杨悦文, 胡晓, 杨义芳, 等.响应面分析法优化紫芝多糖的脱色工艺[J].中国医药工业杂志, 2013, 44(4): 348-351.DOI:10.16522/j.cnki.cjph.2013.04.007.
[12] 菅丽君, 常军民, 李改茹, 等.刺糖多糖的分离纯化与基础结构分析[J].中国药学杂志, 2013, 48(7): 505-508.DOI:10.3969/ j.issn.1009-5551.2013.04.009.
[13] 扶雄, 吴少微, 孟赫诚, 等.鸡骨草多糖的分离纯化及抗氧化活性研究[J].现代食品科技, 2013, 29(7): 1559-1564.DOI:10.13982/ j.mfst.1673-9078.2013.07.013.
[14] 朱胤龙, 陈萍, 张亚环.稀针嗜蓝孢孔菌多糖分析方法研究[J].中国实验方剂学杂志, 2008, 14(9): 1-3.DOI:10.3969/ j.issn.1005-9903.2008.09.001.
[15] 田徽, 李涛, 郭江, 等.马兰多糖的分离纯化及初步结构分析[J].中草药, 2013, 44(16): 2213-2217.DOI:10.7501/ j.issn.0253-2670.2013.16.004.
[16] 刘晓风, 刘琳, 王永刚, 等.啤特果多糖分离纯化及抗氧化活性研究[J].现代食品科技, 2014, 30(7): 179-186.DOI:10.13982/ j.mfst.1673-9078.2014.07.011.
[17] 王文平, 郭祀远, 李琳, 等.野木瓜多糖中糖醛酸含量测定[J].食品科技, 2007, 32(10): 84-86.DOI:10.13684/j.cnki.spkj.2007.10.036.
[18] 李文婕, 杨小明, 张赫男, 等.无花果多糖的纯化及其抗氧化活性研究[J].食品工业科技, 2014, 35(14): 161-165.DOI:10.13386/ j.issn1002-0306.2014.14.027.
[19] ZENG P Y, WU J G, LIAO L M, et al.In vitro antioxidant activities of endophytic fungi isolated from the liverwort Scapania verrucosa[J].Genetics and Molecular Research, 2011, 10(4): 3169-3179.DOI:10.4238/2011.December.20.1.
[20] 王伟, 刘世军, 安法娥, 等.黄连多糖提取、分离纯化鉴定及清除羟基自由基能力测定[J].山东医药, 2013, 53(10): 79-82.DOI:10.3969/ j.issn.1002-266X.2013.10.033
[21] 王迎进, 马文辉, 李嘉慧, 等.苦参多糖的单糖组成分析及体外抗氧化性研究[J].药物分析杂志, 2014, 34(7): 1187-1191.DOI:10.16155/ j.0254-1793.2014.07.007.
[22] ZHANG Y L, ZHANG J B, MO X Y, et al.Modification,characterization and structure-anticoagulant activity relationships of persimmon polysaccharides[J].Carbohydrate Polymers, 2010, 82(2): 515-520.DOI:10.1016/j.carbpol.2010.05.008.
DOI:10.7506/spkx1002-6630-201613016
中图分类号:TS201.2
文献标志码:A
文章编号:1002-6630(2016)13-0089-06
收稿日期:2015-07-27
基金项目:山东省高校科研计划项目(J13LE61)
作者简介:潘莹(1982—),女,讲师,硕士,研究方向为天然产物活性。E-mail:panying111@163.com
Isolation, Purification and Antioxidant Activity of Polysaccharides from Zizyphus jujube cv.Dongzao
PAN Ying1, XU Jingwei2
(1.Department of Biological Engineering, Binzhou Vocational College, Binzhou 256603, China;2.Department of Resources and Environment, Binzhou University, Binzhou 256603, China)
Abstract:Objective: To study the monosaccharide composition, structure and antioxidant activity of polysaccharide fractions isolated and purified from Zizyphus jujube cv.Dongzao.Methods: The extraction of polysaccharides was performed by water extraction and subsequent ethanol precipitation, and after removal of proteins and pigments, the polysaccharides were purified by successive DEAE-52 cellulose column and Sephadex G-100 gel column chromatography.The purity and molecular weights of the purified polysaccharides were determined by Sephadex G-100 column chromatography.Preliminary structural characterization was carried out by ultraviolet-visible (UV-VIS) spectroscopy, infrared (IR)spectroscopy and gas chromatography (GC).The antioxidant activity of the crude and purified polysaccharides was evaluated using the phenanthroline method and 1, 1-diphenyl-2-picrylhydroxyl (DPPH) radical scavenging activity assay.Results: Two polysaccharide fractions (DPA and DPB) were purified to homogeneity from the crude polysaccharides as identified by Sephadex G-100.The molecular weight of DPA and DPB was 1.04 × 104and 3.02 × 105D, respectively.DPA and DPB did not contain protein or nucleic acid, but contained the pyranose ring skeleton glucoside.The monosaccharide composition of DPA consisted of arabinose, mannose, glucose and galactose with a molar ratio of 6.66:1.00:6.75:2.09, whereas that of DPB consisted of rhamnose, arabinose, mannose, glucose and galactose with a molar ratio of 4.33:10.90:1.00:3.25:4.78.The crude polysaccharides, DPA and DPB all had antioxidant activity in a concentration dependent manner.The scavenging percentages of DPA and DPB at 8 mg/mL for hydroxyl radical were 28.52% and 78.79% respectively, which were 9.97% and 24.54% at 0.4 mg/mL, respectively.Conclusion: Both DPA and DPB had antioxidant activity.
Key words:Zizyphus jujube cv.Dongzao; polysaccharide; isolation and purification; structure identification; antioxidant activity
