U266多发性骨髓瘤细胞株中CD138阴性细胞的分离和培养
2016-08-10胡大春
张 霞,胡大春
(云南省昆明市第一人民医院检验科 650011)
U266多发性骨髓瘤细胞株中CD138阴性细胞的分离和培养
张霞,胡大春
(云南省昆明市第一人民医院检验科650011)
摘要:目的从U266多发性骨髓瘤细胞株中分离CD138阴性细胞,对其进行培养,观察分离到的CD138阴性细胞的生长特性。方法用免疫磁珠法分离U266多发性骨髓瘤细胞株中的CD138阴性细胞,用干细胞培养基进行培养。结果从U266多发性骨髓瘤细胞株中分离CD138阴性细胞在干细胞培养基内呈球体生长。结论CD138阴性细胞具有干细胞生长的相关特征。
关键词:多发性骨髓瘤;CD138;肿瘤干细胞
多发性骨髓瘤(MM)是一种主要发生于中老年人群的恶性浆细胞肿瘤,在欧美国家血液肿瘤中的占比达10%。近年来,随着我国进入老龄化社会,MM的发病率已呈明显上升趋势[1]。目前MM治疗措施已有大的进步。可同时针对MM细胞本身和其所处微环境进行大剂量化疗治疗,这些大剂量化疗联合应用自体造血干细胞移植和(或)异体造血干细胞移植,使得部分患者可获得完全缓解(CR),但这些患者多数会出现复发。其复发的主要原因之一是存在于微量残留病灶(MRD),即在患者的体内可能存在极少量能够诱导肿瘤复发的“种子细胞”或者说“肿瘤干细胞”[2]。2012年Kawano等[3]发现,复发、进展中的MM患者与未治疗的MM患者比较,CD138阴性B细胞比例有着显著增加。通过实验研究也发现CD138阴性B细胞增多和MM患者的不良预后、细胞表型的更幼稚,以及对雷利度胺和治疗表现为低敏感,这些特征都证明CD138阴性B细胞可能是MM 肿瘤干细胞。
1材料与方法
1.1材料人MM细胞U266购自中国科学院昆明动物研究所。
1.2仪器与试剂改良型RPMI-1640培养基购自Gibco公司;RNAiso Plus购自TaKaRa公司;CDNA逆转录试剂盒购自广州复能基因有限公司;LONZA X-VIVO无血清培养基购自LONZA公司;rhIL-3、SCF和LIF购自PeproTech公司;PE-CD138抗体购自贝克曼公司;MicroBead CD138抗体购自德国美天旎公司。
1.3方法U266MM细胞株中CD138阴性细胞的分选和培养。首先对U266细胞进行预处理,使用MicroBead CD138抗体和U266细胞进行孵育,然后用分离系统分离获取CD138阴性细胞,最后用干细胞培养基和干细胞培养6孔板进行培养。5 d进行1次传代,2次传代后在进行1次免疫磁珠分离,培养5 d后观察细胞生长的特征、流式细胞CD138阴性细胞纯度的鉴定及传代培养。干细胞培养基配制:由无血清LONZA X-VIVO培养基按比例加入20 ng/mL人类重组白细胞介素3(rhIL-3)、50 ng/mL白血病抑制因子(LIF)、20 ng/mL干细胞因子(SCF)。
2结果
2.1U266 MM细胞株中CD138阴性细胞分选与纯度分析第1次磁珠法分选收集到CD138阴性细胞悬液,用PE-CD138荧光抗体染色,进行流式细胞技术纯度分析,其中CD138阴性细胞数仅占41.4%。由于第1次分选到的细胞中CD138阴性细胞占比较低,不能满足分析需求,因此对第1次分选收集到细胞进行培养后在进行第2次磁珠分选和第2次流式细胞技术纯度分析。第2次磁珠分选后得到的CD138阴性细胞纯度为71.6%,见图1。
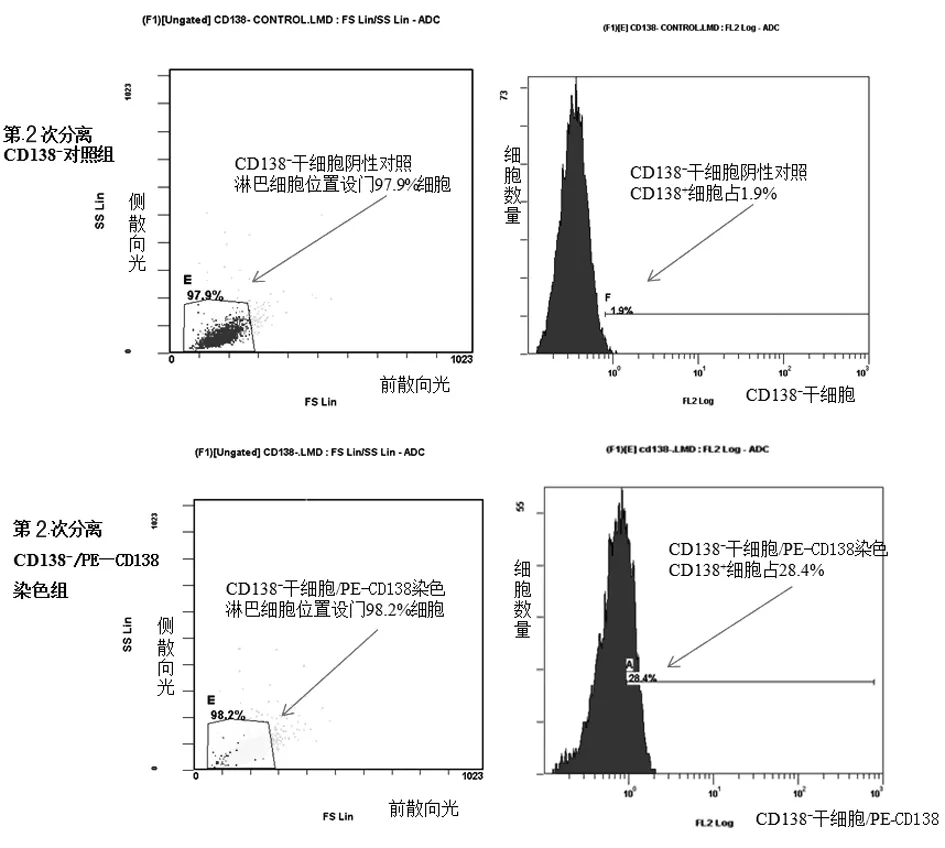
图1 第2次磁珠分选CD138阴性细胞结果
2.2CD138阴性细胞在干细胞培养液中的生长情况CD138阴性细胞在干细胞培养液中呈漂浮立体球状生长,球体巨大,细胞之间结合紧密,其生长情况见图2(低倍镜)。

图2 CD138阴性细胞在干细胞培养液中的生长情况(10×)
3讨论
2004年Matsui 证实MM肿瘤样本和细胞系中存在克隆性极强的CD19+CD138-肿瘤干细胞[4],而源自MM细胞系和临床患者骨髓标本中的CD138-CD34-细胞也被认为是MM干细胞[5]。而肿瘤干细胞是肿瘤细胞增殖、化疗耐药、转移及复发的重要因素,更是治疗的一个关键靶点[6]。
目前肿瘤干细胞研究的首要问题就是分离与鉴定。目前,肿瘤干细胞常用的分离方法有无血清悬浮细胞培养法[7]、侧群细胞法[8]、流式细胞分选法[9]和免疫磁珠分选法[10]。无血清悬浮培养法是人为地制造一富集肿瘤干细胞的培养环境,与肿瘤干细胞实际生长的体内微环境不尽相同,目前有争议;侧群细胞法荧光染料本身具有细胞毒性,被标记分选出的细胞活性有可能受到影响,从而影响实验效果和准确性;流式细胞分选法应用广泛,但耗时较长,分选的细胞活性可能受损影响功能;免疫磁珠法免疫磁珠特异性高,适合分选单个阳性表达的细胞,且分选的细胞纯度及细胞活力均较高,并且可以短时间内反复大量获取所需要的干细胞。本试验经过2次磁珠分选后CD138阴性细胞地纯度才达到71.6%。因为分选的CD138阴性细胞属非阳性细胞,在分选过程中,附着在LD柱上的CD138阳性细胞可因多种因素进入到CD138阴性细胞中,导致CD138阴性细胞的纯度下降:(1)细胞因素,离心的细胞未用胰酶消化,细胞成团,细胞团中心的细胞与免疫磁珠上的CD138抗体未充分接触;细胞计数误差大远低于实际细胞数,导致免疫磁珠CD138抗体用量不足;(2)免疫磁珠CD138因素,主要见于免疫磁珠的抗体效价下降,导致免疫磁珠CD138用量不足;(3)操作者因素,一次性在柱上加入大于说明书规定的buffer用量,将CD138阳性细胞带入CD138阴性细胞中;(4)细胞自身因素,细胞活性下降,CD138阴性细胞含量很少等原因。因此欲获取纯度较高的CD138阴性细胞,一般都要经过2次或多次分选才可能获得较高纯度。
在对CD138阴性细胞培养中,选择2种刺激造血干细胞的细胞因子,rhIL-3和SCF刺激其生长。同时添加LIF抑制CD138阴性细胞向下分化,维持其多能性。另外选择含有IMDM、胰岛素、转铁蛋白和人血清清蛋白无血清淋巴细胞培养基作为基础培养液添加生长因子联合配成干细胞培养基。
用干细胞培养液对CD138阴性细胞培养5~7 d培养形成漂浮状的球体细胞,通常干细胞生长的球体形状可作为干细胞鉴定的一个依据,但是该方法仍有其自身的不足[11]:肿瘤球仍然是个混合细胞群体,它仅代表一小部分的肿瘤起源细胞,其潜在的异质性通过肿瘤球筛选可能被丢失。另外,这些肿瘤球传代要进行大量扩增,而在扩增的过程中可能诱导细胞生物学和基因表达的改变,需要强有力的证据来鉴定细胞表面抗原。因此可选择少量干细胞胚胎标记物来对肿瘤球进行鉴定,同时也可用TSC基于SP细胞特性、肿瘤细胞体外形成克隆能力、动物致瘤性试验等来对肿瘤球进行鉴定。目前已有资料表明MM中CD138阴性细胞表达胚胎干细胞标志SOX2[12]。本试验由于经费非常紧张,未进行相关的试验进行CD138阴性球体细胞的验证,为本试验的一个缺陷。
参考文献
[1]Rajkumar SV.Multiple myeloma:2011 update on diagnosis,risk-stratification,and management[J].Am J Hematol,2012,87(5):511-519.
[2]Bomken S,Fiser K,Heidenreich O,et al.Understanding the cancer stem cell[J].Br J Cancer,2010,103(4):439-445.
[3]Kawano Y,Fujiwara S,Wada N,et al.Multiple myeloma cells expressing low levels of CD138 have an immature phenotype and reduced sensitivity to lenalidomide[J].Int J Oncol,2012,41(3):876-884.
[4]Matsui W,Huff CA,Wang Q,et al.Characterization of clonogenic multiple myeloma cells[J].Blood,2004,103(6):2332-2336.
[5]Yang C,Wang J,Chen D,et al.Paclitaxel-Fe3O4nanoparticles inhibit growth of CD138-D34-tumor stem-like cells in multiple myeloma-bearing mice[J].Int J Nanomedicine,2013,8(10):1439-1449.
[6]Xia J,Chen C,Chen Z,et al.Targeting pancreatic cancer stem cells for cancer therapy[J].Biochim Biophys Acta,2012,1826(2):385-399.
[7]Garcia-Gomez I,Elvira G,Zapata AG,et al.Mesenchymal stem cells:biological properties and clinical applications[J].Expert Opin Biol Ther,2010,10(10):1453-1468.
[8]Hirschmann-Jax C,Foster AE,Wulf GG,et al.A distinct “side population” of cells with high drug efflux capacity in human tumor cells[J].Proc Natl Acad Sci USA,2004,101(39):14228-14233.
[9]Prince ME,Sivanandan R,Kaczorowski A,et al.Identification of a subpopulation of cells with cancer stem cell properties in head and neck squamous cell carcinoma[J].Proc Natl Acad Sci USA,2007,104(3):973-978.
[10]Richardson GD,Robson CN,Lang SH,et al.CD133,a novel marker for human prostatic epithelial stem cells[J].J Cell Sci,2004,117(Pt 16):3539-3545.
[11]窦骏.肿瘤干细胞[M].南京:东南大学出版社,2009:231.
[12]李雅婷,窦骏,文萍,等.小鼠骨髓瘤中肿瘤干细胞的初步分析[J].微生物学免疫学进展,2008,36(4):31-35.
DOI:10.3969/j.issn.1673-4130.2016.14.041
文献标识码:A
文章编号:1673-4130(2016)14-1999-03
(收稿日期:2016-01-28修回日期:2016-03-29)
