布比卡因增强α1受体介导大鼠胸主动脉收缩反应中血管内皮的作用
2016-08-10张贺飞许文琪都倩赵静夏红月任雷鸣
张贺飞,许文琪,都倩,赵静,夏红月,任雷鸣
(河北医科大学中西医结合学院药理学教研室,河北 石家庄 050017)
布比卡因增强α1受体介导大鼠胸主动脉收缩反应中血管内皮的作用
张贺飞,许文琪,都倩,赵静,夏红月,任雷鸣
(河北医科大学中西医结合学院药理学教研室,河北 石家庄050017)
目的分析血管内皮在布比卡因(bupivacaine,BUP)增强苯肾上腺素(phenylephrine,Phe)诱发血管收缩反应中的作用。方法制备大鼠离体胸主动脉血管环,采用机械损伤或工具药干扰血管内皮的舒张功能。记录Phe作为α1受体激动剂诱发的动脉收缩反应。结果BUP(30 μmol·L-1)与内皮完整血管标本孵育20 min后,Phe诱发的血管收缩Emax值为(2.50±0.05) g,明显高于对照组标本的Emax值[(2.22±0.07) g,P<0.01]。孵育时间缩短至5、10或15 min时,BUP无此增强效应。在内皮损伤动脉标本,同浓度BUP孵育20 min时,轻度但明显抑制低浓度Phe诱发的血管收缩反应(P<0.05)。在吲哚美辛、ChTX、apamin和L-NAME预处理的内皮完整血管标本上,ACh诱发的血管舒张反应消失;此时BUP(30 μmol·L-1孵育20 min)对Phe诱发的血管收缩反应无明显影响(P>0.05)。结论在大鼠离体胸主动脉,BUP对α1受体介导收缩的增强作用与其抑制血管内皮的舒张功能密切相关,这种抑制作用间接导致Phe诱发的血管收缩反应明显增强。
布比卡因;苯肾上腺素;胸主动脉;血管收缩;内皮;大鼠
布比卡因(bupivacaine,BUP)属酰胺类长效局麻药,也是临床最常用的局麻药之一。与其他局麻药相比,BUP的治疗浓度与其心血管毒性浓度或中枢神经毒性浓度之间的浓度差较小,临床应用时易发生毒性反应[1-2]。误入静脉或从用药局部吸收过多是BUP诱发毒性反应的主要原因。最近,我们发现大鼠离体胸主动脉暴露于临床浓度的BUP后,α1受体介导的收缩反应随BUP的暴露时间不同而出现截然相反的两种效应,即短时程暴露于BUP后,α1受体激动剂苯肾上腺素(phenylephrine,Phe)诱发大鼠胸主动脉收缩反应的Emax值明显增大;长时程暴露后,收缩反应的Emax值明显减小[3]。此外,我们还发现BUP对血管内皮细胞介导的血管舒张反应具有抑制作用[3]。众所周知,从血管内皮细胞的角度,可将大鼠离体血管舒张反应分为血管内皮依耐性舒张反应和非血管内皮依耐性舒张反应。内皮依耐性血管舒张反应主要与胸主动脉血管产生内皮源性舒张因子NO和前列腺素类物质有关[4-6];而非内皮依耐性舒张主要与药物直接作用于血管平滑肌细胞有关,这些药物可抑制平滑肌细胞的钙离子内流,由此引起血管舒张[7]。
BUP增强α1受体介导血管收缩反应的作用机制尚不清楚。我们推测BUP对大鼠胸主动脉内皮细胞的抑制作用可能参与了BUP短时程暴露诱发的动脉收缩增强。为此,我们采用内皮完整或内皮损伤的大鼠离体胸主动脉环,观察BUP增强α1受体介导血管收缩反应的变化;同时借助药理学工具药,分析血管内皮舒血管因子(NO、PGI2等)在BUP增强α1受体介导血管收缩反应中的作用。
1 实验材料
1.1仪器、药品、动物PowerLab8/35型数据采集系统,AD Instrument Pty Ltd;MLT0380/D型张力换能器,AD Instrument Pty Ltd;7146型纯水仪,Thermo公司;CP213型电子天平,Ohaus Corporation公司;SC-15型数控超级恒温槽,宁波天恒仪器厂;LGY-2型冷光源,大悦维佳(北京)科技有限公司;50 μL微量进样器,上海安亭仪器厂。
布比卡因(bupivacaine,BUP)、苯肾上腺素(phenylephrine,Phe)、乙酰胆碱(acetylcholine,ACh)、吲哚美辛(indomethacin,Indo)、葡萄糖、氯化钙(CaCl2)、氯化钠(NaCl)、氯化钾(KCl)、硫酸镁(MgSO4)、碳酸氢钠(NaHCO3)、磷酸二氢钠(NaH2PO4)购于美国Sigma公司。蜂毒明肽(apamin)、卡律蝎毒素(charybdotoxin,ChTX)购自美国Enzo life sciences公司。N-硝基-L-精氨酸甲酯(L-NG-nitroarg- inine methyl ester,L-NAME)购自日本东京化成工业株式会社。
Wistar大鼠,清洁级,♂,体质量300~350 g,由河北省实验动物中心提供,饲料亦由该中心提供。大鼠饲养于室温:(23±1)℃,相对湿度:(50±5)%,明暗各12 h(光照时间8 ∶00~20 ∶00)的动物饲养室内。自由饮食、饮水。大鼠在该环境下适应性饲养3 d,并于实验前12 h禁食。
2 方法
2.1营养液的配制改良K-H(Krebs-Henseleit)液的成份为(mmol·L-1):NaCl 133、KCl 4.7、MgSO40.61、NaH2PO41.35、CaCl22.52、NaHCO316.3、glucose 7.8[8]。除NaHCO3、CaCl2和葡萄糖于实验前临时加入外,其他成份均配成高浓度母液。实验当日,取适量的各母液,加入超纯水,稀释至所需浓度。配制好的营养液用盐酸调pH至7.2~7.4,以95% O2和5% CO2的混合气体充分预饱和后备用。
2.2标本的制备以乌拉坦(1.5 g·kg-1)皮下注射麻醉大鼠后,经股动脉放血处死。沿胸骨长轴打开胸腔后,迅速取出胸主动脉置于5%CO2+95%O2混合气体预先饱和的4℃改良K-H液中,漂洗干净,仔细分离血管周围脂肪和结缔组织。制备去内皮血管环时,以表面粗糙的聚乙烯插管(外径略小于血管内径)小心摩擦血管内腔去除内皮[9]。截取4 mm宽的血管环,于血管环的管腔中平行穿入两个钨丝环,将标本置于含有10 mL改良K-H液的浴槽中。动脉环的一侧借助钨丝环将标本固定于不锈钢支架的下端,另一侧借助钨丝环经丝线连接于张力换能器,血管的张力信号通过张力换能器记录于数据采集系统。血管环的前负荷3g,并于改良K-H液(37±0.2) ℃中平衡1 h。平衡期间,持续通以5%CO2+95%O2混合气体,每15 min换1次营养液。平衡1 h后开始实验。
2.3实验设计实验中的每个血管标本均观察首轮Phe(0.0001~30 μmol·L-1)诱发的累积浓度-收缩反应曲线,以判定标本反应性;待最大张力稳定后,进一步观察ACh(10 μmol·L-1)诱发血管舒张反应。ACh诱发的舒张反应大于80%作为内皮完整血管的指标,ACh诱发的舒张反应小于20%则作为去除内皮血管的指标[3, 9]。之后,反复冲洗标本并休息45 min,待标本张力恢复到基础水平后,根据实验目的进行如下实验(特殊之处另行说明)。
2.3.1BUP对内皮完整和内皮损伤血管Phe诱发大鼠胸主动脉收缩反应的影响将内皮完整血管标本分为2组,包括BUP组以及对照组(各组标本数为n=12)。BUP组标本与30 μmol·L-1的BUP孵育20 min后,建立第2轮Phe(0.0001~30 μmol·L-1)诱发的血管收缩反应曲线;对照组标本以同体积的蒸馏水代替BUP。内皮损伤血管标本亦分为2组,各组的标本数为n=11;其他实验操作同内皮完整血管。
2.3.2BUP不同孵育时间对于Phe诱发大鼠胸主动脉收缩反应的影响将内皮完整血管标本分为4组,每组的标本数为n=10。除对照组外,其他3组标本与30 μmol·L-1的BUP分别孵育5 min、10 min或15 min后,立即给予最高浓度的Phe(10 μmol·L-1),记录血管收缩反应。对照组标本与蒸馏水孵育15 min后,同法给予Phe。
2.3.3内皮舒血管因子抑制剂对BUP增强Phe诱发大鼠胸主动脉收缩的影响将内皮完整血管标本分为BUP组以及对照组,各组的标本数为n=7。在观察首轮Phe诱发的浓度-效应收缩反应之前,所有标本均首先以1 μmol·L-1浓度Phe预收缩血管,并观察ACh(10 μmol·L-1)诱发的血管舒张反应;反复冲洗标本后,在第2次以1 μmol·L-1浓度Phe预收缩血管前20 min, 将Indo(10 μmol·L-1)、ChTX(0.05 μmol·L-1)、apamin(1 μmol·L-1)和L-NAME(100 μmol·L-1)加入浴槽,并再次观察同浓度ACh诱发的舒张反应。反复冲洗该标本后,BUP组标本与上述4个抑制剂共同孵育20 min后,建立首轮Phe(0.0001~30 μmol·L-1)诱发的血管收缩反应曲线;反复冲洗标本后,BUP组标本与30 μmol·L-1的BUP及上述4个阻断剂共同孵育20 min后,建立第二轮Phe(0.0001~30 μmol·L-1)诱发的血管收缩反应曲线。对照组标本以同体积的蒸馏水代替BUP,其他实验步骤同BUP组血管。
3 结果
3.1BUP对内皮完整血管Phe诱发收缩反应的影响标本在给予BUP前,BUP组与对照组Phe(0.0001~30 μmol·L-1)诱发血管收缩的Emax值分别为(2.19±0.07) g和(2.19±0.05) g,二者无统计学差异(P>0.05,Fig 1A)。30 μmol·L-1浓度BUP孵育20 min后,Phe诱导的血管收缩的Emax值为(2.50±0.05) g,明显高于对照组的Emax值(2.22±0.07) g(P<0.01,Fig 1B)。无论BUP给药前或给药后,Phe诱发血管收缩的-LogEC50(mol·L-1)值,组间比较未见明显差异(P>0.05,数据略)。

Fig 1 Vasoconstrictive responses to phenylephrine in isolated endothelium-intact rat aorta before (A) and after (B) a 20 min incubation with bupivacaine (30 μmol·L-1).
*P<0.05vscontrol.
3.2BUP对内皮损伤血管Phe诱发收缩反应的影响标本在给予BUP前,BUP组与对照组Phe(0.0001~30 μmol·L-1)诱发血管收缩的Emax值分别为(2.87±0.08) g和(2.82±0.11) g,-LogEC50(mol·L-1)值分别为7.96±0.11和8.10±0.18,两组间比较差异未见显著性(P>0.05,Fig 2A)。30 μmol·L-1浓度BUP孵育20 min后,Phe诱导的血管收缩的Emax值,组间比较未见差异(P>0.05,数据略,Fig 2B)。但是,BUP处理组Phe诱导的血管收缩量效曲线右移,其-LogEC50(mol·L-1)值(7.21±0.05)明显小于对照组(7.67±0.01)(P<0.01,Fig 2B)。
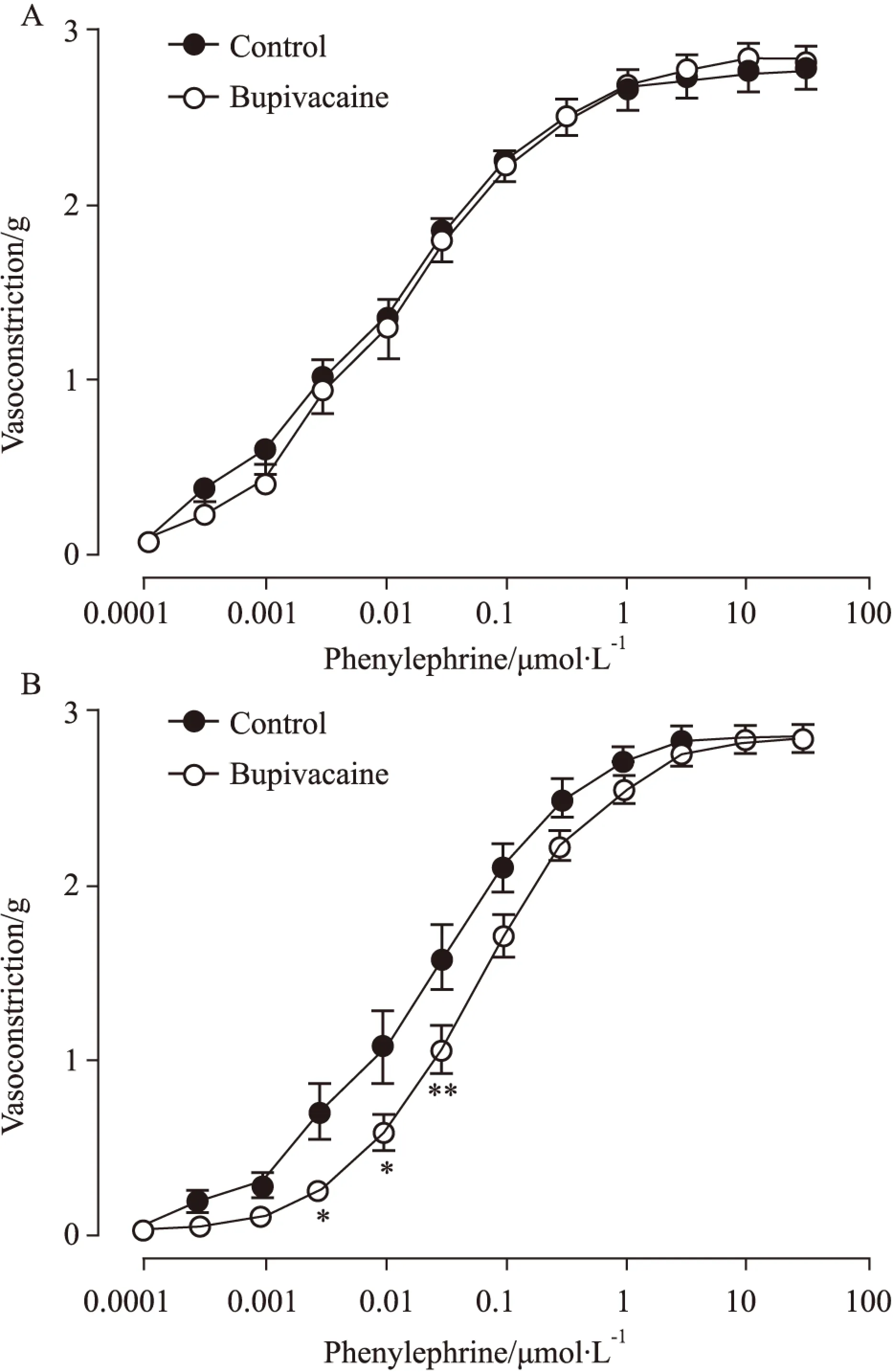
Fig 2 Vasoconstrictive responses to phenylephrine in isolated endothelium-denuded rat aorta before (A) and after (B) a 20 min incubation with bupivacaine (30 μmol·L-1).).
*P<0.05,**P<0.01vscontrol.
3.3BUP不同孵育时间对Phe诱发血管收缩反应的影响标本在给予BUP前,BUP组(3个亚组)与对照组Phe(0.0001~30 μmol·L-1)诱发血管收缩反应相比,Phe诱发的第1轮收缩反应曲线差异未见显著性(P>0.05,Fig 3A)。BUP各组标本给予30 μmol·L-1浓度BUP分别孵育5min、10min、15min后,单浓度Phe(10 μmol·L-1)诱发的收缩反应,与对照组相比,差异亦无统计学意义(P>0.05,Fig 3B)。3.4内皮舒血管因子抑制剂对BUP增强Phe诱发血管收缩反应的影响首次以1 μmol·L-1浓度Phe预收缩BUP组以及对照组血管标本时,将两组的收缩幅度作组间比较,未见统计学差异(P>0.05,Fig 4A);第2次以1 μmol·L-1浓度Phe预收缩标本时,BUP组以及对照组血管的收缩幅度,组间比较时差异仍无统计学意义(P>0.05,Fig 4A),但是4个抑制剂可使1 μmol·L-1浓度Phe的预收缩明显增强,即第2次预收缩明显强于第1次(P<0.01,Fig 4A)。4个抑制剂尚可使ACh诱发的血管舒张反应几乎全部消失(Fig 4B)。标本在给予BUP前,BUP组与对照组Phe(0.0001~30 μmol·L-1)诱发血管收缩的Emax值分别为(2.69±0.06) g和(2.76±0.10) g,-LogEC50(mol·L-1)值分别为7.02±0.06和7.00±0.09,两组间比较差异未见显著性(P>0.05,Fig 5A)。标本给予BUP后,第2轮Phe(0.0001~30 μmol·L-1)诱发的血管收缩反应,与对照组标本相比差异亦未见显著性(P>0.05,Fig 5B)。

Fig 3 Vasoconstrictive responses to phenylephrine in isolated endothelium-intact rat aorta before (A) and after (B) 5, 10 and
4 讨论
血管内皮细胞具有分泌血管舒张因子的功能,在调节血管张力和血压调控方面发挥重要作用。内皮依赖性血管舒张因子主要由NO、PGI2以及内皮衍生超极化因子(endothelium derived hyperpolarizing factor,EDHF)组成[10-13]。EDHF介导的血管舒张反应与平滑肌细胞膜上的钙激活钾通道开放有关,该通道包括小电导钙激活钾通道 (SKca)、中电导钙激活钾通道(IKca)和大电导钙激活钾通道(BKca)。据文献报道,ChTX阻断EDHF途径中的BKca和IKca通道,apamin则阻断EDHF途径中的SKca通道;此外Indo和L-NAME分别阻断PGI2和NO合成;联合应用这4种工具药可以完全取消ACh诱发的动物离体胸主动脉内皮依赖性血管舒张反应[14-16]。

Fig 4 Vasoconstrictive responses (A) to phenylephrine (1 μmol·L-1) and vasodilator responses (B) to acetylcholine (10 μmol·L-1) in isolated endothelium-intact rat aorta before (First) and after (Second) treatment with indomethacin (10 μmol·L-1), ChTX (0.05 μmol·L-1), apamin
P>0.05vscontrol
本研究中,我们分别采用机械损伤和药物抑制两种方法,分析血管内皮在BUP增强Phe诱发大鼠离体胸主动脉收缩反应中的作用。在内皮完整血管标本,我们重现了BUP孵育20 min后明显增强Phe诱发血管收缩反应这一现象(Fig 1B)。然而BUP孵育时间短于20 min时,不能发挥增强效应。在内皮损伤的血管标本上,不仅没有观察到BUP对Phe诱发血管收缩的增强作用;相反,我们发现BUP孵育20 min后,使Phe诱发的浓度-收缩曲线右移,特别是BUP对低浓度Phe的收缩反应具有较强的抑制作用,高浓度Phe收缩反应未受明显影响(Fig 2B)。本研究中,联合应用4种工具药[17-18]完全取消了ACh诱发的内皮依赖性舒张反应,亦使1 μmol·L-1浓度Phe诱发的血管收缩反应明显增强(Fig 4A)。联合应用4种工具药抑制血管内皮细胞的舒张功能后,BUP增强Phe诱发血管收缩反应这一现象消失(Fig 5B)。综合分析上述研究结果,我们认为BUP增强Phe诱发血管收缩的效应与BUP抑制内皮细胞的舒张功能密切相关,该抑制作用具有一定的时间依赖性。

Fig 5 Vasoconstrictive responses to phenylephrine in isolated endothelium-intact rat aorta pretreated with indomethacin (10 μmol·L-1), ChTX (0.05 μmol·L-1), apamin
在机械损伤血管内皮细胞实验与联合应用4种工具药实验中,BUP影响Phe诱发血管收缩的实验结果略有差异。我们推测BUP对血管平滑肌细胞α1受体介导的血管收缩反应,可能仅仅具有抑制作用,并无直接的增强效应。由于机械操作损伤了血管内皮的屏障作用,使得BUP更容易直接作用于血管平滑肌,导致较低浓度Phe诱发的血管收缩更容易被抑制。相反,在联合应用4种工具药实验中,由于血管内皮的屏障作用没有受到损害,30 μmol·L-1的BUP孵育20 min尚难以发挥抑制作用。在内皮完整的大鼠胸主动脉标本上,BUP如若发挥抑制Phe诱发收缩的作用,尚需更高浓度或更长的孵育时间[3]。总之,我们的研究结果证实,在大鼠离体胸主动脉,BUP对α1受体介导收缩的增强作用与其抑制血管内皮的舒张功能密切相关,这种抑制作用间接导致Phe诱发的血管收缩反应明显增强。
(致谢:本研究的所有工作均在河北医科大学中西医结合学院的中西医结合研究所进行。任雷鸣教授设计并指导实验研究,张贺飞、许文琪、都倩、赵静及2014级中西医临床专业夏红月完成实验,任雷鸣、张贺飞、夏红月书写论文。)
[1]Shah S, Gopalakrishnan S, Apuya J, et al. Use of intralipid in an infant with impending cardiovascular collapse due to local anesthetic toxicity[J].JAnesth, 2009, 23(3):439-41.
[2]Hahnenkamp K, Nollet J, Strümper D, et al. Bupivacaine inhibits thromboxane A2-inducedvasoconstriction in rat thoracic aorta [J].AnesthAnalg, 2004, 99(1): 97-102.
[3]Guo H, Zhang H F, Xu W Q, et al. Differential effects of short-term and long-term bupivacaine treatment on α1-adrenoceptor-mediated contraction of isolated rat aorta rings and the reversal effect of lipid emulsion [J].ActPharmacolSin, 2015, 36(8): 976-86.
[4]薛莱, 吴阳, 黄波, 等. GW0742对高糖损伤大鼠胸主动脉内皮的保护作用 [J]. 中国药理学通报, 2015, 31(12): 1675-81.
[4]Xue L, Wu Y,Huang B,et al. Effect of GW0742 on endothelial dysfunction induced by high glucose in isolated rat thoracic aorta [J].ChinPharmacolBull, 2015, 31(12): 1675-81.
[5]蒋昀, 夏强. 邻苯二甲酸二丁酯的收缩血管作用及其机制 [J]. 中国药理学通报, 2014, 30(2): 199-202.
[5]Jiang Y, Xia Q. Vasoconstriction effect of di-n-butyl phthalate and its underlying mechanism [J].ChinPharmacolBull, 2014, 30(2): 199-202.
[6]王政, 蒋嘉烨, 可燕, 等. 三七花总皂苷对大鼠离体胸主动脉的舒张作用及其机制 [J]. 中国药理学通报, 2014, 30(7): 956-60.
[6]Wang Z, Jiang J Y, Ke Y, et al. Vasodilatory effects of flower of Panax notoginseng saponins on rat aorta [J].ChinPharmacolBull, 2014, 30(7): 956-60.
[7]Rhyu M R, Kim E Y, Yoon B K, et al. Aqueous extract of Schizandra chinensis fruit causes endothelium-dependent and -independent relaxation of isolated rat thoracic aorta [J].Phytomedicine, 2006, 13(9-10): 651-7.
[8]高玲娜, 李同荟, 赵静, 等. 多沙唑嗪对映体对大鼠肠系膜微动脉α1受体介导收缩反应的作用 [J]. 中国药理学通报, 2014, 30(10): 1430-6.
[8]Gao L N, Li T H, Zhao J, et al. Effects of doxazosin and its enantiomers on the vasoconstriction of rat isolated mesenteric arterioles via α1-adrenoceptor [J].ChinPharmacolBull, 2014, 30(10): 1430-6.
[9]Li L, Wu T, Wei C, et al. Exhaustive swimming differentially inhibits P2X1 receptor- and α1-adrenoceptor-mediated vasoconstriction in isolated rat arteries [J].ActPharmacolSin, 2012, 33(8): 221-9.
[10] Moncada S, Gryglewski R, Bunting S, et al. An enzyme isolated from arteries transforms prostaglandin endoperoxides to an unstable substance that inhibits platelet aggregation [J].Nature, 1976, 263(5579): 663-5.
[11] Furchgott R F, Zawadzki J V. The obligatory role of endothelial cells in the relaxation of arterial smooth muscle by acetylcholine [J].Nature, 1980, 288(5789): 373-6.
[12] Palmer R M, Ashton D S, Moncada S. Vascular endothelial cells synthesize nitric oxide from L-arginine [J].Nature, 1988, 333(6174): 664-6.
[13] Busse R, Edwards G, Feletou M, et al. EDHF: bringing the concepts together [J].TrendsPharmacolSci, 2002, 23(8): 374-80.
[14] Li J, Cao Y X, Liu H, et al. Enhanced G-protein coupled receptors-mediated contraction and reduced endothelium-dependent relaxation in hypertension [J].EurJPharmacol, 2007, 557(s 2-3): 186-94.
[15] Li J, Cao Y X, Cao L, et al. Heat stress alters G-protein coupled receptor-mediated function and endothelium-dependent relaxation in rat mesenteric artery [J].EurJPharmacol, 2008, 588(2-3): 280-5.
[16] 陈根, 秦旭平, 林杰, 等. 弱氧化低密度脂蛋白对小鼠肠系膜动脉内皮依赖性舒张功能的影响及机制 [J]. 药学学报, 2013, 48(11): 1657-64.
[16] Chen G, Qin X P, Lin J, et al. Minimally modified LDL induced impairment of endothelium-dependent relaxation in mesenteric arteries of mice [J].ActaPharmSin, 2013, 48(11): 1657-64.
[17] 洪锐,孙圆圆,金景玉,等. 2,3-吲哚醌对大鼠离体胸主动脉舒缩功能的影响 [J]. 中国药理学通报, 2014, 30(8): 1179-80.
[17] Hong R, Sun Y Y, Jin J Y, et al. Effect of isatin on contraction and relaxation function of isolated rat thoracic aorta [J].ChinPharmacolBull, 2014, 30(8): 1179-80.
[18] 阎雨,王夙博,袁天栩,等. Rho激酶抑制剂DL0805-0对大鼠离体胸主动脉的舒张作用及机制研究 [J]. 中国药理学通报, 2014, 30(4): 473-7.
[18] Yan Y, Wang S B, Yuan T Y, et al. Vasorelaxant effect of Rho kinase inhibitor DL0805-0 on isolated rat aortic rings and its underlying mechanisms [J].ChinPharmacolBull, 2014, 30(4): 473-7.
Role of endothelium in enhancement of α1-adrenoceptor-mediated vasoconstriction by bupivacaine in isolated rat aorta
ZHANG He-fei,XU Wen-qi,DU Qian,ZHAO Jing,XIA Hong-yue,REN Lei-ming
(DepartmentofPharmacology,CollegeofChineseIntegrativeMedicine,HebeiMedicalUniversity,Shijiazhuang050017,China)
AimTo investigate the role of endothelium in the enhancement of phenylephrine-mediated vasoconstriction by bupivacaine in the isolated rat aorta. MethodsThe isolated rat aortic rings were prepared, and the vascular endothelium was removed chemically or physically. Phenylephrine-mediated vasoconstriction was recorded. ResultsA pretreatment with bupivacaine at 30 μmol·L-1for 20 min significantly increased the Emax value of vasoconstrictive responses to phenylephrine from 2.22±0.07 g of solvent-controlled group to 2.50±0.05 g (P<0.01) in the isolated endothelium-intact rat aorta. However, the Emax value was not significantly changed by a pretreatment with bupivacaine at 30 μmol·L-1for 5, 10 or 15 min (P>0.05). A pretreatment with bupivacaine at 30 μmol·L-1for 20 min slightly but significantly inhibited the vasoconstrictive responses to low concentration of phenylephrine in the isolated endothelium-denuded rat aorta (P<0.05). In the isolated endothelium-intact rat aorta under a combined treatment with indometacin, ChTX, apamin and L-NAME, the vasodilator responses to acetylcholine were completely suppressed, and a pretreatment with bupivacaine at 30 μmol·L-1for 20 min did not significantly affect the vasoconstrictive responses to phenylephrine (P>0.05). ConclusionBupivacaine enhances α1-adrenoceptor-mediated vasoconstriction by inhibiting vascular endothelium in the isolated endothelium-intact rat aorta, Which potentiates indirectly the vasoconstrictive responses to phenylephrine.
bupivacaine; phenylephrine; aorta; vasoconstriction; endothelium; rat
2016-01-09,
2016-04-08
国家重点基础研究发展计划(973计划)资助项目(No 2012CB518601);河北省自然科学基金资助项目(No p016206030,p014206367)
张贺飞 (1991-),男,硕士生,研究方向:心血管药理学,E-mail: 549193649@qq.com;任雷鸣 (1956-),男,教授,研究方向:心血管及自主神经药理学,通讯作者,Tel:0311-86266722, E-mail: ren-leiming@263.net
10.3969/j.issn.1001-1978.2016.07.015
A
1001-1978(2016)07-0960-06
R-332;R322.121;R331.32;R392.11;R971.2
网络出版时间:2016-6-20 11:49网络出版地址:http://www.cnki.net/kcms/detail/34.1086.R.20160620.1149.030.html