宫内缺氧对子代大鼠血浆及肝脏RAS的影响
2016-08-10茅彩萍仲婷婷张象威
茅彩萍,仲婷婷,陈 楠,姜 珊,张象威,曹 莉,
(1. 苏州大学药学院药理学教研室,江苏 苏州 215123;2. 苏州大学附属第一医院胎儿医学研究所、生殖医学中心,江苏 苏州 215006)
宫内缺氧对子代大鼠血浆及肝脏RAS的影响
茅彩萍2,仲婷婷1,陈楠1,姜珊2,张象威1,曹莉1,2
(1. 苏州大学药学院药理学教研室,江苏 苏州215123;2. 苏州大学附属第一医院胎儿医学研究所、生殖医学中心,江苏 苏州215006)
目的研究宫内缺氧(PH)对子代大鼠血液循环系统和肝脏局部肾素-血管紧张素系统(RAS)的影响,以探讨PH导致子代脂肪肝易感性增加的可能机制,寻找药物干预靶点。方法利用饲养舱饲养建立妊娠期宫内缺氧大鼠模型,分别称量孕21 d胎鼠、成年子代大鼠(5月龄)、成年子代大鼠缺氧应激(7 d)后的体重、肝重,并计算肝重指数,检测大鼠血浆及肝脏中AngⅠ、AngⅡ和ACE的含量。结果与正常组相比,PH组胎鼠体重、肝脏重量及肝重指数明显下降,成年后各组这些差别消失;但给予7 d缺氧应激后,PH成年子代大鼠肝重及肝重指数较正常成年子代明显升高。胎鼠两组间和成年子代大鼠两组间血浆及肝脏中AngⅠ和ACE含量均无显著差异;PH成年子代肝脏中AngⅡ含量明显高于正常子代。经过7 d缺氧应激后,大鼠肝脏中的AngⅠ含量和血浆及肝脏中AngⅡ含量均较未缺氧应激组明显升高;宫内缺氧成年子代大鼠肝脏中ACE含量和血浆及肝脏中AngⅡ含量升高幅度均明显大于正常成年子代组。结论PH可引起子代胎儿期及成年后肝脏局部RAS组份含量增高,使得其子代成年后RAS在缺氧刺激后更易被激活,这可能是PH导致子代脂肪肝易感性增加的机制之一。
宫内缺氧;子代;肾素-血管紧张素系统;肝脏;胎儿;血浆
大量研究表明胎儿宫内缺氧(prenatal hypoxia,PH)不仅会引起胎儿宫内生长受限,还会造成胎儿重要组织器官的发育不良,以及成年后的代谢异常[1]。我们以往的研究也表明:PH可引起子代成年后胰岛素敏感性降低和肝脏胰岛素信号通路异常,导致子代大鼠成年后非酒精性脂肪肝(nonalcoholic fatty liver disease,NAFLD)易感性增加[2]。肾素-血管紧张素系统(renin-angiotensin system,RAS)是一种重要的维持机体内环境稳态的激素内分泌系统,由血管紧张素原、肾素、血管紧张素转化酶(angiotensin-converting enzyme,ACE)、血管紧张素Ⅰ(angiotensinⅠ, AngⅠ)、血管紧张素Ⅱ(angiotensinⅡ, AngⅡ)及其相应的受体AT1、AT2构成。近年来诸多研究报道RAS在胰岛素抵抗(insulin resistance, IR)发生和发展的多个环节中发挥重要作用[3],并可通过介导氧化应激诱发大鼠患非酒精性脂肪肝[4]。RAS阻断剂可提高机体胰岛素敏感性,有效逆转肝脏的脂肪沉积及其导致的炎症损伤[5]。RAS系统在胎儿期对机体组织器官的生长发育产生重要影响,胎儿期缺氧可通过RAS介导的“印迹”机制增加出生后个体心脑血管发病的危险性[6]。但PH是否亦可通过RAS系统改变以影响胎儿肝脏,目前国内外尚未见报道。本文在以往研究的基础上,观察了PH对子代大鼠血液循环系统和肝脏局部RAS的影响,探讨PH导致子代NAFLD易感性增加的可能机制,以期寻找药物早期干预的靶点。
1 材料
1.1药品与试剂水合氯醛(国药集团化学试剂有限公司);EDTA(Sigma,美国);氮气、液氮(苏州长桥气体公司);AngⅠ、AngⅡ、ACE放免试剂盒(北京华英生物技术研究所);生理盐水(江苏鹏鹞药业有限公司)。
1.2实验仪器Centrifuge 5417R高速冷冻离心机(德国Eppendorf公司);氧气含量监测仪(S-450,美国IST-AIM公司);Architect c8000全自动血液生化分析仪(美国Abbott公司);冰冻切片机(德国Leica公司);AH-2光学显微镜、数码相机(日本Olympus公司);r-911全自动放免计数仪(中国科技大学实业总公司生产)。
2 方法
2.1建立动物模型及分组将♀♂大鼠以1 ∶1合笼,次日晨检测阴栓判断为妊娠时,记为妊娠d 1(GD 1),孕鼠随机分为对照组及缺氧组,每组10只。将缺氧组孕鼠于GD 4~21放入缺氧舱(体积:140L,O2含量(10±0.5)%,对照组放于氧含量正常的等体积饲养舱中饲养(O2含量21%)。GD 21行剖宫产,每窝随机取2只胎鼠,交予 “奶妈”母鼠正常喂养,其余胎鼠按母鼠妊娠期是否受缺氧刺激分为正常组(FC)和PH组(FH)。将子代成年大鼠分为4组,每组10只(♀♂各半):① 正常子代组(O-FC-C);② 宫内缺氧子代组(O-FH-C);③ 正常子代成年缺氧应激组(O-FC-H);④宫内缺氧子代成年缺氧应激组(O-FH-H)。5月龄后将成年后缺氧应激组给予短期缺氧刺激,方法同上,时间为7 d。动物处死前均称量体重。
2.2血样采集及血浆制备对胎鼠采用断头取血法,将血样收集到含EDTA的抗凝试管中,1 000 r·min-14℃离心10 min,分离血浆。子代成年大鼠禁食不禁水10 h后,腹腔注射水合氯醛麻醉,腹主动脉取血,分离血浆,-20℃保存待检。
2.310%肝脏组织匀浆液制备分离完整的胎鼠及子代成年大鼠肝脏,称重,并计算肝重指数;肝重指数=肝重/体重。称取0.3 g肝组织加液氮研磨成细粉后,加入生理盐水至3 mL,充分混匀,1 000 r·min-1离心10 min,分离上清液,-20℃保存待检。
2.4肝组织冰冻切片的制备及苏丹Ⅲ染色快速分离子代大鼠肝脏,切下直径约2 cm的肝组织(胎鼠取整个肝脏),放入-15℃冰箱冷冻。将已冷冻的组织放在组织支承器上,滴上包埋剂,冰冻,切出8 μm厚的冰冻切片,福尔马林中固定10 min,稍水洗后,用乙醇稍洗,苏丹III染液浸染2 min,乙醇洗去多余染液,继而流水冲洗。用苏木精染液复染细胞核,盐酸酒精分化,水洗10 min蓝化,把切片贴于载玻片上,甘油明胶封盖,光学显微镜下观察,拍照。
2.5血浆及肝匀浆中总胆固醇(TC)和甘油三酯(TG)的检测将血浆和10%肝组织匀浆分别上全自动生化分析仪检测。
2.6血浆及肝匀浆中AngⅠ、AngⅡ、ACE的检测由北京华英生物技术研究所用放免法代为检测。

3 结果
3.1PH对子代大鼠体重、肝重及肝重指数的影响FH组胎鼠较FC组体重、肝重及肝重指数均明显降低(P<0.05)。子代成年O-FC-C组与O-FH-C组之间体重、肝重及肝重指数均无差别。子代成年大鼠给予短期缺氧刺激后,O-FH-H组肝重指数较O-FH-C组明显升高(P<0.05),O-FH-H组大鼠肝脏重量及肝重指数明显高于O-FC-H组(P<0.01),见Tab 1。

Tab 1 Effect of prenatal hypoxia on body weight, liver weight and liver weight to body weight ratio in fetus and offspring ±s,n=10)
ΔΔP<0.01vsFC;#P<0.05vsO-FH-C;*P<0.05,**P<0.01vsO-FC-H
3.2PH对子代成年大鼠和胎鼠肝组织脂肪沉积的影响O-FC-C组大鼠的肝组织未见明显的红染脂滴,O-FH-C组和O-FC-H组大鼠的肝组织中见少量红染脂滴。O-FH-H组大鼠肝组织出现大量红染脂滴。GD21胎鼠,FC组肝组织中有少量红染脂滴。FH组胎鼠的肝组织结构松散,因而冰冻切片出现大块空斑,并见大量红染脂滴,见Fig 1。
3.3PH对胎鼠和子代成年大鼠血浆及肝组织中TG、TC含量的影响子代成年大鼠各组间血浆中TG、TC含量均未见差异(P>0.05);FH组胎鼠与FC组比较,血浆中TG、TC含量也均未见差异(P>0.05)。子代成年大鼠各组间及FH组胎鼠与FC组之间,肝组织中TC含量也均未见差异(P>0.05)。TG含量,O-FH-C组和O-FC-H组大鼠与O-FC-C组相比虽有所增高,但差异均无统计学意义(P>0.05)。而O-FH-H组大鼠肝组织TG含量较O-FH-C组和O-FC-H组明显增高(P<0.05)。FH组胎鼠肝组织TG含量比FC组明显增高(P<0.01),见Tab 2。
3.4PH对子代大鼠血浆中AngⅠ、AngⅡ及ACE含量的影响两组胎鼠间血浆中无论是AngⅠ、AngⅡ,还是ACE的含量均未见差异;子代成年大鼠O-FH-C组与O-FC-C组两组相比,血浆中AngⅠ、AngⅡ和ACE含量也均无差异(P>0.05)。子代成年大鼠给予缺氧刺激后,血浆中AngⅠ和ACE含量未见改变;但AngⅡ含量升高,PH子代O-FH-H组大鼠血浆中AngⅡ含量明显高于O-FC-H组和O-FH-C组(P<0.05),见Fig 2。

Tab 2 Effect of prenatal hypoxia on TC and TG in plasma and liver of fetus and offspring ±s,n=10)
ΔΔP<0.01vsFC;#P<0.05vsO-FH-C;**P<0.01vsO-FC-H
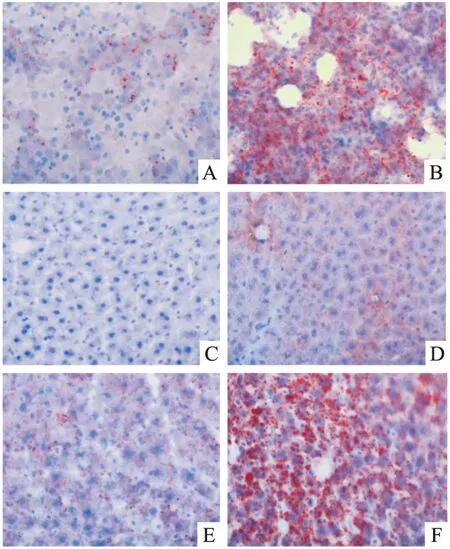
Fig 1 Light microscopic micrographs for liver tissues staining with Sudan Ⅲ
A: FC; B:FH; C:O-FC-C; D:O-FH-C;E:O-FC-H;F:O-FH-H
3.5PH对子代大鼠肝脏组织中AngⅠ、AngⅡ及ACE含量的影响FH组胎鼠较FC组肝匀浆中AngⅡ含量有所增高,但差异无统计学意义(P>0.05),两组胎鼠肝匀浆中AngⅠ、ACE含量也均无差异。子代成年O-FH-C组大鼠肝组织中AngⅡ含量与O-FC-C组相比明显增高(P<0.05),AngⅠ、ACE含量虽有所不同,但两组差异无显著性(P>0.05)。子代成年大鼠给予缺氧刺激后,AngⅠ、AngⅡ含量较缺氧前明显升高(O-FC-HvsO-FC-C;O-FH-HvsO-FH-C);(P<0.05);O-FH-H组大鼠肝匀浆中AngⅡ含量较O-FC-H组明显增高(P<0.05),AngⅠ含量也有增高趋势,但差异无统计学意义(P>0.05);肝组织中ACE含量,O-FC-H组与O-FC-C组相比有所降低,但差异无显著性(P>0.05),O-FH-H组与O-FC-H组和O-FH-C组相比均明显增高(P<0.05),见Fig 3。
4 讨论
妊娠期母体的多种疾患及环境因素都可引起胎儿宫内缺氧(PH)[7-8]。我们以往的研究结果表明:PH可造成子代成年后胰岛素敏感性降低和肝脏胰岛素信号通路异常,致使子代大鼠成年后NAFLD易感性增加[2]。本研究结果显示:PH胎鼠的体重、肝重及肝重指数均明显低于正常胎鼠,这说明PH不仅造成胎鼠的宫内生长受限,而且还抑制了其肝脏的生长发育。PH子代大鼠5月龄(成年)时,经过“追赶生长”,其与同龄正常子代体重、肝重及肝重指数差异均消失。这种“追赶生长”是在PH子代出生前特殊的代谢应答模式基础上完成的,它常伴有胰岛素及瘦素的抵抗、脂质水平改变[9],成为子代成年后NAFLD易感性增加的原因之一。

Fig 2 Effect of prenatal hypoxia on plasma AngⅠ, AngⅡ
1: FC; 2: FH; 3: O-FC-C; 4: O-FH-C; 5: O-FC-H; 6: O-FH-H.*P<0.05vsO-FC-H;#P<0.05vsO-FH-C.

Fig 3 Effect of prenatal hypoxia on 10%(wt/vol) liver homogenate AngⅠ,AngⅡ and ACE concentration in fetus and offspring ±s,n=10)
1: FC; 2: FH; 3: O-FC-C; 4: O-FH-C; 5: O-FC-H; 6: O-FH-H.ΔP<0.05vsO-FC-C;*P<0.05vsO-FC-H;#P<0.05vsO-FH-C.
肾素-血管紧张素系统(RAS)在血压、体液、电解质平衡中起重要作用。多种因素可促使肾小球旁器中的球旁细胞释放肾素,肾素作用于肝脏和脂肪组织产生的血管紧张素原,使其生成AngⅠ;AngⅠ在ACE作用下裂解转化为AngⅡ[10]。AngⅡ是RAS的关键因子[11]。以往认为[12-13],RAS是属于循环内分泌系统,后来诸多研究表明,在心、肾、肺、肝和胰腺中都存在着局部RAS,在这些组织中AngⅡ可以不释放到血液中,可通过自分泌、旁分泌或胞内分泌等方式局部发挥作用。近年来,研究者发现胰岛素信号与RAS之间存在着复杂的调控网络,并尝试用RAS调节剂来治疗和预防肝脏疾病。对循环系统及肝脏局部RAS的调控均有利于预防NAFLD和肝纤维化的发生[14]。本研究观察了PH对子代大鼠血液循环系统和肝脏中AngⅠ、AngⅡ及ACE含量的影响。结果显示:PH虽未表现出对胎鼠及子代成年的循环系统AngⅠ、AngⅡ及ACE含量的直接影响,但却对其成年后肝脏局部RAS产生了“印迹”效应,PH成年子代肝脏中AngⅡ含量均明显高于正常对照组。给予缺氧刺激后,PH子代成年大鼠机体RAS受到激活,且肝脏局部RAS的激活强于循环系统RAS。这说明PH不仅可造成子代成年大鼠肝脏的高AngⅡ状态,还可使成年子代的RAS在缺氧刺激后更易被激活。有研究报道:给成年大鼠输注AngⅡ可促进肝脏合成TG,进而增加血浆中TG含量[15],并可通过介导氧化应激损伤线粒体诱发大鼠患NAFLD[16]。这说明PH子代成年延续自胎儿期的肝脏高AngⅡ水平是PH增加子代脂肪肝易感性的机制之一。肝脏局部RAS可能是药物早期干预PH,导致子代NAFLD易感性增加的新靶点。
(本实验在苏州大学附属第一医院胎儿医学研究所完成。感谢徐智策教授的指导与帮助!)
[1]Rueda-Clausen C F, Dolinsky V W, Morton J S,et al. Hypoxia-induced intrauterine growth restriction increases the susceptibility of rats to high-fat diet-induced metabolic syndrome[J].Diabetes,2011,60(2):507-16.
[2]Cao L, Mao C, Li S,et al. Hepatic insulin signaling changes: possible mechanism in prenatal hypoxia-increased susceptibility of fatty liver in adulthood[J].Endocrinology,2012,153(10):4955-65.
[3]Kalupahana N S, Moustaid-Moussa N. The renin-angiotensin system: a link between obesity, inflammation and insulin resistance[J].ObesRev,2012,13(2):136-49.
[4]张晓平,张峰,陆茵,等. 肝纤维化中肾素-血管紧张素的作用研究进展[J]. 中国药理学通报,2011,27(7):897-900.
[4]Zhang X P, Zhang F, Lu Y,et al. Research progress on the role of renin-angiotensin system in hepatic fibrosis[J].ChinPharmacolBull, 2011,27(7):897-900.
[5]Toblli J E, Munoz M C, Cao G,et al. ACE inhibition and AT1 receptor blockade prevent fatty liver and fibrosis in obese Zucker rats[J].Obesity(SilverSpring),2008,16(4):770-6.
[6]Xue Q, Dasgupta C, Chen M, Zhang L. Foetal hypoxia increases cardiac AT(2)R expression and subsequent vulnerability to adult ischaemic injury[J].CardiovascRes,2011,89(2):300-8.
[7]Moazzen H, Lu X, Liu M, Feng Q. Pregestational diabetes induces fetal coronary artery malformation via reactive oxygen species signaling[J].Diabetes,2015,64(4):1431-43.
[8]Rueda-Clausen C F, Stanley J L, Thambiraj D F,et al. Effect of prenatal hypoxia in transgenic mouse models of preeclampsia and fetal growth restriction[J].ReprodSci,2014,21(4):492-502.
[9]Coupe B, Grit I, Darmaun D, Parnet P. The timing of "catch-up growth" affects metabolism and appetite regulation in male rats born with intrauterine growth restriction[J].AmJPhysiolRegulIntegrCompPhysiol,2009,297(3):R813-24.
[10]Cabello-Verrugio C, Morales M G, Rivera J C,et al. Renin-angiotensin system: an old player with novel functions in skeletal muscle[J].MedResRev,2015,35(3):437-63.
[11]田超,范方田,陈文星,等. 血管紧张素Ⅱ及其Ⅰ型受体在肿瘤血管生成中的作用研究[J]. 中国药理学通报,2014,30(5):608-11.
[11]Tian C, Fan F T,Chen W X, et al. Research progress on the function of angiotensin Ⅱ and its type Ⅰ receptor in tumor angiogenesis[J].ChinPharmacolBull,2014,30(5):608-11.
[12]陈京红. 局部肾素血管紧张素系统的生理学和药理学意义[J]. 中国药理学通报,1990,6(6):344-6.
[12]Chen J H. Physiology and pharmacology of local renin-angiotensin systems[J].ChinPharmacolBull, 1990,6(6):344-6.
[13]Ohashi N, Yamamoto T, Huang Y,et al. Intrarenal RAS activity and urinary angiotensinogen excretion in anti-thymocyte serum nephritis rats[j].AmJPhysiolRenalPhysiol,2008, 295(5): F1512-1518.
[14]Geogescu E F. Angiotensin receptor blockers in the treatment of NASH/NAFLD: could they be a first-class option[J]?AdvTher,2008,25(11):1141-74.
[15]Ran J, Hirano T, Adachi M. Chronic ANG Ⅱ infusion increases plasma triglyceride level by stimulating hepatic triglyceride production in rats[J].AmJPhysiolEndocrinolMetab,2004,287(5):E955-61.
[16]Moreira de Macedo S, Guimaraes T A, Feltenberger J D, Sousa Santos S H. The role of renin-angiotensin system modulation on treatment and prevention of liver diseases[J].Peptides,2014,62:189-96.
Effects of prenatal hypoxia on renin-angiotensin system in plasma and liver of offspring rats
MAO Cai-ping2,ZHONG Ting-ting1,CHEN Nan1, JIANG Shan2, ZHANG Xiang-wei1,CAO Li1,2
(1.CollegeofPharmaceuticalSciences,SoochowUniversity,SuzhouJiangsu215123,China; 2.InstituteforFetology&ReproductiveMedicineCenter,theFirstAffiliatedHospitalofSoochowUniversity,SuzhouJiangsu215006,China)
AimTo study the effects of prenatal hypoxia on the risk of fatty liver disease to search the drug targets.MethodsIntrauterine hypoxia rats model was established. The bodies and livers of fetal rats of 21 days, and adult offspring rats of 5 months with and without anoxic treatment were all weighed. The liver index was calculated and the concentrations of renin-angiotensin system components in circulation system and livers of offspring rats were measured.ResultsThe weight of the bodies, livers and index of liver weight to body weight(liver index) were significantly decreased in the PH group compared with the normal group. These differences disappeared in adulthood. However, the liver index of adult offsprings in the PH group after hypoxia stress for 7 days was significantly increased compared with that of adult offsprings in normal group. There were no significant differences in the concentrations of AngⅠ, AngⅡ and ACE in plasma and livers between the two groups of fetal rats and the two groups of adult offspring rats separately. The concentrations of AngⅡ in the livers of adult rats in PH group were significantly higher than those in normal group. The concentrations of AngⅠ in livers and the concentrations of AngⅡ in plasma and livers in the group treated with hypoxia stress for 7 days were significantly higher than those without hypoxia stress. The concentrations of ACE in livers and the concentrations of AngⅡ in plasma and livers in PH adult offsprings were significantly higher than those of normal adult offsprings.ConclusionPH can induce the increase of RAS content in the livers of fetus and adult rats, RAS is more likely to be activated after hypoxia stimulation in the following adulthood. PH is a potential mechanism that mediates offspring susceptibility of fatty liver.
prenatal hypoxia; offspring; renin-angiotensin system; liver; fetus; plasma
2016-02-16,
2016-04-20
国家自然科学基金资助项目(No 30902018);江苏省博士后基金项目(No 1302063C);苏州大学大学生创新计划项目(No 2013xj059)
茅彩萍(1968-),女,博士,教授,研究方向:围产生理药理,E-mail:maocaiping@suda.edu.cn;仲婷婷(1994-),女,本科生,研究方向:内分泌药理,E-mail:841108240@qq.com;曹莉(1976-),女,博士,副教授,研究方向:内分泌药理学,通讯作者,E-mail:caoli8545@sohu.com
10.3969/j.issn.1001-1978.2016.07.018
A
1001-1978(2016)07-0975-05
R-332;R322.47;R331;R714.5;R845.22
网络出版时间:2016-6-20 11:49网络出版地址:http://www.cnki.net/kcms/detail/34.1086.R.20160620.1149.036.html