TNF-α在丙泊酚诱发的神经元凋亡及认知功能障碍中的作用
2016-08-10邓小园刘红亮戴体俊
邓小园,陈 博,刘红亮,戴体俊
(1. 重庆市肿瘤研究所麻醉科,重庆 400030;2. 徐州医学院麻醉学系,江苏 徐州 221002)
TNF-α在丙泊酚诱发的神经元凋亡及认知功能障碍中的作用
邓小园1,陈博1,刘红亮1,戴体俊2
(1. 重庆市肿瘤研究所麻醉科,重庆400030;2. 徐州医学院麻醉学系,江苏 徐州221002)
目的探讨TNF-α在丙泊酚诱发的海马神经元凋亡及远期认知功能障碍中的作用。方法7 d龄(P7)SD大鼠随机分为3组:Control组,无任何处理;P(single)组,腹腔注射丙泊酚50 mg·kg-1;P(repeated)组,腹腔注射丙泊酚50 mg·kg-1,每天1次,共7次。丙泊酚两组于麻醉结束后2 h(对照组则分别对应上述两时间点)采用Western blot法检测海马组织TNF-α含量。另取P7大鼠随机分为5组:Control组;P(single)组;P(repeated)组;P(single)+ETN组,腹腔注射丙泊酚50 mg·kg-1前30 min侧脑室注射依那西普0.4 mg·kg-1;P(repeated)+ETN组,腹腔注射丙泊酚50 mg·kg-1,每天1次,共7次,第1次和第4次丙泊酚注射前30 min侧脑室注射依那西普0.4 mg·kg-1。于P7、P13、P21、P35时间点,各组采用免疫组化法检测海马CA1区神经元凋亡。剩余大鼠于P36-P41行Morris水迷宫实验。结果丙泊酚单次或多次暴露均使海马组织TNF-α含量明显高于同期对照水平(P<0.05,P<0.01);P(single)组中,活化caspase-3阳性神经元于P7较对照组同时间点明显增多(P<0.05),而于其它时间点差异无显著性(P>0.05),逃避潜伏期和穿越平台次数与对照组比较均无差异(P>0.05);P(repeated)组中,P13、P21、P35时间点活化caspase-3阳性神经元均明显高于同期对照组水平(P<0.01),逃避潜伏期从d1~d5均明显高于对照组同期水平(P<0.01),且穿越平台次数明显低于对照组(P<0.01); 依那西普侧脑室注射后,丙泊酚麻醉后各时点的活化caspase-3阳性神经元、逃避潜伏期及穿越平台次数与对照组比较差异均无显著性(P>0.05)。结论TNF-α介导了丙泊酚诱发的发育期海马神经元凋亡和远期认知功能障碍,而远期认知功能障碍可能与持续性神经元凋亡有关。
丙泊酚;TNF-α;神经炎症;神经元凋亡;认知功能;发育期大脑
静脉全麻药丙泊酚目前在婴幼儿麻醉和镇静中广泛应用,动物实验表明,丙泊酚在临床相关浓度内可诱发发育期大脑广泛神经元凋亡等神经毒性[1],但相关作用机制仍不知晓。丙泊酚激活中枢GABAA受体产生全麻效应,但目前证实GABAA受体不参与丙泊酚诱发的发育期神经毒性[2]。肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)在神经炎症反应中释放最早,且在神经退行性病变的发生发展中发挥重要作用[3]。研究发现,异氟烷及丙泊酚均可导致发育期大脑组织内TNF-α含量明显增加[4-5],而且全麻药多次暴露较单次暴露可诱发更严重的神经毒性[6]。但丙泊酚不同暴露次数如何影响TNF-α在脑组织内的含量,以及TNF-α在丙泊酚诱发的发育期神经毒性中发挥何种作用至今尚不清楚。因此本研究应用新生大鼠,观察丙泊酚不同暴露次数麻醉后海马组织TNF-α的含量,以及应用TNF-α拮抗剂观察其对丙泊酚诱发的海马组织神经元凋亡和远期认知功能障碍的影响。
1 材料与方法
1.1实验动物7 d龄(P7)SD大鼠,SPF级,体质量13~18 g,♀♂各半,由重庆医科大学动物实验中心提供[许可证:SCXK(渝)2012-0001]。
1.2实验试剂及抗体丙泊酚(P,批号:MKBK7900V,Sigma公司,美国);TNF-α拮抗剂依那西普(ETN,批号J36770,辉瑞制药有限公司,德国);羊抗TNF-α多克隆抗体(Santa Cruz公司,美国);兔抗羊二抗及羊抗兔IgG二抗(武汉博士德生物工程有限公司,中国);兔抗active caspase-3多克隆抗体(Abcam公司,美国)。
1.3实验分组及麻醉P7大鼠随机分为3组:Control组(n=12),无任何处理;P(single)组(n=6),腹腔注射丙泊酚50 mg·kg-1;P(repeated)组(n=6),腹腔注射丙泊酚50 mg·kg-1,每天1次,共7次。丙泊酚两剂量组于麻醉结束后2 h(分别为P7和P13时间点),对照组则分别对应上述两时间点(每时间点n=6),采用Western blot法检测海马组织TNF-α含量。
另取P7大鼠随机分为5组:Control组;P(single)组;P(repeated)组;P(single)+ETN组,腹腔注射丙泊酚50 mg·kg-1前30 min侧脑室注射依那西普0.4 mg·kg-1;P(repeated)+ETN组,腹腔注射丙泊酚50 mg·kg-1,每天1次,共7次,第1次和第4次丙泊酚注射前30 min侧脑室注射(方法参照Gonzalez-Rodriguez等[7]所描述)依那西普0.4 mg·kg-1。于出生后d 7、13、21、35(P7、P13、P21、P35)时间点(n=6),各组采用免疫组化法检测海马CA1区神经元凋亡[P7时间点只对应Control、P(single)和P(single)+ETN组]。各组中剩余的15只大鼠继续饲养,并于出生后d 36~41(P36~P41)行Morris水迷宫实验检测学习记忆功能。麻醉过程中大鼠置于透明麻醉箱中,箱内通入30%氧气,流量2 L/min,底部铺电热毯,维持直肠温度(37.0±0.5)℃。1.4Western blot法检测海马TNF-α含量大鼠断头取脑,分离海马组织,细胞裂解液裂解组织提取蛋白,BCA法蛋白定量后,每孔上样量30 μg。经电泳,转膜,封闭后。加入羊抗TNF-α多克隆抗体(1 ∶1 000),4℃孵育过夜,兔抗羊二抗(1 ∶1 000)37℃孵育2 h, ECL化学发光法显影。在Fusion-Fx7凝胶成像图像分析系统上检测,显影结果经Fusion配套软件进行定量分析。目的蛋白与内参β-actin灰度值的比值作为TNF-α蛋白的含量。
1.5免疫组织化学法检测神经元凋亡大鼠吸入4%七氟烷3 min麻醉后,经左心室依次灌注生理盐水和4%多聚甲醛,断头取脑。经酒精梯度脱水、石蜡包埋,制成5 μm石蜡切片。参照新生大鼠脑图谱[8],每只大鼠选择与图谱对应的3张脑组织切片进行染色。石蜡切片经脱腊、水化、抗原修复,H2O2去除内源性过氧化酶活性,正常山羊血清37℃封闭30 min,加入兔抗活化caspase-3多克隆抗体(1 ∶100),4℃孵育过夜;PBS冲洗后,加入羊抗兔IgG二抗37℃孵育30 min;PBS冲洗、DAB显色、苏木精复染、酒精分化、饱和碳酸锂返蓝、脱水、透明,中性树胶封片。活化caspase-3阳性神经元胞质或胞核呈棕黄色,各组每张切片选取3个非重叠海马CA1区锥体细胞层400×视野,计数各视野每平方毫米面积的活化caspase-3阳性细胞数。3个视野×3张切片的平均值作为每只大鼠的最后结果。
1.6Morris水迷宫测试Morris水迷宫系统(淮北正华生物仪器有限责任公司,中国)为一直径160 cm、高50 cm圆形水池,池壁上贴有4个不同形状的白色标记,将水池分为Ⅰ、Ⅱ、Ⅲ、Ⅳ四个象限,将直径为10 cm的圆形平台放置于III象限,并使平台顶低于水面2 cm,池中倒入墨汁以遮盖平台,水温维持在(22.0±0.5)℃。水池上方安装有摄像机并连接ZH-ZFT型自发活动实验视频分析系统,可同步记录大鼠运动轨迹。Morris水迷宫测试分为两部分[9]:① 定位航行实验,实验d 1~5,大鼠每日分别从4个不同入水点入水,记录90 s内寻找到平台的时间(逃避潜伏期),若大鼠在90 s内未找到平台,将其引导至平台并停留15 s,逃避潜伏期记录为90 s;② 空间探索实验,实验d 6撤除平台,将大鼠从离原平台距离最远的入水点入水,记录90 s内穿越原平台次数。

2 结果
2.1丙泊酚不同暴露次数对海马组织TNF-α含量的影响对照组中P7和P13两个时间点,海马组织TNF-α含量无明显变化(P>0.05)。丙泊酚单次和多次暴露均可使海马组织TNF-α含量明显高于同期对照水平(P<0.05,P<0.01)。见Fig 1。
2.2丙泊酚不同暴露次数麻醉后海马CA1区神经元凋亡的动态变化对照组中,从P7至P35的脑发育过程中,海马CA1区锥体细胞层活化caspase-3阳性神经元呈递减趋势;P(single)组中,活化caspase-3阳性神经元于P7较对照组同时间点明显增多(P<0.05),而于P13、P21和P35则与对照组同期水平无差异(P>0.05)。P(repeated)组中,P13、P21、P35时间点活化caspase-3阳性神经元均明显高于同期对照组水平(P<0.01)。 依那西普侧脑室注射后,丙泊酚不同暴露次数麻醉后各时点的活化caspase-3阳性神经元与对照组同期比较差异均无显著性(P>0.05)。见Fig 2。
2.3丙泊酚不同暴露次数对远期认知功能的影响P(single)组中逃避潜伏期和穿越平台次数与对照组比较均无差异(P>0.05);而P(repeated)组中逃避潜伏期从d 1~d 5均明显高于对照组同期水平(P<0.01),且穿越平台次数明显低于对照组(P<0.01);依那西普侧脑室注射后,丙泊酚不同暴露次数麻醉后逃避潜伏期及穿越平台次数与对照组比较差异均无显著性(P>0.05)。见Tab 1。

Tab 1 Effect of propofol on escape latency and platform crossing ±s, n=15)
**P<0.01vscontrol
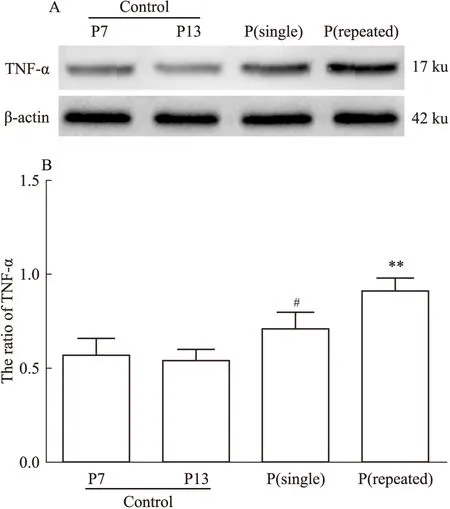
Fig 1 Effect of different doses of
A:TNF-α expression from Westem blot;B:Quantification of TNF-α protein levels(ratio to β-actin);#P<0.05vscontrol(P7);**P<0.01vscontrol(P13)
3 讨论
大脑在发育期对全麻药诱发神经毒性的敏感性明显增加,临床研究表明,4岁以内的婴幼儿多次经历全麻和手术可导致学习能力缺陷的风险增加[10],而啮齿类动物在出生后3周内为脑发育高峰[11],此时期大脑反复暴露于全麻药可导致广泛的神经元凋亡和远期认知功能障碍[4,6]。本实验结果显示,丙泊酚单次暴露仅诱发短暂的海马神经元凋亡,而丙泊酚多次暴露可诱发持续的神经元凋亡及远期认知功能障碍。研究表明,丙泊酚(75 mg·kg-1)连续7次腹腔注射对呼吸、血糖及血气无明显影响[6],而本研究中使用50 mg·kg-1,连续7次腹腔注射以模拟临床多次麻醉或长时间镇静,亦可排除呼吸、血糖及血气变化对实验结果的影响。
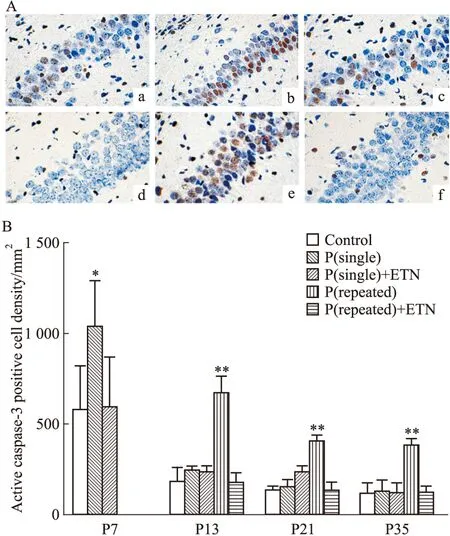
Fig 2 Effect of propofol on dynamic changes of densities of active caspase-3 positive neurons
A:Representative photographs of active caspase-3 positive neurons(brown) in hippocampal CA1 region. a:Control group(P7); b:P(single) group(P7); c:P(single)+ETN group(P7); d:Control group(P13); e:P(repeated) group(P13); f:P(repeated)+ETN group(P13);B:Quantification of densities of active caspase-3 positive neurons.*P<0.05,**P<0.01vscontrol
本实验中丙泊酚单次或多次暴露均导致海马组织内TNF-α含量增加,但导致的神经毒性的不同,可能与丙泊酚不同暴露次数引起的TNF-α蛋白在脑组织内增加的持续时间不同有关。研究表明[12],TNF-α在神经退行性病变中发挥的作用存在作用时间阈值,而丙泊酚多次暴露可能使得海马组织内TNF-α含量维持较长时间的增高,从而导致持续神经元凋亡增加和远期认知功能减退。本实验中,侧脑室注射TNF-α拮抗剂依那西普可拮抗丙泊酚诱导的神经毒性,依那西普与释放至细胞外液中的TNF-α结合并使其丧失生物活性。本实验结果提示,TNF-α介导了丙泊酚诱发的发育期海马神经元凋亡和远期认知功能减退。
生理状态下胶质细胞释放少量TNF-α以维持神经元功能和信息传递,病理条件下则释放过多TNF-α以诱发神经炎症反应。脑内小胶质细胞膜可表达丰富的嘌呤P2X7受体,其在小胶质细胞合成及释放TNF-α的过程中作用至关重要[13]。丙泊酚可增强三磷酸腺苷诱发的P2X7受体电流或调节P2X7受体的活性[14-16]。因此,本研究中丙泊酚诱发的TNF-α含量增加可能与丙泊酚作用于小胶质细胞膜上的P2X7受体有关。TNF-α主要通过TNF-α受体1相关死亡结构域蛋白,激活外源性途径而诱发细胞凋亡[17],这可能是介导丙泊酚诱发的神经元凋亡的机制。但近年来发现丙泊酚诱发的发育期大脑神经元凋亡可通过内源性和外源性两种途径[12],本研究中TNF-α拮抗剂依那西普可完全拮抗丙泊酚诱发的神经元凋亡,因此TNF-α可能亦通过其它机制参与内源性凋亡途径的激活。研究表明,TNF-α在术后认知功能障碍及阿尔兹海默病的发生发展中均发挥重要作用[3],而且TNF-α浓度升高可直接导致认知功能障碍的发生[18]。本研究中丙泊酚多次暴露,诱发TNF-α含量增加,并介导远期认知功能障碍的产生,TNF-α可抑制长时程增强以及神经突起的分化生长[20],这可能是其导致认知功能障碍的原因之一。
脑正常发育过程中,神经元发生生理性凋亡以适应脑功能和结构的变化。本实验发现,脑发育过程中,海马CA1区神经元凋亡程度呈递减趋势,而丙泊酚单次暴露只诱发一过性神经元凋亡增加,丙泊酚多次暴露可诱发持续海马组织神经元凋亡的增加。目前有观点认为,神经元死亡本身可能不足以导致认知功能障碍的发生[18]。但本实验结果提示,丙泊酚多次暴露诱发的海马CA1区持续神经元凋亡的增加,可能与远期认知功能障碍的发生密切相关。
总之,丙泊酚可导致发育期海马组织TNF-α含量升高,而TNF-α拮抗剂依那西普可拮抗丙泊酚诱发的海马CA1区广泛神经元凋亡和远期认知功能障碍,丙泊酚单次暴露诱发的神经元凋亡一过性增强不影响远期认知功能,而丙泊酚多次暴露诱发的神经元凋亡持续性增强可能与远期认知功能减退的发生有关。
(致谢:感谢重庆医科大学附属第一医院实验研究中心陈力学、秦光成等老师在实验中的指导。)
[1]Creeley C, Dikranian K, Dissen G, et al. Propofol-induced apoptosis of neurons and oligodendrocytes in fetal and neonatal rhesus macaque brain[J].BrJAnaesth, 2013, 110(Suppl1): i29-i38.
[2]Peam M L, Hu Y, Niesman I R,et al. Propofol neurotoxicity is mediated by p75 neurotrophin receptor activation[J].Anesthesiology, 2012,116(2): 352-61.
[3]Lyman M, Lloyd D G, Ji X,et al. Neuroinflammation: the role and cosequences[J].NeurosciRes, 2014, 79(2):1-12.
[4]Shen X, Dong Y, Xu Z,et al. Selective anesthesia-induced neuroinflammation in developing mouse brain and cognitive impairment[J].Anesthesiology, 2013, 118(3): 502-15.
[5]Milanovic D, Pesic V, Popic J, et al. Propofol anesthesia induces proapoptotic tumor necrosis factor-α and pro-nerve growth factor signaling and prosurvival Akt and XIAP expression in neonatal rat brain[J].Anesthesiology, 2013, 118(3): 502-15.
[6]Yu D, Jiang Y, Gao J, et al. Repeated exposure to propofol potentiates neuroapoptosis and long-term behavioral deficits in neonatal rats[J].NeurosciLett, 2013, 534: 41-6.
[7]Gonzalez-Rodriguez P J, Li Y, Martinez F, Zhang L. Dexamethasone protects neonatal hypoxic-ischemic brain injury via L-PGDS-dependent PGD2-DP1-pERK signaling pathway[J].PLoSOne, 2014, 9(12):e114470.
[8]Ramachandra R.Atlasoftheneonatalratbrain[M]// Ramachandra R, Subramanian T.BocaRaton, FL:Crc Press, 2011.
[9]Vorhees C V, Williams M T. Morris water maze: procedures for assessing spatial and related forms of learning and memory[J].NatProtoc, 2006,1(2):848-58.
[10]Flick R P, Katusic S K, Colligan R C, et al. Cognitive and behavioral outcomes after early exposure to anesthesia and surgery[J].Pediatrics, 2011, 128(5):e1053-e1061.
[11]Rice D, Barone S Jr. Critical periods of vulnerability for the developing nervous system: evidence from humans and animal models[J].EnvironHealthPerspect, 2000, 108(Suppl3): 511-33.
[12]Liu Y P, Lin H I, Tzeng S F. Tumor necrosis factor-alpha and interleukin-18 modulate neuronal cell fate in embryonic neural progenitor culture[J].BrainRes, 2005, 1054(2): 152-8.
[13]Chu K, Yin B, Wang J, et al. Inhibiton of P2X7receptro ameliorates transient global cerebral ischemia/reperfusion injury via modulating inflammatory responses in the rat hippocampus[J].JNeuroinflammation, 2012, 9:69.
[14]Nakanishi M, Mori T, Nishikawa K, et al. The effects of general anesthetics on P2X7and P2Y receptors in a rat microgial cell line[J].AnesthAnalg, 2007, 104(5):1136-44.
[15]刘红亮, 戴体俊. P2X7受体介导丙泊酚对缺氧海马突触前膜谷氨酸Ca2+依赖性释放的抑制作用[J]. 中国药理学通报, 2010, 26(9):1169-72.
[15]Liu H L, Dai T J. Role of P2X7receptor in the inhibitory effect of propofol on glutamate Ca2+-dependent release from hypoxic hippocampal synaptosomes[J].ChinPharmacolBull, 2010, 26(9):1169-72.
[16]刘红亮, 戴体俊. 利多可因在异丙酚抑制巨噬细胞膜P2X7受体电流中的双向调节作用[J]. 中国药理学通报, 2009, 25(7):911-4.
[16]Liu H L, Dai T J. Impact of lidocaine on the inhibitory effect of propofol on P2X7-gated currents[J].ChinPharmacolBull, 2009, 25(7):911-4.
[17]Harry G J, Lefebvre d′H C, McPherson C A, et al. Tumor necrosis factor p55 and p75 receptors are involvedin chemical-induced apoptosis of dentate granule neurons[J].Neuro-chem, 2008,106(1): 281-98.
[18]Belarbi K, Jopson T, Tweedie D, et al. TNF-alpha protein synthesis inhibitor restores neuronal function and reverses cognitive deficits induced by chronic neuroinflammation[J].JNeuroinflammation, 2012, 9:23.
[19]Mishra A, Kim H J, Shin A H, Thayer S A. Synapse loss induced byinterleukin-1beta requires pre- and post-synaptic mechanisms[J].JNeuroimmunePharmacol,2012,7(3): 571-8.
[20]Stratmann G, May L D, Sall J W,et al. Effect of hypercarbia and isoflurane on brain cell death and neurocognitive dysfunction in 7-day-old rats[J].Anesthesiology, 2009, 110(4): 849-61.
Role of TNF-α in propofol-induced neuronal apoptosis and long-term cognitive impairment in neonatal rats
DENG Xiao-yuan1, CHEN Bo1, LIU Hong-liang1, DAI Ti-jun2
(1.DeptofAnesthesiology,ChongqingCancerInstitute,Chongqing400030,China;2.DeptofAnesthesiology,XuzhouMedicalCollege,XuzhouJiangsu221002,China)
AimTo investigate the role of TNF-α in propofol-induced neuronal apoptosis and long-term cognitive impairment in neonatal rats.MethodsSeven-day-old SD rats were randomly divided into 3 groups:Control group(n=12), P(single) group(n=6): propofol 50 mg·kg-1was injected intraperitoneally(ip.)once;P(repeated) group(n=6):propofol 50 mg·kg-1was injected ip. once daily, and for seven times. Hippocampal TNF-α level was measured 2 hours after propofol anesthesia, there were two time points(n=6) in Control group as control levels(postnatal day 7 for P(single) group and postnatal day 13 for P(repeated) group). In another experiment, 7-day-old rats were randomly divided into 5 groups:Control group; P(single) group; P(repeated) group; P(single)+ETN group: ETN(etanercept) 0.4 mg·kg-1was injected intracerebroventricularly 30 min before propofol administration; P(repeated)+ETN group: ETN 0.4 mg·kg-1was injected intracerebroventricularly 30 min before the 1stand 4thadministration of propofol, which was injected ip. for seven times, once daily. Hippocampal neuronal apoptosis was detected at postnatal day 7[P(repeated) and P(repeated)+ETN groups not involved at this time point], 13, 21 and 35, cognitive function was measured at postnatal day 36 to 41 using Morris water maze test.ResultsPropofol with different exposure times could increase hippocampal TNF-α levels(P<0.05,P<0.01); in P(single) group, active caspase-3 positive neurons in hippocampal pyramidal cell layer were much greater than control level only at postnatal day 7(P<0.05), there were no changes of escape latency or platform crossing times compared with control(P>0.05); in P(repeated) group, active caspase-3 positive neurons were more significantly increased at postnatal day13, 21 and 35 than those in control group(P<0.01), escape latency was increased or platform crossing times were decreased more significantly than control in Morris water maze test(P<0.01); after etanercept was administered intracerebroventricularly, there were no significant changes of active caspase-3 positive neurons, escape latency and platform crossing times after propofol anesthesia compared with control(P>0.05).ConclusionTNF-α mediates hippocampal neuronal apoptosis and long-term cognitive impairment induced by propofol in neonatal rats, and long-term cognitive impairment may be related with persistent neuronal apoptosis.
propofol; Tumor necrosis factor-α; neuroinflammation; neuronal apoptosis; cognitive function; developing brain
2016-01-15,
2016-04-22
重庆市自然科学基金资助项目(No cstc2012jjA10005)
邓小园(1986-),女,硕士生,研究方向:全麻药神经毒性,E-mail: 82144950@qq.com;刘红亮(1975-),男,博士,主任医师,硕士生导师,研究方向:麻醉药中枢神经毒性的作用机制,通讯作者,E-mail: liuhl75@163.com;戴体俊(1943-),男,教授,硕士生导师,研究方向:麻醉药理学,E-mail: daitijun@163.com
10.3969/j.issn.1001-1978.2016.07.012
A
1001-1978(2016)07-0945-05
R-332;R322.81;R329.25;R614.2;R741.022;R971.2
查询稿件情况,请发邮件到稿件查询信箱:zgylxtb@163.com。
网络出版时间:2016-6-20 11:49网络出版地址:http://www.cnki.net/kcms/detail/34.1086.R.20160620.1149.024.html