二甲双胍对高糖培养H9c2细胞Connexin43表达的影响
2016-08-10王光宇毕亚光刘向东张庆勇
王光宇,毕亚光,刘向东,魏 盟,张庆勇
(上海交通大学附属第六人民医院心血管内科,上海 200233)
二甲双胍对高糖培养H9c2细胞Connexin43表达的影响
王光宇,毕亚光,刘向东,魏盟,张庆勇
(上海交通大学附属第六人民医院心血管内科,上海200233)
目的研究二甲双胍(metformin, Met)对高糖培养下的H9c2细胞缝隙连接蛋白43(connexin43,Cx43)表达的影响及其机制。方法高糖培养的大鼠H9c2心肌细胞分别加入3和5 μmol·L-1的两种不同浓度的二甲双胍继续培养24 h。MTT实验检测H9c2细胞活力;LDH释放实验检测细胞毒力;细胞免疫荧光实验检测Cx43的表达和分布;荧光法检测细胞内活性氧(ROS)水平;Western blot检测Cx43、p-AMPK、AMPK和GAPDH的表达。结果Met能增加H9c2细胞活力,降低细胞内ROS水平,对LDH释放差异无显著性;Met使AMPK磷酸化水平明显升高,增加心肌Cx43表达,改善Cx43的分布。结论Met可能通过激活AMPK途径,增加心肌细胞Cx43的表达和减少细胞内ROS的产生,进而发挥心血管的保护效应。
二甲双胍;高血糖;connexin43;氧化应激;AMP依赖的蛋白激酶;H9c2
超过50%的糖尿病患者死亡原因归于心血管疾病[1]。糖尿病可以引起多种并发症,如心肌梗死、糖尿病心肌病,糖尿病肾病等。因此严格的血糖控制对糖尿病患者来说显得尤为重要。
在心肌细胞闰盘处存在一种缝隙连接(gap junction, GJ)通道,由缝隙连接蛋白(connexin, Cx)组成。它是心肌细胞间电、化学信号偶联通道,不仅可以进行细胞间物质交换,如离子、ATP等,还可以传导电信号,实现心肌细胞同步性舒缩,完成泵血过程。心室肌细胞闰盘处主要存在缝隙连接蛋白43(connexin43,Cx43)[2]。研究表明,Cx43的表达或分布异常与许多疾病相关,如心律失常[3]、高血压、动脉粥样硬化[4]等。研究发现高血糖情况下Cx43的表达降低、分布异常、心律失常发生率增加[5]。这些证据提示Cx43在维持心脏正常功能中起着至关重要的作用。
二甲双胍是最常用的口服降糖药,广泛用于治疗2型糖尿病患者。研究表明,二甲双胍能改善骨骼肌胰岛素抵抗[6],减少糖尿病患者全因死亡率和心血管事件发生率[7]。此外,二甲双胍还能改善心肌梗死后重构效应及炎症反应[8],降低糖尿病患者房颤发生率[9]。但二甲双胍发挥心血管保护作用是否与心肌Cx43变化有关,目前尚无定论。本研究拟在H9c2大鼠心肌细胞系中,观察二甲双胍对高糖培养的H9c2细胞Cx43表达的影响及其潜在机制。
1 材料与方法
1.1材料与试剂大鼠心肌细胞株H9c2(2-1)购自中国科学院上海细胞库;Cx43、AMP依赖的蛋白激酶(AMPK)、磷酸化的AMP依赖的蛋白激酶(P-AMPK)、GAPDH抗体购自Cell Signal Technology公司;羊抗兔二抗购自武汉谷歌生物有限公司;二甲双胍(metformin, Met)、二甲基亚砜(DMSO)、噻唑蓝(methylthiazolyl tetrazolium, MTT)购自Sigma公司;DMEM、胎牛血清(FBS)购自美国Gibco公司;ROS检测试剂盒、LDH检测试剂盒、BCA蛋白定量试剂盒购自碧云天生物技术公司;增强型化学发光(ECL)显影液购自Thermo公司;EPOCH型多功能酶标仪购自Bio-Tek公司;PowerPac Universal电泳装置购自Bio-rad公司。
1.2细胞培养及分组用含10% FBS的DMEM培养液培养H9c2细胞,放在含5% CO2,95% O237℃培养箱中。当细胞长满培养皿80%~90%时,用PBS缓冲液冲洗3遍,加1 mL 0.25%的胰酶使其与细胞充分接触,消化1 min,再加3 mL的DMEM培养基终止消化。将细胞悬液加入离心管中,以900×g离心3 min,去除上清,将细胞稀释后转移至6孔板继续培养。待细胞长满80%左右,在高糖(25.0 mmol·L-1)培养的H9c2细胞中分别加3 μmol·L-1Met(Met3)和5 μmol·L-1Met(Met5)继续培养24 h,另设对照组(不含Met,Con)。
1.3细胞活力检测称取适量的MTT,溶解于去离子水中,使其终浓度为0.5 g·L-1,继续培养4 h,去除上清,每孔加DMSO 150 μL,快速震荡10 min,使结晶充分溶解。然后在酶标仪测吸光度在490 nm处的吸光度值[D(490 nm)]。
1.4细胞毒性检测按照试剂盒说明书方法进行操作。简言之,待细胞长满80%左右,设置以下几组:背景空白对照孔、样品对照孔、样品最大酶活性对照孔、不同药物浓度处理样品孔。到达预计检测时间点前1h,在样品最大酶活性对照孔加入原有体积10%的LDH释放液并混匀。到达预定时间后,每组取120 μL的上清加入96孔板中,同时加入60 μL LDH检测工作液,室温避光30 min,在490 nm处测吸光度。细胞毒性/%=(处理样品吸光度-样品对照孔吸光度)/(细胞最大酶活性的吸光度-样品对照孔吸光度)×100。
1.5细胞免疫荧光检测细胞爬片之后,进行预定时间药物处理,然后用PBS清洗3次,每次3 min;用4%的多聚甲醛室温固定30 min,PBS清洗3次,每次3 min。在玻片上滴加山羊血清,室温封闭30 min,吸水纸吸掉封闭液加入Cx43的一抗,4℃孵育过夜。清洗玻片上多余的一抗,加荧光二抗室温避光孵育1 h,滴加DAPI避光孵育5 min,清洗封片,用荧光显微镜观察采集图像。

2 结果
2.1Met对H9c2细胞活力的影响MTT实验结果显示:与Con组相比,3 μmol·L-1和5 μmol·L-1的Met处理能明显增加细胞活力(P<0.05);与Met3组相比,虽然Met5组细胞活力有升高趋势,但是两者间差异无统计学意义(P>0.05),见Fig 1。
2.2Met对H9c2细胞毒力的影响LDH实验结果显示:与Con组相比,Met3和Met5组细胞释放的LDH都有升高趋势,但是差异无统计学意义(P>0.05),见Fig 2。
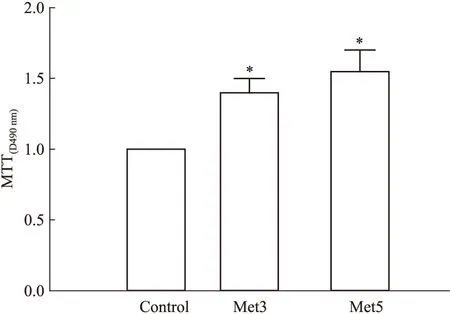
Fig 1 Effects of different concentrations of Met on viability of H9c2 cells measured by ±s,n=3)
*P<0.05vscontrol group
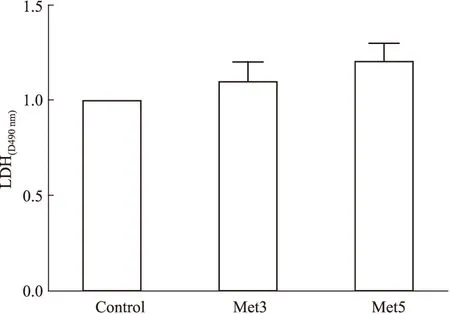
Fig 2 Effects of different concentrations of Met on toxicity
2.3细胞免疫荧光细胞免疫荧光结果显示:与Con组相比,Met3和Met5组细胞Cx43的表达量明显升高,而且在细胞表明分布更加规则(Fig 3白色箭头)。Met3和Met5组组间比较发现Cx43的表达和分布无差异。
2.4Met对细胞内ROS产生的影响用荧光显微镜观察细胞内ROS的变化,结果显示:与Con组相比,Met3和Met5组细胞内的ROS明显减少(Fig 4);与Met3组相比,Met5组细胞内的ROS含量进一步降低。
2.5Met对细胞Cx43,AMPK及p-AMPK表达的影响Western blot结果显示:与Con组相比,Met3和Met5组内Cx43和p-AMPK表达明显升高(Fig 5,P<0.05)。与Met3组相比,Met5组内P-AMPK表达量升高更加明显(P<0.05),但Cx43的含量差异无显著性。
3 讨论
本研究观察到,二甲双胍不仅能增加H9c2细胞活力,还能降低高血糖条件下ROS的产生。在分子生物学水平我们还发现二甲双胍能增加高糖条件下H9c2细胞Cx43和P-AMPK的表达,其中降低ROS产生和增加P-AMPK的表达效应呈现剂量依赖形式。
心肌Cx43在维持心脏正常功能过程中具有重要作用。研究发现,心肌在发育过程中Cx43缺陷可以引起流出道梗阻[10],而且Cx43还参与细胞周期和转录调控[11]。大量研究已经证实,心室肌Cx43的表达和分布与室性心律失常的发生密切相关。

Fig 3 The immunofluorescence of Cx43 in H9c2 cells(n=3)

Fig 4 Effects of different concentrations of Met on the ROS generated of H9c2 cells culture with high glucose(magnification 200×,n=3)

Fig 5 Effects of different concentrations of Met levels of
The protein levels of Cx43, P-AMPK and AMPK were examined by Western blot. One of three representative experiments is shown. Data are the mean ± SD of band intensities volume/GAPDH intensities volume from three different experiments.*P<0.05vscon group;#P<0.05vsMet3 group.
Rutledge等[3]研究发现,心肌梗死后瘢痕边界的Cx43含量明显降低,Cx43也从心肌闰盘处转向细胞侧面,导致侧面连接增多。Rutledge等用c-Src抑制剂提高了梗死边界Cx43的含量,降低室性心动过速易感性。Greener等[12]研究也发现通过基因转染等手段上调猪心肌梗死边界局部心肌Cx43的表达,可以有效的抑制心肌梗死后室性心律失常的发生。不论是动物实验还是细胞实验均表明高血糖能降低心肌Cx43的表达,此外动物实验还证实Cx43表达量的降低及分布异常与糖尿病易于发生心律失常存在密切联系[5]。在本次实验中,我们观察到二甲双胍能增加高血糖情况下细胞Cx43的表达量和改善Cx43的分布,据此推测二甲双胍降低糖尿病患者心血管事件的发生率及死亡率与增加心肌Cx43表达及改善分布有关。
氧化应激在长期高血糖导致心功能不良过程中起重要作用[13]。ROS产生过多可以引起线粒体渗透性转运通道的开放,导致线粒体损伤。研究发现活性氧(ROS)在引起心室重构和心衰过程中扮演重要角色[14]。减少ROS的产生能保护细胞免受氧化应激损伤。我们研究发现高糖培养H9c2细胞能增加ROS的产生,但是加入二甲双胍能抑制细胞ROS的生成,并且呈剂量依赖形式。因此我们有理由相信二甲双胍降低细胞ROS的产生也参与保护心血管这一过程。
研究发现,二甲双胍发挥心血管保护作用的机制主要通过激活AMPK。AMPK的激活不仅可以增加血糖摄取,脂肪酸氧化,提高细胞活力[15],还能减轻心肌梗死带来的炎症反应[8]。本实验也发现,二甲双胍通过增加p-AMPK的表达激活AMPK。Guo等[16]研究发现激活AMPK能上调肾内皮细胞Cx43的表达,延缓肾内皮细胞的衰老。因此,我们推测二甲双胍上调心肌细胞Cx43的表达和降低细胞内ROS的产生与AMPK激活相关。
综上所述,本实验证实,在高糖条件下,二甲双胍能增加H9c2细胞Cx43的表达及改善其分布,此外二甲双胍还能降低细胞内ROS的产生,增加细胞活力。这为二甲双胍治疗糖尿病患者带来的心血管益处提供了重要的实验依据。至于二甲双胍增加Cx43的表达和降低ROS的产生可能与AMPK的激活有关,需要以后的研究进行验证。
(致谢:本研究在上海交通大学附属第六人民医院心血管内科实验室完成,在此致以由衷的感谢!)
[1]Asrih M, Steffens S. Emerging role of epigenetics and miRNA in diabetic cardiomyopathy[J].CardiovascPathol, 2013,22(2):117-25.
[2]Vozzi C, Dupont E, Coppen S R,et al. Chamber-related differences in connexin expression in the human heart[J].JMolCellCardiol, 1999, 31(5): 991-3.
[3]Rutledge C A, Ng F S, Sulkin M S, et al. c-Src kinase inhibition reduces arrhythmia inducibility and connexin43 dysregulation after myocardial infarction[J].JAmCollCardiol, 2014, 63(9): 928-34.
[4]Brisset A C, Isakson B E, Kwak B R. Connexins in vascular physiology and pathology[J].AntioxidRedoxSignal, 2009, 11(2): 267-82.
[5]Okruhlicova L, Tribulova N, Misejkova M, et al. Gap junction remodelling is involved in the susceptibility of diabetic rats to hypokalemia-induced ventricular fibrillation[J].ActaHistochem, 2002, 104(4): 387-91.
[6]吴文君,汤孙寅炎,时俊锋,等. 二甲双胍抑制SREBP-1c改善高脂诱导的骨骼肌胰岛素抵抗[J]. 中国药理学通报,2016,32(1):55-9.
[6]Wu W J,Tang S Y Y,Shi J F,et al. Metformin ameliorates PA-induced skeletal muscle insulin resistance by suppressing SREBP-1c[J].ChinPharmacolBull,2016,32(1):55-9.
[7]Fung C S, Wan E Y, Wong C K, et al. Effect of metformin monotherapy on cardiovascular diseases and mortality: a retrospective cohort study on Chinese type 2 diabetes mellitus patients[J].CardiovascDiabetol, 2015, 14:137.
[8]Soraya H, Rameshrad M, Mokarizadeh A. Metformin attenuates myocardial remodeling and neutrophil recruitment after myocardial infarction in rat[J].Bioimpacts, 2015, 5(1): 3-8.
[9]Chang S H, Wu L S, Chiou M J, et al. Association of metformin with lower atrial fibrillation risk among patients with type 2 diabetes mellitus: a population-based dynamic cohort andinvitrostudies[J].CardiovascDiabetol, 2014, 13(123):1-8.
[10]Walker D L, Vacha S J, Kirby M L. Connexin43 deficiency causes dysregulation of coronary vasculogenesis[J].DevBiol, 2005, 284(2): 479-98.
[11]Giepmans B N. Gap junctions and connexin-interacting proteins[J].CardiovascRes, 2004, 62(2): 233-45.
[12]Greener I D, Sasano T, Wan X, et al. Connexin43 gene transfer reduces ventricular tachycardia susceptibility after myocardial infarction[J].JAmCollCardiol, 2012, 60(12): 1103-10.
[13]Ansley D M, Wang B. Oxidative stress and myocardial injury in the diabetic heart[J].JPathol, 2013, 229(2): 232-41.
[14]Sun X, Chen R C, Yang Z H, et al. Taxifolin prevents diabetic cardiomyopathyinvivoandinvitroby inhibition of oxidative stress and cell apoptosis[J].FoodChemToxicol, 2014, 63:221-32.
[15]Johnson R, Dludla P, Joubert E, et al. Aspalathin, a dihydrochalcone C-glucoside, protects H9c2 cardiomyocytes against high glucose-induced shifts in substrate preference and apoptosis[J].MolNutrFoodRes, 2016,60(4):922-34.
[16]Guo Y N, Wang J C, Cai G Y, et al. AMPK-mediated downregulation of connexin43 and premature senescence of mesangial cells under high-glucose conditions[J].ExpGerontol, 2014, 51:71-81.
Effect of metformin on connexin43 expression in H9c2 cells cultured with high glucose
WANG Guang-yu, BI Ya-guang, LIU Xiang-dong, WEI Meng, ZHANG Qing-yong
(DeptofCardioloy,ShanghaiJiaoTongUniversityAffiliatedSixthPeople′sHospital,Shanghai200233,China)
AimTo investigate the effect of metformin(Met) on connexin43(Cx43) expression in H9c2 cells cultured with high glucose and the relevant mechanisms.MethodsRat myocardial cells H9c2 were cultured with high glucose, then combined with 3 μmol·L-1and 5 μmol·L-1of Met for 24 h respectively. The viability and toxicity of H9c2 cells were detected by MTT and LDH, respectively. The expression and distribution of Cx43 were detected by immunofluorescence staining. The intracellular oxygen species reactive(ROS) level was detected by fluorescencemicroscopy. And the expression of Cx43, P-AMPK, AMPK and GAPDH was determined by Western blot. ResultsThe viability of H9c2 cells was increased and the level of intracellular ROS was decreased in Met group, while there existed no significant difference in LDH release among groups. Met significantly increased the phosphorylation of AMPK and the expression of Cx43, and improved the distribution of Cx43 also.ConclusionThe beneficial effect of Met on cardiovascular system in diabetic patients may via up-regulating the expression of Cx43 and down-regulating of intracellular ROS through activation of AMPK.
metformin; high glucose; connexin43; oxidative stress; AMPK; H9c2
2016-01-20,
2016-04-15
上海自然科学基金资助项目(No 13ZR1431500)
王光宇(1989-),男,硕士,研究方向:心律失常发病机制,E-mail:wanggysjtj@163.com;张庆勇(1972-),男,博士,副教授,硕士生导师,研究方向:糖尿病心律失常发病机制,通讯作者,E-mail:zhangqingyong6th@126.com
10.3969/j.issn.1001-1978.2016.07.008
A
1001-1978(2016)07-0920-05
R-332;R322.11;R329.24;R341;R587.1;R977.15
网络出版时间:2016-6-20 11:49网络出版地址:http://www.cnki.net/kcms/detail/34.1086.R.20160620.1149.016.html