人尿道黏膜上皮细胞系与脱细胞羊膜基质复合培养的实验研究
2016-08-10范巨峰芮宏亮张岩崑范微微黄文罡
范巨峰,芮宏亮,宋 森,张岩崑,范微微,吕 伟,周 璐,李 晶,黄文罡,侯 莹
实验研究
人尿道黏膜上皮细胞系与脱细胞羊膜基质复合培养的实验研究
范巨峰,芮宏亮,宋 森,张岩崑,范微微,吕 伟,周 璐,李 晶,黄文罡,侯 莹
目的 探讨人尿道黏膜上皮细胞系与脱细胞羊膜基质复合培养的效果。方法 将人尿道黏膜上皮细胞系接种于脱细胞羊膜基质上,待细胞在脱细胞羊膜基质上生长至铺满表面,用活细胞示踪剂标记细胞,然后将脱细胞羊膜基质固定、封片,倒置相差和荧光显微镜下进行观察。结果 人尿道黏膜上皮细胞系细胞在脱细胞羊膜基质上生长,细胞呈单层生长,活细胞示踪剂显示细胞生长良好,并具有活细胞功能。结论 人尿道黏膜上皮细胞系是良好的实验室组织工程化尿道种子细胞,脱细胞羊膜基质是良好的实验室组织工程化尿道支架材料,适用于实验室组织工程化尿道复合过程研究。
组织工程; 人尿道黏膜上皮细胞系; 脱细胞羊膜基质; 复合培养
先天性尿道下裂、反复手术失败型尿道下裂与先天性尿道上裂、阴茎缺损等畸形都存在尿道缺损,需要再造尿道,这是整形外科和泌尿外科共同的治疗难题[1-2]。组织工程化尿道的构建即应用组织工程学的原理与方法,构建具有正常形态功能的尿道组织,从而达到修复缺损与畸形的目的。其相关研究主要包括4个方面:种子细胞的研究、支架材料的研究、细胞与支架的复合过程研究、组织工程化尿道的构建。自2013年3月起,我们的实验主要探讨人尿道黏膜上皮细胞系(normal human urinary tract epithelial cells, SV-HUC-1)与脱细胞羊膜基质(human acellular amniotic membrane matrix, HAAM)的复合过程。
1 材料与方法
1.1 主要试剂与仪器 F-12K培养基(美国INVITROGEN公司);胎牛血清(FBS,美国HYCLONE公司);青霉素(华北制药厂);链霉素(华北制药厂);胰蛋白酶(美国SIGMA公司);NaCl分析纯、KCl分析纯、Na2HPO4分析纯、KH2PO4分析纯、NaHCO3分析纯、苯酚红(北京化学试剂公司);直径90 mm塑料细胞培养皿(美国CORNING公司);CO2恒温培养箱(日本NAPCO公司,型号:5410);超净操作工作台(北京半导体设备一厂);倒置相差显微镜(日本OLYMPUS公司);低速离心机(北京医用离心机厂,型号:LD4-2);高温烤箱(日本SAKURA公司,型号:HE-21);微量加样枪(德国EPPENDORF公司)、超声波细胞粉碎机(宁波新芝科器研究所,型号:JY-96-2)。
1.2 主要溶液配制 ⑴含10%FBS的F-12K培养液:在500 ml的F-12K培养基中,加入青链霉素混合液10 ml(青霉素和链霉素终浓度分别为100 U/ml和0.1 mg/ml)和FBS 55 ml,分装后4℃保存。⑵D-Hanks平衡盐溶液:量取800 ml超纯水,依次加入NaCl 8.00 g、KCl 0.40 g、Na2HPO40.06 g、KH2PO40.06 g、NaHCO30.35 g和苯酚红0.02 g(电磁搅拌器搅拌,待1种试剂完全溶解后,再加入另一种试剂),完全溶解后,补足双蒸水至1000 ml,测定pH 7.2~7.4,分装,高压(100~150 kPa)灭菌20 min,室温冷却,-20℃保存。⑶胰蛋白酶(0.05%)EDTA(0.02%)溶液:量取D-Hanks平衡盐溶液300 ml,加入胰蛋白酶 0.25 g,电磁搅拌器搅拌,直至完全溶解;另外量取D-Hanks平衡盐溶液200 ml,加入EDTA 0.10 g,电磁搅拌器搅拌,直至完全溶解,混合2种溶液,以NaHCO3调节pH 7.4,用不锈钢正压膜过滤系统除菌后,分装,-20℃保存,4℃备用。⑷细胞冻存液:分别量取F-12K培养液7 ml、DMSO 1ml和FBS 2 ml,混合均匀,配制成含20%FBS、10%DMSO的冻存液,-20℃保存,室温备用。
1.3 实验方法 ⑴种子细胞制备:将生长至70%融合的SV-HUC-1细胞以PBS清洗2遍,0.25%胰酶-EDTA消化3 min后加入终止液,然后吸入离心管中,1000 r/min离心5 min,弃去上清液,留取细胞备用。⑵支架材料制备:羊膜脱细胞过程,通过钝性分离胎盘羊膜后,以磷酸盐缓冲液(PBS)冲洗,培养皿中甘油浸泡3次,用生理盐水反复冲洗羊膜,用胰酶消化羊膜表层的细胞,振荡、冲洗制成HAAM置于磷酸盐缓冲液中,制成脱细胞羊膜。将HAAM在含10%FBS的F-12K培养基中浸泡1 h,然后铺于培养皿底部。⑶种子细胞与支架材料的复合:将第10代传代SV-HUC-1细胞按1×106/cm2,接种于HAAM上,置于培养箱中,每2 d换液1次,待细胞在HAAM上生长至铺满表面,用活细胞示踪剂标记细胞,然后将HAAM固定、封片,于倒置相差和荧光显微镜下进行观察。
2 结果
SV-HUC-1细胞在HAAM上生长,细胞呈单层生长,活细胞示踪剂显示细胞生长良好。倒置相差显微镜观察显示,HAAM上和非羊膜部分的细胞生长良好,形态规整;倒置荧光显微镜显示,生长在HAAM上的SV-HUC-1细胞存活良好(图1)。
3 讨论
尿道下裂是一种常见的泌尿生殖系统先天性畸形,手术矫治是目前治疗尿道下裂的唯一有效方法,但治疗难度大,手术并发症相对较高。目前尿道下裂的手术方法主要包括:尿道口前移阴茎头成形术;以Danis-Browne法为代表的阴茎皮条埋藏法;以带蒂阴茎、阴囊皮瓣修复尿道的手术方法;以膀胱黏膜、口腔颊黏膜等游离代替物修复尿道的手术方法等。而无论应用哪种手术方式,术后并发症均严重影响了尿道下裂的治疗效果。组织工程学的兴起为组织或器官的重建开辟了新的途径。其方法是将体外培养的高浓度的功能相关活细胞种植于天然的或人工合成的细胞外基质上,经过一段时间培养后,将他们移植到体内,以达到重建新的有功能性组织的目的[3-4],其核心内容是建立由细胞和生物材料构成的三维空间复合体[5-6]。与传统的修复尿道方法相比,组织工程化尿道具有诸多优点:其组织结构为正常尿道黏膜,无论用于再造尿道或修复尿道缺损,其内环境更接近于正常尿道环境,更符合正常人体生理要求;在治疗过程中不增加新的创伤,减少患者的痛苦;可以大大降低尿道狭窄、毛发生长、结石形成等手术并发症的发生率[5-6]。随着气管、血管等组织工程化人体空腔器官的研究进展,对组织工程化尿道的相关研究逐渐得到重视并成为未来的发展趋势。
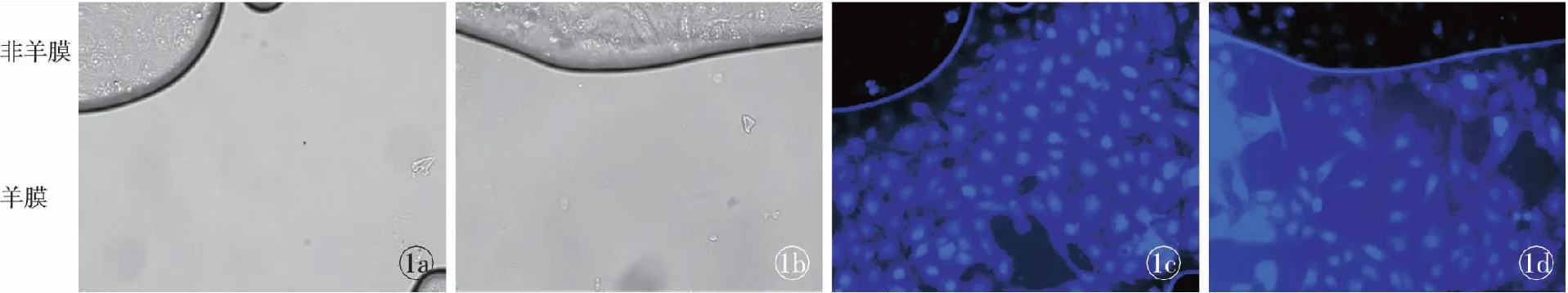
图1 SV-HUC-1细胞在HAAM上生长 a,b. HAAM上和非羊膜部分的细胞生长良好,形态规整(倒置相差显微镜 ×10) c,d. HAAM上SV-HUC-1细胞存活良好(倒置荧光显微镜 ×20)
Fig 1 SV-HUC-1 on human acellular amniotic membrane matrix (HAAM). a,b. cells grew well on SIS and iSIS, cell morphology was regular form (inverted phase contrast microscope ×10). c,d. SV-HUC-1 grew well on HAAM (inverted fluorescence microscope ×20).
在应用组织工程学原理构建尿道过程中,选择合适的种子细胞是确保研究实施的重要条件。直接取自人体或动物的成体膀胱黏膜上皮细胞和尿道黏膜上皮细胞是常用的构建组织工程化尿道的种子细胞。来自泌尿系统的上皮细胞是最适宜用于尿道组织工程的种子细胞,但取自人体或动物的成体泌尿系上皮细胞在经历若干代传代后性质发生较大变化,虽然有研究报道在较短的时间内获得大量扩增的尿道黏膜上皮细胞用于组织工程化尿道的构建[7],但多数研究在应用人体或动物成体细胞作为种子细胞时,在体外培养其传代多为10代以内,之后细胞发生不同程度的变性[8-10],成为组织工程化尿道进一步研究的“瓶颈”。本研究旨在探讨组织工程种子细胞与支架材料的复合过程,需要1种可以反复传代而不发生变性的尿道黏膜上皮种子细胞,绕过成体细胞难以大量传代这一难以避免的事实对整个实验过程的干扰,使实验顺利的进行。因此,本实验选用SV-HUC-1作为种子细胞,这种细胞来源于泌尿系上皮细胞,其特点是在多次传代后仍能够保持原有的细胞性质。在前期实验中我们已经证实,SV-HUC-1细胞在经过体外培养20代后,经倒置相差显微镜观察,细胞形态正常;经细胞鉴定提示,泌尿系细胞标志蛋白Vimentin和CK-18的mRNA表达正常;经活细胞示踪剂示综显示,细胞活性良好。证实SV-HUC-1经体外培养多次传代后仍保持原有细胞特性,是适合用于尿道组织工程实验研究的理想种子细胞[11]。本实验应用经过体外培养10代后的SV-HUC-1作为种子细胞。
生物支架材料在组织工程研究中同样起重要作用,组织工程中所用的支架材料包括合成材料和天然生物材料。合成材料的优点是能大量生产并可根据需要设计材料的特性,但缺点是组织相容性差,可引起不同程度的炎症反应,而且这些材料上培养的细胞和构建的组织,在结构和功能上都与体内情况不完全相同。而天然细胞外基质因其演变过程与临床实际情况近似,在体内的网架结构、空间结构良好,且细胞亲和性好,所以更适用于组织工程[12-13]。目前较为常用的方法是采用单纯脱细胞的胶原筋膜,经修剪后,植入缺损尿道进行修复。如果尿道缺损过长,面积过大,单纯采用脱细胞胶原筋膜修复,效果不甚理想[14]。膀胱黏膜下层和小肠黏膜下层常被用作尿路组织的修复材料,但单独作为移植物时,容易发生挛缩现象。理想的生物支架应具有如下条件:良好的组织相容性;可降解性和降解速率的可控性;无抗原作用;三维立体结构,能够提供细胞黏附和生长空间;易塑形并有一定的机械强度,能够调节细胞黏附、增殖、转移和分化。脱细胞羊基质是通过生物化学方法,去除组织中的细胞和抗原成分,保留细胞外基质框架,其特殊的组织结构利于细胞黏附和生长。因其特有的结构特点和促进组织修复的生物学基础,具备上述理想生物支架材料的各种特点,已成为国内外组织工程研究常用的支架材料选择。新鲜人羊膜具有5层结构:上皮细胞层、基底膜、致密层、纤维母细胞层和海绵层。羊膜具有以下特点:含有纤维粘连素、层粘连素、Ⅳ型胶原、硫酸乙酰肝素蛋白多糖、其他蛋白多糖大分子和多种细胞生长因子,如表皮生长因子、碱性成纤维细胞生长因子,有促进细胞黏附、迁移、增殖、分化等重要功能,羊膜基底膜易于诱导上皮细胞移行长入,增强上皮细胞的黏附性,促进上皮的分化、增殖,阻止上皮细胞凋亡,并含有多种蛋白酶抑制剂,通过抑制相应的蛋白酶而发挥抗炎作用[15]。因脱掉细胞成分后羊膜基质无免疫原性,所含的Ⅰ型和Ⅳ型胶原蛋白、层粘连蛋白、纤维粘连蛋白及硫酸肝素蛋白多糖等成分有利于种子细胞黏附、移行及上皮化,防止细胞凋亡,而且羊膜来源广泛,取材方便,易于处理和保存[15],是一种理想的生物支架。
本实验发现,SV-HUC-1在HAAM上可以生长良好,与支架材料复合良好。证实SV-HUC-1是良好的实验室组织工程化尿道种子细胞,HAAM是良好的组织工程化尿道支架材料,适用于实验室组织工程化尿道复合过程研究。本研究通过观察人尿道黏膜上皮细胞系与HAAM复合培养的效果,为今后组织工程化尿道的复合阶段研究提供了可靠的前期研究基础。
[1] 范巨峰, 李森恺, 李养群, 等. 再造尿道组织材料的易感染性研究[J]. 中华整形外科杂志, 2005,21(2):132-134.
[2] Kozinn SI, Harty NJ, Zinman L, et al. Management of complex anterior urethral strictures with multistage buccal mucosa graft reconstruction[J]. Urology, 2013,82(3):718-723.
[3] Salgado AJ, Oliveira JM, Martins A, et al. Tissue engineering and regenerative medicine: past, present, and future[J]. Int Rev Neurobiol, 2013,108C:1-33.
[4] Simaioforidis V, de Jonge P, Sloff M, et al. Ureteral tissue engineering: where are we and how to prceed? [J]. Tissue Eng Part B Rev, 2013,19(5):413-419.
[5] Pokrywczynska M, Jundzill A, Adamowicz J, et al. Tissue engineering-experimental method of urinary bladder regeneration[J]. Postepy Hig Med Dosw (Online), 2013,67:790-799.
[6] Alberti C. Tissue engineering as innovative chance for organ replacement in radical tumor surgery[J]. Eur Rrv Med Pharmacol Sci, 2013,17(5):624-631.
[7] Wood D. Reach for the sky-tissue engineering in urology[J]. BJU Int, 2013,112(6):708.
[8] 傅 强, 邓晨亮, 殷德明, 等. 脱细胞基质载体和表皮细胞结合构建尿道的实验研究[J]. 中华泌尿外科杂志, 2006,27(4):128-130.
[9] Zhang Y, Atala A. Urothelial cell culture[J]. Methods Mol Biol, 2013,1037:27-43.
[10] Xie M, Song L, Fan S, et al. Evaluation of stretched electrospun silk fibroin matrices seeded with urothelial cells for urethra reconstruction[J]. J Surg Res, 2013,184(2):774-781.
[11] 范微微, 吕 伟, 范巨峰. 人正常泌尿系上皮细胞系作为组织工程化尿道种子细胞的可行性研究[J]. 中国美容医学, 2012,21(3):433-435.
[12] Nuininga JE, van Moerkerk H, Hanssen A, et al. A rabbit model to tissue engineer the bladder[J]. Biomaterials, 2004,25(9):1657-1661.
[13] Palmer BW, Kropp BP. Update on tissue engineering in pediatric urology[J]. Curr Urol Rep, 2013,14(4):327-332.
[14] Singh SK, Agrawal SK, Mavuduru RS. Management of the stricture of fossa navicularis and pendulous urethral strictures[J]. Indian J Urol, 2011,27(3):371-377.
[15] 高 振, 罗晓婷, 邓 炜, 等. 羊膜与羊膜细胞外基质在组织工程中的应用[J]. 中国组织工程研究与临床康复, 2007,11(32):6450-6453.
Research of composite culture of human urinary tract epithelial cells with human coacellular amniotic membrane matrix
FANJu-feng,RUIHong-liang,SONGSen,ZHANGYan-kun,FANWei-wei,LYUWei,ZHOULu,LIJing,HUANGWen-gang,HOUYing.
(DepartmentofPlasticSurgery,BeijingChaoyangHospitalofCapitalMedicalUniversity,Beijing100020,China)
Objective To discuss the effect of composite culture of normal human urinary tract epithelial cells (SV-HUC-1) with human acellular amniotic membrane matrix (HAAM). Methods SV-HUC-1 was inoculated on human acellular amniotic membrane matrix and the cells were tracked with viable cell tracer when growing on the surface of the amniotic membrane matrix. Then, the cells were observed with inverted phase contrast microscope and fluorescence microscope. Results SV-HUC-1 grew well on HAAM with normal monolayer morphology, which was proven by viable cell tracer. Conclusion SV-HUC-1 is a desirable seed cell for urinary tract tissue engineering and grows well on HAAM.
Tissue engineering; Normal human urinary tract epithelial cells; Human acellular amniotic membrane matrix; Composite culture
北京市科技新星(2005B04);北京市卫生系统高层次人才(2011-3-019);北京市卫生局“十百千”人才计划
100020 北京,首都医科大学附属北京朝阳医院 整形外科(范巨峰, 张岩崑, 范微微, 吕 伟, 周 璐, 李 晶, 黄文罡, 侯 莹);卫生部中日友好临床研究所 中心实验室(芮宏亮);清华大学医学院 生物医学系(宋 森)
范巨峰(1971-),男,辽宁大连人,主任医师,博士后.
10.3969/j.issn.1673-7040.2016.04.018
R318.08
A
1673-7040(2016)04-0246-04
2015-11-14)
