兴安落叶松叶碳利用效率对环境变化的适应
2016-08-09全先奎王传宽
全先奎,王传宽
东北林业大学,生态研究中心,哈尔滨 150040
兴安落叶松叶碳利用效率对环境变化的适应
全先奎,王传宽*
东北林业大学,生态研究中心,哈尔滨150040
摘要:兴安落叶松(Larix gmelinii)作为北方森林的主要组成树种,具有广阔的分布范围和多样的生长环境,是研究树木对环境变化响应的理想树种。叶碳利用效率(CUEL)不仅与树木的碳代谢及生长发育密切相关,而且能反映树木对环境变化的响应与适应。将来自不同地区(即环境条件)的6个兴安落叶松种源的种子播种培育在帽儿山森林生态系统研究站内,在其生长30a后采用研究站和种子来源地间干燥度(AI)的差值(ΔAI)来代表环境变化梯度,研究环境变化对CUEL的影响。结果表明:CUEL在不同环境变化梯度间存在显著差异(P<0.05),且呈现随ΔAI的增大而减小的趋势。CUEL与叶片氮含量、叶片磷含量、比叶重及叶绿素含量等均呈线性正相关关系,但较大ΔAI梯度下的CUEL敏感性更高。CUEL与种子来源地平均年降水量呈显著线性正相关关系(P=0.05),而与种子来源地AI则呈显著线性负相关关系(P<0.01);随种子来源地年平均气温、平均年蒸发量的增加而下降,但其相关性不显著。以上结果表明,环境变化使兴安落叶松CUEL产生了适应性变异,表现出树木对原生长环境的生态适应。
关键词:兴安落叶松;光合;碳利用效率;遗传适应; 帽儿山生态站; 同质种植园试验
陆地生态系统碳利用效率(CUE,即净初级生产力与总初级生产力的比率)反映了生态系统碳同化能力和固碳潜力[1],不仅是森林碳汇功能估算和森林碳循环模型构建的基础参数,而且可用于探究树木对全球变化的响应和适应机制[2- 3]。叶片水平的CUE(CUEL)作为叶片碳平衡的重要指标,是光合与呼吸作用综合作用的结果,因其对环境变化(如温度、降水量等)十分敏感而备受关注[2,4]。
由于温度对光合和呼吸的影响机制不同,使得温度与CUEL之间的关系复杂[5],至今尚无一致的结论。例如:有研究表明,在短时间内光合速率随着温度的升高呈指数升高,但是超过最适温度之后幵始下降,而呼吸速率则随着温度的升高一直增大至极限值[6],从而使CUEL随温度的变化出现波动。也有研究报道,光合和呼吸随温度变化表现出不同的敏感性,从而打破了两者之间的平衡[7- 8],进而引起CUEL的变异。还有研究指出,随温度变化,光合和呼吸会保持一个相对恒定的比值[9- 11],即CUEL保持不变;这是因为光合和呼吸经过一定时间后会对温度变化产生自适应[12],从而重新恢复两者之间的平衡[13]。这种适应使得生长在不同温度下的植物存在相似的光合和呼吸速率[7,14]。此外,CUEL对温度变化的响应可能因树种而异。例如:Dillaway等在通过移栽比较4种阔叶树种幼苗的CUE发现,颤杨(Populustremuloides)和纸皮桦(Betulapapyrifera)的CUE随着移栽样地年平均气温的升高而明显减小,最大减幅达37%;而美洲黑杨(Populusdeltoids)和北美枫香(Liquidambarstyraciflua)的CUE的相应减幅较小[1]。
全球不同森林类型CUE分析研究表明,降水适中的温带落叶落叶林的CUE最高,而降水最大的热带雨林和最小的北方森林的CUE较低[15]。Zhang等[16]发现,当年降水量低于2300mm时,CUE随着降水量的增加呈下降趋势;当降水量高于2300mm时,CUE趋于稳定。出现上述格局可能与森林类型生活史的动态变化以及资源利用方式不同有关[17]。然而,野外控制实验研究表明,当降水量减少50%时,生态系统总呼吸增加,净初级生产力降低,从而引起CUE降低[18]。室内人工控水实验研究表明,苗木的呼吸和光合的比率随着降水量的增加而下降,从而使CUE增加[2]。由此可见,环境变化与CUE之间的关系尚需更多的观测试验加以澄清。
兴安落叶松(Larixgmelinii)是我国北方森林的主要组成树种之一,位于气候变化敏感区域。本研究将来自不同地区(即环境条件)的6个兴安落叶松种源的种子播种培育在帽儿山森林生态系统研究站,在其生长30a后比较测定其CUEL差异,探索CUEL对环境变化的响应是环境控制下的表型性驯化还是基因控制下的遗传适应。研究结果将有助于理解和预测气候变化对兴安落叶松的影响。
1材料和方法
1.1研究地概况
研究地设立于帽儿山森林生态站内(45°20′N, 127°30′E)。该地区气候属于大陆性温带季风气候,1989—2009年平均年降水量为629mm,平均年蒸发量为864mm,年平均气温3.1℃,1月和7月份平均气温分别为-18.5℃和22℃。研究样地内土壤和地形条件一致,平均海拔300m,平均坡度10—15°,土壤为暗棕色森林土。
兴安落叶松种子来自于其国内自然分布区内的6个地点(表1)。前期试验于1980年秋采种,1981年在生态站内育苗,1983年春将2年实生苗栽种在研究样地内[19]。样地设计按完全随机区组设计,重复5次,80株小区设计,双行排列,按株行距1.5m×2.0m定植,四周设有保护行,1997年和2001年间伐两次,株行距现为4.5m×2.5m[19]。
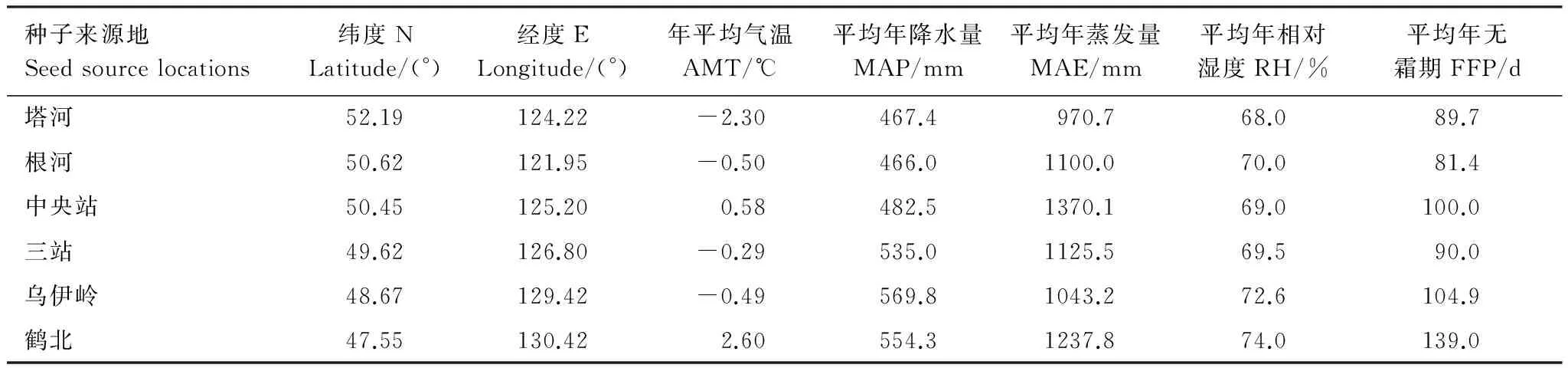
表1 6个兴安落叶松种子来源地地理和气候条件(1974—2005)*
AMT:annual mean air temperature, MAP:mean annual precipitation, MAE:mean annual evaporation, RH:mean annual relative humidity, FFP: mean annual frost free period
1.2CUEL测定
在研究样地内对来自每个地点的落叶松选取3株标准木,然后在每株标准木周围搭建触及冠层(14 m左右)的木架。每株标准木选取冠层上部向阳的当年生枝新生针叶3簇进行气体交换测定。在2009—2011年生长季(5—9月)内,每月中旬选择晴天的6:30—12:00时段,采用LI- 6400便携式CO2/H2O红外分析仪(LI-COR,Lincoln,USA)活体测定针叶气体交换过程以及相应的环境因子。测定时,设定的叶室温度25 ℃,气流进入叶室的流速500μmol/s;先采用饱和光强对叶进行充分光诱导,当光合速率稳定后开始测定光响应曲线,光量子通量密度(PPFD)梯度为:2000、1500、1200、800、400、200、150、100、50、0μmol photons m-2s-1,CO2浓度设定为400μmol CO2/mol。光响应曲线采用Prado和Demoraes[20]非线性方程进行拟合:
Pn=Pmax(1-e-k×(PAR-LCP))
(1)
式中,k为常数,PAR为光合有效辐射,Pmax为最大净光合速率(μmol CO2m-2s-1),Pn为净光合速率(μmol CO2m-2s-1),LCP为光补偿点(μmol CO2m-2s-1)。用200μmol photons m-2s-1以下的PAR和Pn分别为横、纵坐标进行线性回归,回归直线与纵坐标的截距为暗呼吸速率(Rd,mmol H2O m-2s-1)。CUEL由下式获得:
CUEL=Pmax/ (Pmax+Rd)
(2)
之后,采用扫描图像处理获得用于光合测定的针叶面积;随后将针叶样品置于65℃下烘干至恒重 (精度0.0001g),获取其干质量。比叶重(LMA, g/cm2)由下式获得:
LMA = 叶干质量/叶面积
(3)
1.3元素测定
在测定光合的同时,摘取与光合测定针叶相同位置的针叶100g(鲜质量),置于4℃冷藏箱保存带回实验室。室内将部分样品置于65℃烘箱中烘至恒重(精度0.0001g),然用将样品粉碎、过筛、装袋,用于元素含量测定。叶氮含量(NL)采用全自动凯氏定氮仪(Kjeltec 8400, Foss,Hillerød, Danmark)测定,叶磷含量(PL)采用双氧水-硫酸消煮-钼锑抗分光光度法测定。剩余鲜样用于叶绿素测定,叶绿素含量(包括叶绿素a和b)采用丙酮-乙醇等体积混合液浸提,然后通过分光光度法测定。
1.4数据分析
帽儿山生态站和种子来源地的干燥度指数(AI)由下式获得:
AI= MAE/MAP
(4)
式中,MAE为年均蒸发量,MAP为年均降水量。
为了更好地体现环境变化对叶生理生态特征的影响,本文采用研究站和种子来源地间AI的差值(ΔAI)代表环境变化梯度,6个种源构成6个环境变化梯度。帽儿山森林生态站与塔河、根河、中央站、三站、乌伊岭和鹤北6个地点间AI的差值分别为0.70、0.99、1.47、0.73、0.46和0.86,本文采用ΔAI0.70、ΔAI0.99、ΔAI1.47、ΔAI0.73、ΔAI0.46和ΔAI0.86分别代表相应的种子来源地。
应用SPSS 13.0统计软件对数据进行相关分析和方差分析,并用Ducan法进行多重比较。以每株标准木为统计单位,每株标准木CUEL及相关因子值由3簇针叶的平均值求得。方差分析前对所有数据进行方差齐性检验和正态分布检验。采用单因素方差分析比较各环境变化梯度间CUEL及其相关因子的差异。采用协方差分析(ANCOVA)比较分析线性回归方程的斜率和截距的显著性差异。
2结果
2.1环境变化梯度对CUEL及其相关因子的影响
6个环境变化梯度间CUEL存在显著的差异(P<0.05),其变化趋势与Pmax及Rd相反,即Pmax较高,Rd也较大,但CUEL却较小(图1)。6个梯度CUEL大小依次为:(77.02±0.23)% (ΔAI1.47)<(77.69±0.29)%(ΔAI0.99)<(78.57±0.49)%(ΔAI0.86)<(78.88±0.28)%(ΔAI0.70)<(79.79±0.25)%(ΔAI0.73)<(80.69±0.35)%(ΔAI0.46)。6个环境变化梯度间CUEL、Pmax、Rd、LMA、NL、PL和叶绿素含量均具有明显的遗传分化,其遗传分化度为分别为62.95%、50.07%、43.70%、30.00%、39.17%、29.70%和37.00%(表2)。
CUEL和NL、PL、LMA以及叶绿素含量间均呈线性正相关关系,但相关方程的斜率和截距随环境变化梯度而异(P<0.05)(图2,表3)。随着N、PL、和LMA的增大,ΔAI1.47、ΔAI0.99和ΔAI0.863个梯度下的CUEL增大幅度较大(方程斜率),而ΔAI0.46和ΔAI0.70的增幅较小。而随着叶绿素含量增大,CUEL的增幅在梯度间差异不显著(P>0.05)。当NL、PL、LMA以及叶绿素含量为零时CUEL的初始值(方程的截距)均存在显著的梯度差异(P<0.05),并有随ΔAI增大而减小的趋势。
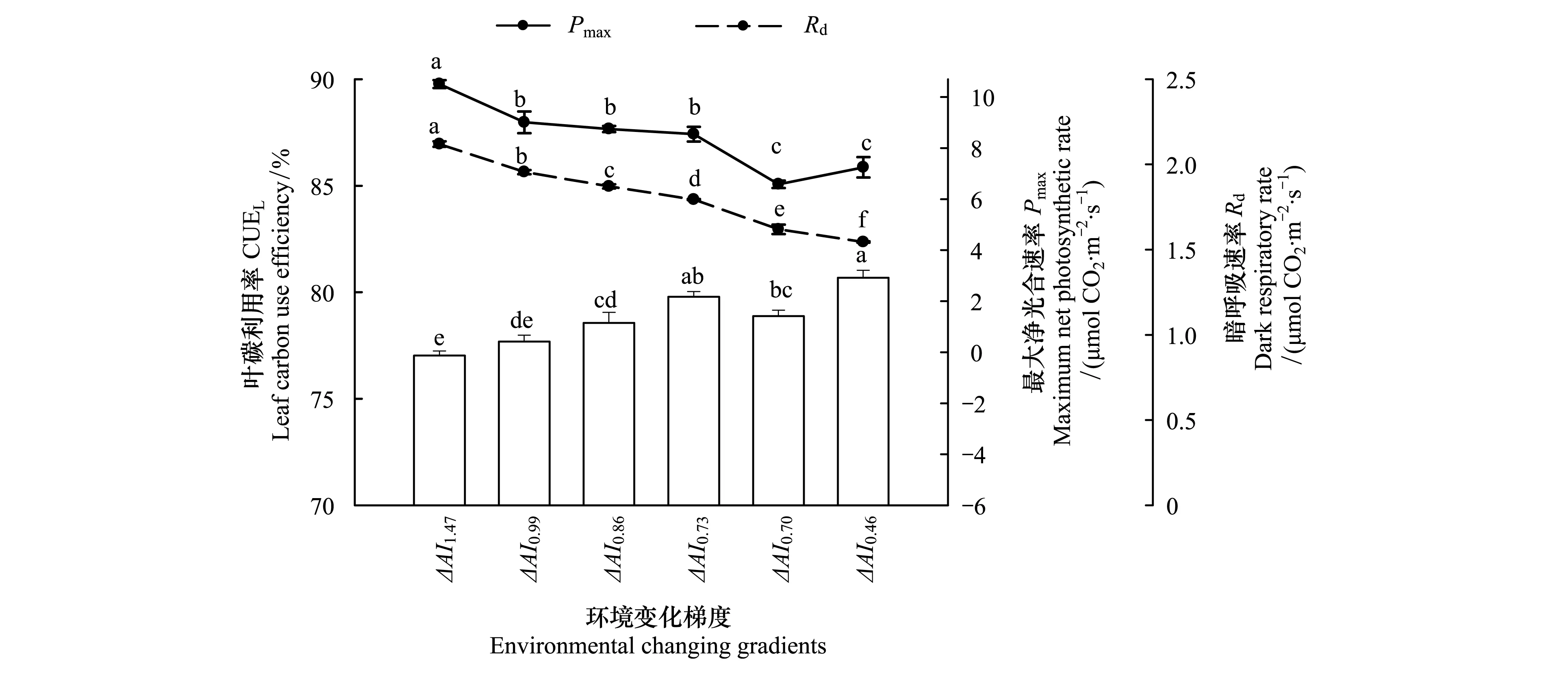
图1 不同环境梯度下兴安落叶松最大净光合速率(Pmax)、暗呼吸速率(Rd)和叶碳利用率(CUEL)比较(平均值±标准误差, n=42)Fig.1 Comparisons of maximum net photosynthetic rate (Pmax), dark respiratory rate (Rd), leaf carbon use efficiency (CUEL) of L. gmelinii across the environmental gradients (mean±SE, n=42)不同字母表示环境梯度间差异显著(α=0.05)

参数Parameter代码Code单位UnitFPD/%叶碳利用效率LeafcarbonuseefficiencyCUEL%16.720.00162.95最大净光合速率MaximumnetphotosyntheticratePmaxμmolCO2m-2s-114.300.00150.07暗呼吸速率DarkrespiratoryrateRdμmolCO2m-2s-19.540.00143.70比叶重LeafmassperareaLMAmg/cm27.180.00130.00叶氮含量LeafnitrogenconcentrationNLmg/g3.680.02539.17叶磷含量LeafphosphorusconcentrationPLmg/g4.970.0013.60叶绿素含量Leafchlorophyllconcentrationmg/g3.600.00837.00
D代表环境梯度间变异占总体变异的百分数,F和P分别为费舍尔统计检验值和显著性水平
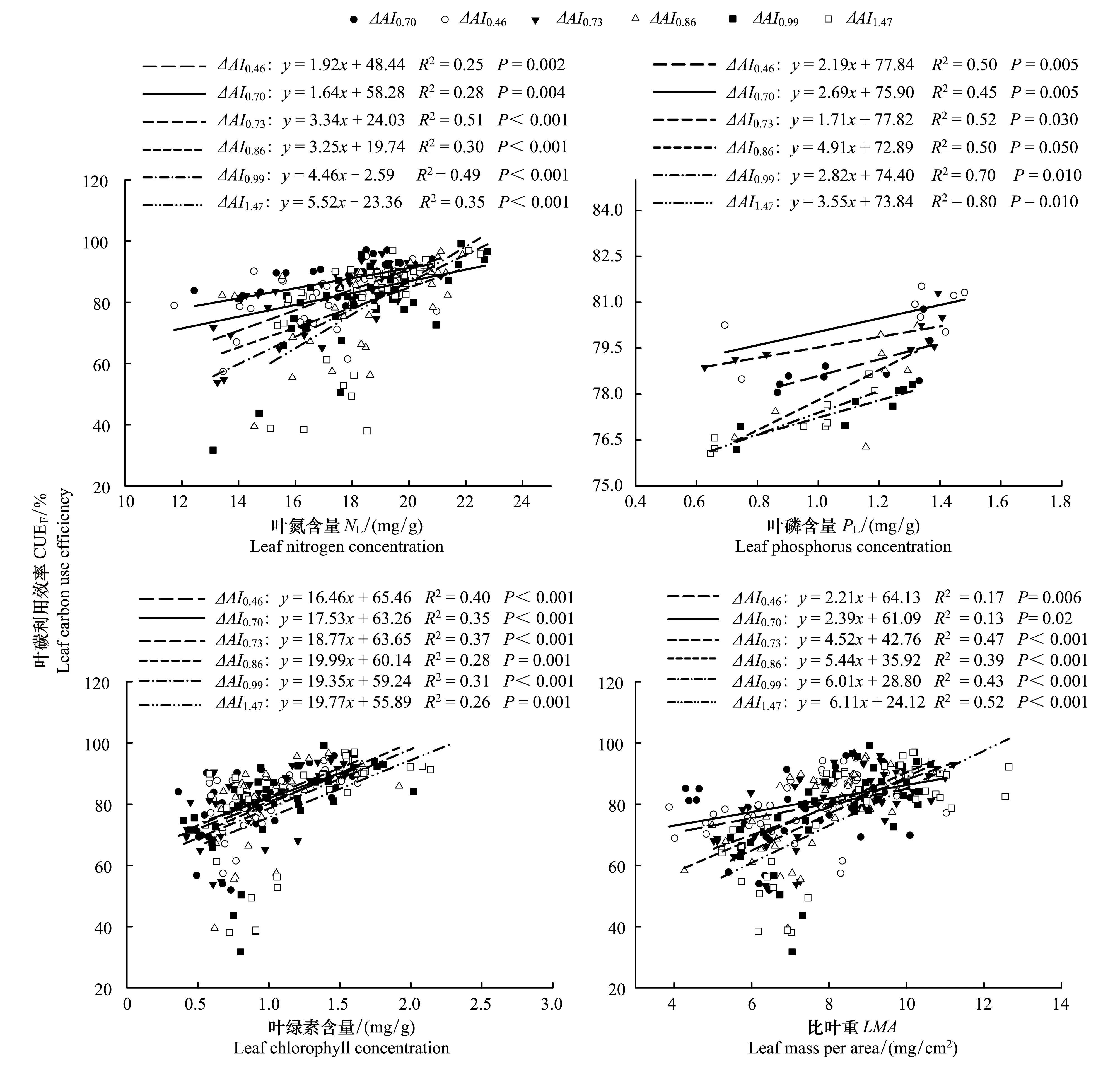
图2 不同环境梯度下兴安落叶松叶碳利用效率(CUEL) 和叶氮含量(NL)、叶磷含量(PL)、叶绿素含量、比叶重(LMA)间关系Fig.2 Relationships between leaf carbon use efficiency (CUEL) and leaf nitrogen concentration (NL), leaf phosphorus concentration (PL), leaf chlorophyll concentration and leaf mass per area (LMA) for L. gmelinii under the six environmental gradients
Table 3The ANCOVA analyses for the slopes and intercepts of the regression equations between leaf carbon use efficiency and associated factors forL.gmelinii

自变量Independentvariable应变量Dependentvariable斜率Slope截距InterceptFPFP叶碳利用效率叶氮含量Leafnitrogenconcentration3.020.0112.040.001Leafcarbonuseefficiency叶磷含量Leafphosphorusconcentration16.68<0.0011250.64<0.001叶绿素含量Leafchlorophyllconcentration1.420.220821.67<0.001比叶重Leafmassperarea3.490.005186.07<0.001
F和P分别为费舍尔统计检验值和显著性水平
2.2CUEL与种子来源地气候因子间的关系
CUEL与种子来源地的地理和气候因子间均存在一定的相关性,但其相关程度和趋势因相关因子而异(图3)。CUEL和种子来源地的平均年降水量(MAP)呈显著线性正相关关系(P=0.05,图3),但与其AI则呈显著线性负相关关系(P<0.01,图3)。CUEL均随种子来源地的年平均气温(AMT)和平均年蒸发量(MAE)增加而下降,但其相关性不显著(P值分别为0.66和0.19)(图3)。CUEL随着种子来源地经度和的纬度增加,均呈现出一定的变化规律,但相关性不显著(图3)。
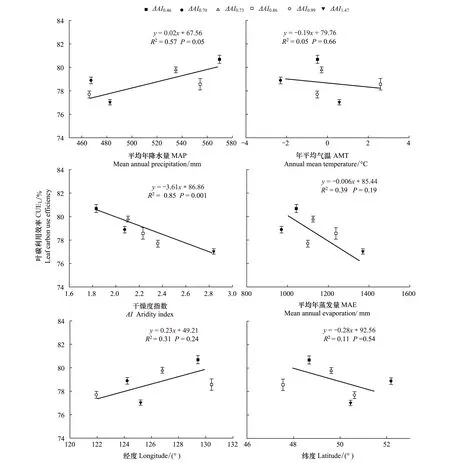
图3 不同环境梯度下叶碳利用效率(CUEL)与种子来源地年平均气温(AMT)、平均年降水量(MAP)、平均年蒸发量(MAE),干燥度指数(AI)、经度及纬度间关系(平均值±标准误差, n=42)Fig.3 Relationships between leaf carbon use efficiency (CUEL) and annual mean temperature (AMT), mean annual precipitation (MAP), mean annual evaporation (MAE), aridity index (AI), longitude, or latitude of the six seed source origins for L. gmelinii trees (mean±SE, n=42)
3讨论和结论
3.1影响CUEL的生物因子
本研究发现,来自6个环境梯度下的兴安落叶松在均质环境下生长30a后,其CUEL、Pmax和Rd均存在显著差异(P<0.05),且随ΔAI变化而呈现出明显的变化规律(图1)。这表明CUEL及其影响因子已产生了遗传变异,CUEL、Pmax和Rd在6个梯度间的遗传分化度分别达62.95%、50.07%、43.70%(表2)。随着ΔAI的增大,兴安落叶松Pmax和Rd均表现出增大的趋势,但Rd的增幅更大,因而CUEL表现出减小的趋势。这说明在环境变化条件下,呼吸比光合具有更大的敏感性,光合和呼吸的比值并不恒定,因而CUEL的发生变异。有研究认为,当温度和水分发生变化时,呼吸比光合更容易受到影响[22- 23]。室内控水试验表明,随着土壤含水率的降低,Rd和Pmax间的比值明显增大[24]。而在大尺度水平上的研究也表明,随着干旱程度的增加,Rd和Pmax间的比值呈增大趋势,并且在一定范围内,水分对呼吸的影响大于对光合的影响[25- 26]。本文仅研究了叶尺度的CUE,而在树木个体水平上是否也存在相似的规律尚需进一步验证。
氮和磷是直接参与树木光合生理代谢过程,进而影响CUEL。氮是氨基酸和核酸的必要组成成分之一,缺乏或过量都会导致叶绿素含量、酶含量和酶活性的下降,并进一步导致光合同化物的减少;因此,在一定的范围内,叶氮含量及利用效率与Pmax呈正相关关系[27- 30]。本研究结果表明,较大ΔAI梯度下的树木具有更高的NL,并且随着NL的增大,其CUEL增幅也明显高于其他梯度(图2)。磷通过影响有机磷循环及RuBP 酶的更新速率而影响叶的光合作用。在一定范围内,随着PL的增大,叶碳同化能力提高,Pmax增大[31]。与NL情况相似,6个环境变化梯度兴安落叶松CUEL和PL存在显著的线性正相关关系(P<0.05),但随着PL的增大,较大ΔAI梯度下的树木CUEL增幅也明显高于其他梯度(图2)。随着LMA的增大,较大ΔAI梯度下的树木具有更高的CUEL(图2),这是因为在干旱不利环境条件下树木为了提高水分利用效率而增大叶的传输组织厚度、叶肉厚度和叶总厚度,进而LMA增大[32- 35]。较大的叶肉厚度使得单位面积叶具有更多的光合构件,从而有利于Pmax的提高[35- 36]。叶绿素在光合作用中起着能量接收和转换作用[37- 38],因而叶绿素含量较高的树木具有较强的Pmax,进而具有较大的CUEL(图2)。
虽然较大ΔAI梯度下的树木具有较小的CUEL,但随着NL和PL的增大,其却表现出较高的CUEL增大幅度,说明较大ΔAI梯度下的树木具有更高的氮和磷利用率,这是因为较大AI环境下的土壤相对贫瘠,因此树木需要维持较高的氮和磷利用效率以提高光合速率。而随着叶绿素含量的增大,CUEL的增幅在6个ΔAI梯度间差异不显著,说明他们具有相同的叶绿素利用效率。而当CUEL为零时,NL、PL、LMA和叶绿素含量的初始值随着ΔAI的增大,均表现出显著增大的规律(P<0.01)。这表明较大ΔAI梯度下的树木叶光合碳同化物开始累积时,需要较高的生理基础条件。这是因为来自较大AI环境下的树木长期生长在相对干旱的环境中,需要更多的光合产物用于维持呼吸的消耗,只有当自身条件改善后,如NL和PL较高时,才能开始净光合产物的累积。
3.2影响CUEL的环境因子
本研究结果表明,随着种子来源地AI的增加,CUEL表现出减小的趋势,这是因为树木在不利的环境条件下为了获取足够的养分资源,会分配较少的光合产物用于生长[39], 而将较多的碳用于维持呼吸[40- 41],从而导致CUEL下降。树木具有较低CUEL的最终表现是树木生长速率较慢,生物量较小。前期研究表明,在6个梯度中,ΔAI1.47梯度下的树木具有最小的胸径和树高,而ΔAI0.46和ΔAI0.86两个梯度下的树木则分别具有最大的胸径和树高[32,42],这和CUEL在6个梯度间的大小排序恰为相反,这也间接支持了本研究所得结果。然而,需要说明的是,树木生物量的积累除了受到实际光合速率的影响外,还与总叶面积及总体呼吸消耗相关。因此,如何准确测定树木个体水平CUE需要进一步研究。
温度作为影响树木CUE最重要的气候因子,已得到广泛的关注[43- 44]。本研究结果显示,CUEL和种子来源地AMT间相关性不显著。原因之一是随着温度的变化,来自不同地区的树木其敏感性不同,因而导致CUEL和温度间相关性不明显[45]。例如:Piao等[44]研究认为,在年平均气温低于11 ℃的区域,呼吸与GPP的比率随温度的升高而减少,而在年平均气温高于11 ℃的地区,呼吸与GPP的比率随着气温的升高而增加。此外,CUEL除了受温度的影响外,还受降水、土壤等环境因子的调控。因此,仅用温度一个因子与其建立关系并不能取得好的效果。本文研究的6个梯度兴安落叶松树木CUEL和种子来源地MAP为线性正相关关系(图3)。这是因为降水量的减少导致总呼吸增加,而净初级生产力和光合速率的降低,从而引起CUE降低[18]。AI作为衡量温度和水分状况的一个综合指标,其与CUEL间的相关性要好于温度和水分。这表明CUEL受到温度、水分等因子综合作用的影响,这与以往对兴安落叶松生长的研究结果相符[19,46]。此外,本实验所选的6个环境梯度树木的地理经度和纬度的跨度分别为8°和5°,环境梯度变化较小,因此,今后研究需要加大环境变化梯度。
综上所述,CUEL既存在明显的环境梯度差异和遗传分化,又表现出和种子来源地环境因子间良好的相关关系。由此推理,环境变化使兴安落叶松叶碳利用效率产生了适应性变异,是树木对种子来源地气候条件长期适应的结果。
致谢:感谢黑龙江帽儿山森林生态系统国家野外科学观测研究站和林木遗传育种国家重点实验室(东北林业大学)提供的野外基础支持。
参考文献(References):
[1]Dillaway D N, Kruger E L. Trends in seedling growth and carbon-use efficiency vary among broadleaf tree species along a latitudinal transect in eastern North America. Global Change Biology, 2014, 20(3): 908- 922.
[2]朱万泽. 森林碳利用效率研究进展. 植物生态学报, 2013, 37(11): 1043- 1058.
[3]Malhi Y. The productivity, metabolism and carbon cycle of tropical forest vegetation. Journal of Ecology, 2012, 100(1): 65- 75.
[4]Bradford M A, Crowther T W. Carbon use efficiency and storage in terrestrial ecosystems. New Phytologist, 2013, 199(1): 7- 9.
[5]Giardina C P, Ryan M G, Binkley D, Fownes J H. Primary production and carbon allocation in relation to nutrient supply in a tropical experimental forest. Global Change Biology, 2003, 9(10): 1438- 1450.
[6]Ow L F, Whitehead D, Walcroft A S, Turnbull M H. Seasonal variation in foliar carbon exchange inPinusradiataandPopulusdeltoides: respiration acclimates fully to changes in temperature but photosynthesis does not. Global Change Biology, 2010, 16(1): 288- 302.
[7]Atkin O K, Holly C, Ball M C. Acclimation of snow gum (Eucalyptuspauciflora) leaf respiration to seasonal and diurnal variations in temperature: the importance of changes in the capacity and temperature sensitivity of respiration. Plant, Cell & Environment, 2000, 23(1): 27- 38.
[8]Tjoelker M G, Oleksyn J, Reich P B. Modelling respiration of vegetation: evidence for a general temperature-dependentQ10. Global Change Biology, 2001, 7(2): 223- 230.
[9]Gifford R M. Plant respiration in productivity models: conceptualisation, representation and issues for global terrestrial carbon-cycle research. Functional Plant Biology, 2003, 30(2): 171- 186.
[10]Loveys B R, Atkinson L J, Sherlock D J, Roberts R L, Fitter A H, Atkin O K. Thermal acclimation of leaf and root respiration: an investigation comparing inherently fast-and slow-growing plant species. Global Change Biology, 2003, 9(6): 895- 910.
[11]Atkin O K, Scheurwater I, Pons T L. High thermal acclimation potential of both photosynthesis and respiration in two lowlandPlantagospecies in contrast to an alpine congeneric. Global Change Biology, 2006, 12(3): 500- 515.
[12]Atkin O K, Tjoelker M G. Thermal acclimation and the dynamic response of plant respiration to temperature. Trends in Plant Science, 2003, 8(7): 343- 351.
[13]Dewar R C, Medlyn B E, McMurtrie R E. Acclimation of the respiration/photosynthesis ratio to temperature: insights from a model. Global Change Biology, 1999, 5(5): 615- 622.
[14]Bunce J A. Acclimation of photosynthesis to temperature in eight cool and warm climate herbaceous C3species: Temperature dependence of parameters of a biochemical photosynthesis model. Photosynthesis Research, 2000, 63(1): 59- 67.
[15]DeLucia E H, Drake J E, Thomas R B, Gonzalez-Meler M. Forest carbon use efficiency: is respiration a constant fraction of gross primary production?. Global Change Biology, 2007, 13(6): 1157- 1167.
[16]Zhang Y J, Xu M, Chen H, Adams J. Global pattern of NPP to GPP ratio derived from MODIS data: effects of ecosystem type, geographical location and climate. Global Ecology and Biogeography, 2009, 18(3): 280- 290.
[17]Malhi Y, Doughty C E, Goldsmith G R, Metcalfe D B, Girardin C A J, Marthews T R, Del Aguila-Pasquel J, Aragão L E O C, Araujo-Murakami A, Brando P, Da Costa A C L, Silva-Espejo J E, Amézquita F F, Galbraith D R, Quesada C A, Rocha W, Salinas-Revilla N, Silvério D, Meir P, Phillips O L. The linkages between photosynthesis, productivity, growth and biomass in lowland Amazonian forests. Global Change Biology, 2015, 21(6): 2283- 2295.
[18]Metcalfe D B, Meir P, Aragão L E O C, Lobo-do-Vale R, Galbraith D, Fisher R A, Chaves M M, Maroco J P, Da Costa A C L, De Almeida S S, Braga A P, Gonçalves P H L, De Athaydes J, Da Costa M, Portela T T B, De Oliveira A A R, Malhi Y, Williams M. Shifts in plant respiration and carbon use efficiency at a large-scale drought experiment in the eastern Amazon. New Phytologist, 2010, 187(3): 608- 621.
[19]杨传平, 姜静, 唐盛松, 李景云, 王会仁. 帽儿山地区21年生兴安落叶松种源试验. 东北林业大学学报, 2002, 30(6): 1- 5.
[20]Prado C H B A, De Moraes J A P V. Photosynthetic capacity and specific leaf mass in twenty woody species of Cerrado vegetation under field conditions. Photosynthetica, 1997, 33(1): 103- 112.
[21]Vitasse Y, Delzon S, Bresson C C, Michalet R, Kremer A. Altitudinal differentiation in growth and phenology among populations of temperate-zone tree species growing in a common garden. Canadian Journal of Forest Research, 2009, 39(7): 1259- 1269.
[22]Woodwell G M. Biotic effects on the concentration of atmospheric carbon dioxide: a review and projection // Changing Climate. Washington, D.C.: National Academy Press, 1983: 216- 241.
[23]Ryan M G, Hunt E R, McMurtrie R E, Ågren G I, Aber J D, Friend A D, Rastetter E B, Pulliam W M, Raison R J, Linder S. Comparing models of ecosystem function for coniferous forests. I. Model description and validation // Melillo J M, Ågren G I, Breymeyer A, eds. Global Change: Effects on Coniferous Forests and Grasslands. SCOPE 56. New York: John Wiley and Sons, 1996: 313- 362.
[24]储子彦, 亚热带39种植物的叶碳效率对环境因子的响应研究[D]. 杭州: 浙江大学, 2008.
[25]Wright I J, Reich P B, Westoby M, Ackerly D D, Baruch Z, Bongers F, Cavender-Bares J, Chapin T, Cornelissen J H C, Diemer M, Flexas J, Garnier E, Groom P K, Gulias J, Hikosaka K, Lamont B B, Lee T, Lee W, Lusk C, Midgley J J, Navas M L, Niinemets Ü, Oleksyn J, Osada N, Poorter H, Poot P, Prior L, Pyankov V I, Roumet C, Thomas S C, Tjoelker M G, Veneklaas E J. The worldwide leaf economics spectrum. Nature, 2004, 428(6985): 821- 827.
[26]Wright I J, Reich P B, Westoby M. Strategy shifts in leaf physiology, structure and nutrient content between species of high-and low-rainfall and high-and low-nutrient habitats. Functional Ecology, 2001, 15(4): 423- 434.
[27]Meziane D, Shipley B. Interacting determinants of specific leaf area in 22 herbaceous species: effects of irradiance and nutrient availability. Plant, Cell & Environment, 1999, 22(5): 447- 459.
[28]Wilson K B, Baldocchi D D, Hanson P J. Spatial and seasonal variability of photosynthetic parameters and their relationship to leaf nitrogen in a deciduous forest. Tree Physiology, 2000, 20(9): 565- 578.
[29]IIO A, Yokoyama A, Takano M, Nakamura T, Fukasawa H, Nose Y, Kakubari Y. Interannual variation in leaf photosynthetic capacity during summer in relation to nitrogen, leaf mass per area and climate within aFaguscrenatacrown on Naeba Mountain, Japan. Tree Physiology, 2008, 28(9): 1421- 1429.
[30]Gunderson C A, O′hara K H, Campion C M, Walker A V, Edwards N T. Thermal plasticity of photosynthesis: the role of acclimation in forest responses to a warming climate. Global Change Biology, 2010, 16(8): 2272- 2286.
[31]刘福德, 王中生, 张明, 王文进, 安树青, 郑建伟, 杨文杰, 张世挺. 海南岛热带山地雨林幼苗幼树光合与叶氮、叶磷及比叶面积的关系. 生态学报, 2007, 27(11): 4651- 4661.
[32]季子敬, 全先奎, 王传宽. 兴安落叶松针叶解剖结构变化及其光合能力对气候变化的适应性. 生态学报, 2013, 33(20): 6967- 6974.
[33]Witkowski E T F, Lamont B B. Leaf specific mass confounds leaf density and thickness. Oecologia, 1991, 88(4): 486- 493.
[34]Castro-Díez P, Puyravaud J P, Cornelissen J H C. Leaf structure and anatomy as related to leaf mass per area variation in seedlings of a wide range of woody plant species and types. Oecologia, 2000, 124(4): 476- 486.
[35]Gratani L, Meneghini M, Pesoli P, Crescente M F. Structural and functional plasticity ofQuercusilexseedlings of different provenances in Italy. Trees, 2003, 17(6): 515- 521.
[36]Robson T M, Sánchez-Gómez D, Cano F J, Aranda I. Variation in functional leaf traits among beech provenances during a Spanish summer reflects the differences in their origin. Tree Genetics & Genomes, 2012, 8(5): 1111- 1121.
[37]Raich J W, Russell A E, Vitousek P M. Primary productivity and ecosystem development along an elevational gradient on Mauna Loa, Hawai′i. Ecology, 1997, 78(3): 707- 721.
[38]Martin R E, Asner G P, Sack L. Genetic variation in leaf pigment, optical and photosynthetic function among diverse phenotypes ofMetrosiderospolymorphagrown in a common garden. Oecologia, 2007, 151(3): 387- 400.
[39]Vicca S, Luyssaert S, Peuelas J, Campioli M, Chapin III F S, Ciais P, Heinemeyer A, Högberg P, Kutsch W L, Law B E, Malhi Y, Papale D, Piao S L, Reichstein M, Schulze E D, Janssens I A. Fertile forests produce biomass more efficiently. Ecology Letters, 2012, 15(6): 520- 526.
[40]Chambers J Q, Tribuzy E S, Toledo L C, Crispim B F, Higuchi N, Santos J D, Araújo A C, Kruijt B, Nobre A D, Trumbore S E. Respiration from a tropical forest ecosystem: partitioning of sources and low carbon use efficiency. Ecological Applications, 2004, 14(S4): 72- 88.
[41]Huasco W H, Girardin C A, Doughty C E, Metcalfe D B, Baca L D, Silva-Espejo J E, Cabrera D G, Aragão L E O C, Davila A R, Marthews T R, Huaraca-Quispe L P, Alzamora-Taype I, Mora L E, Farfán-Rios W, Cabrera K G, Halladay K, Salinas-Revilla N, Silman M R, Meirf P, Malhi Y. Seasonal production, allocation and cycling of carbon in two mid-elevation tropical montane forest plots in thePeruvianAndes. Plant Ecology & Diversity, 2014, 7(1/2): 125- 142.
[42]平川, 王传宽, 全先奎. 环境变化对兴安落叶松氮磷化学计量特征的影响. 生态学报, 2014, 34(8): 1965- 1974.
[43]Marthews T R, Malhi Y, Girardin C A J, Silva Espejo J E, Aragão L E O C, Metcalfe D B, Rapp J M, Mercado L M, Fisher R A, Galbraith D R, FisherJ B, Salinas-Revilla N, Friend A D, Restrepo-Coupe N, Williams R J. Simulating forest productivity along a neotropical elevational transect: temperature variation and carbon use efficiency. Global Change Biology, 2012, 18(9): 2882- 2898.
[44]Piao S L, Luyssaert S, Ciais P, Janssens I A, Chen A P, Cao C, Fang J Y, Friedlingstein P, Luo Y Q, Wang S P. Forest annual carbon cost: a global-scale analysis of autotrophic respiration. Ecology, 2010, 91(3): 652- 661.
[45]Curtis P S, Vogel C S, Gough C M, Schmid H P, Su H B, Bovard B D. Respiratory carbon losses and the carbon-use efficiency of a northern hardwood forest, 1999—2003. New Phytologist, 2005, 167(2): 437- 456.
[46]杨传平, 秦泗华, 张维, 于秉君, 张鹏, 张培杲. 中国兴安落叶松种源试验研究(Ⅱ)——种源初步区划. 东北林业大学学报, 1990, 18(S2): 25- 33.
基金项目:国家“十二五”科技支撑项目(2011BAD37B01);教育部长江学者和创新团队发展计划(IRT_15R09);中央高校基本科研业务费专项资金资助项目(DL10BA19)
收稿日期:2015- 06- 30;
修订日期:2016- 01- 05
*通讯作者
Corresponding author.E-mail: wangck-cf@nefu.edu.cn
DOI:10.5846/stxb201506301346
Adaptation of leaf carbon use efficiency ofLarixgmeliniito environmental change
QUAN Xiankui, WANG Chuankuan*
CenterforEcologicalResearch,NortheastForestryUniversity,Harbin150040,China
Abstract:Dahurian Larch (Larix gmelinii) is a dominant tree species in Eurasian boreal forests, and has a broad biogeographical range under divergent habitats. This makes this tree species ideal for investigating tree adaptation to environmental change. Leaf carbon use efficiency (CUEL) is closely associated with tree carbon metabolism, and tree growth and development. Furthermore, CUEL is sensitive to environmental change. In this study, we measured the CUEL of 30-year-old Dahurian larch trees from six provenances in a common garden at the Maoershan Forest Ecosystem Research Station (45°20′N, 127°30′E) in Northeast China for three years (2009—2011). The six provenances were located across the natural distribution range of the larch, spanning approximately 4° in latitude (48—52°N), 5℃ in mean annual temperature (-2.3—2.6℃), and 200mm in mean annual precipitation (425—622mm). The differences in aridity index (ΔAI, AI = mean annual evaporation/ mean annual precipitation) between the current sites and original locations of the seed sources were used as indices for environmental change gradients (i.e., six provenances were represented as six gradients of environmental change). Our goal was to explore the impacts of environmental changes on larch CUEL and the factors influencing the impacts. We found that CUEL decreased significantly with increasing ΔAI (P<0.05). The CUEL was correlated positively with leaf nitrogen concentration, leaf phosphorus concentration, leaf mass per area, and leaf chlorophyll concentration, but the trees with higher ΔAI values had greater slopes of these relationships. Furthermore, the CUEL was correlated positively with the mean annual precipitation of the seed source original locations (P=0.05), but negatively with the AI of these locations (P<0.01). The CUEL also tended to increase with increasing mean annual temperature and mean annual evaporation of the seed source original locations, but these relationships were not significant (P>0.05). Our results suggest that environmental changes drive the adaptive variability in CUEL of the larch, which is probably attributed to its genotypic adaptation to the environment of the seed source locations.
Key Words:Larix gmelinii; photosynthesis; carbon use efficiency; genotypic adaptation; Maoershan Forest Ecosystem Research Station; common garden experiment
全先奎,王传宽.兴安落叶松叶碳利用效率对环境变化的适应.生态学报,2016,36(11):3381- 3390.
Quan X K, Wang C K.Adaptation of leaf carbon use efficiency ofLarixgmeliniito environmental change.Acta Ecologica Sinica,2016,36(11):3381- 3390.
