西南喀斯特地区两种草本对干湿交替和N添加的生长响应
2016-08-09高凯敏刘锦春梁千慧陶建平
李 周,高凯敏,刘锦春, 梁千慧,陶建平
三峡库区生态环境教育部重点实验室,重庆市三峡库区植物生态与资源重点实验室,西南大学生命科学学院, 重庆 400715
西南喀斯特地区两种草本对干湿交替和N添加的生长响应
李周,高凯敏,刘锦春*, 梁千慧,陶建平
三峡库区生态环境教育部重点实验室,重庆市三峡库区植物生态与资源重点实验室,西南大学生命科学学院, 重庆400715
摘要:喀斯特地区的“岩溶干旱”和频繁的变水环境成为喀斯特地区植被生长和分布的重要选择压力,是该地区植被恢复重建的主要障碍因子。N沉降也会对喀斯特地区的生态系统造成难以预测的影响。为了探究喀斯特地区草本植物对干湿交替和N添加的生长响应,以苍耳(Xanthium sibiricum)和三叶鬼针草(Bidens pilosa)为研究对象,通过盆栽水分受控实验,研究了5种不同水分处理[对照组(CK)、干旱组(D)、1周干湿交替处理组(DW- 1)、2周干湿交替处理组(DW- 2)和3周干湿交替处理组(DW- 3)]与N添加(N+、N-)对两种草本植物生长和生物量的影响。结果表明,干旱胁迫抑制了植物生长和生物量的积累,株高、叶面积、总根长和根体积等生长指标和地上生物量均显著降低,根冠比增大。不同程度的干湿交替对植物的生长和生物量的积累均表现出一定程度的补偿效应,但这种补偿效应的大小随着干旱持续时间的延长而减弱。N添加对植物的生长和生物量积累有显著地促进作用,株高、根表面积、根体积和根生物量较对照组显著增加,但这种促进作用随着干旱历时的增加而减弱,可能与土壤水分状况有关。同时,N添加还影响着植物生物量的分配,在促进两种植物地上和地下生长的同时,还促进了植物根冠比的增加。
关键词:石灰岩; 干湿交替; N添加; 生长状况; 生物量积累和分配
喀斯特地区岩石裸露率高、土层浅薄、贮水能力低、岩石渗漏性强,地表水分亏缺频繁发生,植物常常遭到干旱胁迫;当极端降雨事件过后,干旱得到缓解,喀斯特生境成为暂时性的水湿环境。这种频繁的干湿交替环境成为喀斯特地区植被生长和分布的重要选择压力,也是该地区植被恢复重建的主要障碍因子[1]。有研究指出对干旱有高耐受性的植物往往对水湿环境的耐受性较低[2],植物对水湿环境的耐受能力主要取决于干旱的处理时间[3]。Boyer等[4- 5]对多种植物进行干旱复水实验后发现,植物的生长对于干旱的敏感性要远远大于光合和细胞分裂,适度缺水时作为生长驱动力的膨压下降引起生长停止,而此时光合作用和细胞分裂并未受到明显影响。Hsiao等[6]也指出,叶的扩展生长对缺水最为敏感,轻微的胁迫就会使其受到明显的抑制。
近年来人类活动导致大气中含N化合物浓度激增并向陆地和水生生态系统沉降[7- 8],导致陆地生态系统固N量成倍增加[9- 10]。N是植物所需的重要元素之一,影响植物的生长和生物量分配。许多研究发现,适量的N添加能促进植物生长、叶面积增大和地上部分干重的积累,还能提高叶片的蛋白质含量和改善植物体内的水分状况,提高植物的抗旱性[11- 12]。但也有研究指出,N添加在促进植物叶面积扩大和地上部分生长的同时,也增大了蒸腾面积而不利于植物的水分利用和生长,使植物对干旱更加敏感[13- 14]。此外,有研究发现土壤水分状况会影响植物对N的吸收[15],因此,有学者认为N添加是否能够促进植物的生长与土壤水分含量也有一定关系[16]。
在喀斯特生态系统中,干旱、干湿交替的变水环境和N沉降等环境因子相互作用,共同影响该地区植物的生长、发育和繁殖,从而决定其生产力。目前关于喀斯特生态系统中植物对干旱的适应性或耐受性的研究已经颇多,却很少关注植物对干湿交替的响应,而对干湿交替和N添加相互作用的研究更是甚少。苍耳(Xanthiumsibiricum)和三叶鬼针草(Bidenspilosa)均为菊科一年生草本植物,能够耐干旱瘠薄,对外界环境有着极强的适应能力,在西南喀斯特地区广泛分布,为该地区的先锋适生植物。同时,研究发现,三叶鬼针草对水分变化具有较大的表型可塑性和入侵适应性特征,能迅速响应外界环境变化,在不利条件下能迅速调整各生长和生理特征以有效适应外界环境[17]。因此,本研究拟选择苍耳和三叶鬼针草为研究对象,模拟喀斯特地区生境特点,通过盆栽水分受控实验,探讨以下问题:
(1)干旱和干湿交替对喀斯特一年生草本植物的生长和生物量积累有何影响?
(2)N添加是否会促进干旱和(或)干湿交替下喀斯特一年生草本植物的生长?
(3)在干湿交替中,随着干旱时间的延长,N添加的作用又会发生何种变化?
1材料与方法
1.1试验材料
本实验供试材料苍耳(X.sibiricum)和三叶鬼针草(B.pilosa)的种子均采自重庆市中梁山海石公园。供试土壤为该地区黄色石灰土,土壤的基本理化性质:pH为7.4±0.14,有机质为(0.34±0.02)%,全氮为(0.28±0.03)g/kg,全磷为(0.39±0.02)g/kg,全钾为(23.7±3.22)g/kg,测得田间持水量为(39.8±2.23)%。
1.2试验设计
选取本院2011年5月—2017年6月收治的术后病理确诊为阴茎鳞状细胞癌的50例患者为研究对象,患者均于术后1年内(中位时间为8个月)进行18F-FDG PET/CT检查。中位年龄为64岁(年龄范围:30~76岁)。临床分期采用Jackson分期法,Ⅰ期25例,Ⅱ期16例,Ⅲ期6例,Ⅳ期3例。
2014年4月,将采集到的籽粒饱满的苍耳瘦果和三叶鬼针草种子浸泡后播种,正常浇水育苗,待幼苗长出一对真叶后选取生长整齐、高矮一致的幼苗移栽于内径为17cm的塑料花盆中(干土1.6kg),适应生长2周(长出2对真叶)后进行N添加和水分处理。N处理有两个水平:对照组不添加N(N-)和实验组添加N(N+)。N+组的施氮量是根据西南喀斯特土壤水分特征[18- 20]、当地近20年的平均年降水量在各月的分配以及当地降水中有关N含量测定的资料计算所得,N+组每周对植株喷施浓度为0.69mg/L的NH4NO3溶液50mL,N-组喷施等量清水。
水分处理有5个水平:对照组(CK),干旱处理组(D)和干湿交替处理组(DW- 1,DW- 2和DW- 3)。对照组(CK)的土壤含水量始终保持在田间持水量的80%—90%;干旱组(D)的土壤含水量始终保持在田间持水量的40%—50%;干湿交替组(DW- 1,DW- 2和DW- 3)先“干”后“湿”,“干”保持在田间持水量的40%—50%,“湿”为过饱和复水,复水后使其自然失水至“干”,如此反复。其中每两次复水中的“干”期分别为1周、2周和3周。实验处理历时111d,其中DW- 1干湿交替处理8次,DW- 2干湿交替处理5次,DW- 3干湿交替处理4次。每个处理设置7个重复。不同水分处理的土壤含水量用传统称重法进行控制[21],各处理达到实验设计要求的土壤含水量时,用天平称量盆、植株和土壤总重量(Wtc),之后每天16:00称量实际重量(Wtt),由于植株蒸腾、蒸发及土壤蒸发,使土壤含水量降低,因此每天需对供试植株盆中补充水分(包含每周施加的NH4NO3溶液,剩余的量用清水补齐),补充水分(Wtm)由下式决定:Wtm=Wtc-Wtt,如果Wtc=Wtt则不必补水。处理过程中每3d/次跟踪测定土壤含水量。
实验过程中土壤含水量的变化如下:对照组CK 的土壤含水量为(87±1.95)%;干旱处理组D的土壤含水量为(46±1.4)%;干湿交替处理组DW- 1、DW- 2、DW- 3在“干”条件下土壤含水量分别为(43±1.6)%、(46±2.0)%、(50±2.1)%。试验在西南大学生态园雨棚内完成,园地海拔高度为249m,实验过程中定期除草,尽量减少处理外其他因素的干扰。
1.3指标测定与数据处理
所有试验处理完成后对植株进行指标采集。
(1)株高、叶片、根系形态指标测定用直尺测量株高。幼苗单株取出,流水冲洗,通过数字化扫描仪(STDl600Epson USA)扫描植物叶片及完整的根系图像存入计算机,用win.Rhzo (Version 410B)根系分析系统软件(Regent Instmment Inc,Canada)对叶面积、总根长、根表面积和根体积等指标进行定量分析;
(2)生物量的测定将扫描后的根系、茎、叶片装入牛皮纸袋,置于105℃烘箱中杀青15min,然后在80℃下烘干至恒重,再称量各部分的干重,进一步计算总生物量,根生物量,地上部分生物量,根冠比=单株地下生物量/地上部分生物量;
(3)数据处理实验数据的处理和分析在SPSS(SPSS 19.0 for Windows,SPSS Inc,C11icago,USA)基础上完成。利用Three-way ANOVA分析3因素(物种、水分处理、氮素)对两种草本植物生长特征和生物量的影响;利用One-way ANOVA分析相同N水平下同一物种各指标在不同水分处理间的差异;利用T-test方法检测相同水分条件下同一物种在两种施N处理下各指标的差异,P<0.05表示差异显著。利用Origin 8.6软件作图。
2结果2.1地上部分生长对干湿交替与N添加的响应
水分处理中,干旱胁迫显著抑制了苍耳和三叶鬼针草的株高和叶面积;干湿交替下两物种的株高和叶面积较干旱组均有一定程度的恢复(图1)。在N素处理中,N添加显著促进了苍耳和三叶鬼针草植株的株高,但对叶面积没有显著影响,在3组干湿交替中,随着干旱时间的延长,N添加的促进作用减弱(表1,图1)。三因素方差分析表明株高和叶面积在物种、N和水分处理的交互作用下均有显著差异(表1)。
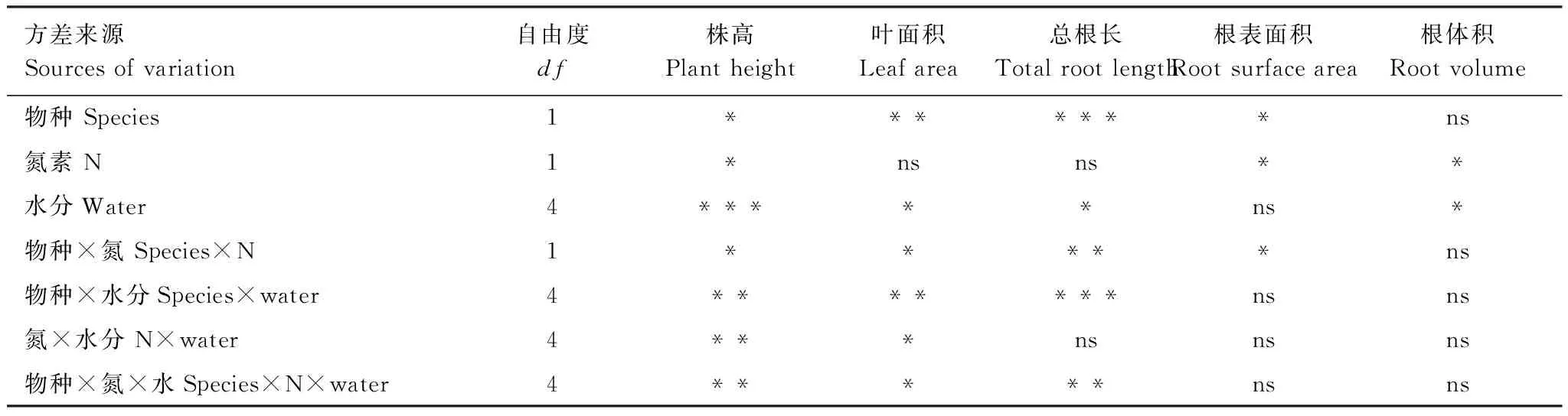
表1 植物生长指标的三因素方差分析
ns未达到显著水平(P>0.05),* 显著水平P<0.05,**P<0. 01,***P<0.001极显著水平

图1 干湿交替和N添加对苍耳和三叶鬼针草植株高度及叶面积的影响(平均值±标准误)Fig.1 Effect of alternating drying-wetting and N addition on plant height and leaf area of X.sibirium and B.pilosa (M±SE)柱上不同小写字母和大写字母分别表示相同水分条件下不同N处理间和相同N处理下不同水分处理间差异显著(P<0.05)
2.2地下部分生长对干湿交替与N添加的响应
与对照相比,干旱条件下苍耳和三叶鬼针草的根系生长受限,总根长和根体积均显著下降;干湿交替处理下两物种各根系生长指标较干旱组均有一定程度的恢复,但随着干旱时间的延长,补偿作用减弱(表1,图2)。
N添加对苍耳和三叶鬼针草的总根长没有显著影响,但对两物种的根表面积和根体积有显著促进作用(表1,图2)。三因素方差分析表明总根长在物种、N和水分处理的交互作用下具有显著差异,而根体积和根表面积两个指标没有(表1)。
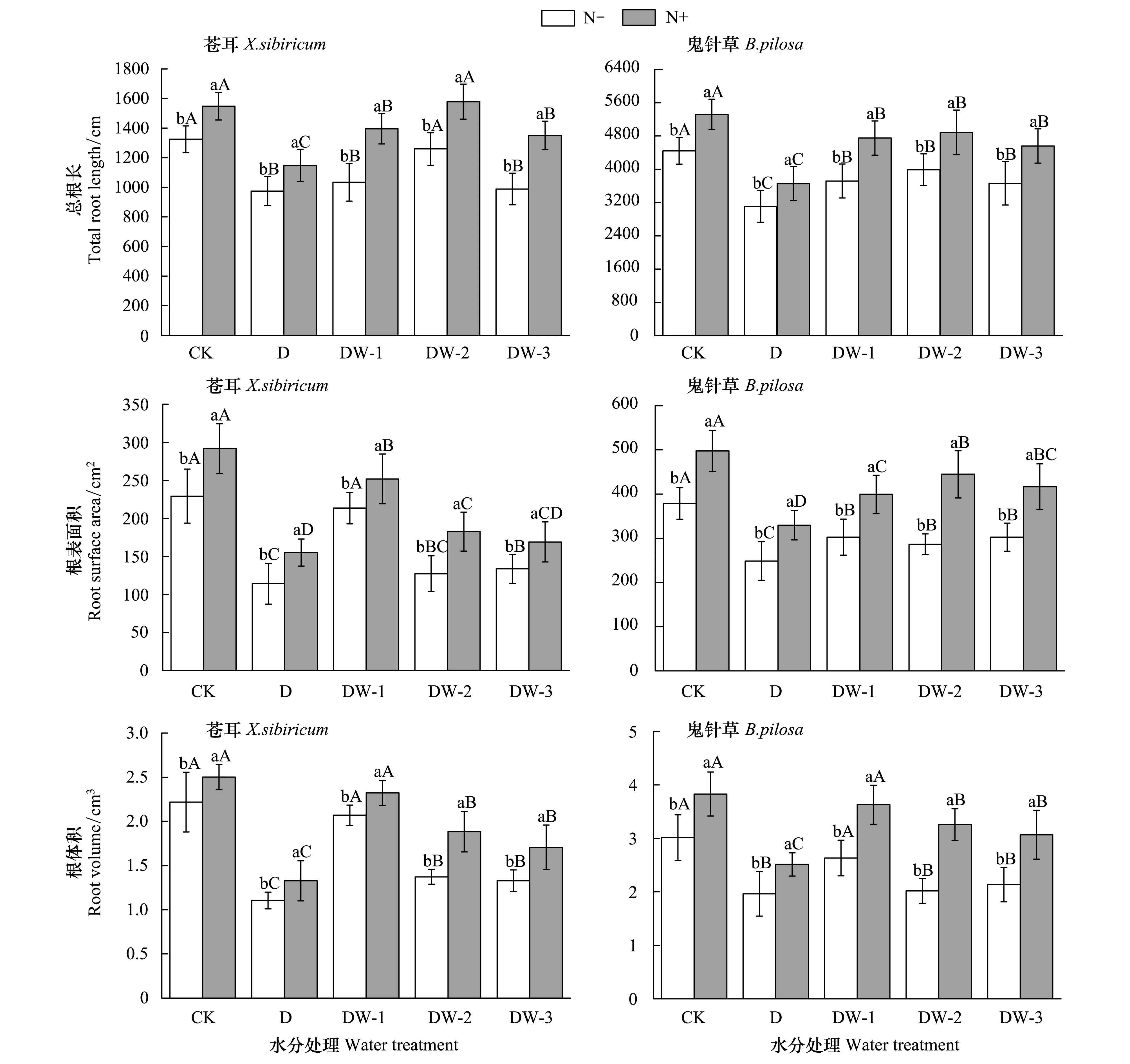
图2 干湿交替和N添加对苍耳和三叶鬼针草地下部分生长的影响(平均值±标准误)Fig.2 Effect of alternating drying-wetting and N addition on belowground growth of X.sibirium and B.pilosa (M±SE)
2.3生物量积累及分配对干湿交替与N添加的响应
与对照相比,干旱处理显著降低了苍耳和三叶鬼针草的地上部分生物量,而对根生物量和总生物量没有显著影响;干湿交替处理对植物生物量的积累表现出现了一定程度的补偿效应,对根生物量和总生物的补偿作用随着干旱时间的延长而减弱(表2,图3)。
N添加对根生物量有显著的促进作用,但对地上部分生物量和总生物量并没有明显的促进作用(表2,图3)。三因素方差分析表明,地上、地下部分生物量和总生物量在物种、N和水分处理的交互作用下具有显著差异(表2)。
表2植物生物量积累和分配指标的三因素方差分析
Table 2Results of Three-way ANOVA test for the effects of species, N and water availability on plant biomass accumulation and allocation
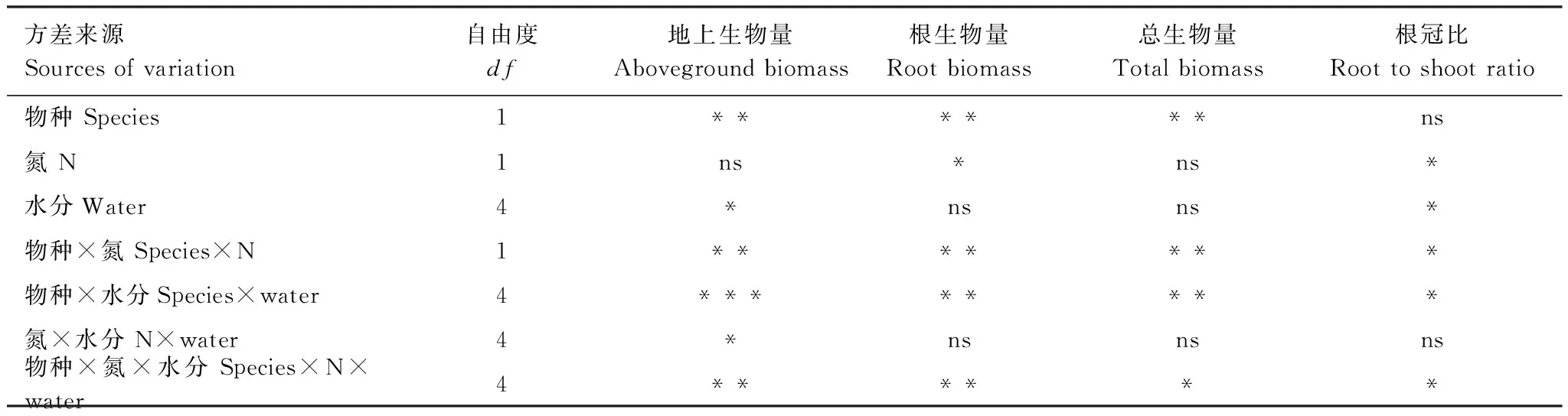
方差来源Sourcesofvariation自由度df地上生物量Abovegroundbiomass根生物量Rootbiomass总生物量Totalbiomass根冠比Roottoshootratio物种Species1******ns氮N1ns*ns*水分Water4*nsns*物种×氮Species×N1*******物种×水分Species×water4********氮×水分N×water4*nsnsns物种×氮×水分Species×N×water4******
ns未达到显著水平P>0.05,* 显著水平P<0.05,**P<0. 01,***P<0.001极显著水平

图3 干湿交替和N添加对苍耳和三叶鬼针草地上、地下及总生物量的影响(平均值±标准误)Fig.3 Effect of alternating drying-wetting and N addition on above- and belowground biomass and total biomass of X.sibirium and B.pilosa (M±SE)
水分处理和N添加对植物根冠比的影响均达到显著水平,根冠比在物种间不存在显著差异(表2)。物种和水分、物种和氮素以及三因素的交互作用对根冠比的影响均达到显著水平。与对照相比,根冠比在干旱和干湿交替处理中显著增大。干湿交替中随着干旱时间的延长,两种植物的根冠比都呈现先升高后不变的趋势(图4)。N素添加显著促进了两种植物根冠比的增加,在干湿交替中,随着干旱时间的延长,促进作用逐渐减弱(表2,图4)。
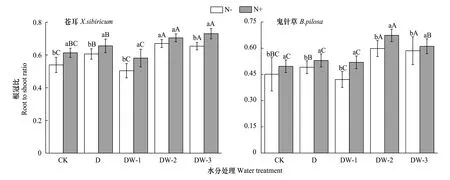
图4 干湿交替和N添加对苍耳和三叶鬼针草根冠比的影响(平均值±标准误) Fig.4 Effect of alternating drying-wetting and N addition on root to shoot ratio of X.sibirium and B.pilosa (M±SE)
3讨论
植物的生长状况对水分不足有着最直接的敏感性,干旱胁迫会引起植物水分亏缺,从而延缓、停止或破坏植物的正常生长,且胁迫程度越高,抑制现象越明显[22- 23]。王晨阳[24]发现在土壤水分不足的条件下,植物茎节伸长迟缓,株高降低,杆变细,随着水分亏缺程度的加剧,各位叶的长度及叶面积减少。而大量研究表明,旱后复水下植物的生长指标可得到一定程度的恢复,从而部分弥补干旱所造成的伤害[25]。本实验中,干旱胁迫显著抑制了苍耳和三叶鬼针草地上部分的生长活动,水分不足使植物茎间活动和叶面积的扩大受到抑制,株高和叶面积较对照组明显降低。不同干旱时间后复水对苍耳和鬼针草的株高和叶面积都表现出一定的补偿作用,株高在旱后复水处理下甚至出现了过补偿效应[26]。旱后复水对叶面积的补偿作用随着干旱历时的增长而减弱,过长时间的干旱处理,对植物叶片组织造成了严重的破坏,导致叶面积难以恢复到对照组水平。
植物根系生长发育动态及形态特征是其生物学特征与环境因素共同作用的结果[27],根系深度反应了植物对干旱环境的响应[28]。普遍认为,土壤水分的降低会诱导植物增加根系深度来寻求土壤深处的水源,从而适应缺水环境。然而,也有研究报道,过度的水分胁迫会导致根系生长速率降低,根长、根数和重量明显减少[29]。刘锦春等[30]也发现,轻度干旱可诱导柏木根系深扎,复水后,根长在原有基础上进一步深扎,而重度干旱则会严重影响根长生长,复水后不能恢复到对照组水平。苍耳和鬼针草的各根系生长指标(总根长、根表面积和根体积)随着干旱历时的增加呈现下降趋势,干旱胁迫并未诱导植物发展更大更深的根系,可能是由于干旱胁迫时间过长,严重干旱对苍耳和鬼针草的根系造成了损害,抑制了其生长,植株不得不转换策略,采取只需要较少碳资源投入的小根系增强竞争力,以适应瘠薄干旱的土壤[31]。同时,旱后复水对植物根系生长具有一定程度的补偿作用,干湿交替组的总根长较干旱组有一定的回升,复水后DW- 1组和DW- 2组能恢复到对照水平,而DW- 3组则不能得到恢复,说明长时间的干旱对根系造成的破坏是不可逆的,旱后复水能刺激根系的生长,在一定程度上缓解和削弱干旱对植物生长造成的损害,但这种补偿作用与胁迫程度的强弱有关,当胁迫强度过大(或)超过阈值时,补偿作用会减弱甚至消失。
生物量是衡量植株生长状况的重要指标,在考虑干旱胁迫及复水对植物的影响时,必须要关注植物干物质的积累和分配。干旱对植物的影响最终也反映在植株的生物量上[32]。许多研究表明,干旱胁迫会抑制植物总生物量的积累,当植物处于轻度干旱胁迫时,地上部分的生物量下降,根部的生物量增加,而当植物处于重度干旱胁迫时,地上部分和地下部分的生物量都出现下降的趋势[33- 36]。陈科皓等[37]发现,干旱后复水有利于促进植物生物量的积累,不同程度干旱处理后复水,单株生物量显著高于对照,同时还能刺激植物根系的生长,促进地下部分生物量的增加。干旱胁迫破坏了苍耳和鬼针草叶片的生长活动,导致光合作用的下降,生物量的积累受到明显抑制,地上部分生物量显著下降,根生物量和总生物量较对照组也明显降低,但不显著。旱后复水刺激了植物的各个器官的生长,使得植物有机物的积累较干旱组更高,但随着干旱历时的延长,对各器官不可逆的破坏,导致这种补偿作用的减弱。干旱组和干湿交替组的根冠比均高于对照组,干旱胁迫加剧时,尽管植物地上和地下部分的生物量都有所下降,但植物选择将较多的碳水化合物分配到地下的根部,提高植株对土壤水的获取能力,缓解干旱胁迫对植物产生的抑制作用。
一定量的N沉降有利于植物的光合作用和生产力的提高,还会改变植株的形态结构,集中表现为根冠比减小。但过量的N沉降不仅不利于植物的光合作用和有机物的积累,而且还会增加植物对干旱的敏感性,降低其抵御能力[38]。肖升木等[39]认为,N的施加对植物地上部分生长有促进作用,但会对根部的生长产生不良影响。而张绪成等[40]却认为,N素不仅能提高植物的光合速率和水分利用效率,还能促进根系和地上部分生长。姜琳琳等[41]也发现,在一定范围内,供N量的增加能够促进玉米地上部分的生长,也能促进玉米根重的增加,而高量供N会抑制根系的生长,导致根冠比下降。本实验中,在不同的水分条件下N素的添加不仅有利于苍耳和鬼针草地上部分的生长,同时也促进了两种植物地下部分的生长,株高、根表面积和根体积均显著增加。同时,N添加促进了两种植物生物量的积累,并且显著促进了根生物量的增加。由于干旱时间的增长,土壤中水分含量的下降,N添加对植物生长和生物量的促进作用逐渐减弱。此外,N素的添加还影响了植物生物量的分配,提高了植物的根冠比。干旱胁迫抑制了植物的生长,而此时N素的添加促进了植物的光合作用和有机物的积累,在促进植物地上和地下部分生物量积累的同时,植物通过发展更多根系来寻求土壤中的水源,增强自身对干旱胁迫的耐受性。
参考文献(References):
[1]朱守谦.喀斯特森林生态研究Ⅲ.贵阳:贵州科技出版社,2003:30- 37.
[2]Kozlowski T T. Responses of woody plants to flooding and salinity. Tree Physiology Monograph,1997,1(1): 1- 29.
[3]Nakai A, Yurugi Y, Kisanuki H. Stress responses inSalixgracilistylacuttings subjected to repetitive alternate flooding and drought. Trees, 2010, 24(6): 1087- 1095.
[4]Boyer J S. Leaf enlargement and metabolic rates in corn, soybean and sunflower at various leaf water potentials. Plant Physiol,1970, 46(2):233- 235.
[5]Meyer R F,Boyer J S.Sensitivity of cell division and cell elongation to low water potentials in soybean hypocotyls. Planta,1972, 108(1):77- 87.
[6]Hsiao T C and J H Jing. Leaf and root expansive growth in response to water deficits. Physiology of Cell Expansion During Plant Growth.eds.d.j.cosgrove & D.p.knievel.am.soc.plant Physiol,1987:180-192.
[7]Vitousek P M,Aber J D,Howarth R W,Llkens G E,Matson P A,Schindler W H,Tilman D G.Human alteration of the global nitrogen cycle:sources and consequences.Ecological Applications,1997,7(3):737- 750.
[8]Kaiser J. The other global pollutant:nitrogen proves tough to curb.Science,2001,294(5545):1268- 1269.
[9]Galloway J N,Schlesinger W H,Levy II H,Michaels A J,Schnoor L.Nitrogen fixation:anthropogenic enhancement-environmental response.Global Biogeochemical Cycles,1995,9(2):235- 252.
[10]Vitousek P M,Farrington H.Nutrient limitation and soil development:experimental test of a biogeochemical theory. Biogeochemistry, 1997,37(1):63- 75.
[11]张岁岐,山仑.氮素营养对春小麦抗旱适应性及水分利用的影响.水土保持研究,1995,2(1):31- 35,55- 55.
[12]Ashraf M,Shabaz M,Ashraf M Y. Influence of nitrogen supply and water stress on growth and nitrogen,phosphorus,potassium and calcium contents in pearl millet.Biologia Plantarum,2001,44(3):459- 462.
[13]Shanguan Z P,Shao M A,Dyckmans J. Nitrogen nutrition and water stress effects on leaf photosynthetic gas exchange and water use efficiency in winter wheat. Environmental and Experimental Botany,2000,44(2):141- 149.
[14]Lu D Q,Yang J R,Ma L Y.Study on effect of irrigation on soil nitrate leaching and uptake.Plant Nutrition and Fertilizer Science, 1999,5(4):307- 315.
[15]梁银丽,陈培元.水分胁迫和氮素营养对小麦根苗生长及水分利用效率的效应.西北植物学报,1995,15(1):21- 25.
[16]薛青武,陈培元.土壤干旱条件下氮素营养对小麦水分状况和光合作用的影响.植物生理学报,1990,16(1):49- 56.
[17]潘玉梅,唐赛春,韦春强,刘明超.不同光照和水分下三叶鬼针草与本地种金盏银盘生长特征的比较研究.热带亚热带植物学报,2012,20(5):489- 496.
[18]周浩,杨宝钢,程炳岩.重庆近46年气候变化特征分析.中国农业气象,2008,29(1):23- 27.
[19]袁玲,周鑫斌,辜夕容,黄建国.重庆典型地区大气湿沉降氮的时空变化.生态学报,2009,29(11):6095- 6101.
[20]王家文,周跃,肖本秀,李江苏.中国西南喀斯特土壤水分特征研究进展.中国水土保持,2003,(2):37- 41.
[21]刘锦春,钟章成,何跃军.干旱胁迫及复水对喀斯特地区柏木幼苗活性氧清除系统的影响.应用生态学报,2011,22(11):2836- 2840.
[22]尹丽,胡庭兴,刘永安,姚史飞,马娟,刘文婷,何操.干旱胁迫对不同施氮水平麻疯树幼苗光合特性及生长的影响.应用生态学报,2010,21(3):569- 576.
[23]桑子阳,马履一,陈发菊.干旱胁迫对红花玉兰幼苗生长和生理特性的影响.西北植物学报,2011,31(1):109- 115.
[24]王晨阳.土壤水分胁迫对小麦形态及生理影响的研究.河南农业大学学报,1992,26(1):89- 98.
[25]山仑,邓西平,苏佩,张岁岐,黄占斌,张正斌.挖掘作物抗旱节水潜力——作物对多变低水环境的适应与调节.中国农业科技导报,2000,2(2): 66- 70.
[26]山仑,苏佩,郭礼坤,刘晚苟.不同类型作物对干湿交替环境的反应.西北植物学报,2000,20(2):164- 170.
[27]张娜,梁一民.干旱气候对白羊草群落地下部分生长影响的初步观察.应用生态学报,2002,13(7):827- 832.
[28]Schuulze E D,Mooney H A,Sala O E.Rooting depth,water availability,and vegetation cover along an aridity gradient in Patagonia.Oecologia,1996,108(3):503- 511.
[29]孙梅霞,祖朝龙,徐经年.干旱对植物影响的研究进展.安徽农业科学,2004,32(2):365- 367,384- 384.
[30]刘锦春,钟章成.水分胁迫和复水对石灰岩地区柏木幼苗根系生长的影响.生态学报,2009,29(12):6439- 6445.
[31]Bemtson G M.Modelling root architecture:are there tradeoffs between efficiency and potential of resource aquisition ?New Phytologist,1993,127(3):483- 493.
[32]张恒月,郭屹立,王磊,魏巍,丁圣彦.干旱和复水对大豆叶片光合生理特性及产量的影响.河南大学学报:自然科学版, 2009,39(2):183- 188.
[33]李芳兰,包维楷,吴宁.白刺花幼苗对不同强度干旱胁迫的形态与生理响应.生态学报,2009,29(10):5406- 5416.
[34]贺海波,李彦.干旱、盐胁迫条件下两种盐生植物生物量分配对策的研究.干旱区研究,2008,25(2):242- 247.
[35]刘长利,王文全,崔俊茹,李帅英.干旱胁迫对甘草光合特性与生物量分配的影响.中国沙漠,2006,26(1):142- 145.
[36]闫海霞,方路斌,黄大庄.干旱胁迫对条墩桑生物量分配和光合特性的影响.应用生态学报,2011,22(12):3365- 3370.
[37]陈科皓,王进鑫,李继文.不同生长期旱后复水对侧柏幼苗生物量的影响.西北林学学院报,2015,30(2):38- 43.
[38]李德军,莫江明,方运霆,彭少麟,Gundersen P.氮沉降对森林植物的影响.生态学报,2003,23(9):1891- 1900.
[39]肖升木,谢学辉,薛凯,周集中,柳建设.氮沉积效应对植物生长及土壤微生物群落结构的影响.东华大学学报:自然科学版,2010,36(6):665- 669.
[40]张绪成,郭天文,谭雪莲,高世铭,上官周平.氮素水平对小麦根-冠生长及水分利用效率的影响.西北农业学报,2008,17(3):97- 102.
[41]姜琳琳,韩立思,韩晓日,战秀梅,左仁辉,吴正超,袁程.氮素对玉米幼苗生长、根系形态及氮素吸收利用效率的影响.植物营养与肥料学报,2011,17(1):247- 253.
基金项目:国家自然科学基金资助项目(31500399);重庆市自然科学基金资助项目(cstc2014jcyjA80016);教育部第49批留学回国人员科研启动基金资助项目
收稿日期:2015- 06- 30;
修订日期:2015- 11- 27
*通讯作者
Corresponding author.E-mail: jinchun@swu.edu.cn
DOI:10.5846/stxb201506301360
Growth response of two annual herb species to alternating drying-wetting and nitrogen addition in the karst area of Southwest China
LI Zhou,GAO Kaimin,LIU Jinchun*,LIANG Qianhui,TAO Jianping
KeyLaboratoryofEco-environmentinThreeGorgesReservoirRegion,ChongqingKeyLaboratoryofPlantEcologyandResourceResearchinThreeGorgesReservoirRegion,SchooloflifeScience,SouthwestChinaUniversity,Chongqing400715,China
Abstract:Plants growing in the subtropical karst region of China are frequently subjected to periodical drought stress within a growing season. The available soil water is sufficient for plant transpiration needs for only 7—14 days following heavy rainfall exceeding soil field capacity, because of the shallow soils and highly porous limestone in this region. However, frequent precipitation in the form of extreme rainfall events allows the soils to remain wet before or after drought. Therefore, "karst drought" and strong fluctuations in water availability are becoming important selection pressure for vegetation growth and distribution in the karst region. In recent years, the concentration of atmospheric nitrogen compounds has been increasing sharply owing to human activities. Nitrogen deposition in a global context also has unpredictable impact on the ecological system in karst region. Thus,simultaneously exploring the response of plants to frequent alternation of drying and wetting and nitrogen deposition and their interaction in vulnerable karst vegetation is necessary; we used two Asteraceae annual herbs, Xanthium sibiricum and Bidens pilosa as the experimental materials. These two species were selected since they are native species,are widely distributed in the southwest karst area of China, and have a strong ability to adapt to the abiotic environment and to tolerate dry and barren conditions. We manipulated three factors (species, water treatment and nitrogen addition) in a factorial randomized design to determine how the two species respond to the different water treatments and nitrogen addition in terms of above- and belowground growth and biomass accumulation. The following results were obtained.Plant growth was markedly restrained by drought stress. Stem length, leaf area, total root length, root volume and aboveground biomass in both the species were significantly lower than thoes of the control whose soil water content was kept in 80%—90% of field capacity. However, the root to shoot ratio of both the species increased significantly. Re-watering after different periods of drought somewhat compensated for the decrease in the growth and biomass accumulation of the plants. However,the compensation effect was related to the drought period, and decreased with prolongation of drought. Nitrogen addition promoted plant growth and singnificantly increased the total and above- and belowground biomass. However, the stimulatory effect of nitrogen addition was weakened with increasing drought duration, which was probably related to the decreased soil moisture. Nitrogen addition also significantly affected the biomass allocation:it increased the root to shoot ratio and stimultaneously stimulated the above- and belowground growth of plants.
Key Words:calcareous region; alternating drying-wetting; nitrogen addition; growth; biomass accumulation and allocation
李周,高凯敏,刘锦春, 梁千慧,陶建平.西南喀斯特地区两种草本对干湿交替和N添加的生长响应.生态学报,2016,36(11):3372- 3380.
Li Z,Gao K M,Liu J C,Liang Q H,Tao J P.Growth response of two annual herb species to alternating drying-wetting and nitrogen addition in the karst area of Southwest China.Acta Ecologica Sinica,2016,36(11):3372- 3380.
