模拟氮沉降对不同类型生物土壤结皮生长和光合生理的影响
2016-08-09周晓兵尹本丰张元明
周晓兵, 尹本丰,2, 张元明,*
1 中国科学院新疆生态与地理研究所,中国科学院干旱区生物地理与生物资源重点实验室,乌鲁木齐 830011 2 北京师范大学生命科学学院,地表过程与资源生态国家重点实验室,北京 100875
模拟氮沉降对不同类型生物土壤结皮生长和光合生理的影响
周晓兵1, 尹本丰1,2, 张元明1,*
1 中国科学院新疆生态与地理研究所,中国科学院干旱区生物地理与生物资源重点实验室,乌鲁木齐830011 2 北京师范大学生命科学学院,地表过程与资源生态国家重点实验室,北京100875
摘要:生物土壤结皮是荒漠生态系统的重要组分,其如何响应氮沉降的增加还鲜见报道。以古尔班通古特沙漠中3种不同类型生物土壤结皮为研究对象,设置0(N0)、0.3(N0.3)、0.5(N0.5)、1.0(N1)、1.5(N1.5)和3.0 (N3) g N m-2a-16个不同氮素处理浓度,研究氮素增加对生物土壤结皮生长和光合生理的影响。结果表明,经过3a的模拟增氮实验,藻类结皮、地衣结皮和苔藓结皮的总叶绿素、实际光化学效率YII、可溶性糖含量以及苔藓个体生物量随着氮素增加先增加后减少,但各指标的最大值位于不同的浓度处理。氮素增加对藻类和地衣结皮类胡萝卜素影响不显著,而低氮(N0.3-N0.5)对苔藓类胡萝卜素具有促进作用。高氮(N3)对3种类型结皮的最大光化学效率Fv/Fm均具有抑制作用。氮素增加对藻类结皮和地衣结皮的可溶性蛋白影响较小,但对苔藓结皮可溶性蛋白的影响表现为先增加后降低的趋势。3种结皮类型中,苔藓结皮对氮素增加的响应最为敏感,受影响最大,其次是藻类和地衣结皮。研究表明,低浓度氮沉降对3种类型结皮生长的影响较小,但是高浓度氮沉降则具有明显的负效应。
关键词:生物土壤结皮; 氮沉降; 色素; 荧光; 渗透调节物质
生物土壤结皮是由细菌、真菌、藻类、地衣和苔藓与表层土壤颗粒组成的复杂复合体,广泛分布于世界上的干旱和半干旱区[1]。生物土壤结皮的发育能够稳定沙面[2]、增加土壤肥力[3]、影响土壤水文[4]、植物种子萌发和植物生长等过程[5-6]。因此,在干旱和半干旱区,生物土壤结皮的生态和功能受到了特别重视。在生态退化或者干扰沙化的区域,生物土壤结皮已经成功用于生态恢复[7]。生物土壤结皮由于其本身的属性,已经成为生态学研究的模式生物类群[8]。
虽然生物土壤结皮能够在极端环境下生存,但是对全球变化因子响应非常敏感[9]。研究表明,降水、温度、紫外辐射、干扰、氮素等条件的变化能够显著影响生物土壤结皮的结构和功能[10- 12]。例如,少量的多频次的降水能够造成苔藓结皮呼吸释放的碳量大于其固定的量,导致苔藓死亡[13]。外来一年生草本植物的动态、降水和温度同样与地衣和苔藓的盖度和物种丰富度相关[14]。氮素的增加也同样的影响生物结皮的生理和生物量[15],影响生物土壤结皮的固氮酶活性和氮素过程[16]。
氮沉降的增加已成为近年来干旱区生态系统面临的重要问题。在农业和工业集中的区域,氮沉降速率增加更加明显[17]。研究表明,在新疆乌鲁木齐仅干氮沉降即可达到2.9 g N m-2a-1[18]。另外,有许多干旱生态系统(如新疆古尔班通古特沙漠边缘)被农田镶嵌和包围,农业大量的氮肥施加和沙漠边缘的城市化进程无疑将带来荒漠生态系统氮素输入的进一步增加。荒漠生态系统由于本身缺乏氮素,少量的氮素增加能够带来生态系统结构和功能显著的改变[19-20]。以前对荒漠生态系统响应氮沉降的研究,多集中于维管植物类群和土壤系统,而专门针对荒漠生态系统地气界面重要的覆盖类群生物土壤土壤结皮研究相对较少。古尔班通古特沙漠发育有良好的生物土壤结皮,主要有藻类结皮、地衣结皮和苔藓结皮,盖度可达40%以上[21]。不同类型的生物土壤结皮如何响应氮素的增加,将关系到该荒漠生态系统结皮的结构和功能的完整,及荒漠生态系统的稳定性。本文以上述3种类型生物土壤结皮为研究对象,研究模拟氮沉降增加对生物土壤结皮生长和与碳氮代谢相关的重要生理特征的影响,为深入了解氮素增加对荒漠生态系统的影响提供科学依据。
1研究方法
1.1研究区自然概况
研究区位于古尔班通古特沙漠中部。该沙漠总面积约4.88×104km2,是中国的第二大沙漠。其平均降水量约70—150 mm, 大部分集中于4—7月,冬季有约20 cm厚的稳定积雪。沙漠年平均气温约为7.26 ℃。春天积雪融化和气温增加有助于生物土壤结皮的发育和短命植物的萌发和生长。藻类结皮的种类主要有沼地微鞘藻(Microcoleuspaludosus),具鞘微鞘藻(M.vaginatus),鞘丝异球藻(Xenococcuslyngbyge),在沙面稳定后出现并快速生长。地衣结皮是主要的结皮类型,主要包括胶衣属(Collematenex),红鳞网衣(Psoradecipiens),丽黄地衣(Xanthoriaelegans)等物种。苔藓结皮主要以齿胁赤藓(Syntrichiacanivervis)为主。维管植物群落以小半乔木梭梭(Haloxylonammolondren)和白梭梭(H.persicum)为优势建群种,尖喙牻牛儿苗(Erodiumoxyrrhynchum)、囊果苔草(Carexphysodes)和角果黎(Ceratocarpusarenarius)等草本植物大量分布。
1.2实验设计
于2010年10月,在沙漠中部(44.62°N, 88.26°E)选择地势平坦,生物结皮发育较一致的区域建立实验样地。样地中,生物土壤结皮的盖度达到80%以上,灌丛以蛇麻黄(Ephedradistachya)为主,盖度约为15%。样地包含有间隔5 m的10个小区(相当于10个重复),每个小区有6个2 × 2 m的小样方,每个小样方同样间隔2 m。每个样方内均有3种类型的结皮分布(苔藓结皮以齿胁赤藓为主),且植物的组成、密度和土壤性质相似(表1)。对每一个小区的不同样方施加不同的氮素处理,施氮浓度分别为0、0.3、0.5、1.0、1.5、3.0 g N m-2a-1,并分别以N0、N0.3、N0.5、N1、N1.5 和N3表示。施氮的浓度范围参照沙漠边缘城市最大氮沉降速率。根据对新疆各氮沉降监测点的分析后估计,实验区域的自然氮沉降约为0.5 g N m-2a-1[22]。施加氮素为NH4NO3和 NH4Cl,配比为2∶1 NH4∶NO3,与沙漠周围降水的氮素形态比一致[23]。从2010年10月开始,每年施氮两次,分别位于3月下旬(融雪后)和10月下旬(降雪前)。氮肥施加时,将氮素溶于水中,均匀喷洒于结皮表面,对照样地喷洒同样的水分,每次喷水带来的降水约0.025mm。

表1 样地土壤理化性质分析
OM: organic matter; TN: total N; TP:total phosphorus; TK:total potassium; EC:electricity conductance
1.3叶绿素荧光测量
在2014年3月,积雪融化后(施氮前),随机选择4个小区进行3种不同结皮类型的生长和生理测量。在每个样方,为3种类型的结皮分别选取4个点进行标记,所选点位相对比较平坦,周围无明显遮挡。叶绿素荧光测量时,每个点的结皮表面湿润程度相同,降低水分差异对结皮表面荧光活性的影响。利用手持荧光仪(PAM 2500, Walz Inc., Effeltrich, Germany)对标记点进行荧光测量,获得实际光化学效率YII和计算最大光化学效率Fv/Fm所需要的参数数据。初始荧光Fo和最大荧光Fm测量时,将测量点遮阴30 min以上,并在黑暗中测量。每个样方的4个点进行平均代表该样方的数据。
1.4取样方法
荧光测量结束后,藻类和地衣结皮利用取样铲将结皮层与结层下层土壤进行剥离。将样品放入冷藏箱带回实验室并放入4℃冰箱中,24 h内分析生理指标。对于苔藓样品,利用直径5 cm PVC管进行取样,放入冷藏箱带回实验室。一部分用于进行形态和生物量测量,其余的去除假根,保留茎叶,液氮冷冻后放入-80 ℃冷冻保存,用于生理分析[24]。3种结皮类型的生理指标包括:叶绿素、可溶性糖、脯氨酸和可溶性蛋白等。
1.5苔藓个体大小测量
利用1 cm× 1 cm的取样器从PVC管中取出苔藓放入具水的培养皿中。将苔藓个体在水中分开轻轻冲洗,注意不能冲断假根。记录苔藓的数量并将苔藓在65℃下烘干,称重后计算苔藓个体的平均生物量大小。
1.6色素测定
称取结皮样品(藻类和地衣结皮2 g, 苔藓0.5 g),在冰上利用95%酒精,加入少许CaCO3进行研磨,在4℃黑暗环境下提取一夜。将样品进行离心,过滤,并在665、649、470 nm下进行比色。根据Lichtenthaler公式进行色素的计算[25]。其中叶绿素可用来指代藻类和地衣结皮中具有叶绿素的光合有机体的生物量[26]。
1.7渗透调节相关物质测定
可溶性糖利用蒽酮比色法进行测定,在625 nm下比色[27]。脯氨酸通过改进的水合茚三酮方法测定,在520 nm处比色[28]。可溶性蛋白用考马斯亮蓝方法进行测定,利用牛血清蛋白作为标准曲线,在595 nm处比色[29]。
1.8统计分析
利用双因素方差分析(ANOVA)来分析不同结皮类型、不同处理以及他们的交互作用。利用单因素方差分析对各指标不同处理或者同一处理不同结皮类型进行统计,利用LSD法进行多重比较。所有的统计利用SAS13.0软件(SAS institute Inc. NC, USA)进行。
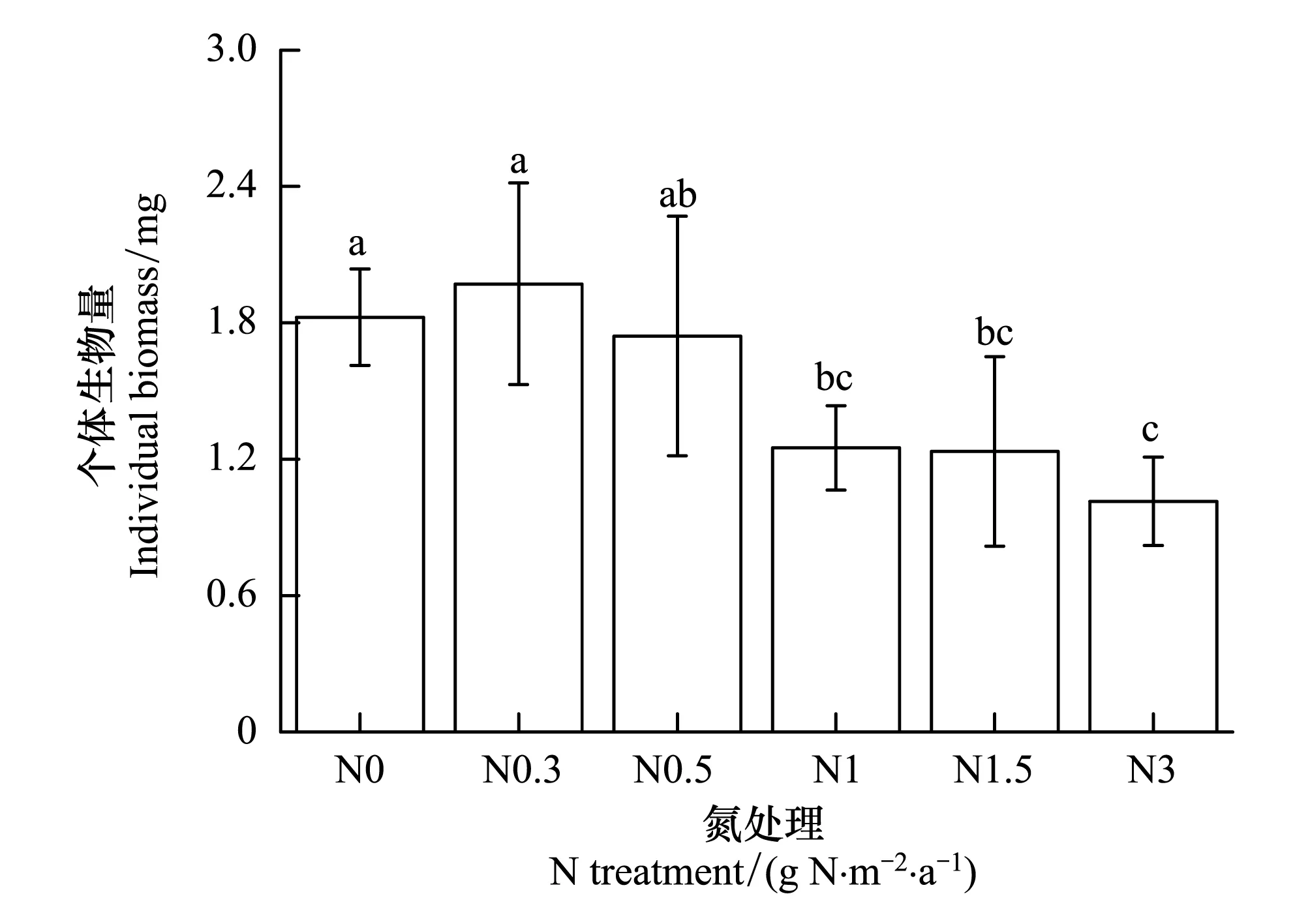
图1 苔藓在不同氮处理下个体生物量 Fig.1 The individual biomass of Syntrichia canivervis under different N treatments不同小写字母表示苔藓个体生物量在不同氮处理间差异显著(P < 0.05)
2结果与分析
2.1苔藓个体生物量响应
结果表明,苔藓个体生物量受到氮增加的显著影响。苔藓个体生物量在低氮浓度下有增加的趋势,但是增加效应不显著(图1,P> 0.05)。N1-N3处理能够显著降低苔藓的个体生物量(P< 0.05)。
2.2光合生理指标的响应特征
不同类型生物结皮之间生理指标的差异显著(表 2),3种结皮类型以苔藓结皮类型中各指标显著高于其他两种类型(图2—图5)。氮素处理及其与结皮的交互作用能够影响叶绿素a+b和可溶性糖含量(P<0.05)。
2.2.1色素含量
苔藓的叶绿素含量具有先增加后降低的趋势(图2)。藻类和地衣结皮的叶绿素含量在低氮浓度下也具有增加趋势,但不显著(P> 0.05)。高氮处理N3显著降低藻类结皮的叶绿素含量(P< 0.05)。氮素增加对藻类和地衣结皮的类胡萝卜素含量影响不显著(图2,P> 0.05),但是低氮显著增加苔藓类胡萝卜素含量(P<0.05)。地衣结皮叶绿素a/b对氮增加响应具有先增加后减少的趋势,而苔藓叶绿素a/b最大值位于对照(N0)水平,但藻类叶绿素a/b差异不显著(图3,P> 0.05)。氮增加对地衣和苔藓结皮的叶绿素/类胡萝卜素影响不显著,对藻类却具有先促进后抑制的作用(图3)。
2.2.2叶绿素荧光
在3种结皮类型中,苔藓的实际光化学效率(YII)和最大光化学效率(Fv/Fm)最大,均显著高于藻类和地衣(P< 0.05),藻类和地衣之间差异不显著(图4,P> 0.05)。低浓度的氮素增加对YII和Fv/Fm影响不大,甚

图2 3种生物土壤结皮在不同氮处理下叶绿素a+b和类胡萝卜素含量Fig.2 Chlorophyll (a+b) and carotenoid content of three biocrusts under different N treatments不同小写字母表示同一类型生物结皮在不同氮处理间差异显著(P < 0.05)

图3 3种生物土壤结皮在不同氮处理下类叶绿素a/b 和叶绿素/胡萝卜素Fig.3 Chlorophyll a/b and Chlorophyll/ Carotenoid of three biocrusts under different N treatments不同小写字母表示同一类型生物结皮在不同氮处理间差异显著(P < 0.05);不同大写字母表示同一氮处理不同结皮类型间差异显著(P < 0.05)

来源df叶绿素a+bChla+b类胡萝卜素Carotenoid叶绿素a/bChla/b叶绿素/类胡萝卜素Chl/carotenoid结皮Biocrusts2381**375.12**54.76**4.35*处理Ntreatments53.19*1.411.791.46结皮×处理Biocrusts×Ntreatments103.06**1.330.791.21来源YIIFv/Fm可溶性糖Solublesugar脯氨酸Proline可溶性蛋白Solubleprotein结皮Biocrusts81.30**40.52**160.81**122.02**65.28**处理Ntreatments8.68**2.85**2.79**0.541.33结皮×处理Biocrusts×Ntreatments0.681.162.8**0.531.33
*P<0.05, **P<0.01
至有一定促进作用。除地衣的Fv/Fm外,高浓度的氮素处理N3能够显著降低各结皮类型的YII和Fv/Fm(P<0.05)。

图4 3种生物土壤结皮在不同氮处理下实际光化学效率YII 和最大光化学效率Fv/Fm Fig.4 Actual photochemical efficiency YII and maximum photochemical efficiency Fv/Fm of three biocrusts under different N treatments不同小写字母表示同一类型生物结皮在不同氮处理间差异显著(P < 0.05);不同大写字母表示同一氮处理不同结皮类型间差异显著(P < 0.05)
2.2.3渗透调节物质
3种结皮中,可溶性糖随着氮素增加呈先增加后减少的趋势,但是其最高浓度所在氮处理不同,藻类和地衣在N1.5处理达最大,而苔藓在N0.3处理达到最大(图5)。氮增加对藻类和苔藓的脯氨酸影响不显著(P> 0.05),而地衣的脯氨酸含量在N0.3处理达最大,而在N1.5处理显著降低(P< 0.05)(图5)。苔藓的可溶性蛋白含量随氮增加先增加后减少,在N1处理达到最大,而藻类和地衣结皮可溶性蛋白对氮增加响应不显著(图5,P> 0.05)。
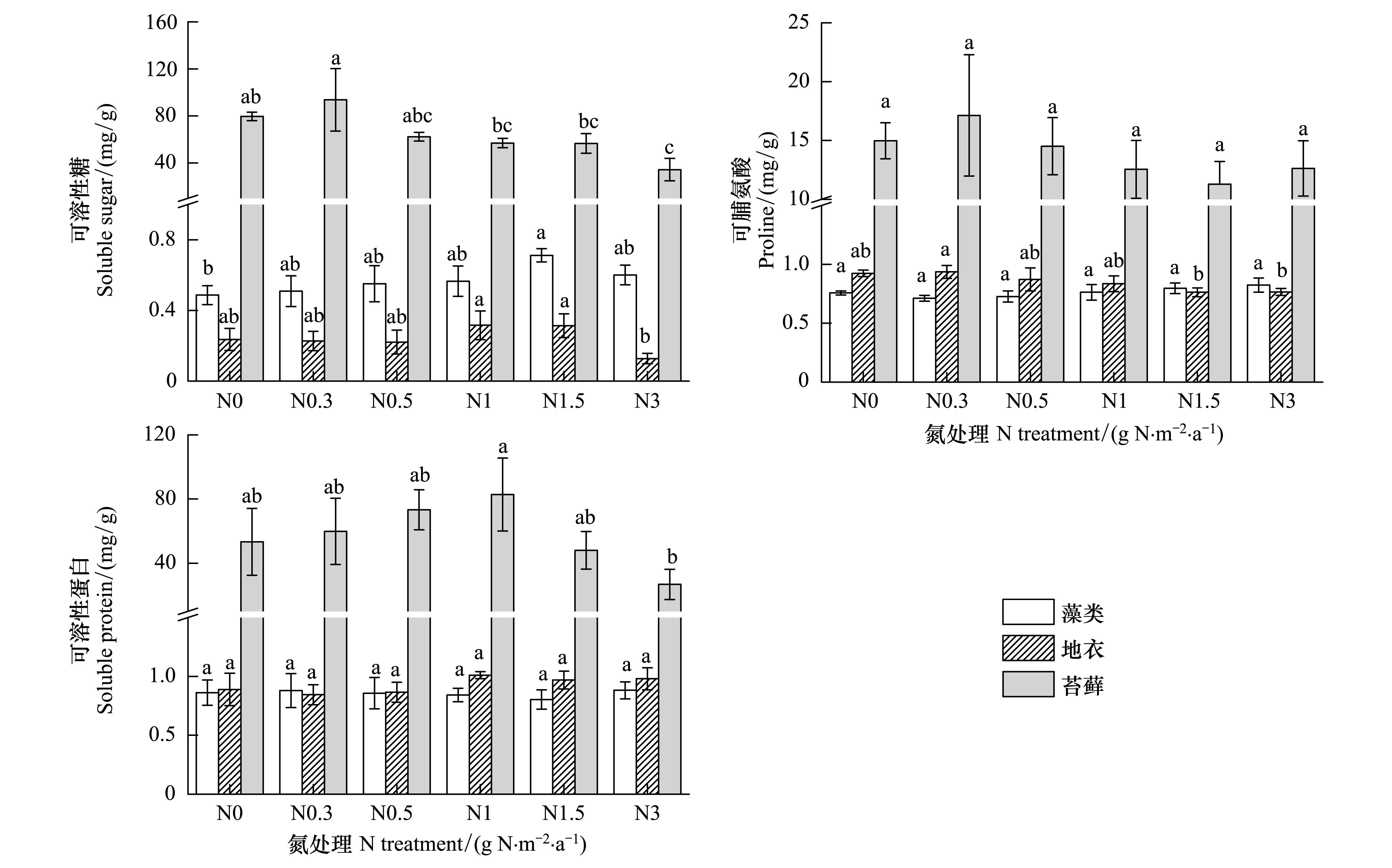
图5 3种生物土壤结皮在不同氮处理下可溶性糖、脯氨酸和可溶性蛋白含量Fig.5 Soluble sugar, proline and soluble protein content of three biocrusts under different N treatments不同小写字母表示同一类型生物结皮在不同氮处理间差异显著(P < 0.05)
3讨论
3.1氮增加对生物土壤结皮的正效应与负效应
由研究结果可知,苔藓个体生物量、各类型生物结皮的总叶绿素、YII和Fv/Fm等指标在低氮浓度下普遍具有增加的趋势,但大部分效应不显著。然而,随着施氮浓度的继续增加,氮素增加的负效应出现。叶绿素荧光是叶绿素分子从激发态回到基态时释放的光子。叶绿素荧光可以用来指示高等植物,藻类和细菌光系统II的光化学效率,广泛运用于植物生长速率的估计[30]。除地衣结皮外,高氮下叶绿素荧光均受到抑制,与叶绿素趋势一致。叶绿素可以作为藻类和地衣中具有叶绿素的光合有机体的生物量指标,高氮降低藻类结皮叶绿素含量,因此氮素增加可以改变藻类结皮的生物量。同样,苔藓个体生物量也具有类似的趋势。低氮增加对生物土壤结皮影响不显著,甚至对其生长有益的结果在已有的对生物土壤结皮的研究中鲜见相关报道。因此,与高等植物类似,一定浓度的氮对生物土壤结皮生长具有正的效应。然而,氮素对生物土壤结皮与维管植物产生效应时的浓度差异较大,生物土壤结皮的响应浓度远低于维管植物[31-32]。在某些森林生态系统中,氮素增加可以增加某些地衣的生长和叶绿素a含量[33]。同样,氮增加也能增加湿润地区苔藓的光合速率,但不同苔藓物种的响应具有差异性[34]。然而,本文研究发现,不同类型结皮氮素的正效应的浓度有所不同,综合各指标可以看出,藻类和地衣正效应有可能在氮素浓度大于1 g N m-2a-1时减弱,而苔藓在大于0.3 g N m-2a-1时促进效应有可能减弱,甚至出现负效应。该浓度远低于其他干旱或森林生态系统。例如,地中海半干旱系统中,影响地衣Cladoniafoliacea叶绿素含量和Fv/Fm的临界氮浓度为大于4 g N m-2a-1[35]。而森林中影响苔藓植物光合的氮临界浓度也能达到2—4 g N/m2[34]。通过对古尔班通古特沙漠的一年生植物研究发现,即使氮的浓度大于6 g N m-2a-1, 对荒漠植物的生长仍具有促进作用[36]。因此,干旱地区特有的生物土壤结皮类群,比起种子植物或其他生态系统中的孢子植物类群,更容易受到氮素增加的影响。
生物土壤结皮色素各组分能够反映与光合相关的有机体的含量和组成状况。叶绿素主要有叶绿素a和叶绿素b组成,结皮中叶绿素b的存在能够增加叶绿素的吸收光谱,尤其在低光条件下增加光合效率[37]。叶绿素a/b是反映叶片中氮素分配一个非常重要的因子,随着氮有效性的增加而降低,并且与叶片光系统Ⅱ和聚光色素比例成正相关[38]。苔藓叶片中叶绿素a/b的先降低后增加的比例变化,说明中度氮素增加使得更多的能量分配于光系统Ⅱ。在藻类和地衣结皮中,蓝藻本身不产生叶绿素b,叶绿素a/b可以用来分析包含有蓝藻和其他光合菌群落的结构变化。氮处理对其影响不显著说明对藻类和地衣结皮中光合菌的结构影响不大。类胡萝卜素能够吸收光能,并且降低叶绿素受到光降解的威胁。高氮下苔藓类胡萝卜素含量的降低使得其保护功能减弱,不利于苔藓的光合和生存。然而,仅藻类结皮的叶绿素和类胡萝卜素的相对比例发生变化并在中氮水平增加,说明适当的氮素沉降将有利于藻类将更多的能量分配给光合作用。
荒漠区高浓度的氮沉降,将会影响生物土壤结皮的功能。而在不同类型生物结皮中,苔藓对外界氮素增加的响应最敏感,其次是藻类和地衣。因此,随着氮沉降的增加,苔藓结皮也将最先受到影响。苔藓受影响最大,可能因为苔藓个体突出于土壤表面,苔藓植物叶片本身没有角质层等保护性结构,且大多为一层细胞构成,从而极易受到氮素沉降的影响。相对于苔藓植物,藻类和地衣等与土壤紧密结合,土壤本身对氮素增加具有一定的缓冲作用,因此受到的影响相对较小。Krupa等综述的结果显示,0.5—1 g N m-2a-1将会使脆弱的陆地生态系统类型(如沼泽,孢子植物系统)受益[39]。本文的实验结果也部分验证了这一结论。
3.2渗透调节物质对氮增加的响应
结皮生物的渗透调节物质,如可溶性糖、脯氨酸和可溶性蛋白,通常用来指示其在胁迫环境中生存状况,尤其是在干旱胁迫条件下[24,29]。对于维管植物来说,这些指标也通常会在氮限制环境改善后降低[32]。然而,本研究发现,藻类和地衣的可溶性糖和脯氨酸含量随氮增加先增加后减少,与其光合生理指标类似,而苔藓却整体呈现下降的趋势(仅在N0.3条件下增加)。藻类和地衣的可溶性蛋白对氮素响应不敏感,苔藓具有先增加后减少的趋势。这些结果表明,渗透调节物质不宜用来反映生物土壤结皮中的氮素限制状况。
两个原因可能导致生物土壤结皮中渗透调节物质对氮的响应与维管植物不同。首先,生物土壤结皮中有一些物种,如念珠藻属(Nostocsp),能够产生胞外多糖,该物质能够很好的粘结沙粒[40-41]。藻类和地衣结皮中的藻类物种适宜的生长条件可能导致胞外多糖的增加,而可溶性糖是胞外多糖的合成来源,因此同样增加。葛红梅等的研究也证实,在氮增加条件下细胞内具有更高的可溶性糖和蔗糖含量[42]。因此,可溶性糖、叶绿素和实际光化学效率(YII)具有同样的变化趋势。而苔藓植物的可溶性糖和脯氨酸含量变化与高等植物有些类似,氮素增加后有所降低。另外,生物土壤结皮中藻类和地衣能够固定氮素,能够为其生长提供足够的氮,满足其自身代谢的需要。苔藓植物需要从环境中获取营养[43],使得苔藓的生长需要更多的外源氮素来满足其生长和代谢。因此,藻类和地衣的可溶性蛋白不受氮素增加的影响,而苔藓能够从外源氮素增加中部分获益,使可溶性蛋白增加。氮素增加对可溶性蛋白的正效应与前人的研究结果一致[34]。但是高氮对苔藓生长产生抑制作用,可能使得细胞结构受到破坏,影响合成蛋白的能力。藻类和地衣结皮脯氨酸的趋势不同,原因尚不清楚,需要进一步实验研究。
致谢:陶冶、吴林、刘耀斌、周志斌、李国栋等对样地设置与氮素处理等帮助,吕湘芳和张洪丽帮助实验,沙漠管理处一站提供实验支持,特此致谢。
参考文献(References):
[1]Belnap J, Lang O L. Biological Soil Crusts: Structure, Function, and Management. Germany, Berlin: Springer-Verlag, 2003.
[2]胡春香, 刘永定, 张德禄, 黄泽波, Paulsen B S. 荒漠藻结皮的胶结机理. 科学通报, 2002, 47(12): 931- 937.
[3]赵允格, 许明祥, 王全九, 邵明安. 黄土丘陵区退耕地生物结皮理化性状初报. 应用生态学报, 2006, 17(8): 1429- 1434.
[4]Zhang J, Zhang Y M, Downing A, Cheng J H, Zhou X B, Zhang B C. The influence of biological soil crusts on dew deposition in Gurbantunggut Desert, Northwestern China. Journal of Hydrology, 2009, 379(3/4): 220- 228.
[5]Li X R, Wang X P, Li T, Zhang J G. Microbiotic soil crust and its effect on vegetation and habitat on artificially stabilized desert dunes in Tengger Desert, North China. Biology and Fertility of Soils, 2002, 35(3): 147- 154.
[6]陈荣毅, 魏文寿, 张元明, 吴楠, 张静. 干旱区生物土壤结皮对种子植物多样性的影响. 中国沙漠, 2008, 28(5): 868- 873.
[7]唐东山, 王伟波, 李敦海, 胡春香, 刘永定. 人工藻结皮对库布齐沙地土壤酶活性的影响. 水生生物学报, 2007, 31(3): 339- 344.
[8]Bowker M A, Maestre F T, Escolar C. Biological crusts as a model system for examining the biodiversity-ecosystem function relationship in soils. Soil Biology and Biochemistry, 2010, 42(3): 405- 417.
[9]房世波, 冯凌, 刘华杰, 张新时, 刘建栋. 生物土壤结皮对全球气候变化的响应. 生态学报, 2008, 28(7): 3312- 3321.
[10]Solheim B, Zielke M, Bjerke J W, Rozema J. Effects of enhanced UV-B radiation on nitrogen fixation in arctic ecosystems // Rozema J, Aerts R, Cornelissen H. Plants and Climate Change. Netherlands: Springer, 2006: 109- 120.
[11]Kidron G J, Barinova S, Vonshak A. The effects of heavy winter rains and rare summer rains on biological soil crusts in the Negev Desert. Catena, 2012, 95: 6- 11.
[12]Evans R D, Belnap J. Long-term consequences of disturbance on nitrogen dynamics in an arid ecosystem. Ecology, 1999, 80(1): 150- 160.
[13]Reed S C, Coe K K, Sparks J P, Housman D C, Zelikova T J, Belnap J. Changes to dryland rainfall result in rapid moss mortality and altered soil fertility. Nature Climate Change, 2012, 2(10): 752- 755.
[14]Belnap J, Phillips S L, Troxler T. Soil lichen and moss cover and species richness can be highly dynamic: The effects of invasion by the annual exotic grassBromustectorum, precipitation, and temperature on biological soil crusts in SE Utah. Applied Soil Ecology, 2006, 32(1): 63- 76.
[15]Belnap J, Phillips S L, Flint S, Money J, Caldwell M. Global change and biological soil crusts: effects of ultraviolet augmentation under altered precipitation regimes and nitrogen additions. Global Change Biology, 2008, 14(3): 670- 686.
[16]Deslippe J R, Egger K N, Henry G H R. Impacts of warming and fertilization on nitrogen-fixing microbial communities in the Canadian High Arctic. FEMS Microbiology Ecology, 2005, 53(1): 41- 50.
[17]Li K H, Liu X J, Song W, Chang Y H, Hu Y K, Tian C Y. Atmospheric nitrogen deposition at two sites in an arid environment of Central Asia. PLoS One, 2014, 9(1): e67018.
[18]张伟, 刘学军, 胡玉昆, 李凯辉, 沈健林, 骆晓声, 宋韦. 乌鲁木齐市区大气氮素干沉降的输入性分析. 干旱区研究, 2011, 28(4): 710- 716.
[19]Báez S, Fargione J, Moore D I, Collins S L, Gosz J R. Atmospheric nitrogen deposition in the northern Chihuahuan desert: Temporal trends and potential consequences. Journal of Arid Environments, 2007, 68(4): 640- 651.
[20]Brooks M L. Effects of increased soil nitrogen on the dominance of alien annual plants in the Mojave Desert. Journal of Applied Ecology, 2003, 40(2): 344- 353.
[21]吴林, 张元明. 以数码照相法估算生物土壤结皮盖度. 中国沙漠, 2013, 33(6): 1810- 1815.
[22]Li K H, Song W, Liu X J, Shen J L, Luo X S, Sui X Q, Liu B, Hu Y K, Christie P, Tian C Y. Atmospheric reactive nitrogen concentrations at ten sites with contrasting land use in an arid region of central Asia. Biogeosciences, 2012, 9(10): 4013- 4021.
[23]Zhang Y, Zheng L X, Liu X J, Jickells T, Cape J N, Goulding K, Fangmeier A, Zhang F S. Evidence for organic N deposition and its anthropogenic sources in China. Atmospheric Environment, 2008, 42(5): 1035- 1041.
[24]尹本丰, 张元明. 荒漠区不同微生境下齿肋赤藓对一次降雪的生理生化响应. 植物生态学报, 2014, 38(9): 978- 989.
[25]Lichtenthaler H K, Wellburn A R. Determinations of total carotenoids and chlorophylls a and b of leaf extracts in different solvents. Biochemical Society Transactions, 1983, 11: 591- 592.
[26]Garcia-Pichel F, Belnap J, Neuer S, Schanz F. Estimates of global cyanobacterial biomass and its distribution. Algological Studies, 2003, 109(1): 213- 227.
[27]Lassouane N, Aïd F, Lutts S. Water stress impact on young seedling growth ofAcaciaarabica. Acta Physiologiae Plantarum, 2013, 35(7): 2157- 2169.
[28]Monreal J A, Jiménez E T, Remesal E, Morillo-Velarde R, García-Maurio S, Echevarría C. Proline content of sugar beet storage roots: Response to water deficit and nitrogen fertilization at field conditions. Environmental and Experimental Botany, 2007, 60(2): 257- 267.
[29]Gonzalez C M, Pignata M L. The influence of air pollution on soluble proteins, chlorophyll degradation, MDA, sulphur and heavy metals in a transplanted lichen. Chemistry and Ecology, 1994, 9(2): 105- 113.
[30]Baker N R. Chlorophyll fluorescence: A probe of photosynthesis in vivo. Annual Review of Plant Biology, 2008, 59: 89- 113.
[31]Throop H L. Nitrogen deposition and herbivory affect biomass production and allocation in an annual plant. Oikos, 2005, 111(1): 91- 100.
[32]Zhou X B, Zhang Y M, Ji X H, Downing A, Serpe M. Combined effects of nitrogen deposition and water stress on growth and physiological responses of two annual desert plants in northwestern China. Environmental and Experimental Botany, 2011, 74: 1- 8.
[33]Johansson O, Olofsson J, Giesler R, Palmqvist K. Lichen responses to nitrogen and phosphorus additions can be explained by the different symbiont responses. New Phytologist, 2011, 191(3): 795- 805.
[34]刘滨扬, 刘蔚秋, 雷纯义, 张以顺. 三种苔藓植物对模拟N沉降的生理响应. 植物生态学报, 2009, 33(1): 141- 149.
[35]Ochoa-Hueso R, Mejías-Sanz V, Pérez-Corona M E, Manrique E. Nitrogen deposition effects on tissue chemistry and phosphatase activity inCladoniafoliacea(Huds.) Willd., a common terricolous lichen of semi-arid Mediterranean shrublands. Journal of Arid Environments, 2013, 88: 78- 81.
[36]Zhou X B, Zhang Y M, Niklas K J. Sensitivity of growth and biomass allocation patterns to increasing nitrogen: a comparison between ephemerals and annuals in the Gurbantunggut Desert, north-western China. Annals of Botany, 2014, 113(3): 501- 511.
[37]Lange L, Nobel P, Osmond C, Ziegler H. Physiological Plant Ecology I——Responses to the Physical Environment. Berlin: Springer-Verlag, 1981: 67, 259.
[38]Kitajima K, Hogan K P. Increases of chlorophylla/bratios during acclimation of tropical woody seedlings to nitrogen limitation and high light. Plant, Cell & Environment, 2003, 26(6): 857- 865.
[39]Krupa S V. Effects of atmospheric ammonia (NH3) on terrestrial vegetation: a review. Environmental Pollution, 2003, 124(2): 179- 221.
[40]Hu C X, Liu Y D, Song L R, Zhang D L. Effect of desert soil algae on the stabilization of fine sands. Journal of Applied Phycology, 2002, 14(4): 281- 292.
[41]Zhang Y M, Wang H L, Wang X Q, Yang W K, Zhang D Y. The microstructure of microbiotic crust and its influence on wind erosion for a sandy soil surface in the Gurbantunggut Desert of Northwestern China. Geoderma, 2006, 132(3/4): 441- 449.
[42]葛红梅, 周旭萍, 夏令, 张德禄, 胡春香. 光强和氮源对念珠藻胞外多糖分泌的影响. 水生生物学报, 2014, 38(3): 480- 486.
[43]Ball B A, Guevara J A. The nutrient plasticity of moss-dominated crust in the urbanized Sonoran Desert. Plant and Soil, 2015, 389(1/2): 225- 235.
基金项目:新疆维吾尔自治区面上基金(2015211A052)
收稿日期:2015- 05- 28;
修订日期:2015- 11- 30
*通讯作者
Corresponding author.E-mail: zhangym@ms.xjb.ac.cn
DOI:10.5846/stxb201505281067
The effects of simulated nitrogen deposition on growth and photosynthetic physiology of three types of biocrusts
ZHOU Xiaobing1, YIN Benfeng1,2, ZHANG Yuanming1,*
1XinjiangInstituteofEcologyandGeography,KeyLaboratoryofBiogeographyandBioresourceinAridLand,ChineseAcademyofSciences,Urumqi830011,China2StateKeyLaboratoryofEarthSurfaceProcessesandResourceEcology,CollegeoflifesciencesofBeijingNormalUniversity,Beijing100875,China
Abstract:Increasing nitrogen (N) deposition has become a threat in many terrestrial ecosystems, and the effects of N deposition have been widely studied. Nitrogen deposition can increase plant biomass, decrease richness of plant species, and alter soil microbial composition and activity. Biocrusts, which consist of communities of bacteria (cyanobacteria), fungi, algae, lichens and mosses, are important for the functioning of desert ecosystems. Biocrusts can stabilize sand surfaces, greatly increase the threshold friction velocity. Biocrusts can also fix N2 and serve as the major source of N for plants and microbes in desert ecosystems. Both N limitation and N excess can result in stress environment for biological activity, especially for physiological responses. However, how biocrusts respond to N physiologically is unclear. In 2010, sixty 2 × 2 m plots were established at the study site, with six plots in each of 10 blocks. Five concentrations of N were applied to each block of the plots in addition to a control without added N. Six simulated N deposition treatments, i.e. 0(N0), 0.3(N0.3), 0.5(N0.5), 1.0(N1), 1.5(N1.5) and 3.0 (N3) g N m-2a-1, were applied on the biocrust plots in the center of the Gurbantunggut desert. The N was added annually in March after the snow thaw and again in October before the first snowfall. NH4NO3and NH4Cl were mixed at a ratio of 2∶1 , which approximated the composition of N deposition in the nearby city.
The growth and physiological indicators of algal, lichen and moss crusts were determined after three year′ exposure to N addition. Chlorophyll (a+b) contents, actual photochemical efficiency YII, soluble sugar concentration of the three biocrust types and moss individual biomass increased and then decreased with the enhancements of N, with peak value at different N applied rates. Carotenoid content of algal and lichen crusts were not significantly affected by N additions (P>0.05). However, low N additions (N 0.3—0.5) had positive effects on the carotenoid contents. High N additions (N3) significantly decreased maximum photochemical efficiencyFv/Fm. N addition non-significantly increased chl a/b of lichen crusts at N1.5 treatments and significantly decreased at N1 treatments compared to N0, while no significant effects of N addition were found in algal crusts. Chlorophyll/carotenoid of algal crusts increased and then decreased with increasing N addition. Lichen and moss crusts did not show significant effects of N addition on the chlorophyll/carotenoid. The highest value of soluble sugar content of moss occurred at N0.3 treatments, while the algal and lichen crusts occurred at N1.5 treatments. N addition had no significant effect on the proline contents of cyanobacterial and moss crusts. Lichen crusts had relatively lower proline contents in response to higher N addition rates, with a significant decrease being observed in response to N1.5 and N3 relative to N0.3. The soluble protein of algal and lichen crusts were not significantly affected by N addition, but moss soluble protein increased and then decreased after a gradient of N addition. Among the three biocrusts, moss were the most sensitive to N treatments, followed by algal and lichen crusts. Our results suggest that low levels of N addition do not significantly affect biocrust performance, but high N pollution negatively affects the growth. Therefore, Chlorophyll and its fluorescence of biocrusts, could be used for the assessment of high N pollution.
Key Words:biocrusts; nitrogen deposition; pigment; fluorescence; osmotic adjustment substance
周晓兵, 尹本丰, 张元明.模拟氮沉降对不同类型生物土壤结皮生长和光合生理的影响.生态学报,2016,36(11):3197- 3205.
Zhou X B, Yin B F, Zhang Y M.The effects of simulated nitrogen deposition on growth and photosynthetic physiology of three types of biocrusts.Acta Ecologica Sinica,2016,36(11):3197- 3205.
