中国东部森林土壤有机碳组分的纬度格局及其影响因子
2016-08-09王春燕何念鹏吕瑜良
王春燕,何念鹏, 吕瑜良
1 西南大学, 地理科学学院, 重庆 400715 2 中国科学院地理科学与资源研究所, 生态系统网络观测与模拟重点实验室, 北京 100101
中国东部森林土壤有机碳组分的纬度格局及其影响因子
王春燕1, 2,何念鹏2, 吕瑜良1,*
1 西南大学, 地理科学学院, 重庆400715 2 中国科学院地理科学与资源研究所, 生态系统网络观测与模拟重点实验室, 北京100101
摘要:土壤有机碳是森林碳库的重要组成部分,其活性有机碳组分不仅是土壤碳周转过程的重要环节,还是气候变化最敏感的指标。以中国东部南北森林样带(NSTEC, North-South Transect of Eastern China)为对象,选择了9个典型森林生态系统(尖峰岭、鼎湖山、九连山、神农架、太岳山、东灵山、长白山、凉水和呼中),涵盖了我国热带森林、亚热带森林和温带森林的主要类型,测定其0—10 cm土壤有机碳(SOC)、易氧化有机碳(EOC)、微生物碳(MBC)和可溶性有机碳(DOC)含量,结合气候、土壤质地、土壤微生物和植被生物量等因素,探讨了森林土壤有机碳组分的纬度格局及其主要影响因素。实验结果表明:SOC、EOC、MBC和DOC含量分别为23.12—77.00 g/kg、4.62—17.24 g/kg、41.92—329.39 mg/kg和212.63—453.43 mg/kg。SOC、EOC和MBC随纬度增加呈指数增长(P < 0.05),而DOC则随纬度增加呈指数降低(P<0.05)。在不同气候带上,SOC和EOC含量表现为热带森林 < 亚热带森林 < 温带森林(P<0.05),DOC含量表现为热带森林 > 亚热带森林 > 温带森林 (P<0.001)。气候、植被生物量、土壤质地和土壤微生物可解释土壤有机碳组分纬度格局的大部分空间变异(SOC 74%; EOC 65%; MBC 51%和DOC 76%)。其中,气候是土壤有机碳组分呈现纬度格局的主要影响因素,土壤质地是SOC和EOC的次要影响因素,而土壤微生物和植被生物量是MBC和DOC的次要影响因素。
关键词:森林;土壤有机碳;易氧化有机碳;微生物碳;溶解性有机碳;纬度格局
森林是陆地生态系统最重要的组分之一,其土壤有机碳贮量约占全球土壤有机碳库的70%[1-2]。土壤有机碳十分复杂,不同组分有机碳的周转时间存在非常大的差异[3];其中,周转较快的活性碳组分,如易氧化有机碳(EOC)、可溶性有机碳(DOC)和土壤微生物碳(MBC)等,对环境因素和人为干扰的响应较其它稳定碳组分更为敏感[4-5]。因此,开展土壤活性碳组分贮量及其周转过程的研究有助于阐明土壤有机碳在人为干扰或气候变化情景下的早期变化和轨迹[6]。
土壤活性碳组分具有不稳定和易氧化分解的特点,易被土壤微生物分解利用并对植物养分供应具有重要作用[7]。Blair等[7]将能被330 mmol/L高锰酸钾氧化的碳称为易氧化有机碳(EOC),并认为该组分可基本区别土壤稳定性碳,此外,EOC占土壤有机碳的比例相对较大,土壤碳库容量的变化也主要发生在EOC[8]。土壤微生物碳(MBC)是土壤养分转化的活性碳库或源,受土壤生物体组成和土壤水分等多种因素的共同影响,是反映土壤微生物活性大小的总体指标之一[9]。土壤MBC占SOC的比例一般在1%—4%范围内[10]。土壤可溶性有机碳(DOC)含量非常少,但它却是土壤微生物活性的最有效基质,是土壤碳、氮、磷和硫矿化的主要能源。鉴于土壤活性碳组分对气候变化的快速响应[11],近年来土壤活性碳组分的研究受到了科学家广泛关注。
目前,土壤碳组分空间格局及其影响因素的研究主要集中在SOC,对土壤活性碳组分空间格局与影响因素的研究非常缺乏。Fang等[12]认为土壤基质与土壤微生物的交互作用显著影响着森林土壤活性碳的变化。土壤碳库是土壤有机碳源输入和输出平衡后的结果[13],输入过程包括固态阶段的解吸附或凋落物的渗漏等,输出过程包括吸附和分解等,这些过程反过来也依靠于外部环境的生物因素(凋落物或生物分解者)和非生物因素(温度,降水及土壤质地)[14]。因此,揭示土壤活性碳组分空间格局的控制机制,需要结合气候,植被和土壤等多种因素进行深入探讨。然而,当前对土壤活性碳组分的研究主要集中在农田生态系统,且大部分研究侧重于活性碳组分对不同土地利用方式和不同管理方式的响应[15]。大尺度下,森林生态系统土壤碳组分空间格局及其影响因素的研究还未见报道。
中国东部南北样带(North-South Transect of Eastern China, NSTEC)是世界上少有的跨越热带到温带并包含众多独特生态系统的样带[16],覆盖了从热带雨林至寒温带针叶林的北半球主要森林类型,为揭示大尺度下森林土壤有机碳组分的空间分布规律及影响因素提供了理想的天然实验平台。本文以NSTEC的9个典型森林生态系统为研究对象,通过分析测试表层土壤SOC、EOC、MBC和DOC含量,再结合气候、植被生物量、土壤质地和土壤微生物等因素,探讨了土壤有机碳组分的空间格局及其主要影响因素。主要研究目的:1)揭示森林土壤有机碳组分随纬度的变化规律;2)探讨影响森林土壤有机碳组分纬度格局的主要因素及其控制机制。其研究结论不仅可为森林土壤碳组分模型模拟的研究及验证提供理论参考,还将为预测陆地生态系统对气候变化的响应提供重要依据。
1材料和方法
1.1研究地点
NSTEC覆盖了40°N以南、108°—118°E,和40°N以北、118°—128°E的中国东部地区,南北相距约3700 km[16]。该样带跨越了多个气候带和植被类型,具有明显的热量梯度与水热组合梯度,是世界上独特完整的以热量梯度驱动的植被连续带[17]。年平均气温在-3.67—23.15℃之间,年均降水量在472.96—2265.80 mm之间。本研究选择了NSTEC具有区域代表性的9个典型森林生态系统为研究对象,从南到北依次是热带山地雨林(尖峰岭)、南亚热带常绿阔叶林(鼎湖山)、亚热带常绿阔叶林(九连山)、北亚热带常绿落叶阔叶混交林(神农架)、暖温带落叶阔叶林(东灵山)、温带针阔叶混交林(长白山;凉水)和寒温带针叶林(呼中)[18]。研究区域与所选森林类型的基本地理信息见表1和图1。
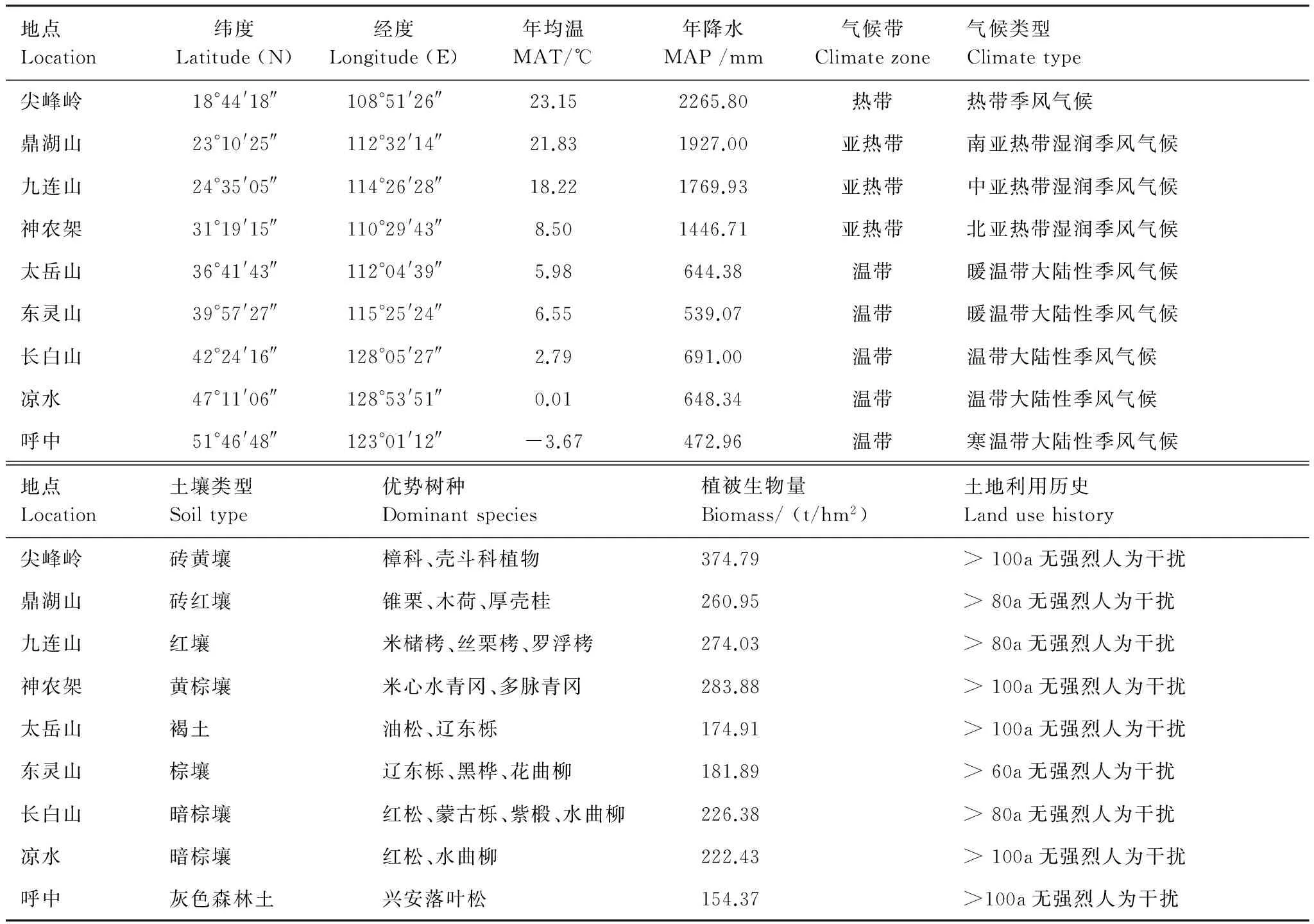
表1 中国东部南北样带不同森林基本信息
MAT: 年均温 mean annual temperature; MAP: 年降水 mean annual precipitation
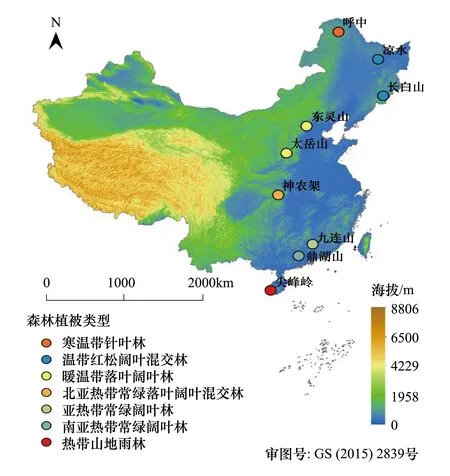
图1 不同森林类型在中国东部南北样带的空间分布 Fig.1 The spatial distribution of selected forests along the north-south transect of eastern China
1.2样点设置及调查采样
野外调查在2013年7—8月进行。为了降低土地利用方式变化和人为干扰对实验结果的影响,在选定的9个典型森林类型所对应的国家级自然保护区的核心区内设置了标准实验样地;这些实验样地均为60—100年未受到强烈人为干扰或砍伐的原始林地。首先,在所选定的调查区域,分别建立4个30 m40 m的乔木层样方,在该乔木样方的4个顶角上分别设置5 m5 m的灌木样方,在该乔木样方的4条边上分别设置1 m1 m的草本样方。每个乔木样方内设置30—40个土壤采样点,去除地表调落物后,采用土钻法对0—10 cm土壤样品进行取样,将多个采样点的土壤样品进行混合,去除土壤可见根系和杂质并过2 mm土壤筛,土壤样品分为风干土和4 ℃冷藏土进行保存。
1.3植物群落结构调查与植被生物量估算
在野外调查过程中,对每个样地内的乔木和灌丛进行了详细的群落结构调查,详细记录样方内出现的胸径≥1 cm乔木(胸径<1 cm的乔木视为灌木)和灌木的种名和个体数;利用胸径尺测量乔木的胸径,目测树高,采用对角线法测定其冠幅;灌木利用游标卡尺测其基径,用圈尺测定其高度和冠幅。最后,利用中国生态系统研究网络(Chinese Ecosystem Research Network,CERN)数据库搜集各物种器官生长方程,分别计算各样方内乔木和灌木的立木生物量。草本样方采用收获法进行调查,即采集样方内草本植物的地上生物量,用烘干恒重法测定每个物种的干物质生物量,再加和获得单位面积的草本生物量。根据样方面积分别计算出单位面积乔木,灌木和草本生物量,三者之和即为调查样地的单位植被生物量(表1)。
1.4土壤有机碳组分的测试
SOC采用重铬酸钾法测定[19]。EOC利用Blair[7]提供的方法和程序测定;即称取约含15—30 mg碳含量的土壤风干样品,放入50 mL离心管中,加入25 mL 浓度为333 mmol/L 的KMnO4溶液。密封瓶口,以25 r/min振荡1 h。振荡后的样品以2000 r/min离心5 min,然后取上清液并用去离子水按 1∶250稀释。将稀释液在565 nm 分光光度计上比色,根据KMnO4溶液的浓度变化即其消耗量计算土壤样品EOC含量,每消耗1 mmol高锰酸钾溶液相当于氧化9 mg碳。
MBC采用改良后的氯仿熏蒸法测定[20]。首先,测定每个土样的含水量,再将10 g鲜土用无乙醇的氯仿熏蒸24 h,熏蒸后的土样按土水比1∶5加入0.5 mol/L的K2SO溶液,在振荡器上振荡,浸提30 min后,滤液经0.45 μm微孔滤膜抽气过滤。同时用10 g未熏蒸的鲜土进行相同浸提处理。熏蒸和未熏蒸的浸提液都采用TOC仪分别测其碳含量。MBC含量为熏蒸前的碳含量减去熏蒸后的碳含量,并乘以转换系数0.38[21]。未熏蒸的土壤浸提液中所测得的碳含量则为DOC。
1.5土壤微生物组成和土壤粒度组成测定
土壤微生物总量、细菌、真菌和放线菌生物量的测定采用磷脂脂肪酸法;将约8 g干重的新鲜土壤分别用磷酸缓冲液、氯仿和甲醇(1∶2∶4),避光振荡离心,转移上清液到分液漏斗中,再向土壤中加入磷酸缓冲液、氯仿和甲醇溶液,静置过夜,避光保存。收集下层氯仿相,氮气吹干。用硅胶柱层析,分离出磷脂。依次用氯仿、丙酮和甲醇洗脱,并收集甲醇相,吹干。在吹干后的样品中加入1 mL的1∶1甲醇甲苯及1 mL的0.2 mol/L氢氧化钾,摇匀,37 ℃水浴加热15 min,最后用正己烷萃取,收集正己烷相并吹干,用气相色谱-质谱联用仪(岛津GC-MS QP 2010 PLUS)测定(微生物组成数据为内部共享数据)。土壤粒度组成由Coulter LS230激光粒度仪测定,再根据国际土壤质地分级标准,分别将<2 μm、2—20 μm和20—2000 μm粒径土粒分为粘粒、粉粒和砂粒。
1.6统计方法
采用单因素方差分析(ANOVA)并结合Duncan法对不同森林类型土壤碳组分及其占SOC的比例进行了差异性检验。采用Person相关性分析对土壤碳组分及其环境因素之间的相关性进行检验。
结构方程模型(Structural Equation Modeling, SEM)是一种多变量统计方法,能够判别多因子间的复杂路径关系。本文利用结构方程将影响土壤碳组分纬度格局的因素分为气候因素(年均温和年降水)、有机质输入因素(植被生物量)、土壤质地因素(粘粒、粉粒和砂粒)和分解因素(土壤微生物(细菌、真菌和真/细)),再根据各碳组分与气候、植被生物量、土壤质地和土壤微生物等环境因子间的相关关系(表4),通过增减因子逐步实现方程的最优化,并获得土壤有机碳组分空间格局的主要影响因素及其相对贡献率。所有分析均基于SPSS 13.0 + Amos7.0软件包进行。
2结果
2.1森林土壤有机碳组分的纬度变化格局
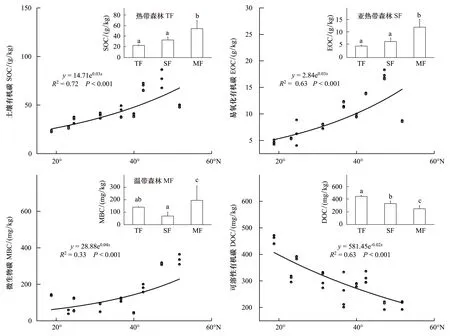
图2 中国东部南北样带森林土壤有机碳组分随纬度的变化Fig.2 Changes in soil organic carbon fractions with latitude along the north-south transect of eastern China柱状图代表不同气候带分区的有机碳组分含量,不同小写字母表示处理间的差异显著(P < 0.05)
SOC随纬度增加呈现出指数增加趋势(P<0.001)(图2),SOC含量在凉水最大(77 g/kg)、在尖峰岭最小(23.12 g/kg)。其中尖峰岭和鼎湖山间差异不显著,神龙架、太岳山和东灵山之间差异不显著。EOC随纬度增加也呈现出指数上升趋势(P<0.001)(图2),其含量在凉水最大(17.24 g/kg);其中,9个森林站点EOC含量差异都十分显著(表2)。MBC随纬度增加整体呈现出指数增加趋势(P<0.001)(图2),东灵山最小(41.92 mg/kg),呼中最大(329.39 mg/kg)(表2)。MBC含量在样带上差异较大,最大值是最小值的7.85倍,其中凉水和呼中间差异不显著,而二者与其它各样点均存在显著差异。DOC纬度分布格局与其它碳组分完全相反,其含量随纬度增加呈现出指数降低趋势(P<0.001)(图2),最高为太岳山(453.43 mg/kg)、最低为凉水(212.67 mg/kg)(表2)。
按气候类型划分,SOC和EOC含量整体表现为热带森林 < 亚热带森林 < 温带森林;DOC含量则表现为热带森林 > 亚热带森林 > 温带森林(图2)。SOC含量在热带森林、亚热带森林和温带森林分别为23.12、33.56、55.31 g/kg;SOC含量在热带和亚热带间差异不显著,而温带显著高于热带和亚热带(P<0.001)(图2)。EOC含量在热带和亚热带森林分别为4.62、6.44 g/kg,二者差异不显著;温带森林EOC含量为12.22 g/kg,显著高于热带和亚热带森林(P<0.001)(图2)。MBC在热带、亚热带和温带森林土壤含量分别为140.78,69.68、195.78 mg/kg(图2);温带森林MBC含量则显著低于热带和亚热带森林(P= 0.002)。热带、亚热带和温带森林土壤DOC含量分别为453.43、335.38、254.84 mg/kg,且三者间均差异显著(P<0.001)(图2)。
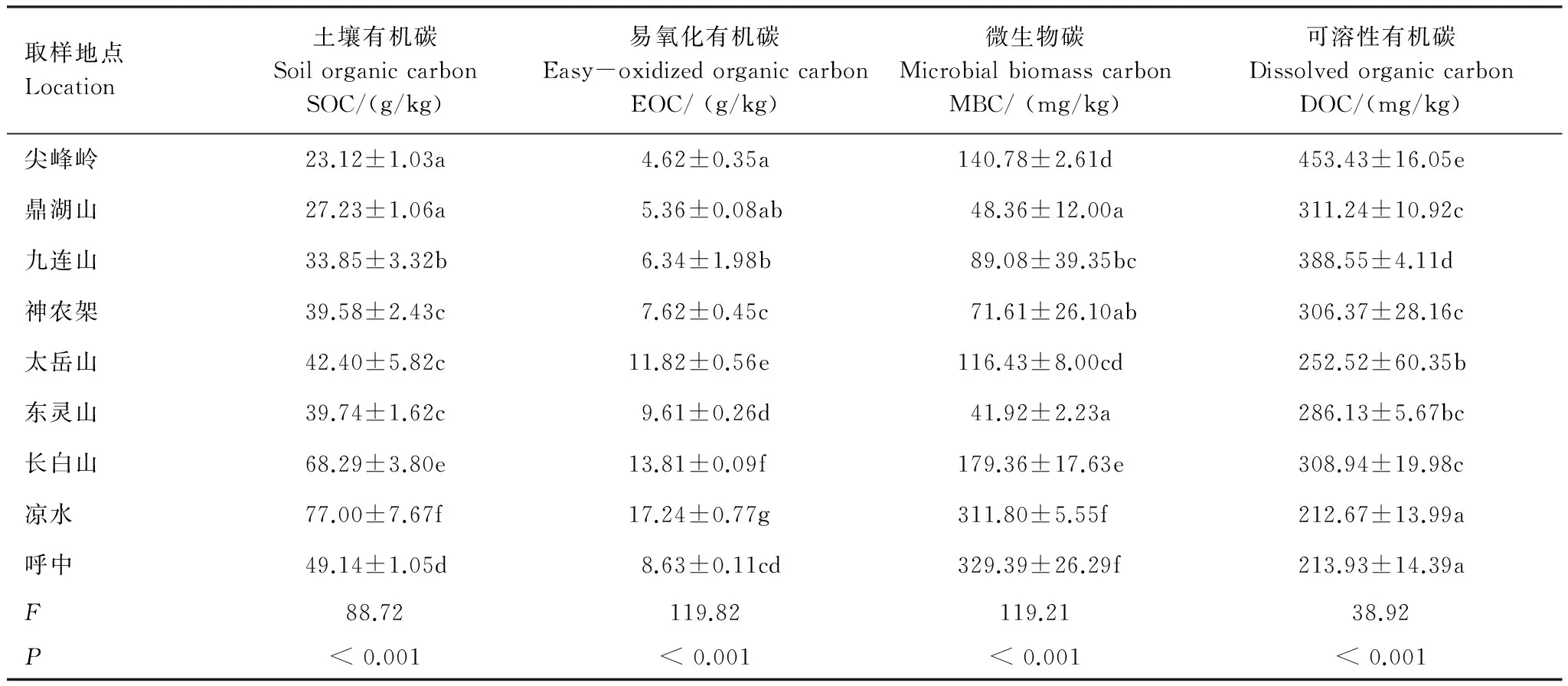
表2 中国东部南北样带森林土壤有机碳组分的差异
同一栏内不同小写字母表示处理间的差异显著(P< 0.05)
2.2土壤活性碳组分与SOC的比例
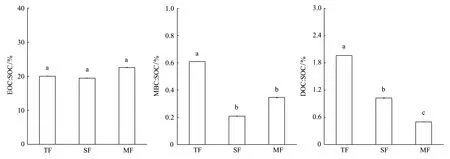
图3 热带、亚热带和温带森林土壤活性碳组分占土壤有机碳的比例Fig.3 The proportion of labile carbon fractions to SOC at tropical forest (TF), subtropical forest (SF), and temperate forest (MF)TF: 热带森林土壤;SF: 亚热带森林土壤;MF: 温带森林土壤;不同小写字母表示处理间的差异显著(P<0.05)
热带、亚热带和温带森林土壤EOC∶SOC分别为20%、19%和23%,三者差异不显著(P= 0.089)(图3)。MBC∶SOC在热带,亚热带和温带森林分别为0.6%、0.2%和0.3%;其中,热带森林MBC∶SOC显著高于亚热带和温带森林(P<0.001),而亚热带和温带森林间差异不显著(图3)。DOC∶SOC在热带、亚热带和温带森林分别为1.9%、1.0%和0.4%,三者差异显著(P<0.001)(图3)。相关分析表明:EOC∶SOC与土壤粘粒显著负相关、与砂粒显著正相关,相关系数分别为-0.43和0.35(表3)。MBC∶SOC与真菌和细菌之比(F∶B)显著负相关(r= -0.37)。DOC∶SOC与MAT和MAP极显著正相关(r分别为0.90和0.89),与土壤微生物总量和细菌含量具有显著负相关关系(r分别为-0.64和-0.55)。
*P<0.05, **P<0.01; PLFA: 微生物总量phospholipid fatty acid; 真菌∶细菌 F∶B: the ratio of fungus to bacteria
2.3土壤碳组分纬度分布格局的主要影响因素
结构方程结果表明:气候、植被生物量、土壤质地和土壤微生物特征分别解释了SOC、EOC、MBC和DOC纬度变异的74%、65%、51%和76%(图4)。SOC和EOC纬度格局主要受到气候和土壤质地的影响;气候对二者具有显著负效应,其路径系数分别为:-0.97(P<0.001)和-0.63(P<0.05);土壤质地对二者具有显著的正效应,其路径系数分别为0.55(P<0.05)和0.30(P<0.05)。然而,植被生物量和土壤微生物对SOC和EOC的影响则相对较弱(图4)。
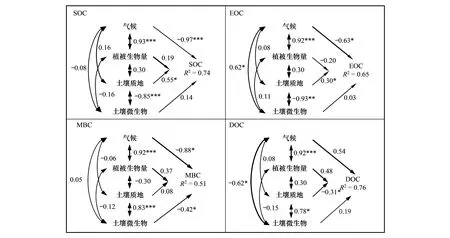
图4 中国东部南北样带生物和非生物因素对森林土壤有机碳组分影响机制的结构方程分析Fig.4 Results of structural equation models for the effects of biotic and abiotic factors on SOC fractions along NSTEC气候因素(Climate)包括:年均温和年均降水量,植被生物量(Biomass);土壤质地因素(Soil texture)包括:粘粒、粉粒和砂粒;土壤微生物因素(Microorganism)包括:土壤细菌、真菌和真菌∶细菌;图中单向实线箭头代表路径系数,双向虚线箭头代表相关系数,箭头的粗细表示相关程度的大小
MBC纬度格局的主要控制因素是气候,气候对MBC具有显著的负效应,其路径系数为-0.88(P<0.05),而MBC的次要控制因素为土壤微生物,土壤微生物对MBC具有显著的负效应,其路径系数为-0.42(P<0.05)。植被生物量对MBC具有正效应,其路径系数为0.37,而土壤质地对MBC的影响却十分微弱,其路径系数为0.08(图4)。DOC则主要受制于气候和植被生物量的正效应,其路径系数分别为0.54和0.48。土壤质地对DOC具有负效应,其路径系数为-0.31,土壤微生物对DOC的影响具有正效应,其路径系数为0.19(图4)。
3讨论3.1森林土壤有机碳组分具有明显的纬度分布格局
SOC、EOC和MBC随纬度增加呈指数增加,而DOC则表现出相反的纬度格局。土壤有机碳组分的纬度变化趋势与气候带的分布格局基本一致(图2)。其中,SOC含量随纬度增加持续显著增加(P<0.001),该结论与Franzluebbers等[22]研究结果基本一致。可能的原因:高纬度地区较低的气温抑制了微生物活性,从而通过限制有机物质分解形成该地区高SOC积累;在低纬地区,高温湿润的气候条件有利于土壤有机质分解[23],其负效应甚至会远强于通过增加生产力而促进有机质输入的正效应。因此,虽然低纬度地区生物量更高(即植被向土壤输入有机质更高),但由于分解或周转速率更快而不利于SOC长期积累[24]。其次,北方森林主要以针叶林或针阔混交林为主,南方主要由阔叶林或季雨林组成,植被类型的不同将造成地被物层和土壤层输入有机物质在类型、数量和化学特性发生变化,一定程度上影响新输入有机质的分解速率[25]。例如,阔叶树种根的渗出液和凋落物具有更高的水溶性糖,加尼奇酸和氨基酸[26],这些物质易于微生物利用,从而增强微生物活性。而针叶林含有更多难以分解物质(木质素和纤维素),高木质素含量和低可溶性糖类[27],使其难以分解而有利于土壤有机碳的积累[28]。
EOC、MBC和SOC的变化趋势一致,都随着纬度的增加而增长(图2),并且EOC、MBC与SOC显著正相关(表4)。Jia等[29]也认为EOC、MBC与SOC具有显著正相关关系。Xu等[30]通过收集整合全球土壤MBC数据发现,MBC含量在北半球高纬度地区高,在低纬度地区及其南半球地区含量低,并且随着纬度增长显著增加。Fang等[12]认为北方森林土壤微生物群落主要利用高能量基质,而亚热带森林微生物可等效地利用土壤基质,导致亚热带森林土壤微生物碳截留率较低,有机质周转更快。此外,EOC和MBC的变化特点可能受到土壤磷缺乏的限制,热带和亚热带森林土壤中的磷由于被铁和铝氧化物吸附而相对缺乏[31],植被和土壤微生物受到磷缺乏的生理抑制而使低纬地区SOC、EOC和MBC含量较高纬度地区更低。同时,EOC含量在不同森林类型上都存在显著差异,表明森林土壤EOC对环境变化较其他碳组分更为敏感。此外,高MBC表明有更高的微生物碳固定,从而一定程度上减少了高纬地区通过化学和物理过程的土壤有机碳丢失。
DOC既是土壤生物化学过程的产物,又是土壤微生物生长、分解有机碳的重要能源[14],具有较高的生物可分解性[32]。DOC随纬度增加而降低,热带、亚热带和温带森林土壤DOC含量也呈现持续显著降低的趋势(图2)。这主要是由于低纬地区温度较高,增加了土壤微生物活性,从而使难分解的土壤大分子有机质更易被降解为可溶性较强的有机质小分子,造成土壤DOC含量由低纬向高纬地区降低的空间格局。Fröberg等[33]对不同气候梯度挪威云杉林的研究表明:森林土壤DOC含量随着纬度增加而降低,并且认为DOC纬度格局主要是受到MAT直接或间接控制的土壤微生物过程和凋落物输入的影响。Liechty等[34]指出温度差异可能导致温带森林比寒带森林DOC浓度增加16%。此外,一些控制实验也发现DOC产生率随温度升高而增加[35]。DOC除源自凋落物、根系分泌物和细根分解产物之外,降水淋溶和土壤腐殖质也是主要来源[14];本研究中DOC与MAT,MAP和植被生物量都表现出显著正相关(表4),间接验证了上述结论。
3.2森林土壤活性碳组分的分配比例
EOC∶SOC在热带、亚热带和温带森林土壤中差异不显著。Biederbeck等[36]通过动力学研究指出,土壤有机碳的短暂波动主要发生在易氧化分解部分,EOC可作为土壤活性有机碳的指示因子。土壤活性有机碳分配比例越高,表明土壤有机碳活性越大,稳定性越差[37]。本研究发现,土壤EOC占SOC的比例远远大于MBC和DOC,因此EOC∶SOC可一定程度上指示森林土壤有机碳稳定性的高低。森林土壤EOC∶SOC在热带、亚热带和温带森林间不存在显著差异,其可能原因是由于本研究站点均为原始林,人为活动干扰小,土壤与当地环境因素长时期的适应使土壤EOC∶SOC比例变得相对稳定。相关分析也表明,EOC∶SOC与土壤质地密切相关,而与温度和降水的关系不密切(表 3)。
MBC∶SOC可用于解释固定在SOC中的微生物细胞,也可表示供微生物分解的基质利用率的高低[38],从微生物角度揭示土壤肥力和土壤碳库的动态变化。本文结果表明∶森林土壤MBC∶SOC比例都在1%左右,属于前人对其比例(1%—4%)界定的下限[10]。这可以用植物和土壤微生物对营养的竞争关系来进行试探性解释;本文实验站点均为多年未受干扰的原始林,SOC含量相对较高,在一定程度上导致MBC∶SOC观测值较低。郭曼等[39]也指出:随着森林日渐成熟或林龄增长,MBC∶SOC比值会逐渐降低。此外,土壤细菌是简单碳水化合物、加尼奇酸和氨基酸的主要分解者,而真菌是顽固性组分的主要分解者[40]。南方森林比北方森林土壤有更高的真菌比细菌的比例,其微生物组成使热带森林相对于亚热带和温带森林具有更高的MBC∶SOC。Witter等[41]认为有机碳输入的增加不仅导致MBC和SOC增加,也是导致更高MBC∶SOC的重要原因。热带森林土壤具有充足的水热条件,相较于其它气候带森林有更多的有机碳输入。DOC∶SOC整体表现为热带森林 < 亚热带森林 < 温带森林(图3),DOC和DOC∶SOC随纬度变化的趋势一致,这说明DOC随纬度的变化较为稳定。DOC很大程度上表征了土壤微生物活性的不稳定机制,但其组分中大约只有10%—40%易降解组分,而大部分组分是由相当稳定的溶解性腐殖质构成[42]。
3.3气候是森林土壤有机碳组分纬度格局的主要影响因素
气候是森林土壤碳组分纬度分布格局的主要影响因素,但不同有机碳组分的次要控制因素却存在较大差异。气候、植被生物量、土壤质地和土壤微生物等4组因子对SOC、EOC、MBC和DOC的解释度分别达到了74%、65%、51%和76%(图4)。降水和温度强烈控制着凋落物的分解和微生物活性[43],通过影响分解速率来影响土壤碳输入和输出的平衡[44]。MAT、MAP和植被生物量两两显著正相关,都随纬度增加而降低(表4)。Sanderman等[45]认为森林土壤有机碳的分解速率随着MAT增加呈指数增长。南方森林生物量输入较大,但在高温+高湿环境下,其对土壤有机质分解速率具有更强的正效应;而高纬度地区,较低的温度抑制了土壤有机质分解速率。Wu等[46]发现:受温度的影响,中国东部森林土壤有机质的矿化速率随纬度升高而降低。因此,气候因素通过对土壤有机质的输入与分解过程施加不同的影响,最终导致SOC具有明显的纬度格局[47-48]。
温度和降水通过影响土壤类型及化学、生物和物理过程的比例,独特的影响着土壤性质[49]。EOC是土壤中氧化分解的产物,森林土壤氧化还原环境的形成也主要受制于气候条件的控制(图4)。Xu[30]整合全球土壤微生物生物量数据建立多元回归方程,发现气候是控制MBC的主要因素。森林土壤DOC主要由单糖和非腐殖质类多糖组成[50]。DOC的物质组成特点使其极容易受到降水淋滤作用的影响,导致降水对DOC作用很大(图4)。因此,EOC、MBC和DOC作为土壤碳的活跃组分其纬度变化格局也主要受制于对气候的响应。
土壤有机碳组分除了共同受气候因素主控之外,它们的次要影响因素却存在较大差异。土壤质地对SOC和EOC的作用显著高于植被生物量和微生物,而MBC和DOC分别受土壤微生物和植被生物量的影响较大(图4)。Hobbie等[51]认为土壤基质质量是影响SOC含量及其纬度分布的主要因素之一。EOC由不稳定的腐殖质物质和多糖组成,包含了所有能被KMnO4氧化分解的有机组分[8]。土壤质地或团聚体的物理和化学保护机制是影响土壤温度敏感性和分解速率的重要因素[52];因此,土壤质地对SOC和EOC影响较强。MBC是土壤活性微生物的碳含量,因此微生物活性及组成是仅次于气候的次要控制因素。Zsolnay等[53]认为森林土壤中腐殖质的淋溶及微生物分解是DOC的主要形成途径。在DOC影响因素的结构方程中(图4),除气候因素的主控效应外,植被生物量和土壤微生物对DOC具有正效应。Bergamaschi等[54]利用δ13C的研究表明可溶性有机质的结构组成与植物残体相似;据估计,约80%DOC产生于新近凋落物层[55]。Smolander等[56]研究发现阔叶林下土壤DOC含量要明显大于针叶林下土壤。此外,土壤质地及其物理和化学保护机制会影响微生物对易分解性有机碳的可获得性[57-58],是土壤质地对DOC影响较为显著的重要原因之一(图4)。
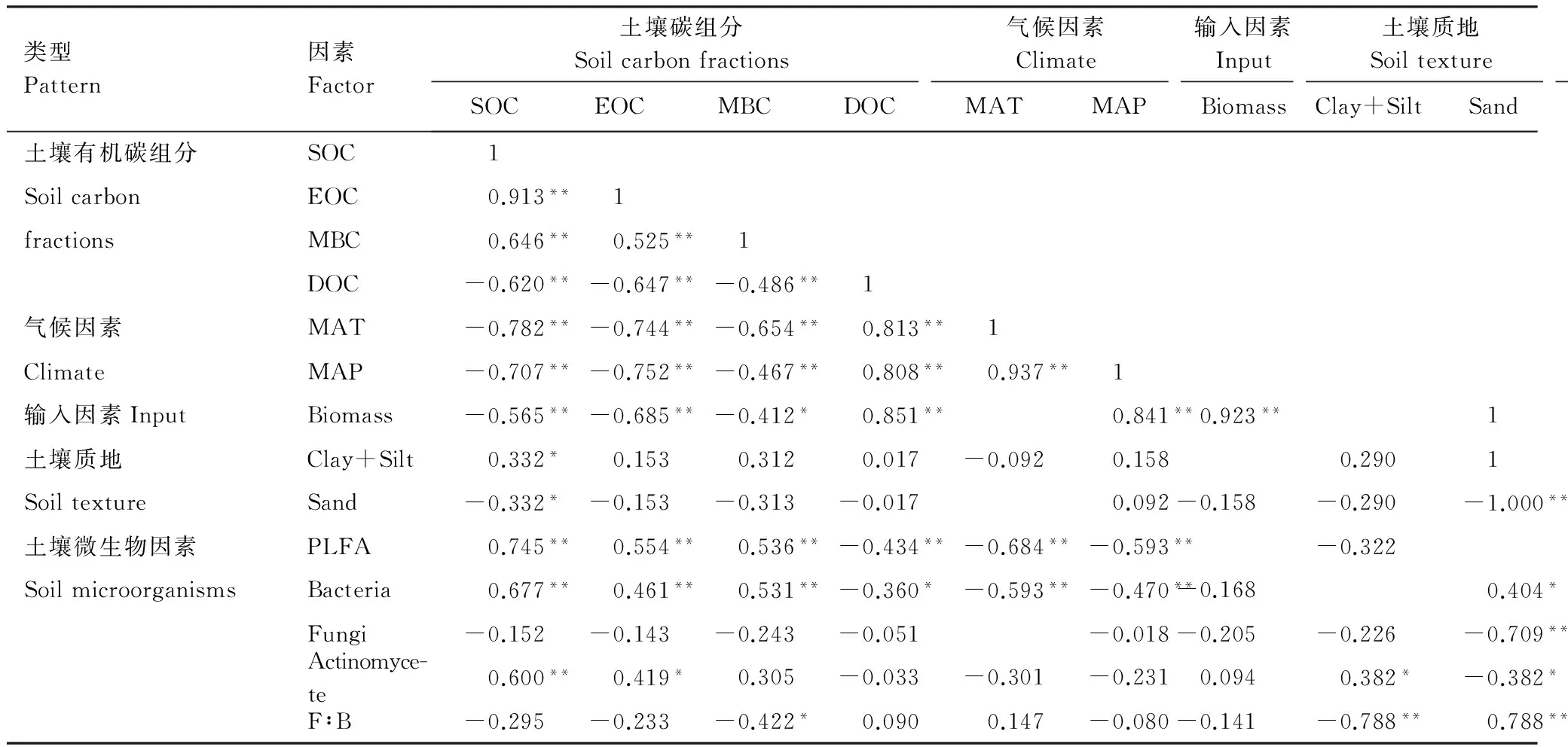
表4 土壤有机碳组分与生物和非生物因素的相关性
SOC: 土壤有机碳;EOC: 易氧化有机碳;MBC: 微生物碳;DOC: 可溶性有机碳;MAT: 年均温;MAP: 年均降水量;Biomass: 植被生物量;Clay+Silt: 粘粒和粉粒的含量;PLFA: 微生物总量;Bacteria: 细菌含量;Fungi: 真菌含量;Actinomycete: 放线菌含量;F∶B: 真菌与细菌的比值; *P<0.05, **P<0.01
4结论
森林土壤碳组分具有明显的纬度格局,SOC、EOC和MBC随纬度增加呈指数上升,而DOC则随纬度增加而降低。气候因素是森林土壤有机碳组分纬度分布格局的主控因素,但不同土壤有机碳组分纬度格局的次要影响因素存在较大的差异;SOC和EOC的次要影响因素是土壤质地,而MBC和DOC的次要影响因素分别是土壤微生物和植被生物量。本研究不仅阐明了森林土壤有机碳组分的纬度格局及其主要影响因素,还为揭示未来气候变化情景下的土壤有机碳周转和固持提供了一定的理论基础。
参考文献(References):
[1]Dixon R K, Solomon A M, Brown S, Houghton R A, Trexier M C, Wisniewski J. Carbon pools and flux of global forest ecosystems. Science, 1994, 263(5144): 185- 190.
[2]Sundquist E T. The global carbon dioxide budget. Science, 1993, 259(5097): 934- 941.
[3]Gregorich E G, Beare M H, McKim U F, Skjemstad J O. Chemical and biological characteristics of physically uncomplexed organic matter. Soil Science Society of America Journal, 2006, 70(3): 975- 985.
[4]Melillo J M, Steudler P A, Aber J D, Newkirk K, Lux H, Bowles F P, Catricala C, Magill A, Ahrens T, Morrisseau S. Soil warming and carbon-cycle feedbacks to the climate system. Science, 2002, 298(5601): 2173- 2176.
[5]Zhu L Q, Hu N J, Yang M F, Zhan X H, Zhang Z W. Effects of different tillage and straw return on soil organic carbon in a rice-wheat rotation system. PLoS One, 2014, 9(2): e88900.
[6]Leifeld J, Kögel-Knabner I. Soil organic matter fractions as early indicators for carbon stock changes under different land-use? Geoderma, 2005, 124(1/2): 143- 155.
[7]Blair G J, Lefroy R D B, Lise L. Soil carbon fractions based on their degree of oxidation, and the development of a carbon management index for agricultural systems. Australian Journal of Agricultural Research, 1995, 46(7): 1459- 1466.
[8]Conteh A, Blair G T, Lefroy R D B, Whitbread A M. Labile organic carbon determined by permanganate oxidation and its relationships to other measurements of soil organic carbon. Humic Substances in the Environment, 1999, 1: 3- 15.
[9]Mazzarino M J, Oliva L, Abril A, Acosta M. Factors affecting nitrogen dynamics in a semiarid woodland (Dry Chaco, Argentina). Plant and Soil, 1991, 138(1): 85- 98.
[10]Jenkinson D S. Microbial biomass in soil: measurement and turnover // Paul E A, Ladd J N, eds. Soil Biochemistry. New York: Marcel Dekker, 1981, 2: 15- 471.
[11]Song B, Niu S L, Zhang Z, Yang H J, Li L H, Wan S Q. Light and heavy fractions of soil organic matter in response to climate warming and increased precipitation in a temperate steppe. PLoS One, 2012, 7(3): e33217.
[12]Fang H J, Cheng S L, Wang Y S, Yu G R, Xu M J, Dang X S, Li L S, Wang L. Changes in soil heterotrophic respiration, carbon availability, and microbial function in seven forests along a climate gradient. Ecological Research, 2014, 29(6): 1077- 1086.
[13]Schlesinger W H. Carbon balance in terrestrial detritus. Annual Review of Ecology and Systematics, 1977, 8: 51- 81.
[14]庞学勇, 包维楷, 吴宁. 森林生态系统土壤可溶性有机质(碳)影响因素研究进展. 应用与环境生物学报, 2009, 15(3): 390- 398.
[15]Datta S P, Rattan R K, Chandra S. Labile soil organic carbon, soil fertility, and crop productivity as influenced by manure and mineral fertilizers in the tropics. Journal of Plant Nutrition and Soil Science, 2010, 173(5): 715- 726.
[16]Lu N, Sun G, Feng X M, Fu B J. Water yield responses to climate change and variability across the North-South Transect of Eastern China (NSTEC). Journal of Hydrology, 2013, 481: 96- 105.
[17]张新时, 杨奠安. 中国全球变化样带的设置与研究, 1995, (1): 43- 52.
[18]Yu G R, Fu Y L, Sun X M, Wen X F, Zhang L M. Recent progress and future directions of ChinaFLUX. Science in China Series D-Earth Sciences, 2006, 49(S2): 1- 23.
[19]Nelson D W, Sommers L E. Total carbon, organic carbon, and organic matter // Page A L, Miller R H, Keeney D R, eds. Methods of soil analysis. Madison, WI: Agronomy Society of America and Soil Science Society of America, 1982: 1- 129.
[20]Baumann A, Schimmack W, Steindl H, Bunzl K. Association of fallout radiocesium with soil constituents: effect of sterilization of forest soils by fumigation with chloroform. Radiation and Environmental Biophysics, 1996, 35(3): 229- 233.
[21]Ocio J A, Brookes P C. Soil microbial biomass measurements in sieved and unsieved soil. Soil Biology and Biochemistry, 1990, 22(7): 999- 1000.
[22]Franzluebbers A J, Haney R L, Honeycutt C W, Arshad M A, Schomberg H H, Hons F M. Climatic influences on active fractions of soil organic matter. Soil Biology and Biochemistry, 2001, 33(7/8): 1103- 1111.
[23]Oades J M. The retention of organic matter in soils. Biogeochemistry, 1988, 5(1): 35- 70.
[24]Fantappiè M, L′Abate G, Costantini E A C. The influence of climate change on the soil organic carbon content in Italy from 1961 to 2008. Geomorphology, 2011, 135(3/4): 343- 352.
[25]Yano Y, Lajtha K, Sollins P, Caldwell B A. Chemistry and dynamics of dissolved organic matter in a temperate coniferous forest on Andic soils: effects of litter quality. Ecosystems, 2005, 8(3): 286- 300.
[26]Priha O, Grayston S J, Hiukka R, Pennanen T, Smolander A. Microbial community structure and characteristics of the organic matter in soils underPinussylvestris,PiceaabiesandBetulapendulaat two forest sites. Biology and Fertility of Soils, 2001, 33(1): 17- 24.
[27]Hobbie S E. Temperature and plant species control over litter decomposition in Alaskan tundra. Ecological Monographs, 1996, 66(4): 503- 522.
[28]De Deyn G B, Cornelissen J H C, Bardgett R D. Plant functional traits and soil carbon sequestration in contrasting biomes. Ecology Letters, 2008, 11(5): 516- 531.
[29]Jia G M, Xi Y, Zhang B L, Chen F Q. Soil labile organic carbon and microbial activity changes with age in citrus (CitrussinensisOsb.) plantations in China. Australian Forestry, 2014, 77(3/4): 153- 158.
[30]Xu X F, Thornton P E, Post W M. A global analysis of soil microbial biomass carbon, nitrogen and phosphorus in terrestrial ecosystems. Global Ecology and Biogeography, 2013, 22(6): 737- 749.
[31]Sanchez P A. Soil fertility and hunger in Africa. Science, 2002, 295(5562): 2019- 2020.
[32]Andreasson F, Bergkvist B, Bååth E. Bioavailability of DOC in leachates, soil matrix solutions and soil water extracts from beech forest floors. Soil Biology and Biochemistry, 2009, 41(8): 1652- 1658.
[33]Fröberg M, Berggren D, Bergkvist B, Bryant C, Mulder J. Concentration and fluxes of dissolved organic carbon (DOC) in three norway spruce stands along a climatic gradient in sweden. Biogeochemistry, 2006, 77(1): 1- 23.
[34]Liechty H O, Kuuseoks E, Mroz G D. Dissolved organic carbon in northern hardwood stands with differing acidic inputs and temperature regimes. Journal of Environmental Quality, 1995, 24(5): 927- 933.
[35]Andersson S, Nilsson S I, Saetre P. Leaching of dissolved organic carbon (DOC) and dissolved organic nitrogen (DON) in mor humus as affected by temperature and pH. Soil Biology and Biochemistry, 2000, 32(1): 1- 10.
[36]Biederbeck V O, Janzen H H, Campbell C A, Zentner R P. Labile soil organic matter as influenced by cropping practices in an arid environment. Soil Biology and Biochemistry, 1994, 26(12): 1647- 1656.
[37]朱志建, 姜培坤, 徐秋芳. 不同森林植被下土壤微生物量碳和易氧化态碳的比较. 林业科学研究, 2006, 19(4): 523- 526.
[38]Hu S, Coleman D C, Carroll C R, Hendrix P F, Beare M H. Labile soil carbon pools in subtropical forest and agricultural ecosystems as influenced by management practices and vegetation types. Agriculture, Ecosystems & Environment, 1997, 65(1): 69- 78.
[39]郭曼, 郑粉, 安韶山, 刘雨, 安娟.植被自然恢复过程中土壤有机碳密度与微生物量碳动态变化. 水土保持学报, 2010, 24(1): 229- 232, 238- 238.
[40]Myers R T, Zak D R, White D C, Peacock A. Landscape-level patterns of microbial community composition and substrate use in upland forest ecosystems. Soil Science Society of America Journal, 2001, 65(2): 359- 367.
[41]Witter E, Kanal A. Characteristics of the soil microbial biomass in soils from a long-term field experiment with different levels of C input. Applied Soil Ecology, 1998, 10(1/2): 37- 49.
[42]Haynes R J. Labile organic matter fractions as central components of the quality of agricultural soils: An overview. Advances in Agronomy, 2005, 85: 221- 268.
[43]Aerts R. Climate, leaf litter chemistry and leaf litter decomposition in terrestrial ecosystems: A triangular relationship. Oikos, 1997, 79(3): 439- 449.
[44]Post W M, Emanuel W R, Zinke P J, Stangenberger A G. Soil carbon pools and world life zones. Nature, 1982, 298(5870): 156- 159.
[45]Sanderman J, Amundson R G, Baldocchi D D. Application of eddy covariance measurements to the temperature dependence of soil organic matter mean residence time. Global Biogeochemical Cycles, 2003, 17(2): 3001- 3015.
[46]Wu H B, Guo Z T, Peng C H. Distribution and storage of soil organic carbon in China. Global Biogeochemical Cycles, 2003, 17(2): 1048.
[47]Post W M, Pastor J, Zinke P J, Stangenberger A G. Global patterns of soil nitrogen storage. Nature, 1985, 317(6038): 613- 616.
[48]Yuan W P, Zhou G S, Wang Y H, Han X, Wang Y S. Simulating phenological characteristics of two dominant grass species in a semi-arid steppe ecosystem. Ecological Research, 2007, 22(5): 784- 791.
[49]Dahlgren R A, Boettinger J L, Huntington G L, Amundson R G. Soil development along an elevational transect in the western Sierra Nevada, California. Geoderma, 1997, 78(3/4): 207- 236.
[50]Kalbitz K, Solinger S, Park J H, Michalzik B, Matzner E. Controls on the dynamics of dissolved organic matter in soils: A review. Soil Science, 2000, 165(4): 277- 304.
[51]Hobbie S E, Schimel J P, Trumbore S E, Randerson J R. Controls over carbon storage and turnover in high-latitude soils. Global Change Biology, 2000, 6(S1): 196- 210.
[52]Wei H, Guenet B, Vicca S, Nunan N, Asard H, AbdElgawad H, Shen W J, Janssens I A. High clay content accelerates the decomposition of fresh organic matter in artificial soils. Soil Biology and Biochemistry, 2014, 77: 100- 108.
[53]Zsolnay A. Dissolved humus in soil waters // Piccolo A, ed. Humic Substances in Terrestrial Ecosystem. Amsterdam: Elsevie, 1996: 171- 223.
[54]Bergamaschi B A, Fram M S, Kendall C, Silva S R, Aiken G R, Fujii R. Carbon isotopic constraints on the contribution of plant material to the natural precursors of trihalomethanes. Organic Geochemistry, 1999, 30(8): 835- 842.
[55]Huang W Z, Schoenau J J. Fluxes of water-soluble nitrogen and phosphorus in the forest floor and surface mineral soil of a boreal aspen stand. Geoderma, 1998, 81(3/4): 251- 264.
[56]Smolander A, Kitunen V. Soil microbial activities and characteristics of dissolved organic C and N in relation to tree species. Soil Biology and Biochemistry, 2002, 34(5): 651- 660.
[57]Percival H J, Parfitt R L, Scott N A. Factors controlling soil carbon levels in New Zealand grasslands: Is clay content important?. Soil Science Society of America Journal, 2000, 64(5): 1623- 1630.
[58]Arrouays D, Vion I, Kicin J L. Spatial analysis and modeling of topsoil carbon storage in temperate forest humic loamy soils of france. Soil Science, 1995, 159(3): 191- 198.
基金项目:中国科学院战略性先导科技专项资助项目(XDA05050702);国家自然科学基金重大项目(31290221, 31470506);中国科学院地理科学与资源研究所可桢杰出青年人才项目(2013RC102)
收稿日期:2015- 03- 31;
修订日期:2015- 12- 08
*通讯作者
Corresponding author.E-mail: lyliang@swu.edu.cn
DOI:10.5846/stxb201503310630
Latitudinal patterns and factors affecting different soil organic carbon fractions in the eastern forests of China
WANG Chunyan1,2, HE Nianpeng2, LYU Yuliang1,*
1CollegeofGeographicalScience,SouthwestUniversity,Chongqing400715,China2KeyLaboratoryofEcosystemNetworkObservationandModeling,InstituteofGeographicSciencesandNaturalResourcesResearch,ChineseAcademyofSciences,Beijing100101,China
Abstract:Soil organic carbon (SOC) is one of the most important pools in forest ecosystems. The labile fractions of the SOC pool play critical roles in the SOC turnover processes and are a sensitivity indicator of SOC responses to future climate change. In this study, nine typical forest ecosystems (Jiangfengling, Dinghushan, Jiulianshan, Shengnongjia, Taiyueshan, Donglingshan, Changbaishan, Liangshui, and Huzhong) were selected along the North-South Transect of Eastern China (NSTEC), and covered tropical, subtropical, and temperate climate zones. The SOC, easy-oxidized organic carbon (EOC), microbial biomass carbon (MBC), and dissolved organic carbon (DOC) contents were measured in the 0—10cm soil layer, and climate factors, soil texture, soil microbes, and vegetation biomass were used to explore the latitudinal pattern of SOC fractions in forests and the main factors influencing them. The results showed that the SOC, EOC, MBC, and DOC contents were 23.12—77.00 g/kg, 4.62—17.24 g/kg, 41.92—329.39 mg/kg, and 212.63—453.43 mg/kg, respectively. SOC, EOC, and MBC increased exponentially as the latitude increased (P < 0.05), whereas DOC decreased exponentially as the latitude increased (P<0.05). The SOC and EOC contents in forest soils were in the following order: tropical forest < subtropical forest < temperate forest (P<0.05), and the order for DOC content was tropical forest > subtropical forest > temperate forest (P<0.001). The results of the structural equation modeling showed that climate, soil texture, soil microbe, and vegetation biomass significantly affected the spatial variations in SOC fractions, and they can explain 74%, 65%, 51%, and 76% of the variation in SOC, ECO, MBC, and DOC, respectively. Furthermore, the latitudinal patterns for the SOC fractions were mainly controlled by climate, with soil texture as the sub-dominant factor for SOC and EOC, and soil microbe and vegetation biomass as the sub-dominant factors for MBC and DOC, respectively.
Key Words:forest; soil organic carbon; easy-oxidized organic carbon; microbial biomass carbon; dissolved organic carbon; latitude patterns
王春燕,何念鹏, 吕瑜良.中国东部森林土壤有机碳组分的纬度格局及其影响因子.生态学报,2016,36(11):3176- 3188.
Wang C Y, He N P, Lü Y L.Latitudinal patterns and factors affecting different soil organic carbon fractions in the eastern forests of China.Acta Ecologica Sinica,2016,36(11):3176- 3188.
