南亚热带格木和红椎凋落叶及细根分解特征
2016-08-09王卫霞史作民刘世荣
王卫霞, 史作民, 罗 达, 刘世荣
1. 中国林业科学研究院森林生态环境与保护研究所, 国家林业局森林生态环境重点实验室, 北京 100091 2. 新疆农业大学林学与园艺学院,乌鲁木齐 830052
南亚热带格木和红椎凋落叶及细根分解特征
王卫霞1,2, 史作民1, *, 罗达1, 刘世荣1
1. 中国林业科学研究院森林生态环境与保护研究所, 国家林业局森林生态环境重点实验室, 北京100091 2. 新疆农业大学林学与园艺学院,乌鲁木齐830052
摘要:采用原位分解法对南亚热带格木(Erythrophleum fordii)和红椎(Castanopsis hystrix)人工纯林的凋落叶和细根分解动态及凋落叶和细根分解速率之间的相关关系进行了比较研究。结果显示,格木、红椎人工林凋落叶和细根分解系数分别为0.98a-1、0.88a-1和 0.65a-1、0.59a-1。格木、红椎凋落物分解主要受凋落物自身化学性质的影响,而与林分内环境条件的关系不显著。分解初期,凋落叶和细根的质量损失均与氮含量显著正相关(R2分别为0.525和0.549),与C/N比显著负相关(R2分别为0.764和0.361);而分解后期,凋落叶和细根的质量损失均与氮含量显著正相关(R2分别为0.565和0.511),与C/N比、木质素含量、木质素/N比显著负相关(R2分别为0.482和0.574;0.525和0.519;0.523和0.486)。格木、红椎凋落叶分解速率和细根分解速率表现出明显的正相关性,这主要归因于凋落叶、细根基质质量对凋落叶分解速率和细根分解速率的影响具有明显的相似性。
关键词:凋落叶;细根;分解速率;基质质量;南亚热带
森林凋落物(包括枯死细根)的分解,是森林生态系统物质循环及林地土壤养分输入的重要过程和途径。凋落物分解受外界环境条件、凋落物自身化学性质及土壤有机质等因素的综合影响[1- 3]。温度和水分是凋落物分解的重要环境影响因素,主要是通过改变微生物群落结构、活性从而间接调控凋落物的分解及养分释放[4],而在给定的环境区域中,凋落物基质质量(即凋落物化学性质)是影响凋落物分解的最重要的决定因素[1,5]。
在过去的几十年中,很多研究者对地上部分凋落物进行了大量的研究,并且较为深入地解释了不同树种特性对地上部分凋落物分解的影响[6- 10],而对于不同树种特性对地下部分凋落物分解的影响则了解较少,同时人们对地上部分凋落物和地下部分凋落物分解之间关系的了解也不多。Vivanco和Austin[11]研究了不同物种特性对凋落叶和细根分解的影响,但他们并没有阐述凋落叶和细根分解之间的相关关系。而Hobbie等[10]将不同温带树种的凋落叶和细根样品同时铺设在欧亚槭(Acerpseudoplatanus)林分下,发现不同树种的凋落叶分解速率与细根分解速率之间并没有明显相关关系。他们的研究排除了不同树种林分内微环境指标对凋落物分解的影响。但是在现实环境中凋落物分解多发生在凋落物本身所属树种林分下,对于这种原位分解环境下凋落叶和细根分解之间相关关系的研究还相对较少。然而,通常情况下根系的地下活动很难被观测到,因此估算根系分解速率挑战性很大[12],而且根系中的细根具有较快的周转速率[13- 14],经过细根生产和分解而循环的碳、氮量与地上部分相当[15]。因此,增加对凋落物地下部分分解以及凋落物地上与地下部分分解之间的相关关系的理解能够更好地认知森林生态系统的养分循环[16]。20世纪80年代在我国热带和亚热带地区发起了大规模的造林运动,大量的乡土珍贵阔叶树种被用于改建人工林经营模式,研究这些乡土阔叶树种凋落物的分解规律,旨在能够使森林管理者更好地了解当地森林生态系统碳氮循环过程,以便有效地对人工林进行经营管理。
本研究以我国南亚热带地区格木和红椎人工林为研究对象,研究格木、红椎凋落叶和细根在各自林分下的分解过程及分解过程中其基质质量的动态变化。拟回答以下问题:(1) 格木、红椎凋落叶和细根的分解有何不同?(2) 格木、红椎凋落叶和细根分解受哪些因子的影响?以及 (3) 格木、红椎凋落叶和细根分解之间是否存在相关关系?
1研究方法
1.1研究区概况
研究地点位于广西西南边陲的凭祥市境内中国林业科学研究院热带林业实验中心白云实验林场(22.06°N, 106.46°E)。该地区位于南亚热带季风气候区域内的西南部,属湿润半湿润气候。境内日照充足,降雨充沛,干湿季节分明;年均气温为21℃,平均月最低温度12.1℃,平均月最高温度26.3℃;年平均降水1400mm,主要发生在每年4—9月份;≥10℃活动积温6000—7600℃。主要地貌类型以低山丘陵为主,地带性土壤以红壤为主,主要由花岗岩风化形成。
选取格木和红锥人工林为研究对象,它们均是在马尾松人工林皆伐炼山后经块状整地营建的人工纯林,各林分基本情况见表1。
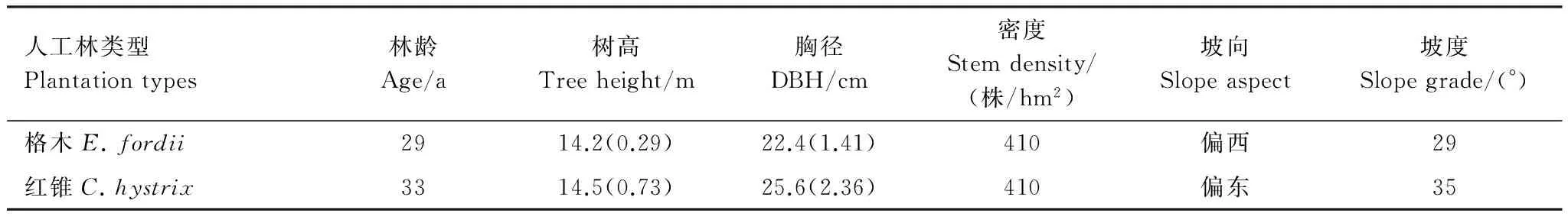
表1 实验林地概况
树高、胸径为 mean(SE) The data of tree height and DBH were mean(SE)
1.2研究方法
1.2.1实验设计和样品采集
2011年5—7月,在格木和红锥的各自林下收取新近自然凋落、上层未分解的凋落叶样品。同时,在格木、红锥的各自林下挖取土壤表层0—10cm深的新鲜细根(直径<2mm)样品。所有的凋落叶和细根样品在空气中风干至恒重[17]。分别称取10g风干重的凋落叶样品装入凋落叶分解袋中,称取2g风干重的细根样品装入细根分解袋中,其中凋落叶分解袋的规格为孔径1mm,尺寸为25cm×25cm的尼龙网袋,细根分解袋的规格为孔径0.3mm,尺寸为10cm×10cm的尼龙网袋。
在格木和红锥人工林类型中,分别随机设置了5个20m×20m的样方。2011年7月底,将每个树种装好袋的凋落叶样品选择同一天放回到初始样地的腐殖层上,每个树种装好袋的细根样品埋回初始样地的0—10cm土层中,细根分解袋于45°倾斜埋入土壤,这样有利于细根样品与土壤表面充分接触[18]。2011年7月至2013年1月间,每隔3个月从格木和红锥各自样地中随机取回20袋(5个样方×4袋/每次每个样方)凋落叶和25袋细根(5个样方×5袋/每次每个样方)分解袋,使用镊子小心地清除侵入到分解袋内的根系、土壤颗粒等,然后把处理干净的凋落叶和细根样品放入65℃烘箱中,48h后称量干质量并计算干质量残留率和分解速率[18]。随后将样品磨粉过筛,待化学分析。每种人工林下地表层(0—10cm)土壤温度在凋落物分解试验期间的每个月用便携式数字温度计测定1次,土壤含水量采用质量含水量法进行测定。
1.2.2样品分析方法
本研究中,对分解前和分解一段时间后的凋落叶和细根样品烘干磨碎,过0.2mm筛,采用重铬酸钾外加热法测定总有机碳[19];采用凯式法测定全氮[20];采用钼锑抗比色法测定全磷;采用硫酸法测定木质素;纤维素的测定采用范氏(Van Soest)洗涤纤维分析法。
1.3数据处理
采用常用的Olson[21]单指数模型计算格木和红椎凋落物分解质量损失系数:
Xt/X0=e-kt
式中,Xt表示分解时间t时刻的凋落物残体质量,X0表示初始凋落物质量,e是自然对数的底,k表示凋落物的分解系数,t是分解时间(3, 6, 9, 12, 15, 18个月)。
采用单因素方差分析(ANOVA)评估格木和红锥不同树种间凋落叶和细根的分解系数k。凋落叶和细根的分解质量损失量与凋落物化学性质关系采用Spearman相关分析法进行分析。所有数据采用SPSS18.0和Sigmaplot10.0进行处理分析,统计显著性检验设定的标准为P<0.05。
2结果与分析
2.1凋落物初始化学性质
格木、红椎凋落叶和细根初始化学性质如表2所示。方差分析结果表明,格木和红椎的凋落叶、细根初始化学性质均存在显著差异(P<0.05)。格木凋落叶和细根均具有较高的碳、氮含量及N/P比和较低的C/N比、木质素/N比,红椎凋落叶和细根均具有较高的C/N比和木质素/N比。
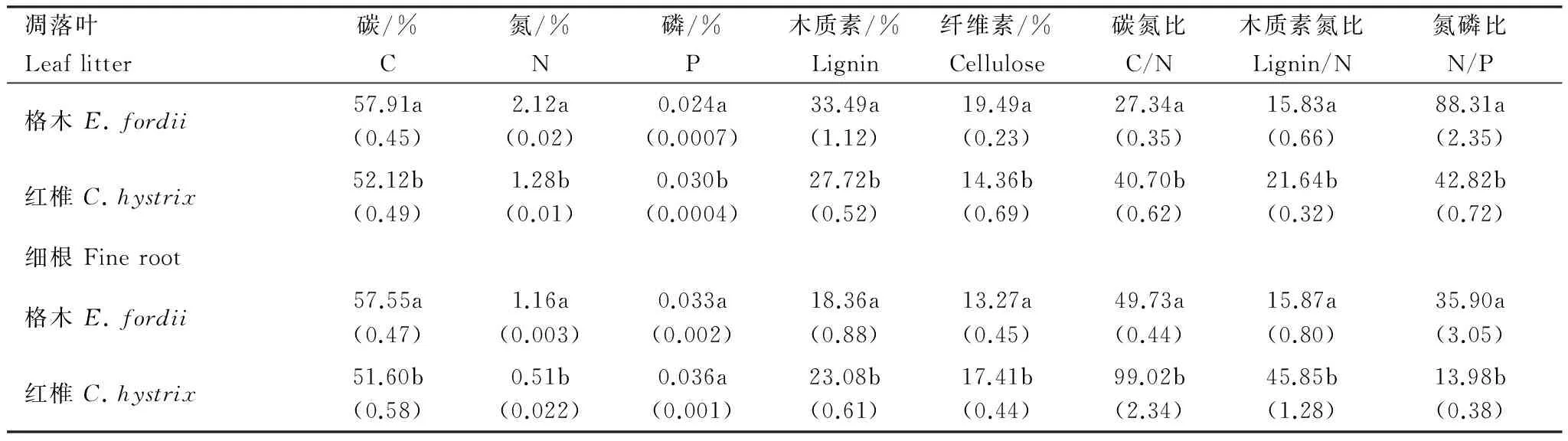
表2 格木、红椎凋落叶、细根初始化学性质
同列不同字母表示格木、红椎间差异显著(P<0.05)
2.2凋落物分解速率
格木、红椎的凋落叶、细根经过18个月的分解,其残重率分别为26.22%、28.48%和42.90%、44.70% (图1),格木、红椎的凋落叶、细根分解系数分别为0.98a-1、0.88a-1和0.65a-1、0.59a-1(图2)。
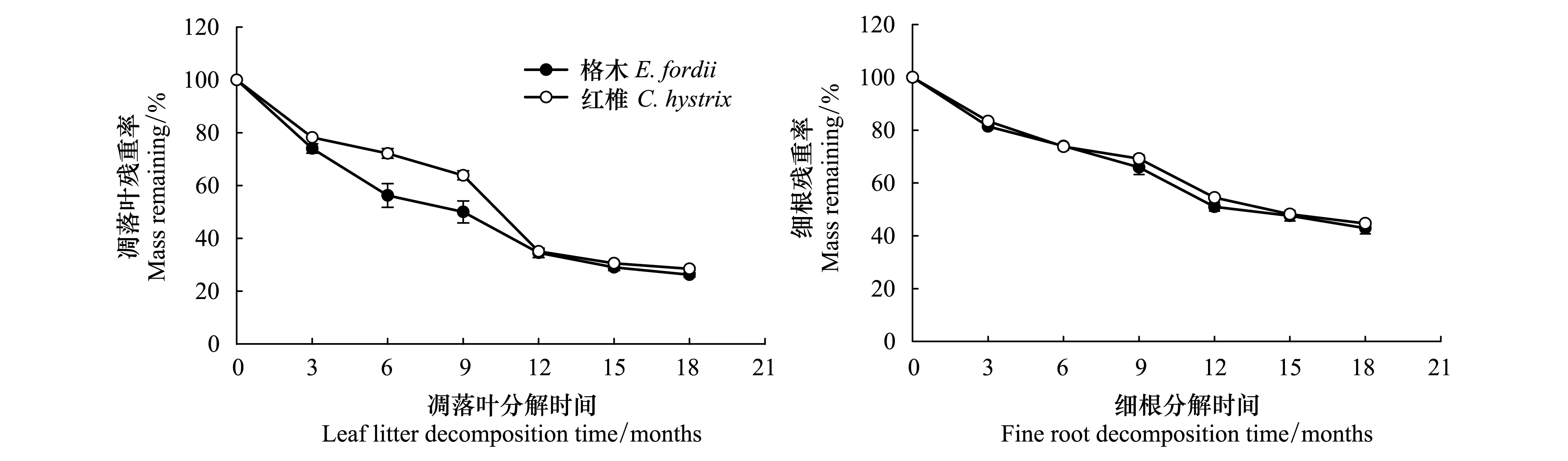
图1 格木、红椎凋落叶和细根分解过程中重量变化Fig.1 Changes of mass loss in decomposing leaf litter and fine root of E. fordii and C. hystrix
格木、红椎凋落叶的分解系数与细根的分解系数均表现为显著差异(图2),两树种凋落叶分解系数与细根分解系数具有显著的相关关系(R2=0.49,P=0.006, 图3)。
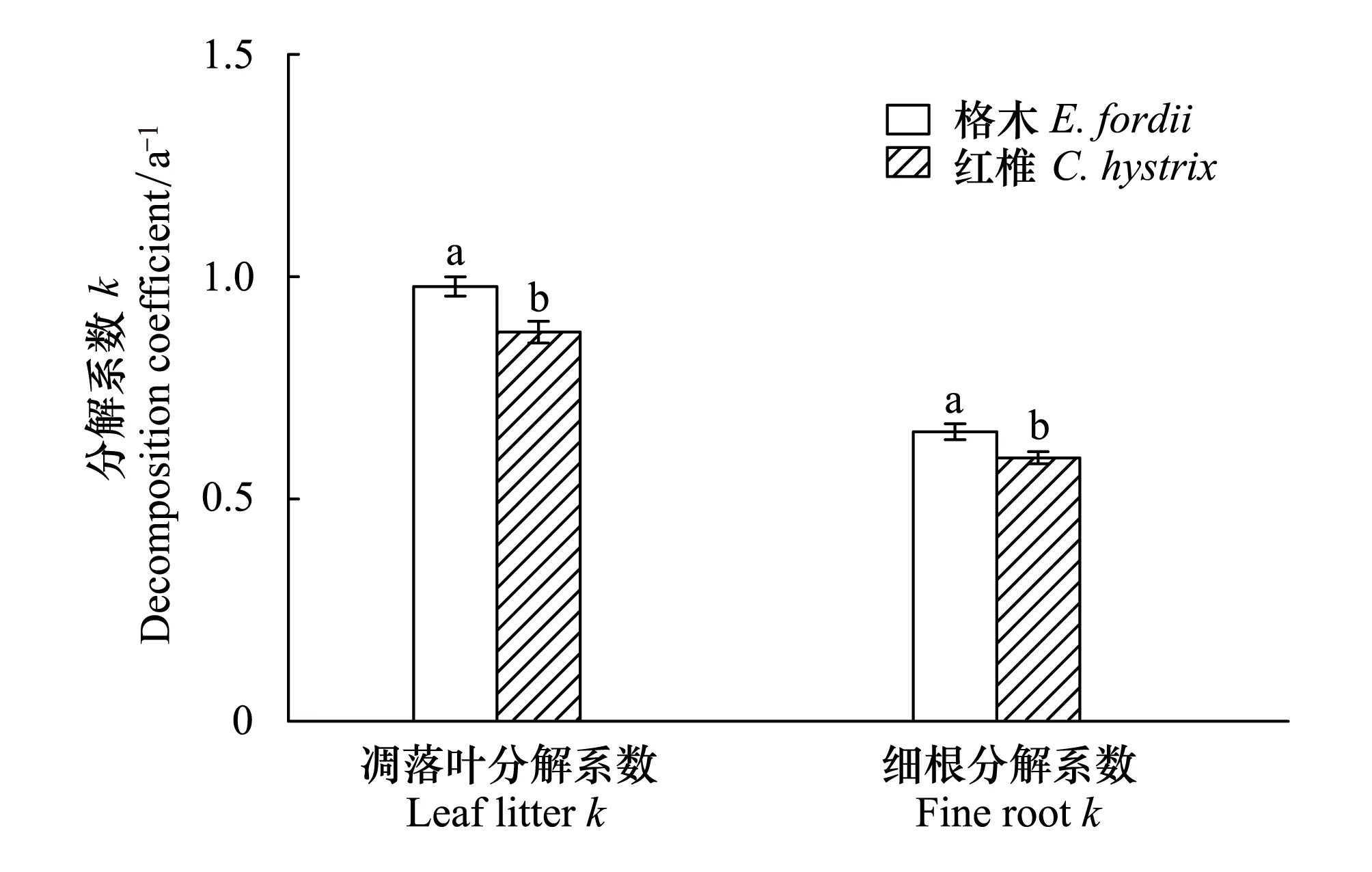
图2 格木、红椎凋落叶和细根分解系数 Fig.2 Leaf litter and fine root decomposition coefficient (k) of E. fordii and C. hystrix
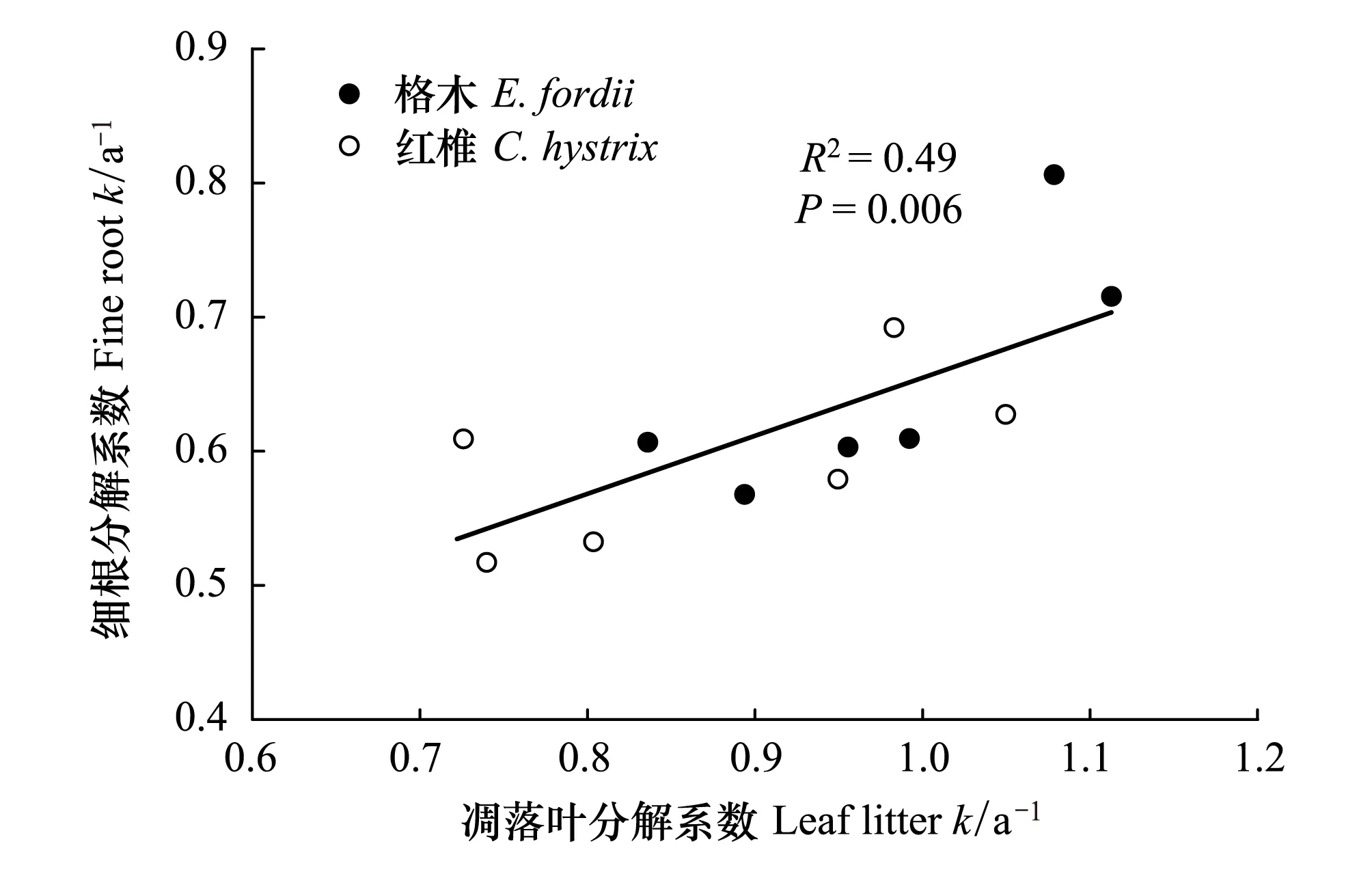
图3 格木、红椎凋落叶和细根分解速率相关关系 Fig.3 Relationship between decomposition rates of leaf litter and fine root of E. fordii and C. hystrix
2.3凋落物在分解过程中基质质量的变化
凋落物的基质质量在分解过程中呈不断变化的趋势(图4和图5)。格木、红椎凋落叶和细根样品中的碳含量在分解过程中呈逐渐下降的趋势(图4和图5)。分解18个月后,格木、红椎凋落叶和细根样品中的碳含量分别比初始碳含量下降了35.22%、25.51%和24.92%、23.86%。而格木、红椎凋落叶和细根样品中的氮含量在分解过程中则呈逐渐增加的趋势(图4和图5)。分解18个月后,格木、红椎凋落叶和细根样品中的氮含量分别比初始氮含量增加了18.49%、26.23%和24.59%、88.67%。分解过程中,格木凋落叶和细根样品中的氮含量始终要高于红椎。格木、红椎样品中的磷含量在凋落叶和细根的分解过程中变化并不一致,磷含量在凋落叶分解过程中总体上呈上升趋势(图4),而在细根分解过程中则呈先下降后上升再下降的趋势(图5)。
纤维素和木质素作为较难分解的复杂化合物,在格木、红椎凋落叶和细根分解过程中,其变化趋势也是不同的。格木、红椎的凋落叶和细根样品中的木质素的初始含量要大于纤维素初始含量(表2),在分解过程中,纤维素含量呈逐渐下降的趋势(图4和图5),分解18个月后,格木、红椎凋落叶和细根样品中的纤维素含量分别比初始纤维素含量下降了50.96%、41.08%和41.22%、38.35%。木质素含量则呈先升高后降低的趋势(图4和图5)。
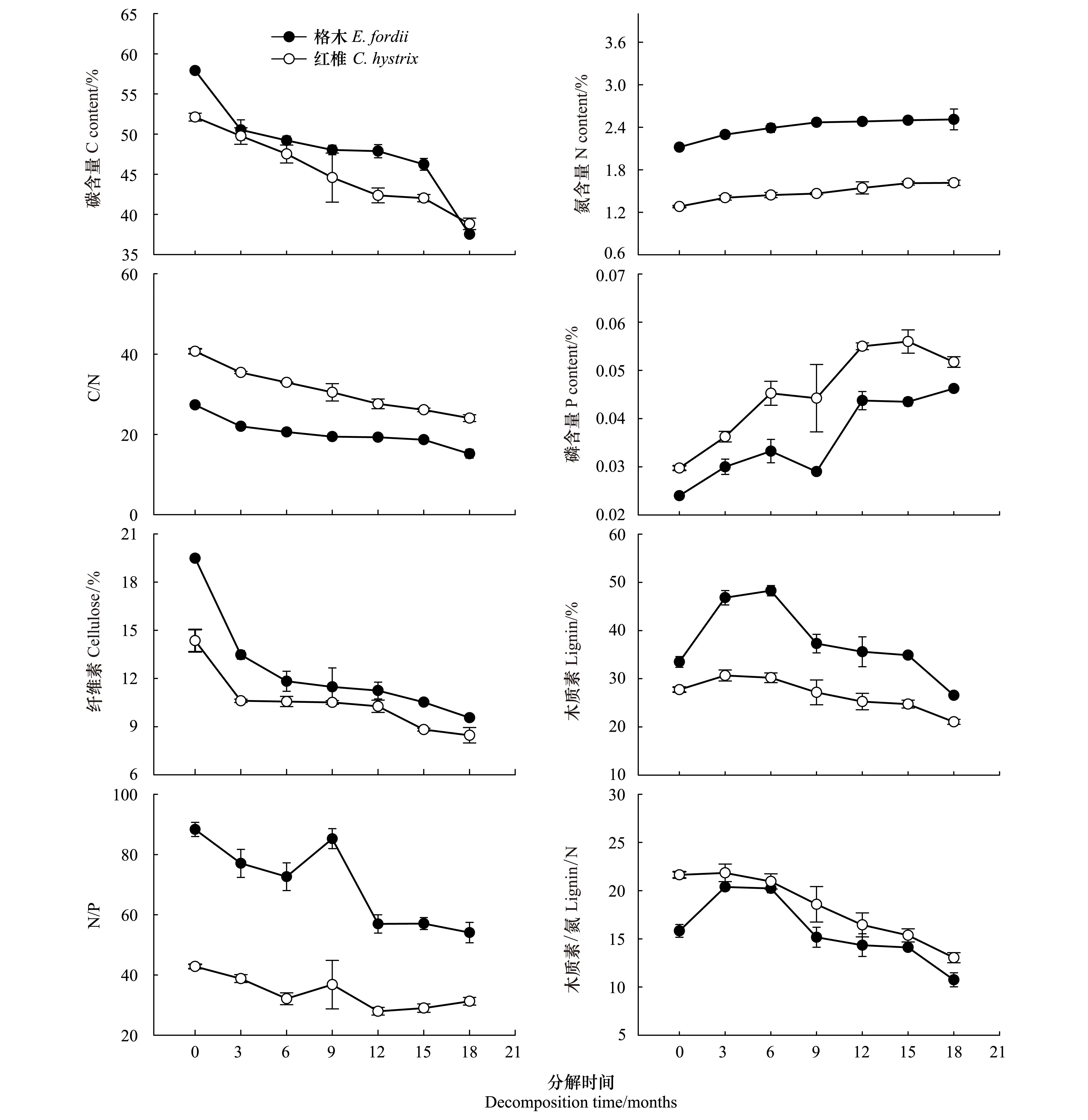
图4 格木、红椎凋落叶基质质量动态变化Fig.4 Dynamic of leaf litter substrate quality of E. fordii and C. hystrix
格木、红椎凋落叶和细根样品的C/N比、N/P比、木质素/N比变化也不同(图4和图5)。格木、红椎凋落叶和细根初始C/N比大小顺序均为格木<红椎,随着分解的进行,C/N比显著降低(图4和图5),在18个月的分解过程中,格木凋落叶和细根样品的C/N比始终明显低于红椎。分解18个月后,格木、红椎凋落叶和细根样品中的C/N比分别比初始C/N比下降了44.42%、40.88%和 39.74%、58.27%。不同树种凋落叶、细根样品中的N/P比在分解过程中的变化趋势波动较大(图4和图5)。格木、红椎凋落叶和细根木质素/N比在整个分解过程中均表现为格木<红椎,木质素/N比在分解初期逐渐升高,随后则逐渐下降(图4和图5)。
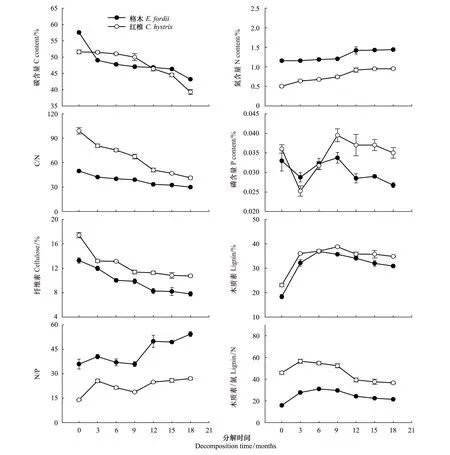
图5 格木、红椎细根基质质量动态变化Fig.5 Dynamic of fine root substrate quality of E. fordii and C. hystrix
2.4环境因子对凋落物分解的影响
环境因子与凋落物的干重损失之间的相关分析表明,格木、红椎凋落叶和细根的干重损失与土壤水分含量、土壤温度均无显著相关关系(表3)。
2.5基质质量对凋落物分解的影响
格木、红椎凋落物的基质质量不同,其分解速率也不同,而且不同的基质质量特征与分解质量损失的相关关系也不同(表4)。在整个18个月的分解过程中,凋落叶、细根样品的质量损失均与氮含量、C/N比显著相关,氮含量越高,C/N比越小,越有利于分解。而在分解后期阶段,凋落叶、细根样品的质量损失除与氮含量、C/N比显著相关外,还与木质素及木质素/N比显著相关(表4)。
表3格木、红椎凋落叶、细根干重损失量与土壤水分含量、温度的关系
Table 3Relationship between dry mass loss of leaf litter and fine root ofE.fordiiandC.hystrixand soil water content and temperature in the plantations

不同树种凋落物Thelitterofdifferentspecies土壤水分Soilwatercontent土壤温度SoiltemperatureR2PR2P格木叶TheleaflitterofE.fordii0.0310.1760.0000.771格木根ThefinerootofE.fordii0.0470.1310.0000.923红椎叶TheleaflitterofC.hystrix0.0360.1610.0000.847红椎根ThefinerootofC.hystrix0.0060.2840.0000.675
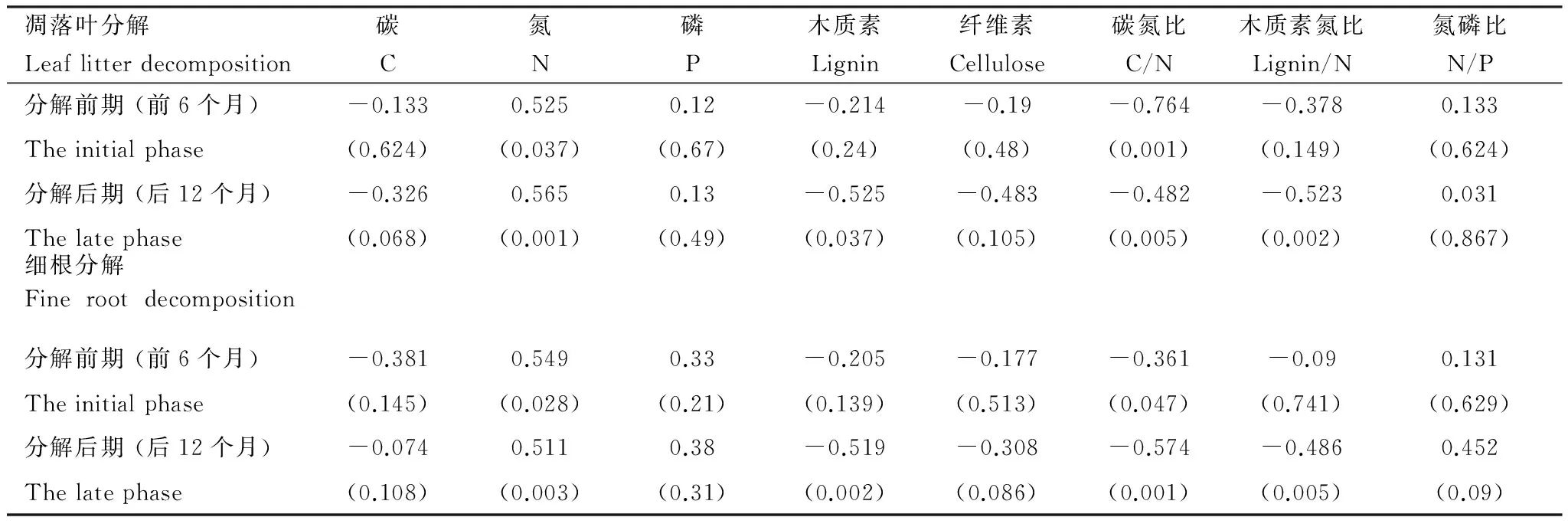
表4 格木、红椎凋落物质量损失与基质质量相关关系
表中值为Spearman′s 相关系数,括号中值为显著性水平
3讨论
3.1土壤温度、水分含量对凋落物分解的影响
土壤温湿度对凋落物分解的影响主要是通过水分的淋溶作用直接影响凋落物的分解,也可能通过影响微生物分解者从而影响凋落物的分解速率[22- 23]。但研究表明,这种影响在大尺度上或者是温湿度变化比较大的情况下才比较显著[24- 28]。例如,Cusack等[24]对热带地区不同森林类型的凋落叶和细根分解进行了长达10a的研究结果表明,热带地区不同森林类型之间由于降水格局的差异使得降水显著影响了凋落物的分解速率,其影响主要体现在降水对凋落物化学成分淋溶的物理过程的影响[29]。Berg 等[27]和Meentemeyer[28]的研究也认为,在大尺度上(跨气候带的样地间),气候因素的差异对凋落物分解速率的影响更大,而在局部区域尺度上,凋落物基质质量对凋落物分解速率的影响可能更突出[5,27,30]。Xu 和 Hirata[31]对亚热带7种常见树种凋落叶的分解研究发现,凋落叶基质质量对凋落叶分解速率的影响更突出。本研究中,格木红椎凋落叶和细根干重损失量与土壤温湿度没有显著的相关关系(表3),可能和研究区内土壤温湿度相对稳定有关。可见在本研究区域尺度上,凋落物基质质量对凋落物分解速率的影响更突出。
3.2基质质量对凋落物分解的影响
凋落物的组成及其基质质量是影响凋落物分解的最重要的功能特征[32]。本研究中格木、红椎的凋落物的初始化学性质和分解格局具有很大的不同,格木的凋落物具有较高的氮含量和较低的C/N比、木质素/N比,而红椎的凋落物具有较低的氮含量和较高的C/N比、木质素/N比(表1)。正是由于凋落物初始化学性质的不同,使得格木、红椎凋落物的分解动态显著不同(图1和图2)。已有的研究表明,在凋落物的分解过程中,凋落物的化学性质始终会影响凋落物的分解速率[31,33- 34],只是凋落物基质质量对分解的影响与分解阶段有关。研究表明,分解前期由氮含量制约凋落物分解速率,氮含量高的凋落物要比氮含量低的凋落物分解快;而分解后期则由木质素含量或木质素/N比制约分解速率,氮含量则延缓了凋落物的分解速率[35- 38]。Xu 和 Hirata[31]对亚热带7种常见树种凋落物干重损失与基质质量的相关关系的研究发现,在凋落物分解初期(前3—4个月),凋落物的干重损失与氮含量显著正相关,与木质素/N比和C/N比显著负相关;在凋落物分解后期(1/2a),凋落物的干重损失与氮含量显著正相关,与木质素含量、木质素/N比和C/N比显著负相关。本研究中,在凋落物分解初期(前6个月),凋落物的质量损失较快,且与氮含量显著正相关,与C/N比显著负相关;而凋落物分解后期(1a)其质量损失相对较缓慢,且与氮含量显著正相关,与C/N比、木质素、木质素/N比显著负相关(表4)。此外,氮含量、木质素含量及木质素/N比对凋落物分解的影响比其他基质质量对凋落物分解的影响更强烈。Tian等[39]认为凋落物的初始木质素含量及木质素/N比越高,越有利于抵抗分解者对凋落物的攻击,从而减缓了枯落物的分解。而氮素是微生物生长繁殖必不可少的重要的营养元素,植物凋落物中氮含量越高,微生物代谢活性越强,繁殖越快,分解速率也就越快。在本研究中,均是氮含量高的凋落叶和细根的分解速率要比氮含量低的凋落叶和细根的分解速率要快(图1),并且在整个分解过程中凋落叶和细根样品中氮含量均与其质量损失呈显著的正相关关系(表4)。此外,本研究中格木凋落叶的木质素含量高于红椎凋落叶,但格木凋落叶的分解速率仍然高于红椎,这可能主要是由于格木凋落叶中含有较高的氮含量及较低的C/N 比、木质素/N比。
在本研究中格木、红椎凋落叶和细根分解速率之间存在显著的正相关关系(图3),和Hobbie等[10]对不同树种凋落物在同一林分下的分解研究结果不同,表明在原位和移位条件下进行分解实验,其凋落叶和细根分解速率之间的相关关系是存在差异的。本研究中的凋落叶和细根分解速率之间存在显著的正相关关系且凋落叶的分解速率都高于细根的分解速率,这一结果与Wang等[40]及Vivanco和Austin[11]的研究结果一致。该结果主要是因为凋落物基质质量氮含量、C/N比、木质素/N比对凋落叶和细根分解速率具有相似的影响,而且两个树种格木、红椎凋落叶的氮含量高于细根氮含量,而C/N比、木质素/N比却低于细根C/N比、木质素/N比(图4和图5)。
综上所述,在我国南亚热带地区,格木和红椎树种对凋落叶和细根的原位分解速率的影响相似,从而引起格木和红椎树种对地上和地下凋落物原位分解速率产生一致的影响。因此,凋落叶的较快分解对应着细根的较快分解。格木和红椎凋落叶和细根分解速率之间明显的正相关关系主要是由于凋落物基质质量氮含量、C/N比、木质素/N比对凋落叶和细根分解速率具有相似的影响。本研究结果可为南亚热带地区树种对凋落物原位分解产生影响的某些生态过程提供解释的依据。
参考文献(References):
[1]Berg B, McClaugherty C. Plant Litter: Decomposition, Humus Formation, Carbon Sequestration. Berlin Heidelberg: Springer-Verlag, 2003.
[2]Silver W L, Miya R K. Global patterns in root decomposition: comparisons of climate and litter quality effects. Oecologia, 2001, 129(3): 407- 419.
[3]Sullivan N H, Bowden W B, McDowell W H. Short-term disappearance of foliar litter in three species before and after a hurricane. Biotropica, 1999, 31(3): 382- 393.
[4]Austin A T, Vitousek P M. Precipitation, decomposition and litter decomposability ofMetrosiderospolymorphain native forests on Hawai′i. Journal of Ecology, 2000, 88(1): 129- 138.
[5]Aerts R. Climate, leaf litter chemistry and leaf litter decomposition in terrestrial ecosystems: a triangular relationship. Oikos, 1997, 79(3): 439- 449.
[6]Wright I J, Reich P B, Westoby M, Ackerly D D, Baruch Z, Bongers F, Cavender-Bares J, Chapin T, Cornelissen J H C, Diemer M, Flexas J, Garnier E, Groom P K, Gulias J, Hikosaka K, Lamont B B, Lee T, Lee W, Lusk C, Midgley J J, Navas M L, Niinemets Ü, Oleksyn J, Osada N, Poorter H, Poot P, Prior L, Pyankov V, Roumet C, Thomas S C, Tjoelker M G, Veneklaas E J, Villar R. The worldwide leaf economics spectrum. Nature, 2004, 428(6985): 821- 827.
[7]McGroddy M E, Daufresne T, Hedin L O. Scaling of C:N:P stoichiometry in forests worldwide: implications of terrestrial Redfield-type ratios. Ecology, 2004, 85(9): 2390- 2401.
[8]Güsewell S. N:P ratios in terrestrial plants: variation and functional significance. New Phytologist, 2004, 164(2): 243- 266.
[9]Reich P B, Oleksyn J. Global patterns of plant leaf N and P in relation to temperature and latitude. Proceedings of the National Academy of Sciences of the United States of America, 2004, 101(30): 11001- 11006.
[10]Hobbie S E, Oleksyn J, Eissenstat D M, Reich P B. Fine root decomposition rates do not mirror those of leaf litter among temperate tree species. Oecologia, 2010, 162(2): 505- 513.
[11]Vivanco L, Austin A T. Intrinsic effects of species on leaf litter and root decomposition: a comparison of temperate grasses from North and South America. Oecologia, 2006, 150(1): 97- 107.
[12]Bloomfield J, Vogt K, Wargo P M. Tree root turnover and senescence//Waisel Y, Eshel A, Kafkafi U, eds. Plant Roots: the Hidden Half. 2nd ed. New York: Marcel Dekker, 1996: 363- 381.
[13]Gill R A, Jackson R B. Global patterns of root turnover for terrestrial ecosystems. New Phytologist, 2000, 147(1): 13- 31.
[14]Guo D L, Mitchell R J, Withington J M, Fan P P, Hendricks J J. Endogenous and exogenous controls of root life span, mortality and nitrogen flux in a longleaf pine forest: root branch order predominates. Journal of Ecology, 2008, 96(4): 737- 745.
[15]Nadelhoffer K J, Raich J W. Fine root production estimates and belowground carbon allocation in forest ecosystems. Ecology, 1992, 73(4): 1139- 1147.
[16]Chen H, Harmon M E, Sexton J, Fasth B. Fine-root decomposition and N dynamics in coniferous forests of the Pacific Northwest, U.S.A. Canadian Journal of Forest Research, 2002, 32(2): 320- 331.
[17]Mo J M, Brown S, Xue J H, Fang Y T, Li Z A. Response of litter decomposition to simulated N deposition in disturbed, rehabilitated and mature forests in subtropical China. Plant and Soil, 2006, 282(1/2): 135- 151.
[18]Ostertag R, Marín-Spiotta E, Silver W L, Schulten J. Litterfall and decomposition in relation to soil carbon pools along a secondary forest chronosequence in Puerto Rico. Ecosystems, 2008, 11(5): 701- 714.
[19]Nelson D W, Sommers L E. Total carbon, organic carbon, and organic matter//Sparks D L, Page A L, Helmke P A, et al eds. Methods of Soil Analysis. Part 3-Chemical Methods. Madison, Wisconsin: SSSA and ASA, 1996: 961- 1010.
[20]Bremner J M. Nitrogen-total//Sparks D L, Page A L, Helmke P A, et al eds. Methods of Soil Analysis. Part 3. Chemical Methods. Madison, Wisconsin: SSSA and ASA, 1996: 1085- 1122.
[21]Olson J S. Energy storage and the balance of producers and decomposers in ecological systems. Ecology, 1963, 44(2): 322- 331.
[22]Singh K P, Singh P K, Tripathi S K. Litterfall, litter decomposition and nutrient release patterns in four native tree species raised on coal mine spoil at Singrauli, India. Biology and Fertility of Soils, 1999, 29(4): 371- 378.
[23]郭剑芬, 杨玉盛, 陈光水, 林鹏, 谢锦升. 森林凋落物分解研究进展. 林业科学, 2006, 42(4): 93- 100.
[24]Cusack D F, Chou W W, Yang W H, Harmon M E, Silver W L, Team T L. Controls on long-term root and leaf litter decomposition in neotropical forests. Global Change Biology, 2009, 15(5): 1339- 1355.
[25]Wieder W R, Cleveland C C, Townsend A R. Controls over leaf litter decomposition in wet tropical forests. Ecology, 2009, 90(12): 3333- 3341.
[26]Fioretto A, Musacchio A, Andolfi G, De Santo A V. Decomposition dynamics of litters of various pine species in a Corsican pine forest. Soil Biology and Biochemistry, 1998, 30(6): 721- 727.
[27]Berg B, Berg M P, Bottner P, Box E, Breymeyer A, de Anta R C, Couteaux M, Escudero A, Gallardo A, Kratz W, Madeira M, Mälkönen E, McClaugherty C, Meentemeyer V, Muoz F, Piussi P, Remacle J, Vi de Santo A. Litter mass loss rates in pine forests of Europe and Eastern United States: some relationships with climate and litter quality. Biogeochemistry, 1993, 20(3): 127- 159.
[28]Meentemeyer V. Macroclimate the lignin control of litter decomposition rates. Ecology, 1978, 59(3): 465- 472.
[29]Cleveland C C, Neff J C, Townsend A R, Hood E. Composition, dynamics, and fate of leached dissolved organic matter in terrestrial ecosystems: results from a decomposition experiment. Ecosystems, 2004, 7(3): 275- 285.
[30]Berg B, Staaf H. Leaching, accumulation and release of nitrogen in decomposing forest litter. Ecology Bulletin, 1981, 33: 163- 178.
[31]Xu X N, Hirata E. Decomposition patterns of leaf litter of seven common canopy species in a subtropical forest: N and P dynamics. Plant and Soil, 2005, 273(1/2): 279- 289.
[32]Meier C L, Bowman W D. Links between plant litter chemistry, species diversity, and below-ground ecosystem function. Proceedings of the National Academy of Sciences of the United States of America, 2008, 105(50): 19780- 19785.
[33]Cornelissen J H C, Thompson K. Functional leaf attributes predict litter decomposition rate in herbaceous plants. New Phytologist, 1997, 135(1): 109- 114.
[34]Sariyildiz T, Anderson J M. Interactions between litter quality, decomposition and soil fertility: a laboratory study. Soil Biology and Biochemistry, 2003, 35(3): 391- 399.
[35]Taylor B R, Parkinson D, Parsons W F J. Nitrogen and lignin content as predictors of litter decay rates: a microcosm test. Ecology, 1989, 70(1): 97- 104.
[36]Cotrufo M F, Ineson P. Effects of enhanced atmospheric CO2and nutrient supply on the quality and subsequent decomposition of fine roots ofBetulapendulaRoth. andPiceasitchensis(Bong.) Carr. Plant and Soil, 1995, 170(2): 267- 277.
[37]Taylor B R, Prescott C E, Parsons W J F, Parkinson D. Substrate control of litter decomposition in four Rocky Mountain coniferous forests. Canadian Journal of Botany, 1991, 69(10): 2242- 2250.
[38]Berg B, Matzner E. Effect of N deposition on decomposition of plant litter and soil organic matter in forest systems. Environmental Reviews, 1997, 5(1): 1- 25.
[39]Tian G, Kang B T, Brusaard L. Biological effects of plant residues with contrasting chemical compositions under humid tropical conditions-decomposition and nutrient release. Soil Biology and Biochemistry, 1992, 24(10): 1051- 1060.
[40]Wang H, Liu S R, Mo J M. Correlation between leaf litter and fine root decomposition among subtropical tree species. Plant and soil, 2010, 335(1/2): 289- 298.
基金项目:国家“十二五”科技支撑计划课题(2012BAD22B0102); 中国科学院碳专项课题(XDA05060100)
收稿日期:2014- 07- 16;
修订日期:2016- 03- 09
*通讯作者
Corresponding author.E-mail: shizm@caf.ac.cn
DOI:10.5846/stxb201407161450
Decomposition characteristics of leaf litter and fine roots ofErythrophleumfordiiandCastanopsishystrixin subtropical China
WANG Weixia1,2, SHI Zuomin1,*, LUO Da1, LIU Shirong1
1KeyLaboratoryonForestEcologyandEnvironmentalSciencesofStateForestryAdministration,InstituteofForestEcology,EnvironmentandProtection,ChineseAcademyofForestry,Beijing100091,China2CollageofForestryandHorticulture,XinjiangAgriculturalUniversity,Urumqi830052,China
Abstract:We determined the in situ decomposition of leaf litter and fine roots of Erythrophleum fordii and Castanopsis hystrix in subtropical China using the nylon mesh-bag method. The results indicated that the decomposition coefficients for leaf litter and fine roots of E. fordii and C. hystrix were 0.98 a-1and 0.88 a-1and 0.65 a-1and 0.59 a-1, respectively. Decomposition rates for leaf litter and fine roots were primarily influenced by the chemical properties of the litter, rather than by the environmental factors in the plantations. During the initial phase, the percentage of dry mass loss was positively correlated with N content (R2=0.525 and 0.549, respectively) and negatively correlated with the C/N ratio (R2=0.764 and 0.361, respectively) for leaf litter and fine roots. During the late phase of decomposition, decomposition rates were positively correlated with N content (R2=0.565 and 0.511, respectively) and negatively correlated with lignin content (R2=0.525 and 0.519, respectively), C/N (R2=0.482 and 0.574, respectively), and lignin/N ratios (R2=0.523 and 0.486, respectively) for leaf litter and fine roots. The significant correlation between leaf litter and fine root decomposition rates could be attributed to the similar effects of chemical properties on decomposition rates.
Key Words:leaf litter; fine roots; decomposition rate; chemical properties; subtropical
王卫霞, 史作民, 罗达, 刘世荣.南亚热带格木和红椎凋落叶及细根分解特征.生态学报,2016,36(12):3479- 3487.
Wang W X, Shi Z M, Luo D, Liu S R.Decomposition characteristics of leaf litter and fine roots ofErythrophleumfordiiandCastanopsishystrixin subtropical China.Acta Ecologica Sinica,2016,36(12):3479- 3487.
