毛竹林细根生长对施肥的响应研究
2014-12-06朱强根金爱武
朱强根 金爱武 周 婧
( 1 丽水学院 浙江丽水 323000 2 浙江农林大学林业与生物技术学院 浙江临安 311300)
细根是植物吸收水分和养分的重要器官,并与土壤紧密接触,因此施肥管理常常是影响细根生长及动态变化的一个重要方面[1]。在非克隆植物研究上,细根常常在贫瘠的土壤上具有更大的生物量用以吸收水分和养分,而在养分富足的土壤中则减少细根生长量,表现为一种“趋贫特化”[2-3];克隆植物由于存在生理整合作用,各相连分株在异质资源的斑块上表现的是一种“趋富特化”,施肥可能促进根系的生长而实现克隆分工作用[4-5]。毛竹是人工经营的重要竹种,而施肥是毛竹经营的一项重要管理措施,研究施肥对细根生长的影响对于了解毛竹生物学特性和指导生产实践均有着重要的现实意义。
1 材料和方法
1.1 研究区概况
试验地设在浙江省遂昌县,位于东经118°41′ – 119°30′,北纬28°13′ – 18°49′,属亚热带季风气候区,温暖湿润,四季分明,雨量充沛。多年平均气温16.8 ℃,极端最高气温40.1℃,极端最低气温零下9.9 ℃;无霜期251 d,降水量1 510 mm;土壤pH值为4.90 ~5.50。
1.2 试验设计与方法
在遂昌县选取经营管理一致、林地环境条件相同的9块样地,每块样地设置面积不小于400 m2的样方。试验设3种施肥处理和2种取样处理,每个处理设置3个样方作为重复。
3种不同的施肥处理方式为:1 m沟施(TR1)、2 m 沟施(TR2)和3 m 沟施(TR3)。施肥时间为2013年5月19日,使用螯合型笋竹专用肥(氮∶磷∶钾=17∶8∶5),用量为1 500 kg/hm2。根据单位面积的施肥用量计算,1 m 沟施、2 m 沟施和3 m 沟施处理下,施肥沟上的肥料使用量分别为0.14 kg/m、0.26 kg/m 和0.36 kg/m。
细根取样分沟上取样和沟外取样2种处理。取样于2013年8月21日进行,采用直径46 cm土钻分别在沟上和沟外2种位置上取样,即在施肥沟和距离施肥沟50 cm 处钻取土芯,深度为25 cm,每个样方采用对角线法分别在沟上和沟外各钻取土芯9个,共钻取162个土芯。土芯带回实验室浸泡24 h,采用2 mm、1 mm和0.25 mm 套筛法把细根清洗干净,根据细根外形、颜色、弹性等拣去死根。将活根采用根系分析仪测定不同直径的细根根长、根尖数、根表面积和根体积;测定完毕后,再对细根样品进行人工直径分级,分0~1 mm(径级I)、1~2 mm(径级II)和2~5 mm(径级III)等3个径级[6],分拣完成后置于烘箱内60 ℃下烘干至恒重,称取细根质量。
1.3 数据处理
采用SPSS14.0软件对3种施肥方式、2种取样位置和3种径级的细根生物量、根长、根尖数、根表面积和根体积等生长参数进行多因素方差分析,检验各因素处理间的差异显著性及其因素间的交互作用;另外,就各生长参数在不同施肥方式或不同取样位置上进行单因素方差分析,所有方差分析结果均进行Duncan多重比较。
2 结果与分析
2.1 毛竹林细根生长对不同施肥方式和取样位置的响应
对3种施肥方式、2种取样位置和3种径级细根的生长参数进行多因素方差分析,结果见表1。可以看出,3种施肥方式间,各生长参数均存在极显著差异(p < 0.001);2种取样位置间,根长和根尖数达到了显著差异(p < 0.05),根表面积达到极显著差异(p< 0.001);3种细根径级间,除根体积外,细根生物量、根长、根尖数和根表面积均存在极显著差异(p< 0.001)。

表1 施肥方式、取样位置和不同径级下细根生长量的方差分析
毛竹林细根生长量不仅在不同施肥方式或取样位置上存在显著的差异,而且2者对细根的生长存在显著的交互作用影响。根长、根尖数和根表面积均达到了显著水平(p < 0.05),表明不同施肥方式处理下,根长、根尖数和根表面积在取样位置上的差异表现不完全一致。施肥方式和取样位置还影响了细根的径级分布,除根体积外,根生物量、根长、根尖数和根表面积均存在显著差异(p < 0.05)。另外,在施肥方式、取样位置与细根径级间的二级交互作用下,根长和根尖数存在显著差异(p < 0.05),表现了根长和根尖数受多种因素的综合影响。
2.2 毛竹林细根生物量
毛竹林细根生物量在TR1、TR2和TR3处理下,沟上细根生物量分别为5.16 t/hm2、5.35 t/hm2和10.54 t/hm2,沟外细根生物量分别为5.58 t/hm2、5.95 t/hm2和8.67 t/hm2,均表现为TR3>TR2>TR1(图1)。细根生物量的这种变化与施肥沟上的肥料用量一致,即随着沟上施肥用量增加,细根生物量也相应得到了增长,其中,施肥用量为0.36 kg/m 的3 m 沟施处理下,细根生物量显著高于1 m 沟施(施肥量0.14 kg/m)和2 m沟施(施肥量0.26 kg/m)(p < 0.001)。从取样位置来看,毛竹林细根总生物量在3 m沟施处理下,沟上较沟外细根生物量增长了21.55%,但未达到显著水平(p > 0.05),可能是施肥沟和距离施肥沟50 cm 处的养分在土壤中的移动在一定程度上降低了沟上和沟外细根生长的差异。

图1 不同施肥方式和取样位置细根生物量
2.3 毛竹林细根长度、根尖数、根表面积和根体积
在TR1、TR2和TR3处理下,毛竹林细根长度沟上分别为0.36 m/cm2、0.28 m/cm2和0.64 m/cm2,沟外分别为0.32 m/cm2、0.28 m/cm2和0.46 m/cm2(图2A);毛竹林细根根尖数沟上分别为101.22个/cm2、74.16个/cm2和179.13个/cm2,沟外分别为87.50个/cm2、73.92个/cm2和125.36个/cm2(图2B);毛竹林细根表面积沟上分别为7.07 cm2/cm2、6.21 cm2/cm2和13.15 cm2/cm2,沟外分别为5.76 cm2/cm2、5.56 cm2/cm2和8.49 cm2/cm2(图2C)。不管沟上还是沟外,不同施肥方式下,毛竹林根长、根尖数和根表面积均一致表现为TR3处理显著大于TR1和TR2处理,即以0.36 kg/m的施肥量显著促进了细根的生长。从取样位置来看,与细根总生物量不同,细根根长、根尖数和根表面积在3 m沟施处理下均达到了显著差异(p<0.05),其中,根表面积达到极显著差异(p<0.001),可见细根根长、根尖数和根表面积能较好的反映施肥对细根生长的影响。毛竹林细根体积在3种不同施肥方式下,TR3处理下的沟上细根体积显著高于TR1和TR2处理(p < 0.05),但沟外细根体积在施肥方式上的差异不显著,细根体积在2种不同的取样位置上也没有显著差异(图2D)。
2.4 毛竹林细根生长量的径级分布
毛竹林细根生物量、根长、根尖数和根表面积均存在不同径级间的显著差异(表2),从细根生物量来看,径级I、径级II和径级III分别为3.56 t/hm2、1.23 t/hm2和2.08 t/hm2,表现为径级I >径级III >径级II,其中径级I细根生物所占比例约为一半(51.85%)。径级I的细根长和根尖数在分别为0.34 m/cm2和105.29个/cm2,占总量比例分别为86.52%和98.51%,可见根长和根尖数的生长量主要集中分布0~1 mm 直径的细根上。从根表面积来看,径级I、径级II和径级III分别为4.95 cm2/cm2、1.86 cm2/cm2和0.90 cm2/cm2,表现为径级I >径级II >径级III,其中径级II和径级III两者之和所占比例为35.75%,在养分的吸收上仍表现出具有重要的作用。细根体积在不同径级的分布上差异不显著,3种径级的细根体积几乎各占1/3。

图2 不同施肥方式和取样位置下细根的根长(A)、根尖数(B)、根表面积(C)和根体积(D)
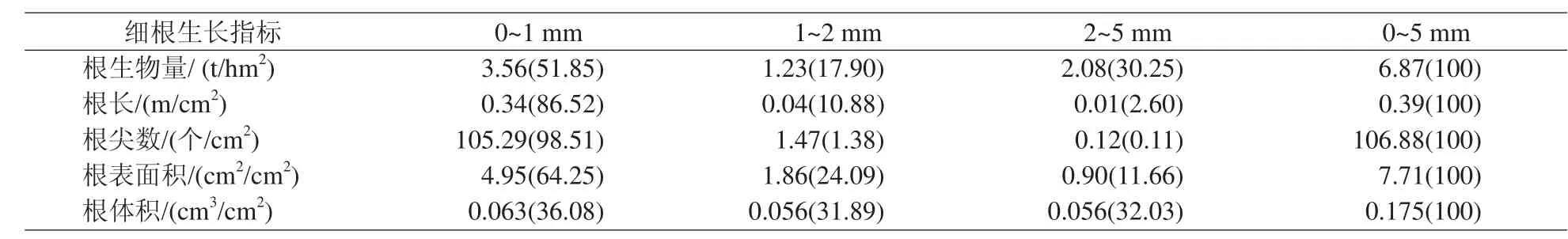
表2 毛竹林细根生长量的径级分布
3 小结
细根是植物从土壤吸收养分的主要器官。调查表明,毛竹林细根平均生物量为6.87 t/hm2,与其他纯林树种相比(如杉木[7]、杨树[6]和楠木[8]等),毛竹具有较大的细根生物量,表现了很强的土壤水分和养分吸收能力。毛竹林细根生长在不同的施肥方式下呈现显著差异,细根生物量表现为3 m 沟施 > 2 m 沟施 > 1 m 沟施,与之施肥用量的多少相对应,表明随着施肥量的增加,毛竹通过在施肥点上增加细根生物量以提高对肥料的吸收利用;细根根长、根尖数、根表面积和根体积作为衡量细根活力和吸收能力的主要参数,在不同施肥方式下的差异也表现出相同的变化趋势。从取样位置来看,不同细根生长参数总体表现为沟上大于沟外,特别在沟上施肥量达到0.36 kg/m 的3 m 沟施处理下,沟上细根根长、根尖数和根表面积均显著高于沟外,在施肥点上毛竹通过增加细根生长量或细根活力来对养分的充分吸收利用,这种在施肥沟上(或更大的施肥量下)细根生长量增加体现了毛竹细根生长的“趋富特化”现象。另外,毛竹林细根生长在径级上的分布主要集中在0~1 mm,特别是根长和根尖数占有比例均超过85%,表明0~1 mm 直径细根是毛竹林土壤水分和养分的主要根系吸收器官。
[1] Yavitt J B, Harms K E, Garcia M N, et al. [J]. Soil fertility and fine root dynamics in response to 4 years of nutrient (N, P, K) fertilization in a lowland tropical moist forest, Panama[J]. Austral Ecology,2011, 36(4): 433–445.
[2] Powers J S, Treseder K K, Lerdau M T. Fine roots,arbuscular mycorrhizal hyphae and soil nutrients in four neotropical rain forests: patterns across large geographic distances[J]. New Phytology, 2005,165(3): 913–21.
[3] Espeleta J F, Clark D A. Multi-scale variation in fi neroot biomass in a tropical rainforest: a seven-year study[J]. Ecology Monographs, 2007, 77(3): 377–404.
[4] Stuefer J F, During H J, de Kroon H. High benefi ts of clonal integration in two stoloniferous species, in response to heterogeneous light environments[J].Journal of Ecology, 1994, 82:511–518.
[5] Wijesinghe D K, Hutchings M J. The effects of spatial scale of environmental heterogeneity on the growth of a clonal plant: an experimental study with Glechoma hederaceae[J]. Journal of Ecology, 1997,85: 17–28.
[6] 王良桂,朱强根,张焕朝,等.苏北杨树人工林细根生产力与周转[J].南京林业大学学报:自然科学版,2008,32(5):76–80.
[7] 吕理兴.杉木人工林及林下植被细根生物量和形态分布特征[J].亚热带资源与环境学报,2012,7(2):70–75.
[8] 郑金兴,陈光水,高人,等.楠木人工林细根生物量季节动态及周转[J].三明学院学报,2012,29(6):89–94.
