不同管理模式对温室土壤螨群落结构的影响
2016-08-09李钰飞郑春燕李吉进孙钦平邹国元刘本生许俊香高利娟刘东生
李钰飞, 郑春燕, 李吉进, 孙钦平, 邹国元, 刘本生, 许俊香, 高利娟, 刘东生, 李 季,*
1 北京市农林科学院植物营养与资源研究所,北京 100097 2 中国农业大学资源与环境学院,北京 100193
不同管理模式对温室土壤螨群落结构的影响
李钰飞1,2, 郑春燕2, 李吉进1, 孙钦平1, 邹国元1, 刘本生1, 许俊香1, 高利娟1, 刘东生1, 李季2,*
1 北京市农林科学院植物营养与资源研究所,北京100097 2 中国农业大学资源与环境学院,北京100193
摘要:为了解日光温室内不同农业管理模式对土壤螨群落的影响,以日光温室长期定位试验为研究对象,于2012年8月至2012年12月进行了5次取样,调查了有机(ORG)、无公害(LOW)和常规(CON)管理模式下土壤螨的丰度与群落结构。结果显示:管理模式对螨的丰度、各亚目的比例、菌食性隐气门螨和捕食性螨比例均无显著影响,仅对菌食性非隐气门螨和食线虫螨有显著影响。土壤螨的总数及各营养类群的数量呈现不同程度的时间波动,且波动程度在不同的管理模式下存在差异。粉螨是温室土壤中最为丰富的类群(平均 37.8%)。尽管螨的类群数目呈现ORG(26)>LOW(21)>CON(18)的趋势,但香农指数和优势度指数没有显著变化。总之,在高投入、高扰动日光温室环境中,管理模式对土壤螨的数量和群落结构影响均较小。
关键词:土壤螨;温室;有机模式;无公害模式;群落结构;多样性
土壤生物是地下生态系统的重要组成部分,它们既是土壤生态过程的执行者,也是指示土壤质量变化的有力工具[1]。近年来,通过土壤生物的群落特征反映土壤质量已成为土壤生态学的主要研究方向[2- 4]。土壤螨类通过加速物质循环和能量流动维持着地下生态系统的过程[5- 7]。此外,螨占据碎屑食物网的多个营养级,如具有腐食性和菌食性的甲螨(Oribatida),一般被归为K对策者,常出现在扰动强烈或初级演替生境中[8];而位于食物链顶端的中气门亚目(Mesostigmata)是重要的捕食者[9]。二者也被认为是反映人为影响下土壤状况变化的重要指示生物[9- 11]。
在农业生态系统中,土壤螨的分布组成及数量与土地管理、耕作、化肥和农药施用等农业活动密切相关[12- 15]。有机农业和无公害农业通过施入有机肥及避免或减少化学品投入,降低对土壤环境的破坏,从而使农业生态系统具有可持续性。大量研究表明这两种农业管理模式相比常规农业改善了土壤结构,提高了土壤养分[16- 18],有利于病害防控[19];同时管理模式也对各类土壤生物产生了不同程度的影响[20- 22]。有报道表明,集约化农业措施会导致甲螨物种多样性降低[23]。施用有机肥有利于增加捕食性螨的数量,施用化肥的农田则有更多的执行r对策的菌食性螨[24]。然而,大多研究是在室外农田开展的,对日光温室土壤生物的调查则鲜有报道。
温室是中国北方重要的农业土地利用类型。相比露天环境,温室具有一定的特殊性,其常处于半封闭状态,具有高温、高湿、高投入等特点[19]。对温室土壤生物的研究有利于了解由这种特殊环境引起的地下生态系统和生态过程的变化。已有研究表明温室土壤食物网结构相对简单,生态系统稳定性较低[25]。对于土壤螨类,有机和无公害作为两种环境友好型农业模式,是否有利于螨多样性的提高?是否有利于高营养级螨类群的存活?为此以中国农业大学曲周日光温室长期定位试验为研究对象,对比有机、无公害和常规管理模式下土壤螨的群落结构,以期为丰富温室条件下的土壤生物学指标做出贡献,同时也为下一步构建土壤食物网打下基础。
1材料与方法
1.1试验地点与设计
试验地点位于河北省邯郸市曲周县中国农业大学曲周实验站内(36°52′N, 115°01′E)。试验站地处曲周县北部,属于温带半湿润季风气候区,冬春寒冷干燥,夏季温暖多雨,明显地表现出干湿季节的更替。年均温度13.2℃,年均降雨量542.7 mm,60%发生在7—9月。年蒸发量1841 mm,年均无霜期201d。试验区土壤为改良后的盐化潮土。
本研究依托于有机蔬菜生产长期定位试验,该试验启动于2002年6月,所采用的日光温室为拱圆式,长52 m,宽7 m,占地面积0.04 hm2,棚内年均温度18.7℃。温室内多种蔬菜轮作(每年两至三茬),包括西红柿、黄瓜、芹菜、菜花和茄子,并以西红柿和黄瓜为主。本研究开始前的最后一茬蔬菜为西红柿,试验进行期间棚内蔬菜为黄瓜。
试验设置3个温室系统。1)有机模式(ORG):只施用有机肥,不使用任何化肥和农药;病虫害防控主要采取物理控制,并结合硫磺熏蒸和高温闷棚等措施。2)无公害模式(LOW):以施用有机肥为主和少量施用化肥;病虫害防治以生物防治为主,在严重时使用化学农药(杀菌剂和杀虫剂);该模式下化学品(包括化肥和农药)的投入量为常规模式的一半。3)常规模式(CON):根据当地农户传统的温室管理模式,施用化肥为主,少量施用有机肥;采用化学防治防控病虫害,使用的化学农药包括多种杀菌剂和杀虫剂。取样期间样地施肥措施描述如下:定植前(2012年8月22日),有机温室施用60 t/hm2有机肥;无公害温室施用30 t/hm2有机肥和1.5 t/hm2化肥;常规温室施入16.3 t/hm2有机肥和3 t/hm2化肥。在种植中期(10月10日)和末期(11月2日),每个种植系统均进行追肥。有机温室施入2 t/hm2有机肥,无公害和常规温室分别施入250 kg/hm2和500 kg/hm2化肥。有机肥由牛粪、鸡粪、秸秆、棉仁饼和红糖堆制而成,养分包含1.21% N、0.60% P2O5和1.58% K2O(干基)。化肥由尿素、硫酸钾和磷酸钙组成,混合比例为3∶4∶5。
1.2取样方法
每个温室设置3个取样样方(9 m×7 m)作为3个重复,样方之间相隔4 m。根据一茬黄瓜的生长期,分5次进行取样,分别为8月(种植前)、9月(幼苗期)、10月(生长中期)、11月(收获期)和12月(收获末期);取样深度:0—10 cm,10—20 cm;共计90个样。采取“Z”字形取样,每个样方5—7钻(直径3cm),约750 g土装入自封袋,带回实验室保存于4℃冰箱中备用。为了便于将土壤螨丰度表示为每平米数量,于第一次取样时测定土壤容重(环刀法)。所有土样分为两部分,一部分用于土壤理化分析[26],另一部分用于测定土壤生物。
1.3土壤螨的分离与鉴定
土壤螨的分离采用Tullgren漏斗法。称取250 g鲜土置于Tullgren 漏斗上收集土壤螨48 小时,所用热源为标准 25 W 白炽灯。获取的螨保存在 75%的酒精中,随后用霍氏封固液(Hoyer′s medium)制作成永久玻片,于光学显微镜下进行形态学鉴定。前气门亚目Prostigmata、中气门亚目Mesostigmata和无气门亚目Astigmata螨鉴定到科[27- 28],甲螨亚目Oribatida鉴定至属[29]。
根据食物网分析需求,将所有螨划分为菌食性隐气门螨、菌食性非隐气门螨、食线虫螨和捕食性螨四个功能群[30]。其中中气门亚目的尾足螨科Uropodidae被划归为食线虫螨;中气门亚目其余类群和前气门亚目的吸螨科Bdellidae与长须螨科Stigmaeidae划归至捕食性螨;其他前气门亚目螨和无气门亚目螨则被划归为菌食性非隐气门螨[30- 31]。
1.4数据分析
采用香农指数(Shannon-Wiener index,H′)和优势度指数(Simpson′s index,λ)评价螨的多样性。
式中,pi是第i个分类单元个体数在螨总数中的比例[32]。
螨丰度、各亚目相对丰度、各功能群相对丰度及生态指数采用多因素方差分析(MANOVA)判断取样时间、深度或管理模式是否有显著的影响效应。各亚目及功能群的相对丰度和生态指数再进行单因素方差分析(ANOVA)以比较管理模式的差异(以取样时间和深度作为重复),多重比较方法采用Tukey′s HSD。单因素方差分析前需进行齐次性检测,对不满足齐次性假设的进行ln x 或arsin 转换,仍不满足假设的采取Kruskal-Wallis非参数检验,并用Mann-Whitney非参数检验两两比较处理间的差异。所有统计工作均在SPSS 16.0 中完成,显著性水平设为P<0.05。
2结果
2.1土壤螨的丰度
取样期间,3个温室螨的平均丰度为9822个/m2。垂直分布呈明显的表聚性,土壤表层丰度(18707个/m2)是深层(937个/m2)的20倍。其中有机温室螨的平均丰度为10368个/m2,无公害温室的为11180个/m2,常规温室的为7918个/m2。总体上管理模式对螨的丰度没有显著影响(P>0.05),而取样时间和深度对其有显著影响(P<0.05)(表1)。螨丰度在3个温室间的动态变化规律差异较大,其中无公害模式下呈现较为强烈的波动性,表层土壤的峰值出现在10月,而深层出现在9月;有机温室螨丰度表现为随时间逐渐升高;常规温室也有小幅波动,峰值出现在11月(图1)。
表1土壤螨生态指数、总丰度及各亚目和营养类群的相对丰度多因素方差分析
Table 1Result of analysis variance (ANOVA,Pvalues) for ecology indices, mite abundance and relative abundance of various suborder and trophic groups

螨生态指数和类群Miteecologyindicesandtaxonunit取样时间Samplingtime(S)管理模式Managementpractices(M)深度Depth(D)S×MS×DD×MS×D×MH'0.0040.102<0.0010.0910.0030.5320.025λ0.0370.089<0.0010.0400.0060.3440.051MAB<0.0010.437<0.0010.007<0.0010.5660.008Pro<0.0010.055<0.0010.0230.0070.0100.001Mes0.1210.6170.0080.033<0.0010.2560.017Ast0.0030.098<0.001<0.001<0.0010.6710.057FCR(Ori)0.0100.1040.0230.0020.0300.6370.351FNCR0.3200.0210.0780.003<0.0010.7870.018NEM0.1410.0020.9150.6770.0580.9230.068PRE0.0870.7350.0030.0040.0060.5500.002
H′:香农指数;λ:优势度指数;MAB:螨总数Mite abundance;Pro:前气门亚目Prostigmata;Mes:中气门亚目Mesostigmata;Ast:无气门亚目Astigmata;FCR: 菌食性隐气门螨Fungivorous cryptostigmatic;Ori:甲螨亚目Oribatida;FNCR: 菌食性非隐气门螨Fungivorous non-cryptostigmatic;NEM: 食线虫螨Nematophagous mites;PRE: 捕食性螨Predaceous mites;P<0.05被认为具有显著性差异

图1 不同管理模式下土壤螨丰度的动态变化Fig.1 Dynamics of the abundance of soil mite under different management practicesORG:有机模式organic management practices;LOW:无公害模式low input management practices;CON: 常规模式 conventional management practices;左侧图代表0—10 cm土层,右侧图代表10—20 cm土层;误差线表示标准误
2.2土壤螨的营养类群
管理模式对菌食性非隐气门螨和食线虫螨的相对丰度有显著影响(P<0.05)(表1),其中在0—10 cm土层有机温室的食线虫螨比例显著高于无公害和常规温室(P<0.05)(表2);对其他营养类群则均无显著影响(P>0.05)。取样时间对4个营养类群相对丰度均无显著影响(P>0.05),取样深度对菌食性隐气门螨和捕食性螨有显著影响(P<0.05)。
3个温室中,除常规温室的10—20 cm土层外,均为菌食性非隐气门螨占优势;捕食性螨在有机和无公害温室中均为次优势类群(表2)。菌食性隐气门螨平均比例在表层仅高于前气门螨,其在深层的比例更低。各营养类群丰度的动态变化见图2,复杂的曲线反映出大部分类群并未呈现出清晰的规律。菌食性隐气门螨在有机和无公害温室的表层土呈现较为强烈的波动,常规温室中动态平缓;在深层土壤,仅无公害和常规温室发

表2 不同种植模式下土壤螨分类单位的相对丰度及生态指数
ORG:有机模式organic management practices;LOW:无公害模式low input management practices;CON: 常规模式 conventional management practices;各亚目、营养类群及生态指数符号见表1注释 The meaning of abbreviation were showed in table 1
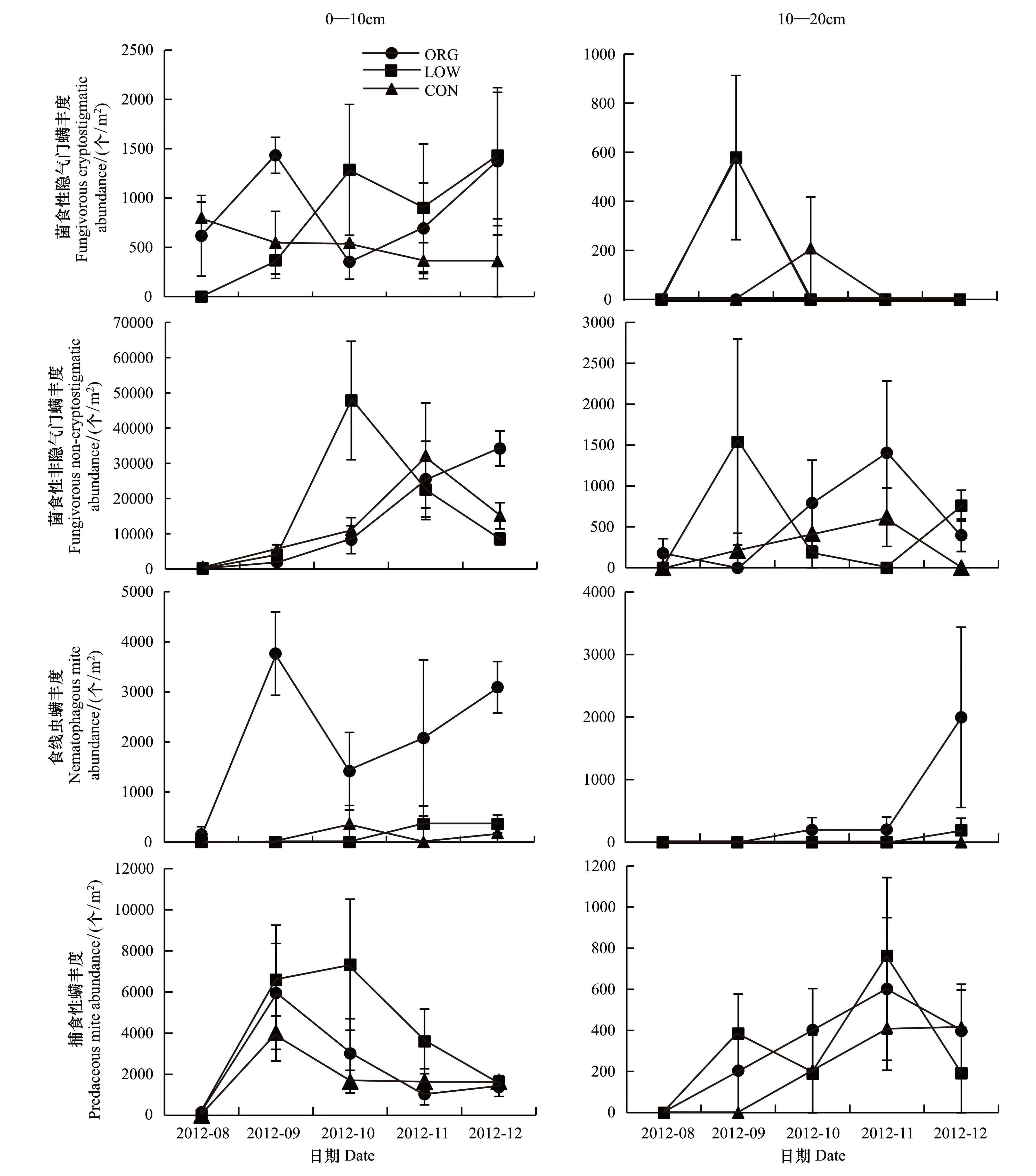
图2 不同管理模式下螨各营养类群丰度的动态变化Fig.2 Dynamic of mite trophic groups abundance under different management practices误差线表示标准误
现了菌食性隐气门螨,分别在9月和10月。对于菌食性非隐气门螨,无公害温室土壤表层的螨峰值出现在10月,深层的出现在9月;常规温室的峰值出现在11月;有机温室中,表层土螨的数量随时间逐渐增加,而在深层土其峰值出现在11月。有机温室中食线虫螨的数量要高于另两个温室,表层土的峰值出现在9月,而深层土壤出现在12月。对于捕食性螨,在表层土壤总体趋势为无公害温室的数量高于有机和常规;在深层土壤无公害和有机的略高于常规。
2.3螨的群落结构
多因素方差分析显示管理模式对螨各亚目均无显著影响(P>0.05),但在有机模式下表层土壤的中气门螨显著高于常规模式(P<0.05);取样时间仅对前气门螨有显著影响;取样深度对各亚目均有显著影响(P<0.05)。在3个温室中,表层土壤无气门亚目所占比例最高(平均60.3%);深层土壤中中气门亚目占优势(平均47.7%)。
取样期间共发现土壤螨34个分类单位,其中有机模式下26个,无公害模式下21个,常规模式下18个(表2)。无气门亚目的粉螨科Acaridae(包括若螨)(37.8%)是优势度最高的类群。除此以外中气门亚目的厉螨科Laelapidae (13.1%)、派盾螨科Parholaspididae (10.4%)、尾足螨科Uropodidae (6.4%)和前气门亚目的微离螨科Microdispidae (6.6%)也是优势类群(相对丰度>5%)。
如表1和表2所示,管理模式对Shannon-Wiener指数H′和优势度指数λ均无显著影响(P>0.05)。取样时间和深度对二者均有显著影响(P<0.05)。表层土壤具有更高的螨的多样性,相应的优势度较低。不同取样时间管理模式对螨生态指数的影响见图3。由于深层土及8月份表层土分离出的螨很少,多半数据无法计算生态指数,因此仅比较9—12月的土壤表层的相关数据。单因素方差分析显示仅12月份的H′和λ有显著性差异,无公害系统的H′显著高于有机系统(P<0.05),λ呈相反趋势。总体而言取样期间9月份是螨多样性最高,优势度最低的时间。
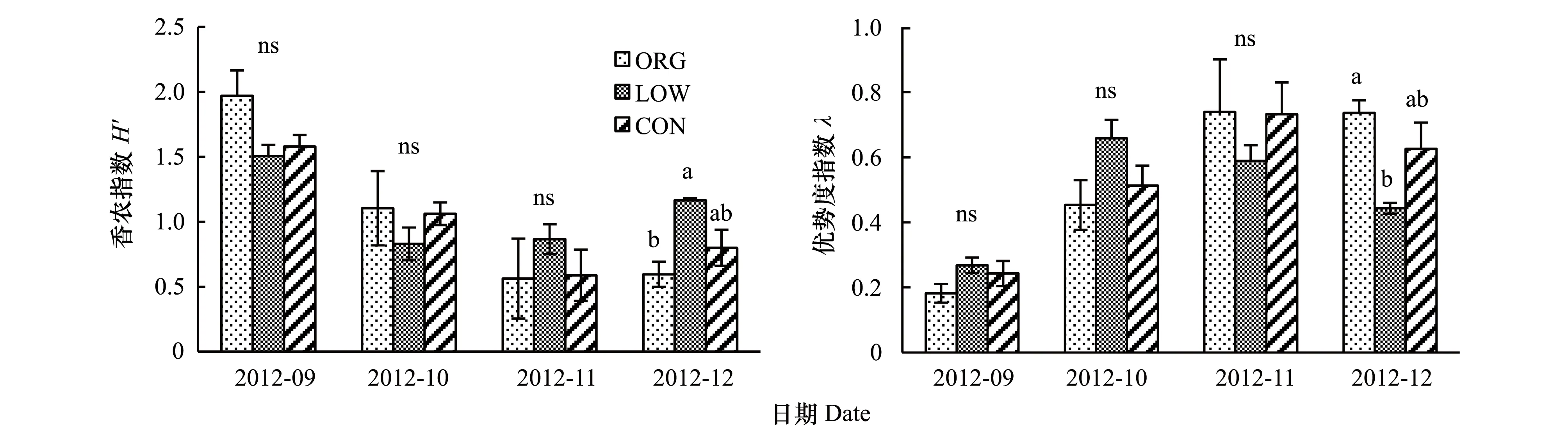
图3 取样期间管理模式对0—10 cm 土层螨的生态指数影响Fig.3 Ecological indices under different management practices at the 0—10 cm soils during the sampling time不同小写字母间表示显著性差异,ns表示管理模式间无显著差异 ;误差线表示标准误
3结论与讨论
取样期间,3个温室螨的平均密度为9822个/m2,此结果高于周边自然林地(1601个/m2)[33],但略低于周边另一个长期施肥定位农田(11951个/m2)[31]。其中自然林地为未经任何农业措施干扰的,由原貌盐碱地演替而来的生境,其土壤养分含量较低[34]。由此可见低肥力的土壤环境经农业培肥后对土壤动物产生了积极影响。为了不受季节限制和提高作物产量,温室内的肥料投入量远高于农田,但并没有进一步提高土壤螨的丰度。Bedano等[12]认为集约化的农业管理会降低螨的密度;另一个相似的对比研究中,古曦[35]发现温室中螨的数量略高于其周边常规农田,但统计分析并未显示显著差异。如果分析螨的垂直分布,本研究所获表层土的螨数量高达18707个/m2,是深层土壤的近20倍,说明10—20 cm土层螨的丰度拉低了整体0—20 cm的平均丰度。螨在土壤中的垂直分布呈明显的表聚性与其他学者的报导一致[31, 36],但本试验显示出了表层与深层过大的差距,甚至有的样品10—20 cm土层样品并未分离到螨。可能的原因两点,一方面土壤深层螨的密度确实很低,如沈静和王慧芙[36]发现85%螨分布于枯枝落叶层和0—5 cm土壤。另一方面,螨的分离时间参考Cao等[31]为48 h,而Winter和Behan-Pelletier[37]推荐3—4 d。分离时间较短可能导致部分螨未被分离出来,且处于深层的土壤含水量更高,不利于螨的移动。
螨的数量与诸多土壤环境因子有关。如林英华等[38]发现有机质和全氮对蜱螨类的影响最大,也有学者指出土壤螨的数量与土壤养分呈正相关[39- 40]。但本研究3个温室螨的密度并没有显著差异,甚至土壤养分含量最高的有机温室的螨还略低于无公害的。可能的解释有两点,本试验开始前温室土壤养分已处于很高水平[18],当环境因子的限度接近或超过土壤生物的生态阈值时,对其种群数量的影响可能减弱;此外,某些土壤因素可能对螨产生了负面影响,如Cao等[31]发现施用了11a的有机肥和化肥的农田螨丰度显著低于对照的,并将原因归结于土壤中过高的有效磷含量抑制了真菌丰度,进而降低了甲螨的丰度。本试验3个温室的土壤有效磷均远超正常水平(参见文献[26]),可能对菌食性螨产生了不利影响。
本研究不同模式下螨的总数及各营养类群均呈现时间上的波动,以往的研究也证实螨的个体数量存在较强的季节变化趋势[36, 41]。温室环境受人为控制,螨的动态可能与扰动下的土壤因子变化和其他生物因素密切相关。如8月份施肥后螨的数量呈增加趋势;3个温室间螨总数及各营养类群数量变化规律差别较大,也可能源于土壤食物网的上行效应与下行效应共同作用,而各温室二者在不同时间点起到的效应存在差别。如整个取样期间常规温室的真菌生物量[42]与菌食性非隐气门螨丰度变化规律一致;而在有机温室菌食性螨及取食菌食性螨的捕食性螨在10—11月份呈现此消彼长的趋势。
多因素方差分析显示管理模式对各亚目螨类比例均无显著影响,对营养类群比例的显著影响也仅限菌食性非隐气门螨和食线虫螨。按取样深度分开进行单因素方差分析后,仅表层的食线虫螨比例存在显著的管理模式效应,即有机模式高于无公害和常规模式。若将其归入捕食性螨,则可看出有机温室土壤顶级捕食者的比例高于无公害和常规温室。说明有机农业模式下有更多资源传递到了土壤食物网顶级营养位。Cole[39]在一个土壤肥力对微节肢动物群落影响的研究中提到,高肥力土壤通过食物网上行效应增加了土壤捕食者数量,进而增强了潜在的下行效应,调控低营养级土壤生物的种群。但从总体分类亚目和功能群结构比例的角度来看,管理模式的影响并不大。
本研究显示温室生境中粉螨为优势度最高的类群,与韩雪梅等[43]调查不同棚龄螨区系的结果一致。但作为自然条件下最为丰富的甲螨(菌食性隐气门螨),其比例仅高于前气门螨。这点与具有相同土壤背景的室外环境下甲螨为最优势类群的结果显著不同[31, 33],说明了温室与室外土壤环境差异较大。韩雪梅等[43]也发现常规农田转化为温室后,甲螨逐渐被无气门螨(主要指粉螨)取代。
相比常规农业,有机农业和无公害农业被期望能对生物多样性的保护起到积极作用。以往也有报导认为有机系统相比常规系统具有更高的生物多样性[44-46],但Hole等[47]总结了大量的研究结果后,认为这种推断仍存在一定的不确定性,甚至与本试验同步的线虫研究发现常规温室的多样性最高,无公害次之,而有机的最低[26]。对于土壤螨类,取样期间三个温室间螨的多样性和优势度均无显著差异,由此说明温室条件下的有机农业和无公害农业并未比常规农业表现出多样性的优势,尽管在前两者中发现了更多螨的分类单位,此结果与Doles等[48]对有机和常规果园土壤微节肢动物的报道一致。在另两个可供参考的施肥试验中,胡敦效和吴珊眉[24]发现尽管有机处理具有更高的螨的丰富度,但多样性低于化肥处理;Cao等[31]则认为在0—10 cm土层,长期施用有机肥和化肥均比不施肥处理降低了螨的多样性,但有机肥处理和化肥处理之间并没有显著差异。
本试验结果与同步进行的微生物量碳、原生动物和线虫试验[26, 42]的结果有相似之处,即种管理模式对土壤生物的群落结构及多样性影响较小;但也存在不同的规律,对于小型土壤动物(线虫和原生动物)和微生物而言有机模式尚能表现出生物量上的优势,但对于中型土壤动物螨,在生物量这一指标上也没有显著差异,由此反映出集约化农业对土壤生物的影响可能因体型大小而异[49]。对于温室这种特殊环境下不同管理模式地下生态过程的揭示,尚需通过构建土壤食物网来进一步深入分析。有关本课题土壤食物网结构及能量流动的结果将在后续的报导中陆续呈现。
参考文献(References):
[1]曹志平. 生态农业未来的发展方向. 中国生态农业学报, 2013, 21(1): 29- 38.
[2]Cluzeau D, Guernion M, Chaussod R, Martin-Laurent F, Villenave C, Cortet J, Ruiz-Camacho N, Pernin C, Mateille T, Philippot L, Bellido A, Rougé L, Arrouays D, Bispo A, Pérès G. Integration of biodiversity in soil quality monitoring: baselines for microbial and soil fauna parameters for different land-use types. European Journal of Soil Biology, 2012, 49: 63- 72.
[3]Nesbitt J E, Adl S M. Differences in soil quality indicators between organic and sustainably managed potato fields in Eastern Canada. Ecological Indicators, 2014, 37(Part A): 119- 130.
[4]Parisi V, Menta C, Gardi C, Jacomini C, Mozzanica E. Microarthropod communities as a tool to assess soil quality and biodiversity: a new approach in Italy. Agriculture, Ecosystems & Environment, 2005, 105(1/2): 323- 333.
[5]Beare M H, Reddy M V, Tian G, Srivastava S C. Agricultural intensification, soil biodiversity and agroecosystem function in the tropics: the role of decomposer biota. Applied Soil Ecology, 1997, 6(1): 87- 108.
[6]Moore J C, Zwetsloot H J C, de Ruiter P C. Statistical analysis and simulation modelling of the belowground food webs of two winter wheat management practices. Netherlands Journal of Agricultural Science, 1990, 38(3A): 303- 316.
[7]Renker C, Otto P, Schneider K, Zimdars B, Maraun M, Buscot F. Oribatid mites as potential vectors for soil microfungi: study of mite-associated fungal species. Microbial Ecology, 2005, 50(4): 518- 528.
[8]Behan-Pelletier V M. Oribatid mite biodiversity in agroecosystems: role for bioindication. Agriculture, Ecosystems & Environment, 1999, 74(1/3): 411- 423.
[9]Koehler H H. Predatory mites (Gamasina, Mesostigmata). Agriculture, Ecosystems & Environment, 1999, 74(1/3): 395- 410.
[10]Minor M A, Norton R A. Effects of soil amendments on assemblages of soil mites (Acari: Oribatida, Mesostigmata) in short-rotation willow plantings in central New York. Canadian Journal of Forest Research, 2004, 34(7): 1417- 1425.
[11]Salamon J A, Alphei J, Ruf A, Schaefer M, Scheu S, Schneider K, Sührig A, Maraun M. Transitory dynamic effects in the soil invertebrate community in a temperate deciduous forest: effects of resource quality. Soil Biology and Biochemistry, 2006, 38(2): 209- 221.
[12]Bedano J C, Cantú M P, Doucet M E. Influence of three different land management practices on soil mite (Arachnida: Acari) densities in relation to a natural soil. Applied Soil Ecology, 2006, 32(3): 293- 304.
[13]Cortet J, Gillon D, Joffre R, Ourcival J M, Poinsot-Balaguer N. Effects of pesticides on organic matter recycling and microarthropods in a maize field: use and discussion of the litterbag methodology. European Journal of Soil Biology, 2002, 38(3/4): 261- 265.
[14]Reeleder R D, Miller J J, Coelho B R B, Roy R C. Impacts of tillage, cover crop, and nitrogen on populations of earthworms, microarthropods, and soil fungi in a cultivated fragile soil. Applied Soil Ecology, 2005, 33(3): 243- 257.
[15]Tabaglio V, Gavazzi C, Menta C. Physico-chemical indicators and microarthropod communities as influenced by no-till, conventional tillage and nitrogen fertilisation after four years of continuous maize. Soil and Tillage Research, 2009, 105(1): 135- 142.
[16]Clark M S, Horwath W R, Shennan C, Scow K M. Changes in soil chemical properties resulting from organic and low-input farming practices. Agronomy Journal, 1998, 90(5): 662- 671.
[17]Reganold J P, Palmer A S, Lockhart J C, Macgregor A N. Soil quality and financial performance of biodynamic and conventional farms in New Zealand. Science, 1993, 260(5106): 344- 349.
[18]张阿克, 韩卉, 杨合法, 李季. 常规、无公害和有机蔬菜生产模式对土壤性状的影响. 江苏农业学报, 2013, 29(6): 1345- 1351.
[19]杨合法, 范聚芳, 戈志奇, 沈广成, 吕润海, 李季. 有机、无公害及常规生产模式番茄病害及防治效果比较研究. 中国生态农业学报, 2009, 17(5): 933- 937.
[20]Bloem J, Lebbink G, Zwart K B, Bouwman L A, Burgers S L G E, Vos J A, de Ruiter P C. Dynamics of microorganisms, microbivores and nitrogen mineralisation in winter wheat fields under conventional and integrated management. Agriculture, Ecosystems & Environment, 1994, 51(1/2): 129- 143.
[21]Brussaard L, Bouwman L A, Geurs M, Hassink J, Zwart K B. Biomass, composition and temporal dynamics of soil organisms of a silt loam soil under conventional and integrated management. Netherlands Journal of Agricultural Science, 1990, 38(3A): 283- 302.
[22]Wu S M, Hu D X, Ingham E R. Comparison of soil biota between organic and conventional agroecosystems in Oregon, USA. Pedosphere, 2005, 15(3): 395- 403.
[23]Farská J, Prejzková K, Rusek J. Management intensity affects traits of soil microarthropod community in montane spruce forest. Applied Soil Ecology, 2014, 75: 71- 79.
[24]胡敦孝, 夏云龙, 吴珊眉. 不同施肥条件下土壤螨群落结构及其变化的研究. 北京农业大学学报, 1995, 21(4): 417- 423.
[25]Chen Y F, Cao Z P, Popescu L, Kiepper B H. Static and dynamic properties of soil food web structure in a greenhouse environment. Pedosphere, 2014, 24(2): 258- 270.
[26]Li Y F, Li J, Zheng C Y, Cao Z P. Effects of organic, low input, conventional management practices on soil nematode community under greenhouse conditions. Acta Agriculturae Scandinavica, Section B-Soil & Plant Science, 2014, 64(4): 360- 371.
[27]Krantz G W. A Manual of Acarology. 2nd ed. Oregon: Oregon State University Book Stores, 1978.
[28]尹文英. 中国土壤动物检索图鉴. 北京: 科学出版社, 1998.
[29]Balogh J, Balogh P. The Oribatid Mites Genera of the World. Budapest: The Hungarian National Museum Press, 1992.
[30]Holtkamp R, Kardol P, van der Wal A, Dekker S C, van der Putten W H, de Ruiter P C. Soil food web structure during ecosystem development after land abandonment. Applied Soil Ecology, 2008, 39(1): 23- 34.
[31]Cao Z P, Han X M, Hu C, Chen J, Zhang D P, Steinberger Y. Changes in the abundance and structure of a soil mite (Acari) community under long-term organic and chemical fertilizer treatments. Applied Soil Ecology, 2011, 49: 131- 138.
[32]Shannon C E, Weaver W. The Mathematical Theory of Communication. Urbana: University of Illinois Press, 1949.
[33]郑春燕. 不同农作措施下土壤螨群落结构的变化 [D]. 北京: 中国农业大学, 2011.
[34]Li Y F, Cao Z P, Hu C, Li J, Yang H F. Response of nematodes to agricultural input levels in various reclaimed and unreclaimed habitats. European Journal of Soil Biology, 2014, 60: 120- 129.
[35]古曦. 山东寿光日光温室和农田土壤中螨类的群落结构 [D]. 北京: 中国农业大学, 2009.
[36]沈静, 王慧芙, 陈国孝, 徐汝梅. 北京小龙门森林生态系统定位站土壤螨类的垂直分布和季节变动. 蛛形学报, 1999, 8(2): 111- 117.
[37]Winter J P, Behan-Pelletier V M. Microarthropods // Carter M R, Gregorich E G, eds. Soil Sampling and Methods of Analysis. Boca Raton: CRC Press, 2007: 399- 414.
[38]林英华, 张夫道, 杨学云, 宝德俊, 石孝均, 王胜佳, 王伯仁. 农田土壤动物与土壤理化性质关系的研究. 中国农业科学, 2004, 37(6): 871- 877.
[39]Cole L, Buckland S M, Bardgett R D. Relating microarthropod community structure and diversity to soil fertility manipulations in temperate grassland. Soil Biology and Biochemistry, 2005, 37(9): 1707- 1717.
[40]Wu Y P, Li Y F, Zheng C Y, Zhang Y F, Sun Z J. Organic amendment application influence soil organism abundance in saline alkali soil. European Journal of Soil Biology, 2013, 54: 32- 40.
[41]傅荣恕, 苗明升. 泰山地区土壤甲螨的群落组成和季节变动. 动物学报, 2001, 47(专刊): 13- 18.
[42]李钰飞. 有机、无公害和常规蔬菜种植模式下温室土壤生物群落结构及食物网的特征研究[D]. 北京: 中国农业大学, 2014.
[43]韩雪梅, 李丹丹, 梁子安, 陈云峰, 胡诚. 北方常见农业土地利用方式对土壤螨群落结构的影响. 生态学报, 2013, 33(16): 5026- 5034.
[44]Brown R. Grass margins and earthworm activity in organic and integrated systems. Aspects of Applied Biology, 1999, 54: 207- 210.
[45]Mäder P, Fliessbach A, Dubois D, Gunst L, Fried P, Niggli U. Soil fertility and biodiversity in organic farming. Science, 2002, 296(5573): 1694- 1697.
[46]Mulder C, Zwart D, Van Wijnen H J, Schouten A J, Breure A M. Observational and simulated evidence of ecological shifts within the soil nematode community of agroecosystems under conventional and organic farming. Functional Ecology, 2003, 17(4): 516- 525.
[47]Hole D G, Perkins A J, Wilson J D, Alexander I H, Grice P V, Evans A D. Does organic farming benefit biodiversity?. Biological Conservation, 2005, 122(1): 113- 130.
[48]Doles J L, Zimmerman R J, Moore J C. Soil microarthropod community structure and dynamics in organic and conventionally managed apple orchards in Western Colorado, USA. Applied Soil Ecology, 2001, 18(1): 83- 96.
[49]Postma-Blaauw M B, de Goede R G M, Bloem J, Faber J H, Brussaard L. Soil biota community structure and abundance under agricultural intensification and extensification. Ecology, 2010, 91(2): 460- 473.
基金项目:科技部科技支撑项目(2012BAD14B01);农业部行业专项项目(201303089- 2);环保公益性行业科研专项项目(2013467036)
收稿日期:2014- 10- 10; 网络出版日期:2015- 10- 10
*通讯作者
Corresponding author.E-mail: liji@cau.edu.cn
DOI:10.5846/stxb201410101996
Effects of different management practices on soil mite community structure under greenhouse conditions
LI Yufei1,2, ZHENG Chunyan2, LI Jijin1, SUN Qinping1, ZOU Guoyuan1, LIU Bensheng1, XU Junxiang1, GAO Lijuan1, LIU Dongsheng1, LI Ji2,*
1InstituteofPlantNutritionandResources,BeijingAcademyofAgricultureandForestrySciences,Beijing100097,China2CollegeofResourcesandEnvironmentalScience,ChinaAgriculturalUniversity,Beijing100193,China
Abstract:Soil mite distribution is closely associated with various agricultural activities in agroecosystems. The effects of organic (ORG), low-input (LOW), and conventional (CON) management practices on soil mite abundance and community structure under greenhouse conditions were determined by conducting an experiment at the Quzhou Experimental Station of the China Agricultural University (36.5°N, 115.0°E), Hebei Province, China. Soil sampling was performed five times between August and December 2012 (an entire cucumber growing season) at two soil depths (0—10 cm and 10—20 cm), and each of the management practices was replicated three times. All mite taxa obtained were divided into four trophic groups: fungivorous cryptostigmatic, fungivorous non-cryptostigmatic, nematophagous, and predaceous mites. Shannon-Wiener (H′) and dominance (λ) indices were calculated to evaluate mite diversity. The results revealed that the average mite abundance according to sampling date and depth in the ORG, LOW, and CON management practices was 10368 ind/m2, 11180 ind/m2 and 7918 ind/m2, respectively. In all the three greenhouses, the vertical distribution of soil mites showed surface-aggregation, and the mean abundance of mites in the 0—10 cm soil depth (18707 ind/m2) was 20-fold that in the 10—20 cm depth (937 ind/m2). Statistical analyses indicated that the management practices only significantly impacted the relative abundance of fungivorous non-cryptostigmatic and nematophagous mites, but no significant effect was found on the abundance of soil mites, the relative abundance of various suborders of mites, and the relative abundance of fungivorous cryptostigmatic and predaceous mites. The total mite abundance and the abundance of the various trophic groups fluctuated to different degrees during the sampling period; they also differed among the greenhouses. A strong fluctuation in mite density was found under low-input management practice, with the highest numbers noted in October and September for the 0—10 cm and 10—20 cm soil depths, respectively. The total mite abundance in the organic greenhouse increased gradually over time, and that under conventional management practices exhibited a slight fluctuation, with the highest number observed in November. Fungivorous non-cryptostigmatic mites were dominant in most soils except in the 10—20 cm depth of conventional soils; nematophagous mites were the subdominant trophic group in both organic and low-input soils. Acaridae was the most abundant family (mean=38.7%). Other dominant mite taxa included Laelapidae (13.1%), Parholaspididae (10.4%), Uropodidae (6.4%), and Microdispidae (6.6%). Mite richness decreased in the following order: ORG (26) > LOW (21) > CON (18); however, no significant effect was observed in the H′ or λ indices. One-way analysis of variance of H′ and λ in the 0—10 cm depth only revealed a significant difference in December, suggesting that H′ was significantly higher under LOW than under ORG management practices. In general, the highest H′ value was observed in November, and the λ index was the lowest in this month. Thus, under greenhouse conditions in which the soil environments are highly disturbed and receive high inputs, management practices had small effects on both soil mite abundance and community structure.
Key Words:soil mites; greenhouse; organic management practices; low-input management practices; community structure; diversity
李钰飞, 郑春燕, 李吉进, 孙钦平, 邹国元, 刘本生, 许俊香, 高利娟, 刘东生, 李季.不同管理模式对温室土壤螨群落结构的影响.生态学报,2016,36(12):3802- 3811.
Li Y F, Zheng C Y, Li J J, Sun Q P, Zou G Y, Liu B S, Xu J X, Gao L J, Liu D S, Li J.Effects of different management practices on soil mite community structure under greenhouse conditions.Acta Ecologica Sinica,2016,36(12):3802- 3811.
