水稻草矮病毒侵染的水稻根系差异蛋白鉴定
2016-08-09丁新伦谢荔岩张洁吴祖建
丁新伦 谢荔岩 张洁 吴祖建
(福建农林大学 植物病毒研究所/福建省植物病毒重点实验室, 福州 350002; *通讯联系人, E-mail: wuzujian@126.com)
水稻草矮病毒侵染的水稻根系差异蛋白鉴定
丁新伦谢荔岩张洁吴祖建*
(福建农林大学 植物病毒研究所/福建省植物病毒重点实验室, 福州 350002;*通讯联系人, E-mail: wuzujian@126.com)
DING Xinlun, XIE Liyan, ZHANG Jie, et al. Identification of differentially expressed proteins in roots of rice(Oryzasativa) infected withRicegrassystuntvirus.ChinJRiceSci, 2016, 30(4): 356-362.
丁新伦, 谢荔岩, 张洁, 等. 水稻草矮病毒侵染的水稻根系差异蛋白鉴定. 中国水稻科学, 2016, 30(4): 356-362.
摘要:为鉴定与水稻草矮病毒(Rice grassy stunt virus, RGSV)侵染引起的水稻根系发育不良的相关蛋白,解析根系发育不良症状的形成机理以及水稻草矮病毒与水稻互作的分子机制,采用双向荧光差异凝胶电泳(2D-DIGE)结合基质辅助激光解析串联飞行时间质谱技术(MALDI-TOF-MS)对RGSV侵染水稻后根系的差异表达蛋白进行分离和鉴定,并对鉴定的差异表达蛋白进行GO聚类分析和KEGG生物通路注释。结果表明,差异倍数大于2的蛋白质点有56个,其中,表达丰度升高的点有34个,表达丰度下降的点有22个;质谱成功鉴定出27个蛋白质点,分属于25种蛋白质。GO聚类分析表明差异表达蛋白涉及14个生物学过程,在生物功能上分属10类。细胞组件分析显示差异表达蛋白定位于不同的细胞部位。KEGG通路分析显示差异蛋白参与了12个生物通路。
关键词:水稻草矮病毒; 水稻根系; 差异表达蛋白; 双向荧光差异凝胶电泳; 基质辅助激光解析串联飞行时间质谱技术
植物受病毒侵染后不仅地上部会表现各种症状,而且地下根系的发育也会受到影响。病毒侵染导致根系发育异常主要表现出根变短、根细弱、不定根减少、根质量下降、褐根多和易拔起等症状。如南方水稻黑条矮缩病毒(Southern rice black-streaked dwarf virus,SRBSDV)导致水稻根系不发达,须根少而短,严重时根系呈黄褐色[1]。黄瓜花叶病毒(Cucumber mosaic virus,CMV)引起烟草和辣椒根系变短,根质量下降[2]。大豆花叶病毒(Soybean mosaic virus,SMV)可使感病品种大豆根系生长量减少57%~60%[3],马铃薯Y病毒(Potato virus Y,PVY)甚至可导致根系坏死[4]。尽管病毒侵染引起寄主根系发育异常的现象已引起关注,但已有报道多是对其症状的描述,而有关病毒引起根系症状异常的分子机制研究则较少,机理也不清楚。王煜炜等[5]研究表明黄瓜花叶病毒(CMV-Fny-satT1)和番茄不孕病毒(TAV-Bj)侵染番茄引起与根系发育相关miR164的含量升高,而其靶标NAC1mRNA含量明显降低,最终导致侧根数量大大减少。
水稻草矮病毒,又称水稻草状矮化病毒(Rice grassy stunt virus,RGSV),属于纤细病毒属(Tenuivirus)。该病毒侵染引起的水稻草矮病(Ricegrassystunt)主要发生在热带和亚热带稻区,最早于1964年在菲律宾被首先确认,随后在中国、日本、南亚及东南亚的一些国家陆续被报道。我国的广东、广西、海南、福建和台湾等地也有发生的报道[6]。RGSV侵染除了引起水稻植株严重矮化和分蘖增多等地上症状外,还严重干扰根系的发育,表现为根系不发达、根长变短、根质量减轻、不定根减少等症状。丁新伦等[7]研究发现,RGSV侵染水稻后可引起根系发育相关基因OsPHR2和Crl-5基因下调表达。
比较蛋白质组学技术已成为生命科学领域十分有效的研究手段,可以检测参与RGSV和寄主水稻互作的多个蛋白质。本研究采用双向荧光差异凝胶电泳(2D-DIGE)结合基质辅助激光解析串联飞行时间质谱技术(MALDI-TOF-MS)对RGSV侵染的水稻根系在蛋白质表达水平的变化进行了分析,旨在鉴定与RGSV侵染引起水稻根系发育不良的相关蛋白,结果将有助于解析根系发育不良症状的形成机理,也为进一步理解RGSV与水稻互作的分子机制提供线索。
1材料与方法
1.1材料
RGSV毒源和昆虫介体无毒褐飞虱(Nilaparvata lugens)均由福建农林大学植物病毒研究所保存。供试水稻为杂交水稻汕优63。DIGE试剂盒、IPG胶条(24cm,pH4~pH7)均购自美国GE公司;甲醇和丙酮等有机试剂购自美国ThermoFisher公司;交联聚乙烯吡咯烷酮(PVPP)购自美国BBI公司。
1.2方法
1.2.1取样
将昆虫介体褐飞虱在RGSV病株上饲毒72h,并转饲于水稻健株上度过循回期,随后接种汕优63幼苗,传毒72h,接种后30d取样。经无毒褐飞虱取食后的汕优63植株作为对照。8~10株水稻根系混合取样,RGSV处理和对照各设3次重复。样品在液氮中速冻后,保存于-80℃下。
1.2.2蛋白质的提取与纯化
水稻根系蛋白的提取与纯化参照Carpentier等[8]的方法,略有修改。取3g根系在液氮中研磨,酚提取液(0.1gPVPP、10mL酚提取液和10mLTris饱和酚)抽提;冰上30min后离心(5000r/min,30min);取上层酚相,再用等体积的酚提取液抽提;加入5倍体积的醋酸铵甲醇溶液,冰上30min后,-20℃下过夜;离心(5000r/min,30min),沉淀用甲醇和丙酮先后洗涤,再用丙酮溶解,离心(12 000r/min,20min),将获得的沉淀室温干燥,即可得到蛋白质团块,-80℃下保存备用。
1.2.3一向等电聚焦和二向SDS-PAGE
在干燥后的蛋白质团块中加入200μLAlKlysis缓冲液(20mmol/LTris,2mol/L硫脲,7mol/L尿素和2%CHAPs)溶解(pH8.5)。Cy3染料和Cy5染料分别用于标记健株和病株根系的蛋白,Cy2染料标记健株和病株根系等量混合后的蛋白作为内标。使用不同染料标记的蛋白在同一根IPG胶条和同一张胶里进行电泳,IPG等电聚焦系统(GE公司)进行双向凝胶电泳第1向,等电聚焦程序如下:S1, 0.5h升至300V;S2, 0.5h升至700V;S3, 1.5h升至1500V;S4,3h运行到9000V;S5, 9000V下保持4h,整个聚焦过程总电压为52kV·h。将平衡好的胶条转移到12.5%SDS-PAGE凝胶上,置于ETTANDALTsix电泳系统(GE),二向电泳程序如下:先以2W/胶条运行45min;然后再以17W/胶条运行约4.5h,直至溴酚蓝跑到底。
1.2.4扫描与图像分析
经荧光标记的蛋白用激光扫描仪Typhoon9400(GE公司)扫描获得2D-DIGE的蛋白表达图像,采用图像分析软件系统ImageMaster2Dplatinum7.0(GE)对图像进行分析,以确立差异表达大于1.5倍的蛋白质点。
1.2.5MALDI-TOF-MS鉴定及蛋白质查询
选取的蛋白质经酶解后,委托广州辉骏生物科技有限公司采用基质辅助激光解吸电离飞行时间质谱仪(AutoflexspeedTMMALDI-TOF-TOF,BrukerDalton,德国)进行质谱分析。实验样品的质谱图均以默认模式获得。利用软件BioTools(BrukerDalton)在NCBI数据库中寻找相匹配的蛋白质并进行功能查询。
1.2.6生物信息学分析
采用GOminer软件对差异蛋白进行基因本体(Geneontology,GO)聚类分析,在京都基因与基因组百科全书(KyotoEncyclopediaofGenesandGenomes,KEGG)数据库中进行生物通路分析。

A-Cy3标记水稻健株根部蛋白,Cy5标记RGSV水稻病株根部蛋白;B-Cy3 标记RGSV水稻病株根部蛋白,Cy5 标记水稻健株根部蛋白;C-RGSV病株根部差异蛋白表达升高;D-健株根部差异蛋白表达升高。
A,Cy3-labeledproteinsofRGSV-uninfectedriceroots.Cy5-labeledproteinsofRGSV-infectedriceroots.B,Cy3-labeledproteinsofRGSV-infectedriceroots;Cy5-labeledproteinsofRGSV-uninfectedriceroots.C,Up-regulatedproteinsinRGSV-infectedriceroots.D,Up-regulatedproteinsinuninfectedriceroots.
图1水稻病健植株根部蛋白双向凝胶电泳及差异表达蛋白位点
Fig. 1. 2-DEmapsofproteinsinricerootsinfectedwithRGSV.
2结果与分析
2.1RGSV侵染水稻根部差异表达蛋白质组分析
RGSV水稻病株和健株根部蛋白的双向荧光差异凝胶电泳叠加图见图1-A和1-B。DIGE分析显示RGSV侵染水稻后根部差异倍数大于1.5的差异蛋白质点有141个(图1),其中,表达丰度升高的点有60个(图1-C),表达丰度下降的点有81个(图1-D);而差异倍数大于2的蛋白质点有56个,其中,表达丰度升高的点有34个,表达丰度下降的点有22个。
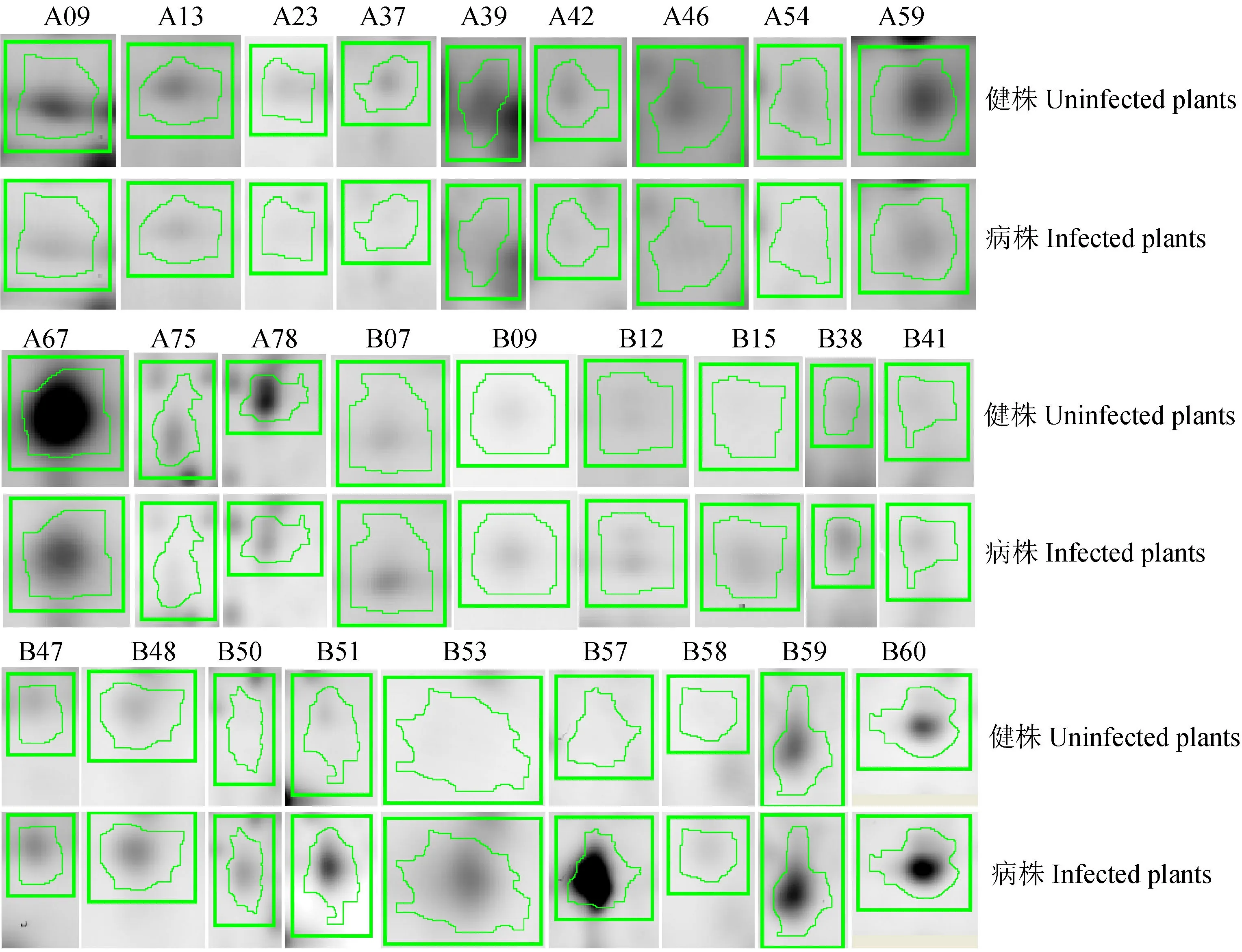
图2经质谱鉴定的差异表达蛋白点的放大图
Fig. 2.The‘spotview’ofproteinsidentifiedbyMS.
2.2差异表达蛋白MALDI-TOF-MS鉴定
在差异倍数大于2的蛋白质点中选取42个差异表达最明显的蛋白质点进行MALDI-TOF-MS分析,鉴定出27个蛋白质点,各蛋白的电泳斑点局部放大见图2。在鉴定出的蛋白质中表达上调的有15个,下调的有12个。B50和B51经鉴定同为RGSV的P5蛋白,B53和B57经鉴定同为RGSV的20.6kD非结构蛋白。通过与NCBI数据库比对和查询,获得各蛋白点的信息,包含蛋白质的名称、等电点、分子量、登录号、蛋白质得分和差异蛋白比值(表1)。
2.3差异蛋白的生物信息学分析
对已鉴定的差异蛋白进行GO功能注释。生物学过程分析表明差异蛋白涉及生物合成过程、碳水化合物代谢过程、细胞氨基酸代谢过程、运输、小分子代谢过程、分解代谢过程、对胁迫的响应、含碱基化合物的分解过程、细胞氮化合物代谢过程和前体代谢物质和能量的产生等多个生物学过程。在生物功能上分属10类,包括离子作用、激酶活性、ATP酶活性、跨膜转运活性、氧化还原酶活性、裂解酶活性、RNA结合、DNA结合、结合核酸的转录因子活性和水解酶活性。细胞组件分析显示差异蛋白定位于细胞质、蛋白复合体、胞液、胞内、线粒体、质体、核、质膜和细胞壁等部位。
KEGG通路分析显示,3个蛋白参与了代谢途径,2个蛋白参与了次级代谢产物的生物合成,其他10个蛋白分别参与了乙醛酸和二羧酸代谢、内质网上的蛋白质加工过程、丙酮酸代谢、柠檬酸循环、苯丙氨酸代谢、光合生物固碳反应、植物与病原物互作、氧化磷酸化、碳代谢和类苯丙烷合成等生物通路。
3讨论
本研究利用2D-DIGE技术分析了RGSV侵染水稻根系的差异表达蛋白谱,并利用质谱技术鉴定了部分差异蛋白。本研究鉴定了25个差异蛋白,其中包括2个RGSV编码的病毒蛋白和23个寄主水稻的蛋白。水稻草矮病株根部OsPHR2和Crl-5基因表达下调[7]。本研究未鉴定到这两个蛋白,这2个蛋白表达量变化还需进一步的实验分析。丁新伦等[9]在水稻草矮病株叶部中鉴定了24个蛋白,包含2个病毒蛋白和22个寄主蛋白,在水稻草矮病毒根部和叶部鉴定到的病毒蛋白均为P5蛋白和20.6kD非结构蛋白,而鉴定到的根部蛋白和叶部蛋白均不同。
表1经质谱鉴定的差异表达蛋白
Table1.DifferentiallyexpressedproteinsidentifiedbyMS.
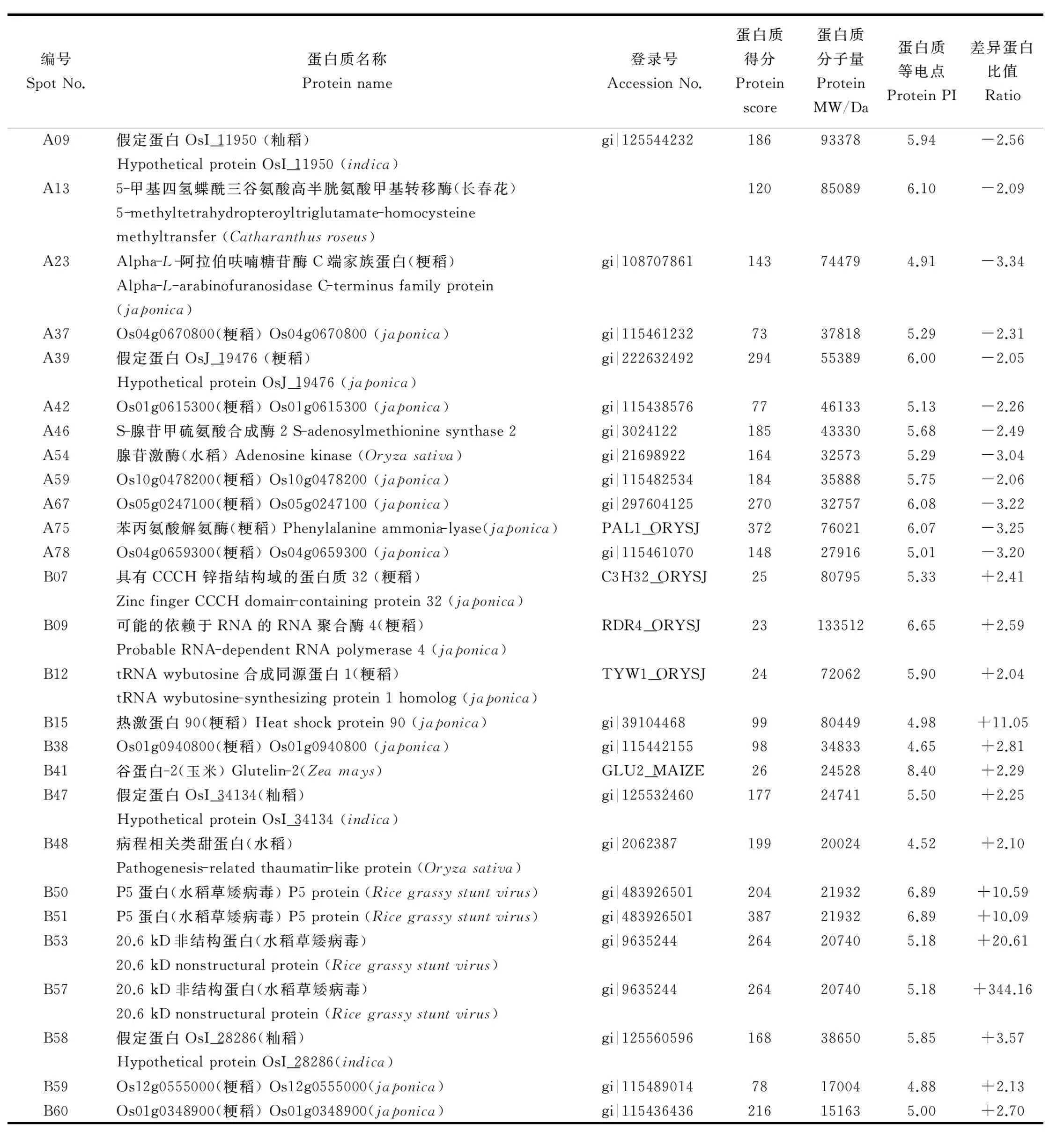
编号SpotNo.蛋白质名称Proteinname登录号AccessionNo.蛋白质得分Proteinscore蛋白质分子量ProteinMW/Da蛋白质等电点ProteinPI差异蛋白比值RatioA09假定蛋白OsI_11950(籼稻)HypotheticalproteinOsI_11950(indica)gi|125544232186933785.94-2.56A135-甲基四氢蝶酰三谷氨酸高半胱氨酸甲基转移酶(长春花)5-methyltetrahydropteroyltriglutamate-homocysteinemethyltransfer(Catharanthusroseus)120850896.10-2.09A23Alpha-L-阿拉伯呋喃糖苷酶C端家族蛋白(粳稻)Alpha-L-arabinofuranosidaseC-terminusfamilyprotein(japonica)gi|108707861143744794.91-3.34A37Os04g0670800(粳稻)Os04g0670800(japonica)gi|11546123273378185.29-2.31A39假定蛋白OsJ_19476(粳稻)HypotheticalproteinOsJ_19476(japonica)gi|222632492294553896.00-2.05A42Os01g0615300(粳稻)Os01g0615300(japonica)gi|11543857677461335.13-2.26A46S-腺苷甲硫氨酸合成酶2S-adenosylmethioninesynthase2gi|3024122185433305.68-2.49A54腺苷激酶(水稻)Adenosinekinase(Oryzasativa)gi|21698922164325735.29-3.04A59Os10g0478200(粳稻)Os10g0478200(japonica)gi|115482534184358885.75-2.06A67Os05g0247100(粳稻)Os05g0247100(japonica)gi|297604125270327576.08-3.22A75苯丙氨酸解氨酶(粳稻)Phenylalanineammonia-lyase(japonica)PAL1_ORYSJ372760216.07-3.25A78Os04g0659300(粳稻)Os04g0659300(japonica)gi|115461070148279165.01-3.20B07具有CCCH锌指结构域的蛋白质32(粳稻)ZincfingerCCCHdomain-containingprotein32(japonica)C3H32_ORYSJ25807955.33+2.41B09可能的依赖于RNA的RNA聚合酶4(粳稻)ProbableRNA-dependentRNApolymerase4(japonica)RDR4_ORYSJ231335126.65+2.59B12tRNAwybutosine合成同源蛋白1(粳稻)tRNAwybutosine-synthesizingprotein1homolog(japonica)TYW1_ORYSJ24720625.90+2.04B15热激蛋白90(粳稻)Heatshockprotein90(japonica)gi|3910446899804494.98+11.05B38Os01g0940800(粳稻)Os01g0940800(japonica)gi|11544215598348334.65+2.81B41谷蛋白-2(玉米)Glutelin-2(Zeamays)GLU2_MAIZE26245288.40+2.29B47假定蛋白OsI_34134(籼稻)HypotheticalproteinOsI_34134(indica)gi|125532460177247415.50+2.25B48病程相关类甜蛋白(水稻)Pathogenesis-relatedthaumatin-likeprotein(Oryzasativa)gi|2062387199200244.52+2.10B50P5蛋白(水稻草矮病毒)P5protein(Ricegrassystuntvirus)gi|483926501204219326.89+10.59B51P5蛋白(水稻草矮病毒)P5protein(Ricegrassystuntvirus)gi|483926501387219326.89+10.09B5320.6kD非结构蛋白(水稻草矮病毒)20.6kDnonstructuralprotein(Ricegrassystuntvirus)gi|9635244264207405.18+20.61B5720.6kD非结构蛋白(水稻草矮病毒)20.6kDnonstructuralprotein(Ricegrassystuntvirus)gi|9635244264207405.18+344.16B58假定蛋白OsI_28286(籼稻)HypotheticalproteinOsI_28286(indica)gi|125560596168386505.85+3.57B59Os12g0555000(粳稻)Os12g0555000(japonica)gi|11548901478170044.88+2.13B60Os01g0348900(粳稻)Os01g0348900(japonica)gi|115436436216151635.00+2.70
+, 上调; -, 下调。
+,Up-regulated; -,Down-regulated.
在水稻病株根系中鉴定到2个RGSV编码蛋白:22kDP5和20.6kD非结构蛋白。RGSV22kDP5是vRNA5编码的非结构蛋白,可在水稻病株叶片[9-10]和介体褐飞虱中大量积累[10],可能在病毒侵染植物和昆虫介体中起作用。20.6kD非结构蛋白由vRNA6编码,可在水稻病叶中大量积累[9-10],其含量变化与症状的严重度密切相关,为病害特异性蛋白(Specific-diseaseprotein,SP)[11-12]。本研究表明,P5蛋白和20.6kD非结构蛋白均可在RGSV侵染的水稻根系中积累,20.6kD非结构蛋白积累量更多。P5和20.6kD非结构蛋白可能是RGSV侵染引致水稻根系发育异常的关键蛋白。
在鉴定出的水稻蛋白中,有5个蛋白参与胁迫反应,包括S-腺苷甲硫氨酸合成酶2、热激蛋白90、病程相关类甜蛋白、Os10g0478200、和Os12g0555000。蛋白点A46鉴定为S-腺苷甲硫氨酸合成酶2,催化合成S-腺苷甲硫氨酸,是生物体内主要的甲基供体,并且另一蛋白点A13鉴定为5-甲基四氢蝶酰三谷氨酸高半胱氨酸甲基转移酶。这2种蛋白均参与了与甲基转移相关的反应,基因表达均下调。由此可以推测与甲基转移相关的反应,如DNA的甲基化等,在RGSV和水稻互作中起调控作用。蛋白点B15鉴定为热激蛋白90(Heatshockprotein90,HSP90),HSP90在植物生长发育、对非生物胁迫环境应答和抗病性反应中起着重要作用[13]。烟草HSP90与RAR1和TIR-NB-LRR蛋白互作,提高了植株对烟草花叶病毒(Tobacco mosaic virus,TMV)的抗性[14]。在小麦植株中过表达TaHsp90.2和TaHsp90.3基因,可显著提高其对条锈病的抗性[15]。RGSV侵染后诱导HSP90上调表达,KEGG通路分析显示其参与植物与病原物互作途径。RGSV侵染可诱导HSP90在水稻根中表达,HSP90可能在水稻对RGSV的抗病反应中起重要作用。蛋白点B48鉴定为病程相关类甜蛋白(thaumatin-likeprotein,TLP),该蛋白属于病程相关蛋白的PR5家族,病原物可诱导其表达,与植物的抗逆性有关。TLPs可参与多种植物病原真菌侵染之后的主动防御反应,如水稻纹枯病菌(Rhizocotoniasolani)侵染水稻可诱导TLPs基因表达,提高了水稻对该病原菌的抗性[16-17]。RGSV侵染诱导TLP基因表达上调,TLP可能参与了RGSV侵染后水稻的主动防御反应过程。
蛋白点B09鉴定为可能的依赖于RNA的RNA聚合酶4。植物RNA依赖的RNA聚合酶(RNA-dependantRNApolymerase,RDR)主要参与了与植物基因沉默相关的小RNA产生,通过基因沉默效应放大作用,以调节植物的生长发育、逆境应答以及对病毒的防御等生物学过程[18]。烟草NtRDR1和拟南芥AtRDR1受病毒感染的诱导而表达,并且基因的缺失影响着植物对病毒的防御能力[19-20]。RNA依赖性RNA聚合酶OsRDR6在水稻抵御条纹叶枯病毒的过程中发挥重要作用[21]。可能的依赖于RNA的RNA聚合酶4受RGSV的诱导表达上调,可能参与了水稻对RGSV的抗性反应。
蛋白点A75鉴定为苯丙氨酸解氨酶(Phenylalanineammonia-lyase,PAL)。PAL是植物苯丙氨酸类代谢过程中关键限速酶,其产物木质素、黄酮和酚类物质与抗病性相关[22-23]。植物激素水杨酸(SalicylicAcid,SA)是植物抗病反应的信号分子,PAL也是SA合成途径中的关键酶之一[24-25]。Tonnessen等[26]的研究表明OsPAL4参与水稻的防卫反应,在病原物的抗性反应中表达上调,缺失了OsPAL4基因的水稻突变体对水稻白叶枯病、稻瘟病和稻纹枯病感病性增强。RGSV可能通过干扰PAL的表达抑制植物的防御反应。
其他蛋白如假定蛋白OsI_11950和Os04g0670800等其功能未知。本研究在水稻草矮病株根系中鉴定出来的部分蛋白可能在水稻抗RGSV的抗性中起作用,其在根系发育异常以及RGSV与水稻互作中的作用还需进一步验证。
参考文献:
[1]周国辉, 张曙光, 邹寿发, 等. 水稻新病害南方水稻黑条矮缩病发生特点及危害趋势分析. 植物保护, 2010, 36(2): 144-146.
ZhouGH,ZhangSG,ZouSF,etal.OccurrenceanddamageanalysisofanewricedwarfdiseasecausedbySouthern rice black-streaked dwarf virus. Plant Prot, 2010, 36(2): 144-146. (inChinesewithEnglishabstract)
[2]周雪平, 濮祖芹, 方中达. 黄瓜花叶病毒(CMV)土壤非介体传播研究. 南京农业大学学报, 1994, 17(2): 39-42.
ZhouXP,PuZQ,FangZD.Non-vectoredsoiltransmissionofcucumbermosaicvirus. J Nanjing Agric Univ, 1994, 17(2): 39-42. (inChinesewithEnglishabstract)
[3]KeelingBL.Effectofsoybeanmosaicvirusonrootvolumeanddryweightofsoybeanplants. Crop Sci, 1982, 22(3): 629-630.
[4]陈德鑫, 王凤龙, 李多川, 等. 山东烟草病毒病发生特点及防治对策. 中国烟草科学, 2007, 28(1): 25-28.
ChenDX,WangFL,LiDC,etal.EpidemiccharacteristicsoftobaccovirusdiseaseandcontrolmeasuresinShandongProvince. Chin Tob Sic. 2007, 28(1):25-28. (inChinesewithEnglishabstract)
[5]王煜炜, 冯俊丽, 林若虹, 等. 病毒侵染对番茄根茎组织中miRNAs调控通路的影响. 北京: 中国科技论文在线[2012-02-23].http: //www.paper.edu.cn/releasepaper/content/201202-928.
WangYW,FengJL,LinRH,etal.TheinterferenceofmiRNAspathwayduringtomatorootandstemtissuesdevelopmentuponvirusinfections.Beijing:SciencepaperOnline[2012-02-23].http://www.paper.edu.cn/releasepaper/content/201202-928.
[6]林奇英, 谢联辉, 谢荔岩, 等. 中菲两种水稻病毒病的比较研究: Ⅱ.水稻草状矮化病的病原学//谢联辉. 水稻病毒:病理学与分子生物学. 福州: 福建科学技术出版社, 2001:176-180.
LinQY,XieLH,XieLY,etal.ComparativestudyontwokindsofricevirusdiseasebetweenChinaandPhilippines: Ⅱ.Pathogenofricegrassystuntvirusdisease//XieLH.RiceVirus:PathologyandMolecularBiology.Fuzhou:FujianScience&TechnologyPublishingHouse, 2001:176-180.
[7]丁新伦, 谢荔岩, 潘贤, 等. 水稻草状矮化病毒侵染下水稻根发育相关基因的表达分析. 中国农学通报, 2014, 30(36): 120-123.
DingXL,XieLY,PanX,etal.Transcriptionalanalysisoftherootdevelopmentrelatedgenesinhostrice(Oryza sativa)infectedwithRice grassy stunt virus. Chin Agric Sci Bull, 2014, 30(36):120-123. (inChinesewithEnglishabstract)
[8]CarpentierSC,WittersE,LaukensK,etal.Preparationofproteinextractsfromrecalcitrantplanttissues:Anevaluationofdifferentmethodsfortwo-dimensionalgelelectrophoresisanalysis. Proteomics, 2005, 5: 2497-2507.
[9]丁新伦, 谢荔岩, 吴祖建. 水稻草状矮化病毒侵染寄主水稻差异表达蛋白的鉴定和分析. 中国农业科学, 2014, 47(9):1725-1734.
DingXL,XieLY,WuZJ.Identificationandanalysisofdifferentiallyexpressedproteinsofhostrice(Oryza sativa)infectedwithRice grassy stunt virus. Sci Agric Sin, 2014, 47(9): 1725-1734. (inChinesewithEnglishabstract)
[10]ChomchanP,MirandaGJ,ShirakoY.Detectionofricegrassystunttenuivirusnonstructuralproteinsp2,p5andp6frominfectedriceplantsandfromviruliferousbrownplanthoppers. Arch Virol, 2002, 147(12): 2291-2300.
[11]KakutaniT,HayanoY,HayashiT,etal.Ambisensesegment4ofricestripevirus:Possibleevolutionaryrelationshipwithphlebovirusesanduukuviruses(Bunyaviridae). J Gen Virol, 1990, 71: 1427-1432.
[12]ZhuY,HayakawaT,ToriyamaS.CompletenucleotidesequenceofRNA4ofricestripevirusisolateTandcomparisonwithanotherisolateandwithmaizestripevirus. J Gen Virol, 1992, 73: 1309-1312.
[13]SangsterTA,QueitschC.TheHSP90chaperonecomplex,anemergingforceinplantdevelopmentandphenotypicplasticity. Curr Opin Plant Biol, 2005, 8: 86-92.
[14]LiuY,Burch-SmithT,SchiffM,etal.MolecularchaperoneHsp90associateswithresistanceproteinNanditssignalingproteinsSGT1andRar1tomodulateaninnateimmuneresponseinplants. J Biol Chem, 2004, 279: 2101-2108.
[15]WangGF,WeiXN,FanRC,etal.Molecularanalysisofcommonwheatgenesencodingthreetypesofcytosolicheatshockprotein90 (Hsp90):FunctionalinvolvementofcytosolicHsp90sinthecontrolofwheatseedlinggrowthanddiseaseresistance. New Phytol, 2011, 191(2): 418-431.
[16]VelazhahanR,ChencoleK,AnurathaCS,etal.Inductionofthaumatin-likeprotein(TLPs)inRhizoctoniasolani-infectedriceandcharacterizationoftwonewcDNAclones. Physiol Plantarum, 1998, 102: 21-28.
[17]FuD,TisseratNA,XiaoY,etal.OverexpressionofriceTLPD34enhancesdollar-spotresistanceintransgenicbentgrass. Plant Sci, 2005, 168(3): 671-680.
[18]QiX,BaoFS,XieZ.SmallRNAdeepsequencingrevealsroleforArabidopsis thalianaRNA-dependentRNApolymerasesinviralsiRNAbiogenesis. PLoS ONE, 2009, 4(3):e4971.
[19]XieZ,FanB,ChenC,etal.AnimportantroleofaninducibleRNA-dependentRNApolymeraseinplantantiviraldefense. PNAS, 2001, 98(11): 6516-6521.
[20]YuD,FanB,MacFarlaneSA,etal.AnalysisoftheinvolvementofaninducibleArabidopsisRNA-dependentRNApolymeraseinantiviraldefense. Mol Plant Microbe Interact, 2003, 16(3): 206-216.
[21]JiangL,QianD,ZhengH,etal.RNA-dependentRNApolymerase6ofrice(Oryza sativa)playsroleinhostdefenseagainstnegative-strandRNAvirus, Rice stripe virus. Virus Res, 2012, 163(2): 512-519.
[22]LaCameraS,GouzerhG,DhondtS,etal.Metabolicreprogramminginplantinnateimmunity:Thecontributionsofphenylpropanoidandoxylipinpathways. Immunol Rev, 2004, 198(1): 267-284.
[23]VogtT.Phenylpropanoidbiosynthesis. Mol Plant, 2010, 3(1): 2-20.
[24]GrunerK,GriebelT,NávarováH,etal.Reprogrammingofplantsduringsystemicacquiredresistance. Front Plant Sci, 2013, 4: 1-28.
[25]MalamyJ,CarrJP,KlessigDF,etal.Salicylicacid:Alikelyendogenoussignalintheresistanceresponseoftobaccotoviralinfection. Science, 2014, 80(250): 1002-1004.
[26]TonnessenBW,ManosalvaP,LangJM,etal.Ricephenylalanineammonia-lyasegeneOsPAL4isassociatedwithbroadspectrumdiseaseresistance. Plant Mol Biol, 2015, 87(3): 273-286.
收稿日期:2015-12-28; 修改稿收到日期: 2016-05-23。
基金项目:国家自然科学基金资助项目(31301640); 国家科技支撑计划资助项目(2012BAD19B03)。
中图分类号:S435.111.4; S511.034
文献标识码:A
文章编号:1001-7216(2016)04-0356-07
Identification of Differentially Expressed Proteins in Roots of Rice(Oryzasativa) Infected withRicegrassystuntvirus
DING Xin-lun, XIE Li-yan, ZHANG Jie, WU Zu-jian*
(KeyLaboratoryofPlantVirologyofFujianProvince/InstituteofPlantVirology,FujianAgricultureandForestryUniversity,Fuzhou350002,China;*Corresponding author, E-mail: wuzujian@126.com)
Abstract:In order to find the proteins related to root maldevelopment caused by Rice grassy stunt virus(RGSV), elucidate the mechanism of root maldevelopment and better understand the molecular basis of interaction between RGSV and host rice, 2D-DIGE coupled with MALDI-TOF-MS was used to screen and identify differentially expressed proteins between RGSV-infected and RGSV-uninfected rice roots. The acquired proteins were further analyzed using GoMiner programs and KEGG pathway database. The results showed that 56 protein spots (differential ratio>2) were differentially expressed, including 34 up-regulated and 22 down-regulated protein spots. Among them, 27 differentially expressed protein spots which belonged to 25 proteins were identified, and these proteins were mainly involved in 14 biological processes, 10 molecular functions and 12 KEGG pathways.
Key words:Rice grassy stunt virus; rice roots; differentially expressed proteins; 2D-DIGE; MALDI-TOF-MS
