水稻热耗散对逆境的响应
2016-08-09赵霞杨华伟刘然方陈婷婷奉保华张彩霞杨雪芹陶龙兴
赵霞 杨华伟 刘然方 陈婷婷 奉保华 张彩霞 杨雪芹 陶龙兴,*
(1自贡市农业科学研究所, 四川 自贡 643000;2中国水稻研究所 水稻生物学国家重点实验室, 杭州 310006;#共同第一作者;*通讯联系人,E-mail: taolongxing@caas.cn)
水稻热耗散对逆境的响应
赵霞1,2,#杨华伟1,#刘然方1陈婷婷2奉保华2张彩霞2杨雪芹2陶龙兴2,*
(1自贡市农业科学研究所, 四川 自贡 643000;2中国水稻研究所 水稻生物学国家重点实验室, 杭州 310006;#共同第一作者;*通讯联系人,E-mail:taolongxing@caas.cn)
ZHAOXia,YANGHuawei,LIURanfang,etal.Responsesofheatdissipationinricetostress.ChinJRiceSci, 2016, 30(4): 431-440.
赵霞, 杨华伟, 刘然方, 等. 水稻热耗散对逆境的响应. 中国水稻科学, 2016, 30(4): 431-440.
摘要:非光化学猝灭(NPQ)常用于评估以热能途径耗散的光能(热耗散),热耗散在维持光能转化平衡中起着重要作用,是水稻叶片重要的光防御机制。大量研究表明,热耗散的诱导受跨类囊体膜ΔpH、叶黄素循环和PsbS蛋白等的调控;NPQ与光保护效应不呈线性关系,只有在某些特定条件下,NPQ才可作为光保护效应的有效指标;在高温、低温、缺氮、干旱、盐胁迫等逆境下水稻NPQ显著增加,热耗散可能与水稻抗逆性密切相关。本文从热耗散的诱导和调控机制、NPQ与光保护效应以及水稻NPQ对环境因子(温度、氮营养、水分、盐)的响应等4个方面综述了水稻叶片热耗散的研究进展,并对水稻NPQ与抗逆性关系的研究作了展望。
关键词:水稻; 热耗散; 光合作用; 光保护; 逆境
植物叶片吸收的光能通过3个途径耗散:叶绿素荧光、光化学反应和热能。其中,光化学反应所占比例最大,其次为热能,叶绿素荧光最小。利用分配于3个途径的光能此消彼长的原理,测定叶绿素荧光的变化,反映光合系统的运行状态[1]。非光化学猝灭(NPQ)常用于估算以热能途径耗散的光能(热耗散)[2, 3]。20世纪60年代,Duysens等[4]通过测定叶片荧光变化揭示了光合系统的基本细节并提出第二种光猝灭状态“Q`”,其定义暗示了NPQ的本质。随后Wraight等[6]提出NPQ是非辐射的光能猝灭,并强调其光保护作用。到20世纪70年代,NPQ调控机制得到初步认识[7, 8]。有学者认为由于热耗散对光能的耗散,可减少分配于光化学反应的光能;因此在低光照下,热耗散是光能的浪费[9-12]。但大量研究认为,以热能的形式无害地耗散吸收的多余光能,在光能转化与利用平衡关系中发挥着重要作用,是植物不可或缺的光防御机制[13-16]。
水稻是C3作物,在高光照和高温环境下生长,对光能的 利用率较低。夏季正午的强光环境,水稻叶片光过饱和现象明显,光呼吸显著高于C4作物,导致净光合速率的降低,光能利用率低,并且伴随着激发能在叶片中大量积累,活性氧的大量生成,光抑制现象明显。较强的热耗散能力可以促进过剩光能以热能形式耗散,降低光合系统内激发能压力,减少活性氧的产生和光抑制的发生频率,是重要的光合防御机制之一[15,16],近年关于水稻叶片热耗散及其检测指标NPQ的研究日益增加[17]。在研究热耗散调控机制的同时,较多学者探索水稻热耗散对温度、水分、氮素等逆境的响应特征,并推测热耗散可能与水稻抗逆性密切相关[18, 19]。但目前关于水稻叶片热耗散的诱导机制及其对逆境响应特征的系统总结和概括很少。本文综述了热耗散的产生和调控机制以及对温度、氮素、水分和盐胁迫的响应,旨在深入理解热耗散在水稻生长过程中的作用,为水稻抗逆性育种和栽培生理研究提供理论参考。
1热耗散的产生及调控机制
根据NPQ的诱导和恢复时间将NPQ分成3种类型:快速诱导NPQ(qE);慢速诱导,特定环境下可长期存在的NPQ,也被称为光抑制猝灭(qI);以及诱导时间居于qE和qI的状态过渡NPQ(qT)。也有研究将NPQ分为诱导耗散和基础耗散[20, 21]。在光照约0~6min后NPQ达到最高值[22]。研究证实,碳同化相关酶的光激活过程相对较慢导致NPQ诱导过程的出现。高等植物热耗散发生在光合系统Ⅱ(PSⅡ)的捕光色素复合体(LHCⅡ)内,并非发生在PSII的光反应中心,LHCⅡ的构象变化是热耗散的结构基础[14]。从高光照下热耗散的诱导过程可以看出(图1),高光照首先诱导跨类囊体膜质子梯度△pH)形成,LHCⅡ质子化,紫黄素去环氧化向花药黄素、玉米黄素转化,玉米黄素与LHCⅡ结合,LHCⅡ与PSⅡ核心蛋白分离并在类囊体膜上聚合,LCHⅡ构象处于猝灭状态;PsbS蛋白增加类囊体膜的流动性,进一步促进LHCⅡ构象转换。LHCⅡ构象的改变,为激活态叶绿素a传递光能给类胡萝卜色素提供结构基础,实现热耗散[23]。随着切片技术和电子显微技术的发展,已观察到类囊体膜、LHCⅡ的构象变化[8, 14, 24-26]。
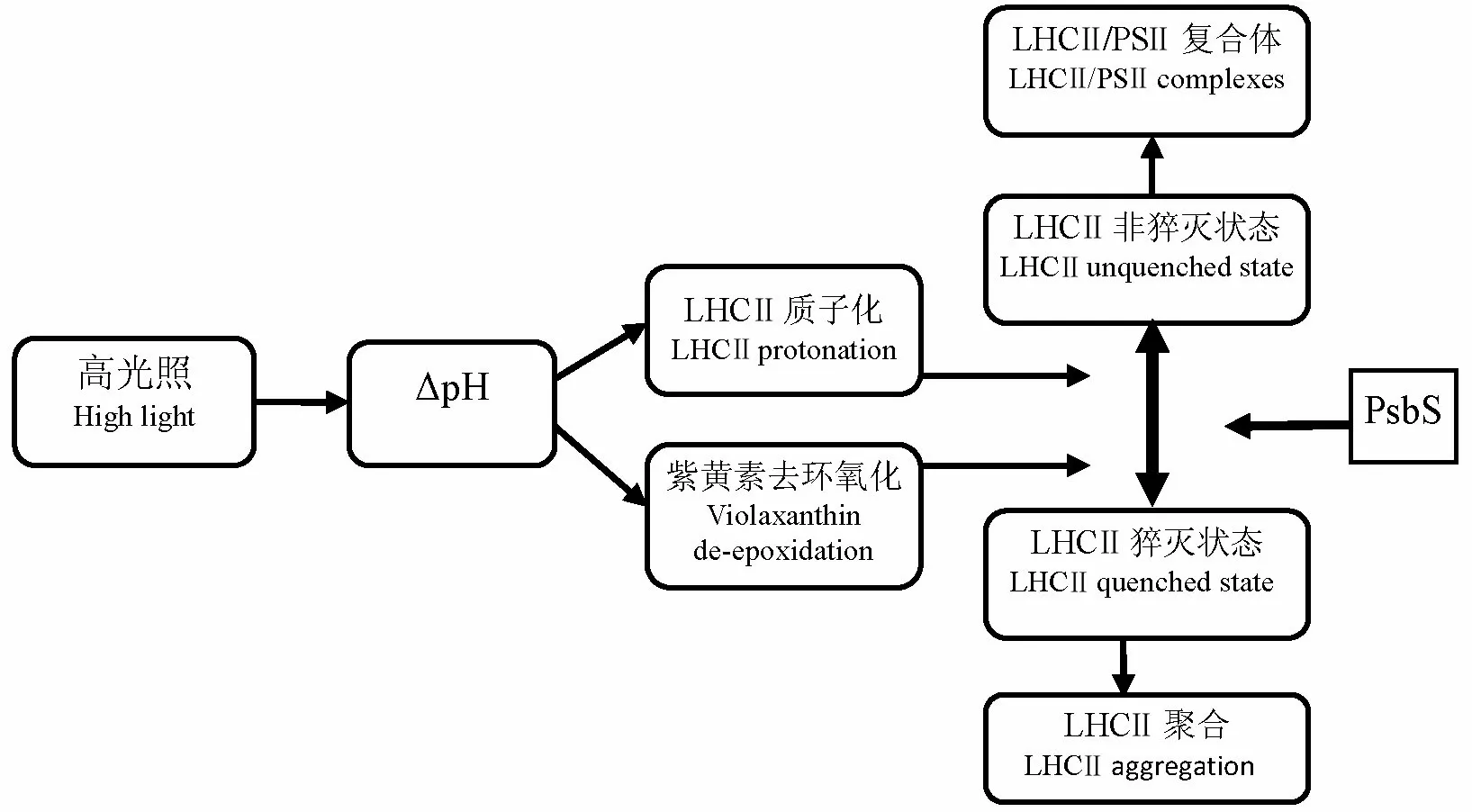
图1高光照下热耗散诱导(根据Horton[8]修改 )
Fig. 1.SchematicdiagramofNPQinductioninhighlightintensity(Hortonetal[8],withsomemodifications) .
综上可以看出,△pH是调控热耗散的关键因子。在光合作用电子传递过程中,质子通过细胞色素b6f复合体的作用转运至类囊体内腔,类囊体腔内质子积累,跨类囊体膜的质子梯度(△pH)形成。三磷酸腺苷(ATP)合成时,腔内质子排出;较高的跨类囊体膜电势梯度也会促进腔内质子的排出。当类囊体腔内质子的流入大于排出时,类囊体腔内酸化,pH值降低至5.8以下,紫黄素去环氧化酶激活,PsbS蛋白质子化,热耗散被诱导[28]。因此,类囊体内腔pH值的降低是热耗散诱导的初始生化信号,并通过此信号反馈调节光合作用的天线色素系统和电子传递。不仅叶片色素含量、线性电子传递速率、ATP酶活性可调控热耗散,影响跨类囊体膜电势梯度的生理代谢过程均可能参与热耗散调控,如ATP的积累、环式电子传递、光呼吸、Mg2+、K+、Cl-等离子的跨膜运输[27-32]。
叶黄素循环由紫黄素(V)、花药黄素(A)、玉米黄素(Z)共同组成,在热耗散诱导过程中也发挥着重要作用。紫黄素去环氧化酶催化紫黄素生成中间产物花药黄素,再进一步去环氧化转化为玉米黄素,玉米黄素在类囊体膜上积累,诱导NPQ的产生。NPQ下降时,玉米黄素环氧化酶催化玉米黄素生成花药黄素,再进一步转化为紫黄素。通常采用去环氧化状态[DES=(Z+0.5A)/( Z+A+V)]衡量三种叶黄素之间的转化情况[33]。花药黄素和玉米黄素分子结构上分别存在10个和11个共轭碳碳双键,而紫黄素只有9个共轭碳碳双键,玉米黄素和花药黄素在分子构型上处于较低的能态,具有从激发态叶绿素获得能量并以热能形式耗散的潜能[33-36]。紫黄素去环氧化酶抑制剂二硫苏糖醇(DTT)处理叶片,叶片NPQ、D1蛋白含量、最大量子产额(Fv/Fm)显著降低[37],而抗坏血酸(紫黄素去环氧化酶的辅酶)处理叶片,可显著增加叶黄素循环去环氧化和NPQ,有效缓解高温导致的Fv/Fm降低[38]。Quaas等[39]研究表明不同种类的藻,热耗散机制不同,莱茵衣藻等藻类的热耗散不依赖于叶黄素循环。Roach等[40]也得到相似的结果。近年研究发现类胡卜素,特别是叶黄素在热能耗散和光防御过程中发挥重要作用[41]。在蓝藻中鉴定出橙色类胡萝卜素蛋白,其光激活态是光强感应器和能量耗散器。其结构包括一个N端结构域和一个共价结合的类胡萝卜素。激活过程伴随着类胡萝卜素在蛋白内的转移和蛋白与色素的重构[42,43]。
2NPQ与光保护
植物经过漫长的演化过程,形成了多种光防御机制,如叶片、叶绿体的避光运动、热耗散,天线色素的可逆脱离,增强光合作用和光呼吸以加速能量代谢,加强活性氧的清除,加快修复循环等[49]。光呼吸是C3作物重要的光防御措施之一,但光呼吸加速碳水化合物的消耗,降低净光合速率。有研究表明增强光合作用以减少光能剩余也是一年生植物的一种光保护策略[50],但光合作用的增幅有限。在光过饱和情况下,热耗散的诱导不会降低净光合速率、相对光呼吸,发挥其保护效应的代价较小。在正午高温高光强环境下,热耗散发挥着重要的光保护作用,也是C3作物重要的光防御机制之一[51,52]。目前通常采用荧光参数NPQ对叶片热耗散水平进行估算,但近年有研究表明当叶绿体内存在非紧密连接PSⅡ反应中心的LHCⅡ时,荧光参数NPQ值偏大,将夸大热耗散的光保护效应[53]。NPQ与光保护效应不呈线性关系,只有在某些特定条件下,NPQ才可作为光保护效应的有效指标[54]。Ruban等[55]提出NPQ分为光保护必需NPQ(pNPQ)和非必需NPQ,pNPQ与通常测定的qE存在明显的差异,推荐使用pNPQ作为光保护的有效指标。Ware等[56]在NPQ研究中,应用了pNPQ。虽然NPQ在评估光保护效应时存在一定的争议,但目前依然是评价叶片热耗散能力水平的重要指标[13],更为有效的光保护效应指标还有待进一步的探索。
3水稻热耗散对逆境的响应
水稻生育期内环境不断变化,不仅只有高光照环境才能引起光能捕获过剩,其他环境因子也会影响能量转换和碳同化过程。当光破坏发生于受体侧时,由于CO2同化受阻,质体醌完全还原,稳定的还原型质体醌(QA-)很快积累,QA-的积累促进三线态P680(光合系统II)的形成,而三线态P680与O2作用形成单线态氧(1O2),1O2是强氧化剂,它会破坏附近的蛋白和色素分子[57-59]。自然条件下光抑制现象发生较少,但伴随干旱、低温等逆境时,光抑制现象明显。叶片热耗散的诱导可耗散逆境胁迫下不能有效利用的光能,降低PSⅡ内还原能压力,有效减少活性氧生成,缓解逆境下的光抑制[60](图2),同时NPQ也可作为一种信号减少LHCⅡ对光的吸收[61, 62]。夏季正午NPQ峰值的出现有利于缓解高温、水分亏缺、胞间CO2浓度低导致的光过饱和现象[51, 52]。在拟南芥、烟草等作物中也已证明增加叶片类胡萝卜素含量可显著增加NPQ,从而增加植株抗逆性[63, 64]。PsbS蛋白基因沉默的水稻植株,NPQ显著降低,PSⅡ内还原能压力(1-qP)显著增加,在光波动环境下,类囊体内超氧化物、单线态氧、过氧化氢等含量显著增加,水稻植株生长迟缓[65, 66]。
3.1NPQ对温度胁迫的响应
环境温度随着日变化和季节而波动,温度的波动对植物多种光合生理过程均有直接的影响,包括碳同化固定、还原,蔗糖合成,光合产物的运输与分配和两个光系统之间的电子传递。然而在0℃~50℃范围内,原初反应阶段的光能吸收、传递和两个光系统反应中心的电荷分离对温度变化不敏感[57]。低温下,ATP供应不足,1,5-二磷酸核酮糖(RuBP)再生限制与淀粉和蔗糖积累的反馈抑制,均可引起光能捕获和利用之间失衡,活性氧含量显著增加,导致光反应中心失活速度增加,光合相关酶活性降低,实际量子产额(ΦPSⅡ)、电子传递速率(ETR)、最大量子产额(Fv/Fm)以及光合作用均显著降低[67]。低温胁迫水稻NPQ显著增加,并随着胁迫时间的延长而增加,有效减少叶绿体活性氧的生成[68-70]。Bonnecarrère等[71]指出增加NPQ的诱导是抗低温粳稻品种对低温环境的适应策略之一。温度在35℃~45℃范围内,可引起水稻高温胁迫。高温胁迫影响放氧复合体和1,5-二磷酸核酮糖羧化酶/加氧酶(Rubisco)的活化酶[57]。Rubisco是一个热稳定性酶,高温下其活化水平显著降低,导致碳同化能力的降低。Yan等[35]研究指出超过35℃的高温显著增加水稻植株NPQ,叶黄素循环与热耗散在缓解高温引起的光抑制中起着重要的作用。
3.2NPQ与水稻氮营养
C3作物叶片75%~80%的氮以光合酶形式存在于叶绿体中,而Rubisco酶占叶片氮的12%~35%,占可溶性蛋白总量的一半左右,是叶片中氮的主要储存形式[72]。氮在光合生理中的分配影响着叶片光合作用、光合氮利用效率[73-75]。单位叶面积氮含量可以解释35%的水稻光合作用遗传多样性[76]。氮缺乏引起单位叶面积的叶绿素、Rubisco和光合电子传递组分含量急剧降低。光合碳还原循环酶含量减少是缺氮叶片光合能力降低的主要原因,卡尔文循环效率降幅大于光能转换过程。由于碳同化的限制,PSⅡ处于能量过饱和状态[57]。缺氮水稻对光抑制敏感性显著高于氮供应充足水稻[77],减少光能吸收和增加热耗散以缓解PSⅡ内还原能压力是水稻对缺氮的适应性响应[78, 79]。缺氮叶片类胡萝卜素与叶绿素的比例增加,有利于防治单线态氧的形成[15, 34, 57]。也有研究表明NPQ增加的部分为快速诱导NPQ(qE),缺氮对慢速诱导NPQ没有显著影响[80]。
随着施氮量增加,水稻单位叶面积叶绿素含量、类胡萝卜素含量、Rubisco酶含量均显著增加,但光合作用增加的幅度较小,甚至出现小幅降低的趋势[81]。关于施氮量对NPQ的影响及其在光合过程中的作用还缺少相关研究[82-84]。Li等[85]研究表明,相对于低氮处理,高氮处理水稻叶绿素和Rubisco酶含量显著增加,但Rubisco酶活性降低,羧化效率、光合作用上升幅度较小。随着施氮量的增加,水稻叶片对光能吸收显著增加,而碳同化不能协调增加,过剩光能在PSⅡ内积累。由此可推测热耗散的诱导有利于水稻对高氮环境的适应,可能在水稻氮肥耐性中发挥重要作用。Shrestha等[86]提出NPQ的诱导与水稻氮营养状态密切相关,反映叶黄素循环去环氧化状态的光化学反射指数(PRI)可作为水稻田间氮实时诊断的可靠指标。
3.3NPQ对干旱胁迫的响应
2017年11月25日,原国家新闻出版广电总局、教育部正式对国内外公布中国学术期刊网络出版官方平台,该出版传播平台的出版网站是中国知网。为了确保学术成果的首发权与快速传播,任何一篇投稿,一经编辑部录用和审定,无需确定其后在纸质刊物出版的时间和页码,通过电子杂志社审核,即可在《中国学术期刊(网络版)》也就是俗称的CAJ-N中以网络中英文首发方式面向全世界,目前已经有651种网络首发期刊。
水稻叶片相对含水量从92%降到79%时,光合作用的降低主要是由于气孔关闭,胞间CO2浓度降低,光呼吸增强;当叶片含水量降至79%以下时,叶肉导度、Rubisco酶羧化效率、RuBP再生能力的降低导致光合作用降低,严重干旱使水稻叶片卷曲,叶片叶绿素a、b和类胡萝卜素含量降低,光能截获也显著降低[30]。加强激发能的猝灭是植物适应长期干旱的重要生化机制之一。水分胁迫处理几天后非循环电子传递速率降低,而围绕PSⅠ的循环电子传递速率提高,热耗散(qE)成倍增加[15]。qE的增加与循环和非循环电子传递控制的质子流入类囊体的增加以及ATP酶控制的质子流出类囊体的减少有关[57]。热耗散关键调控因子叶黄素循环物质是抗旱关键激素脱落酸(ABA)合成的前体,合成玉米黄素的关键酶β-类胡萝卜素羟化酶基因(DSM2)的表达在水稻抗旱中起着关键作用[87]。但Pieters等[88]指出,干旱胁迫下水稻Araure4叶黄素循环物质库和去环氧化状态均显著高于旱稻Fonaiap2000,而Fv/Fm、ΦPSⅡ显著低于Fonaiap2000。干旱处理下两品种碳水化合物含量差异显著。这可能是由于葡萄糖、果糖在Araure4叶片中的积累对光合作用的反馈抑制作用造成的。虽然热耗散调控物质与抗旱激素ABA在同一代谢通路上,但水稻叶片热耗散的诱导对水稻抗旱性的贡献还需要进一步明确。
3.4NPQ对盐胁迫的响应
早期盐胁迫同干旱胁迫的症状相似,植株均表现出缺水的症状,随着盐胁迫时间的延长,表现出离子的毒害作用,细胞内Na+浓度超过100mmol/L,将抑制多种酶的活性[89]。盐胁迫水稻NPQ显著增加,较高的叶黄素循环物质有利于对盐胁迫快速响应[90]。喷施外源ABA显著增加水稻叶片内源ABA
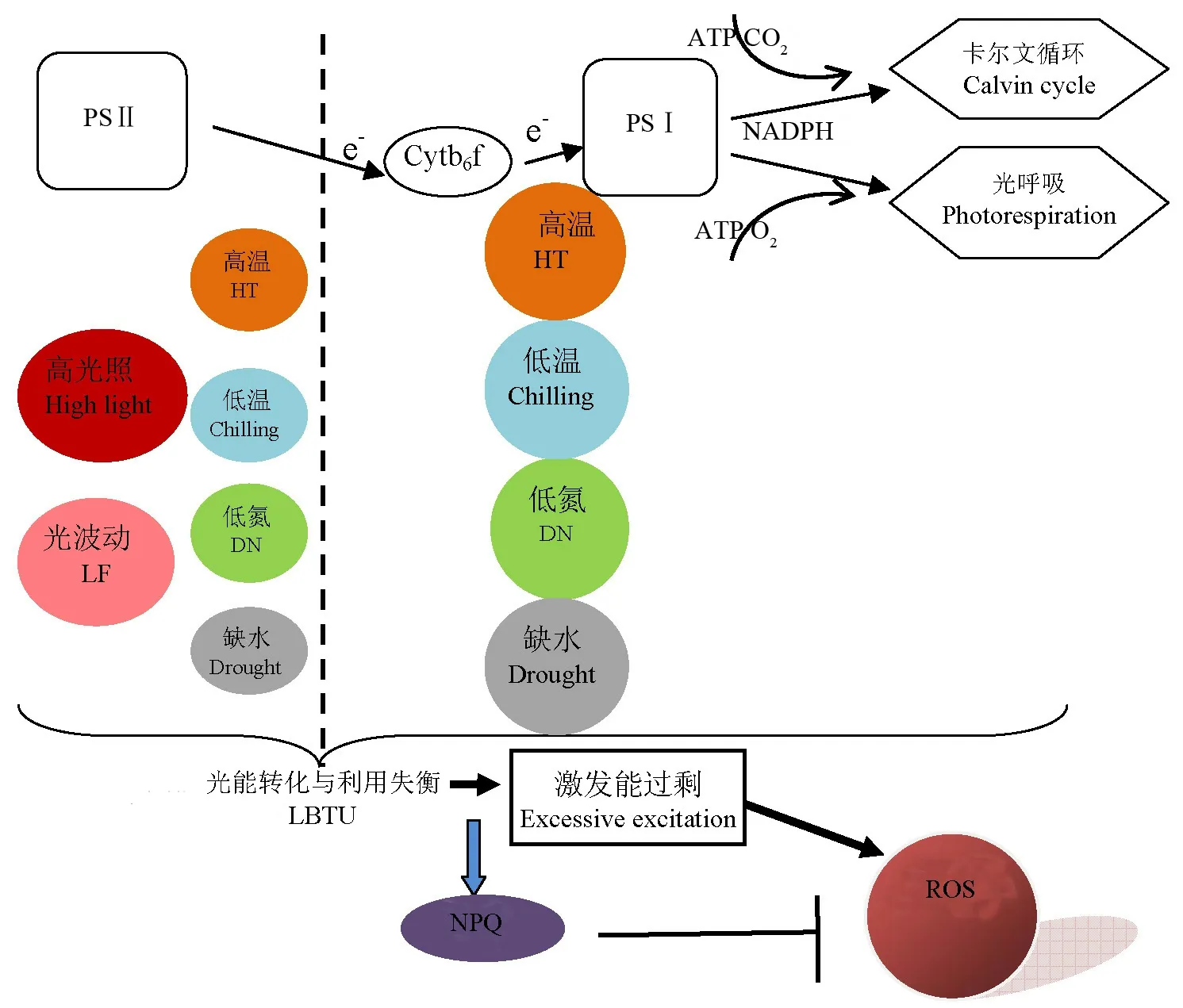
对于相同颜色的圆圈,其大小表示同一环境因子对相应光合生理过程的影响程度;“……”表示抑制作用。当低温等逆境胁迫对PSⅡ下游电子传递链以及碳同化、光呼吸的抑制作用大于对PSⅡ的光能转化时,光能转化与利用失衡,PSⅡ内还原能过剩,促进活性氧的生成。NPQ的诱导有利于耗散过剩激发能,抑制活性氧的生成。ROS-活性氧。
Thesizesofcirclesinthesamecolorsrepresenttheeffectofoneenvironmentalfactoroncorrespondingphotosyntheticprocess. "……"representsrepression.Whentheinfluenceofsuchstressaschillingonelectrontransportchain,carbonassimilationorphotorespirationexceedsthatontransformationoflightenergyinPSⅡ,theproductionofreactiveoxygenspeciesisstimulatedbyexcessivereducingpowerinPSⅡduetotheimbalancebetweentransformationandutilizationoflightenergy.ROS,Reactiveoxygenspecies.HT,Hightemperature.LF,Lightfluctuation.DN,Deficienceinnitrogen.LBTU,Imbalancebetweentransformationandutilizationoflightenergy.
图2环境因子对NPQ的诱导机制
Fig. 2.EffectofenvironmentalfactoronNPQinduction.
含量、叶黄素循环去环氧化和NPQ;光保护的增强可能是外源ABA提高水稻耐盐性的原因[91]。Fang等[92]筛选出的编码类胡萝卜素合成途径关键酶基因的水稻突变体,类胡萝卜素含量显著减少,叶片NPQ显著减小,活性氧显著增加,光抑制现象明显。但在Moradi等[90]的研究中,相对于盐敏感水稻品种,耐盐品种IR651和IR632未表现出NPQ优势,IR651和IR632的耐盐性与其还原性抗坏血酸含量较高有关。热耗散可能只是水稻耐盐适应机制之一,不同水稻品种的耐盐机制有所不同。
4研究展望
4.1水稻热耗散生物学过程和关键基因、代谢物的鉴定
近年在拟南芥、藻类等生物中发现存在多种热耗散机制,相关的主效基因也被克隆,关键调控物质的生理生化特性也阐述得较清楚。但在水稻上,还缺乏热耗散的机理性研究,如热耗散调控物质的挖掘及其合成、运输、功能发挥的研究,通过基因组学、转录组学等进一步发现热耗散调控的关键基因及其表达特点。
4.2热耗散与水稻抗逆性关系
综上所述,在高光照、低温、高温、干旱、缺氮等逆境下,水稻叶片NPQ显著增加,NPQ的增加有利于耗散过剩的激发能,减少活性氧的生成及光抑制的产生。但热耗散增加是否是水稻对逆境的适应性响应,热耗散的诱导速度及水平的高低与水稻抗逆性关系还需进一步研究与验证;评估热耗散保护效应的有效指标仍需探索,为从育种和栽培技术上增强水稻抗逆性提供新的思路。
4.3热耗散与水稻株型改良
前人关于改善水稻植株形态、群体结构的研究多关注于增加群体光能截获[89];从前面的论述可以看出,午间光能截获过剩,光抑制现象明显,尤其是上层叶片,光抑制的出现不利用水稻群体光合作用和生物量积累的提高[93,94]。因此,在改善植株形态及群体结构时,应考虑不同高度冠层的光照强度、叶片不同色素含量和比例、热耗散能力、叶片受光姿态与光抑制发生频率的关系。在将来的水稻株型改良中,能否将热耗散作为一个重要的参考指标,是需要进一步探讨的问题。
4.4潜在的热耗散调控措施
一般认为,热耗散是对逆境的一种被动反应,不利于植物光合作用;但越来越多的证据表明,热耗散是植物主动适应逆境的响应。植株如何主动调控热耗散增强植株的抗逆性?植物激素是否参与调控过程?这些都是值得我们进一步探讨的问题。ABA在水稻植株体内参与多种生理代谢,在水稻非生物胁迫中发挥着重要作用[95]。赤霉素(GA)是水稻生长促进激素,参与水稻节间伸长和种子萌发等多个生理过程[96],与ABA存在明显的交互作用[91, 97]。叶黄素循环物质是ABA合成的前体,GA和叶黄素循环合成前体均是牻牛儿焦磷酸(GGPP)[98, 99],因此ABA、GA合成与热耗散诱导密切相关[100, 101],探索ABA、GA对热耗散调控的机理可为从化控方面提高水稻抗逆性提供新的思路。
氮肥调控是水稻生产过程中常用的农艺措施之一,氮营养同时影响水稻叶片光能的吸收能力(叶绿素、类胡萝卜素含量)和利用能力(Rubisco酶含量及活性),研究NPQ对叶片氮浓度的响应,探索氮肥调控NPQ的可能性,对提高水稻光合作用、氮光合利用率以及抗逆性具有重要的意义。
参考文献:
[1]BakerNR.Chlorophyllfluorescence:Aprobeofphotosynthesisinvivo. Annu Rev Plant Biol, 2008,59:89-113.
[2]JiB,JiaoD.Photoinhibitionandphotooxidationinleavesofindicaandjaponicariceunderdifferenttemperaturesandlightintensities.Acta Bot Sin, 2000,43(7):714-720.
[3]MaxwellK,JohnsonGN.Chlorophyllfluorescence-apracticalguide.J Exp Bot, 2000, 51(345):659-668.
[4]DuysensL,SweersH.Mechanismoftwophotochemicalreactionsinalgaeasstudiedbymeansoffluorescence. Stud Microal Photosyn Bac, 1963:353-372.
[5]PapageorgiouG.Light-inducedchangesinthefluorescenceyieldofchlorophyllainvivo:Ⅰ.Anacystisnidulans. Biophys J, 1968, 8(11):1299-1315.
[6]WraightCA,CroftsAR.Energydependentquenchingofchlorophyllafluorescenceinisolatedchloroplasts. Eur J Biochem, 1970, 17(2):319-327.
[7]JohnsonG,YoungA,ScholesJ,etal.ThedissipationofexcessexcitationenergyinBritishplantspecies. Plant, Cell Environ, 1993, 16(6):673-679.
[8]HortonP.Developmentsinresearchonnon-photochemicalfluorescencequenching:Emergenceofkeyideas,theoriesandexperimentalapproaches.Non-PhotochemicalQuenchingandEnergyDissipationinPlants,AlgaeandCyanobacteria.Dordrecht,Springer, 2014:73-95.
[9]ZhuXG,OrtDR,WhitmarshJ,etal.TheslowreversibilityofphotosystemIIthermalenergydissipationontransferfromhightolowlightmaycauselargelossesincarbongainbycropcanopies:Atheoreticalanalysis. J Exp Bot, 2004, 55(400):1167-1175.
[10]LiY,RenB,GaoL,etal.Lesschlorophylldoesnotnecessarilyrestrainlightcaptureabilityandphotosynthesisinachlorophyll-deficientricemutant. J Agron Crop Sci, 2013, 199: 49-56.
[11]欧立军. 水稻叶色突变体的高光合特性. 作物学报, 2011, 37(10):1860-1867.
OuLJ.Highphotosyntheticefficiencyofleafcolourmutantofrice(Oryza sativaL.). Acta Bot Sin, 2011, 37(10):1860-1867(inChinesewithEnglishabstract).
[12]WangQ,ZhangQD,ZhuXG,etal.PSⅡphotochemistryandxanthophyllcycleintwosuperhigh-yieldricehybrids,LiangyoupeijiuandHua-an3duringphotoinhibitionandsubsequentrestoration. Acta Bot Sin, 2002, 44(11):1297-1302.
[13]LazárD.Parametersofphotosyntheticenergypartitioning. J Plant Physiol, 2015, 175:131-147.
[14]GossR,LepetitB.BiodiversityofNPQ. J Plant Physiol, 2015, 172(1):13-32.
[15]MoralesF,AbadíaJ,AbadíaA.Thermalenergydissipationinplantsunderunfavorablesoilconditions.Non-PhotochemicalQuenchingandEnergyDissipationinPlants,AlgaeandCyanobacteria.Dordrecht,Springer, 2014:605-630.
[16]Demmig-AdamsB,StewartJJ,AdamsWW.ChloroplastPhotoprotectionandtheTrade-OffBetweenAbioticandBioticDefense.Non-PhotochemicalQuenchingandEnergyDissipationinPlants,AlgaeandCyanobacteria.Dordrecht,Springer, 2014:631-643.
[17]王强. 超高产杂交稻(Oryza sativaL)光合作用和光抑制的研究. 北京:中国科学院, 2002.
WangQ.Photosynthesisandphotoinhibitionoftwosuperhigh-yieldricehybrids,LiangyoupeijiuandHua-an3.Beijing:ChineseAcademyofSciences, 2002. (inChinesewithEnglishabstract).
[18]KasajimaI,EbanaK,YamamotoT,etal.Moleculardistinctioningeneticregulationofnonphotochemicalquenchinginrice. PNAS, 2011, 108(33):13835-13840.
[19]FoyerCH,ShigeokaS.Understandingoxidativestressandantioxidantfunctionstoenhancephotosynthesis. Plant Physiol, 2011, 155(1):93-100.
[20]赵明, 姜雯, 丁在松, 等. 玉米和小麦在光合诱导期间非光化学猝灭(qN)差异. 作物学报, 2006, 31(12):1544-1551.
ZhaoM,JiangW,dingZS,etal.Differencesbetweenmaizeandwheatfornon-photochemicalquenching(qN)duringphotosyntheticinduction. Acta Bot Sin, 2006, 31(12):1544-1551. (inChinesewithEnglishabstract).
[21]IkeuchiM,UebayashiN,SatoF,etal.PhysiologicalfunctionsofPsbS-dependentandPsbS-independentNPQundernaturallyfluctuatinglightconditions. Plant Cell Physiol, 2014, 55(7):1286-1295.
[22]HubbartS,AjigboyeOO,HortonP,etal.ThephotoprotectiveproteinPsbSexertscontroloverCO2assimilationrateinfluctuatinglightinrice. Plant J, 2012, 71(3):402-412.
[23]RubanAV.Identificationofamechanismofphotoprotectiveenergydissipationinhigherplants. Nature, 2007, 450(7169):575-578.
[24]AndersonJM,HortonP,KimEH,etal.Towardselucidationofdynamicstructuralchangesofplantthylakoidarchitecture. Philosoph Trans Royal Soc B:Biol Sci, 2012, 367(1608):3515-3524.
[25]JohnsonMP,GoralTK,DuffyCD,etal.PhotoprotectiveenergydissipationinvolvesthereorganizationofphotosystemⅡlight-harvestingcomplexesinthegranamembranesofspinachchloroplasts. Plant Cell Online, 2011, 23(4):1468-1479.
[26]GoralTK,JohnsonMP,BrainAP,etal.Visualizingthemobilityanddistributionofchlorophyllproteinsinhigherplantthylakoidmembranes:Effectsofphotoinhibitionandproteinphosphorylation. Plant J, 2010, 62(6):948-959.
[27]JohnsonG,YoungA,HortonP.Activationofnon-photochemicalquenchinginthylakoidsandleaves. Planta, 1994, 194(4):550-556.
[28]KramerDM,CruzJA,KanazawaA.Balancingthecentralrolesofthethylakoidprotongradient. Trends Plant Sci, 2003, 8(1):27-32.
[29]VazJ,SharmaPK.Relationshipbetweenxanthophyllcycleandnon-photochemicalquenchinginrice(Oryza sativaL. )plantsinresponsetolightstress. Ind J Exp Biol, 2011, 49:60-67.
[30]ZhouY,LamHM,ZhangJ.Inhibitionofphotosynthesisandenergydissipationinducedbywaterandhighlightstressesinrice. J Exp Bot, 2007, 58(5):1207-1217.
[31]ThayerSS,BjörkmanO.LeafxanthophyllcontentandcompositioninsunandshadedeterminedbyHPLC. Photosyn Res, 1990, 23(3):331-343.
[32]MiyakeC,MiyataM,ShinzakiY,etal.CO2ResponseofcyclicelectronflowaroundPSI(CEF-PSI)intobaccoleaves—relativeelectronfluxesthroughPSⅠandPSⅡdeterminethemagnitudeofnon-photochemicalquenching(NPQ)ofchlfluorescence. Plant Cell Physiol, 2005, 46(4):629-637.
[33]Demmig-AdamsB,AdamsWW.Theroleofxanthophyllcyclecarotenoidsintheprotectionofphotosynthesis. Trends Plant Sci, 1996, 1(1):21-26.
[34]HortonP,RubanAV,YoungAJ.RegulationofthestructureandfunctionofthelightharvestingcomplexesofphotosystemIIbythexanthophyllcycle. Photochem Carot, 1999:271-291.
[35]ChenLS,ChengL.Bothxanthophyllcycle-dependentthermaldissipationandtheantioxidantsystemareup-regulatedingrape(Vitis labruscaL.cv.Concord)leavesinresponsetoNlimitation. J Exp Bot, 2003, 54(390):2165-2175.
[36]ChengL.Xanthophyllcyclepoolsizeandcompositioninrelationtothenitrogencontentofappleleaves. J Exp Bot, 2003, 54(381):385-393.
[37]JiB,JiaoD.RelationshipsbetweenD1protein,xanthophyllcycleandphotodamage-resistantcapacityinrice(Orysa sativaL. ). Chin Sci Bull, 2000, 45(17):1569-1575.
[38]YinY,LiS,LiaoW,etal.PhotosystemⅡphotochemistry,photoinhibition,andthexanthophyllcycleinheat-stressedriceleaves. J Plant Physiol, 2010, 167(12):959-966.
[39]QuaasT,BerteottiS,BallottariM,etal.Non-photochemicalquenchingandxanthophyllcycleactivitiesinsixgreenalgalspeciessuggestmechanisticdifferencesintheprocessofexcessenergydissipation. J Plant Physiol, 2015, 172:92-103.
[40]RoachT,MillerR,AignerS,etal.Diurnalchangesinthexanthophyllcyclepigmentsoffreshwateralgaecorrelatewiththeenvironmentalhydrogenperoxideconcentrationratherthannon-photochemicalquenching. Ann Bot, 2015, 116(4):519-527.
[41]JahnsP,HolzwarthAR.TheroleofthexanthophyllcycleandofluteininphotoprotectionofphotosystemII. Biochim Biophys. Acta (BBA)-Bioenergetics, 2012, 1817(1):182-193.
[42]LeverenzRL,SutterM,WilsonA,etal.A12 Åcarotenoidtranslocationinaphotoswitchassociatedwithcyanobacterialphotoprotection. Science, 2015, 348(6242):1463-1466.
[43]KirilovskyD.Modulatingenergyarrivingatphotochemicalreactioncenters:Orangecarotenoidprotein-relatedphotoprotectionandstatetransitions. Photosyn Res, 2015, 126(1):3-17.
[44]Demmig-AdamsB,AdamsWW.Photosynthesis:Harvestingsunlightsafely. Nature, 2000, 403(6768):371-374.
[45]LiXP,GilmoreAM,CaffarriS,etal.RegulationofphotosyntheticlightharvestinginvolvesintrathylakoidlumenpHsensingbythePsbSprotein. J Biol Chem, 2004, 279(22):22866-22874.
[46]BallottariM,TruongTB,DeRE,etal.IdentificationofpH-sensingsitesinthelightharvestingcomplexstress-related3proteinessentialfortriggeringnon-photochemicalquenchinginChlamydomonasreinhardtii. J Biol Chem, 2016:p.jbc.M115. 704601.
[47]BrooksMD,JanssonS,NiyogiKK,etal.PGRL1-mediatedcyclicelectronflowiscrucialforacclimationtoanoxiaandcomplementarytonon-photochemicalquenchingintressadaptation. Plant Physiol, 2014:p.pp. 114.240648.
[48]NaranjoB,MignéeC,KriegerLA,etal.ThechloroplastNADPHthioredoxinreductaseC,NTRC,controlsnon-photochemicalquenchingoflightenergyandphotosyntheticelectrontransportinArabidopsis. Plant, Cell Environ, 2015,p.pce. 12652.
[49]许大全. 植物光合机构的光破坏防御. 科学, 2002, 54(1):16-20.
XuDQ.Photoprotectionofplantphotosyntheticorganism. Science, 2002, 54(1):16-20(inChinesewithEnglishabstract).
[50]Demmig-AdamsB.Non-photochemicalfluorescencequenchingincontrastingplantspeciesandenvironments.Non-PhotochemicalQuenchingandEnergyDissipationinPlants,AlgaeandCyanobacteria.Dordrecht,Springer, 2014:520-550.
[51]LiuJY,QiuBS,LiuZL,etal.Diurnalphotosynthesisandphotoinhibitionofriceleaveswithchlorophyllfluorescence. Acta Bot Sin-English Ed, 2004, 46(5):552-559.
[52]IshidaS,UebayashiN,TazoeY,etal.DiurnalanddevelopmentalchangesinenergyallocationofabsorbedlightatPSⅡinfield-grownrice. Plant Cell Physiol, 2014, 55(1):171-182.
[53]WareMA,BelgioE,RubanAV.Photoprotectivecapacityofnon-photochemicalquenchinginplantsacclimatedtodifferentlightintensities. Photosyn Res. 2015, 126:261-274.
[54]LambrevPH,MiloslavinaY,JahnsP,etal.Ontherelationshipbetweennon-photochemicalquenchingandphotoprotectionofPhotosystemII. Biochim Biophy Acta, 2012, 1817:760-769.
[55]RubanAV,BelgioE.Therelationshipbetweenmaximumtoleratedlightintensityandphotoprotectiveenergydissipationinthephotosyntheticantenna:Chloroplastgainsandlosses. Philosoph Trans Royal Soc B:Biol Sci, 2014, 369(1640):13-22.
[56]WareMA,BelgioE,RubanAV.ComparisonoftheprotectiveeffectivenessofNPQinArabidopsisplantsdeficientinPsbSproteinandzeaxanthin. J Exp Bot, 2014:477-489.
[57]许大全. 光合作用学, 北京:科学出版社, 2013:191-199.
XuDQ.Thescienceofphotosynthesis.Beijing:SciencePress, 2013:191-199(inChinesewithEnglishabstract).
[58]PospíšilP.ProductionofreactiveoxygenspeciesbyphotosystemII. Biochim et Biophysica Acta (BBA)-Bioenergetics, 2009, 1787(10):1151-1160.
[59]MohammadAH,SoumenB,ArminSM,etal.Hydrogenperoxideprimingmodulatesabioticoxidativestresstolerance:InsightsfromROSdetoxificationandscavenging. Fron Plant Sci. 2015, 6:1-19.
[60]TakahashiS,BadgerMR.Photoprotectioninplants:AnewlightonphotosystemIIdamage. Trends Plant Sci, 2011, 16(1):53-60.
[61]RochaixJD.Regulationanddynamicsofthelight-harvestingsystem. Ann Rev Plant Biol, 2014, 65:287-309.
[62]HortonP,JohnsonMP,Perez-BuenoML,etal.Photosyntheticacclimation:Doesthedynamicstructureandmacro-organisationofphotosystemⅡinhigherplantgranamembranesregulatelightharvestingstates. FEBS J, 2008, 275(6):1069-1079.
[63]GiulianoG,TavazzaR,DirettoG,etal.Metabolicengineeringofcarotenoidbiosynthesisinplants. Trends Biotech, 2008, 26(3):139-145.
[64]DavisonP,HunterC,HortonP.Overexpressionofβ-carotenehydroxylaseenhancesstresstoleranceinArabidopsis. Nature, 2002, 418(6894):203-206.
[65]IshidaS,MoritaK,KishineM,etal.AllocationofabsorbedlightenergyinPSⅡtothermaldissipationsinthepresenceorabsenceofPsbSsubunitsofrice. Plant Cell Physiol, 2011, 52(10):1822-1831.
[66]ZulfugarovIS,TovuuA,EuYJ,etal.ProductionofsuperoxidefromPhotosystemIIinarice(Oryza sativaL. )mutantlackingPsbS. BMC Plant Biol, 2014, 14(1):242-253.
[67]XuCC,JeonYA,LeeCH.Relativecontributionsofphotochemicalandnon-photochemicalroutestoexcitationenergydissipationinriceandbarleyilluminatedatachillingtemperature. Physiol Plant, 1999, 107(4):447-453.
[68]WiseR.Chilling-enhancedphotooxidation:Theproduction,actionandstudyofreactiveoxygenspeciesproducedduringchillinginthelight. Photosyn Res, 1995, 45(2):79-97.
[69]ZhangY,ChenL,HeJ,etal.Characteristicsofchlorophyllfluorescenceandantioxidativesysteminsuper-hybridriceanditsparentalcultivarsunderchillingstress. Biol Plant, 2010, 54(1): 164-168.
[70]HirotsuN,MakinoA,UshioA,etal.Changesinthethermaldissipationandtheelectronflowinthewater-watercycleinricegrownunderconditionsofphysiologicallylowtemperature. Plant Cell Physiol, 2004, 45(5):635-644.
[71]BonnecarrèreV,BorsaniO,DíazP,etal.Responsetophotoxidativestressinducedbycoldinjaponicariceisgenotypedependent. Plant Sci, 2011, 180(5):726-732.
[72]WadaS,HayashidaY,IzumiM,etal.Autophagysupportsbiomassproductionandnitrogenuseefficiencyatthevegetativestageinrice. Plant Physiol, 2015, 168(1):60-73.
[73]GuJ,YinX,StomphTJ,etal.Canexploitingnaturalgeneticvariationinleafphotosynthesiscontributetoincreasingriceproductivity?Asimulationanalysis. Plant, Cell Environ, 2014, 37(1):22-34.
[74]XuGH,FanXR,MillerAJ.Plantnitrogenassimilationanduseefficiency. Ann Rev Plant Biol, 2012, 63:153-182.
[75]MakinoA,SatoT,NakanoH,etal.Leafphotosynthesis,plantgrowthandnitrogenallocationinriceunderdifferentirradiances. Planta, 1997, 203(3):390-398.
[76]KanemuraT,HommaK,OhsumiA,etal.Evaluationofgenotypicvariationinleafphotosyntheticrateanditsassociatedfactorsbyusingricediversityresearchsetofgermplasm. Photosyn Res, 2007, 94(1): 23-30.
[77]KumagaiE,ArakiT,KubotaF.Characteristicsofgasexchangeandchlorophyllfluorescenceduringsenescenceofflagleafindifferentrice(Oryza sativaL. )cultivarsgrownundernitrogen-deficientcondition. Plant Prod Sci, 2009, 12(3):285-292.
[78]HuangZA,JiangDA,YangY,etal.Effectsofnitrogendeficiencyongasexchange,chlorophyllfluorescence,andantioxidantenzymesinleavesofriceplants. Photosynthetica, 2004, 42(3):357-364.
[79]EvansJ,PoorterH.Photosyntheticacclimationofplantstogrowthirradiance:Therelativeimportanceofspecificleafareaandnitrogenpartitioninginmaximizingcarbongain. Plant, Cell Environ, 2001, 24(8):755-767.
[80]MakinoA,NakanoH,MaeT.Responsesofribulose-1, 5-bisphosphatecarboxylase,cytochromef,andsucrosesynthesisenzymesinriceleavestoleafnitrogenandtheirrelationshipstophotosynthesis. Plant Physiol, 1994, 105(1):173-179.
[81]EvansJR.PhotosynthesisandnitrogenrelationshipsinleavesofC3plants. Oecologia, 1989, 78(1):9-19.
[82]王仁雷, 华春, 魏锦城. 氮水平对水稻汕优64和金南风光合特性的影响. 中国水稻科学, 2002, 16(4):331-334.
WangRL,HuaC,WeiJC,etal.Effectofnitrogenlevelsonphotosyntheticcharacteristicsofricevariety(combination)Shanyou64andKinmaze. Chin J Rice Sci, 2002, 16(4):331-334. (inChinesewithEnglishabstract).
[83]李勇. 氮素营养对水稻光合作用与光合氮素利用率的影响机制研究. 南京:南京农业大学, 2013.
LiY.Studiesonmechanismsoftheeffectsofdifferentnitrogensuppliesonphotosynthesisandphotosyntheticnitrogenuseefficiencyofriceplants.Nanjing:NanjingAgriculturalUniversity. 2013.
[84]LongJ,MaG,WanY,etal.Effectsofnitrogenfertilizerlevelonchlorophyllfluorescencecharacteristicsinflagleafofsuperhybridriceatlategrowthstage. Rice Sci, 2013, 20(3):220-228.
[85]LiY,YangX,RenB,etal.Whynitrogenuseefficiencydecreasesunderhighnitrogensupplyinrice(Oryza sativaL. )seedlings. J Plant Growth Reg, 2012, 31(1):47-52.
[86]ShresthaS,BrueckH,AschF.Chlorophyllindex,photochemicalreflectanceindexandchlorophyllfluorescencemeasurementsofriceleavessuppliedwithdifferentNlevels. J Photochem Photobiol B:Biology, 2012, 113:7-13.
[87]DuH,WangN,CuiF,etal.Characterizationoftheβ-carotenehydroxylasegeneDSM2conferringdroughtandoxidativestressresistancebyincreasingxanthophyllsandabscisicacidsynthesisinrice. Plant Physiol, 2010, 154(3):1304-1318.
[88]PietersAJ,ElSoukiS.EffectsofdroughtduringgrainfillingonPSIIactivityinrice. J Plant Physiol, 2005, 162(8):903-911.
[89]ChavesM,FlexasJ,PinheiroC.Photosynthesisunderdroughtandsaltstress:Regulationmechanismsfromwholeplanttocell. Ann Bot, 2009, 103(4):551-560.
[90]MoradiF,IsmailAM.Responsesofphotosynthesis,chlorophyllfluorescenceandROS-scavengingsystemstosaltstressduringseedlingandreproductivestagesinrice. Ann Bot, 2007, 99(6):1161-1173.
[91]ZhuSQ,ChenMW,JiBH,etal.RolesofxanthophyllsandexogenousABAinprotectionagainstNaCl-inducedphotodamageinrice(Oryza sativaL)andcabbage(Brassica campestris). J Exp Bot, 2011, 62(13):4617-4625.
[92]FangJ,ChaiC,QianQ,etal.MutationsofgenesinsynthesisofthecarotenoidprecursorsofABAleadtopre-harvestsproutingandphoto-oxidationinrice. Plant J, 2008, 54(2):177-189.
[93]ErikH,MurchieYC,HubbartS,etal.InteractionsbetweenSenescenceandLeafOrientationDetermineinSituPatternsofPhotosynthesisandPhotoinhibitioninField-GrownRice. Plant Physiol, 1999:553-563.
[94]LongSP,AmyMC,ZhuXG.Meetingtheglobalfooddemandofthefuturebyengineeringcropphotosynthesisandyieldpotential. Cell, 2015, 161(1):56-66.
[95]PengS,KhushGS,VirkP,etal.Progressinideotypebreedingtoincreasericeyieldpotential. Field Crops Res, 2008, 108(1):32-38.
[96]YeN,JiaL,ZhangJ.ABAsignalinriceunderstressconditions. Rice, 2012, 5(1):1-9.
[97]PeterH,StephenGT.Gibberellinbiosynthesisanditsregulation. Biochem J, 2012, 444(1):11-25.
[98]HoffmannBS,KendeH.Theroleofabscisicacidandgibberellinintheregulationofgrowthinrice. Plant Physiol, 1992, 99(3):1156-1161.
[99]CheminantS,WildM,BouvierF,etal.DELLAsregulatechlorophyllandcarotenoidbiosynthesistopreventphotooxidativedamageduringseedlingdeetiolationinArabidopsis. Plant Cell Online, 2011, 23(5):1849-1860.
[100]QinG,GuH,MaL,etal.DisruptionofphytoenedesaturasegeneresultsinalbinoanddwarfphenotypesinArabidopsisbyimpairingchlorophyll,carotenoid,andgibberellinbiosynthesis. Cell Res, 2007, 17(5):471-482.
[101]DuanHK,YanZ,QiD,etal.ComparativestudyontheexpressionofgenesinvolvedincarotenoidandABAbiosyntheticpathwayinresponsetosaltstressintomato. J Integr Agric, 2012, 11(7):1093-1102.
收稿日期:2016-01-06; 修改稿收到日期: 2016-03-17。
基金项目:国家自然科学基金委员会与国际农业研究磋商组织合作研究项目(31561143003);国家自然科学基金资助项目(31501264、31101116、31201150);公益性行业(农业)科研专项(201203029,201203096);国家水稻产业体系项目(CARS-01-27);中央级公益性科研院所专项基金资助项目(2014RG004-4); 粮食丰产增效科技创新项目(2016YFD0300208)。
中图分类号:Q945.11; S511.01
文献标识码:A
文章编号:1001-7216(2016)04-0431-10
ResponsesofHeatDissipationinRicetoStress
ZHAOXia1,2,#,YANGHua-wei1,#,LIURan-fang1,CHENTing-ting2,FENGBao-hua2,ZHANGCai-xia2,YANGXue-qin2,TAOLong-xing2,*
(1ZigongInstituteofAgriculturalSciences,Zigong643000,China;2StateKeyLaboratoryofRiceBiology,ChinaNationalRiceResearchInstitute,Hangzhou310006,China;#Theseauthorscontributedequallytothiswork;*Correspondingauthor,E-mail:taolongxing@caas.cn)
Abstract:Non-photochemistry quenching (NPQ) has been used to estimate the level of heat dissipation,which is originally transformed from light energy. Heat dissipation plays a key role in maintaining the balance of light energy transformation, and it is the main mechanism of rice leaf to deal with excessive light energy. Numbers of previous studies have demonstrated that the induced process of heat dissipation is regulated by ΔpH across thylakoid membrane, xanthophyll cycle and PsbS protein, etc. The relationship between NPQ and photoprotection is not linear.NPQ only acts as an effective indicator of photoprotection in some specified situation. Heat dissipation is closely related with the stress resistance of rice in that NPQ level in rice leaf increases under stress conditions of heat, chilling, nitrogen deficiency and drought. This paper reviews the recent progress of heat dissipation, and mainly by summarizing the induction and regulation procedure of heat dissipation, the relationship of NPQ and photoprotection and the response of NPQ to environmental factors, such as temperature, nitrogen nutrition,water and salt. The research prospects on the relationship of NPQ and photoprotection of rice is also discussed.
Key words:rice; heat dissipation; photosynthesis; photoprotection; stress
