酪氨酸激酶抑制剂高剂量脉冲式给药克服非小细胞肺癌获得性耐药的体外观察研究
2016-08-09万宜涛潘跃银
万宜涛,袁 媛,潘跃银,张 颖
酪氨酸激酶抑制剂高剂量脉冲式给药克服非小细胞肺癌获得性耐药的体外观察研究
万宜涛1,袁 媛2,潘跃银3,张 颖1
目的 探讨吉非替尼高剂量脉冲式给药作用于非小细胞肺癌吉非替尼耐药细胞株PC9/GR的抗肿瘤效应及其可能机制。方法 MTT法检测吉非替尼对PC9/GR的增殖抑制率,计算半数抑制浓度(IC50),根据IC50值,分为吉非替尼常规剂量给药组和脉冲式剂量给药组,分别作用于PC9/ GR细胞株,荧光显微镜观察各处理组中细胞凋亡形态学变化,流式细胞术检测细胞凋亡率,Western blot法检测表皮生长因子受体(EGFR)相关信号通路蛋白如p-EGFR、EGFR、磷酸化的丝氨酸/苏氨酸蛋白激酶(p-AKT)、AKT、磷酸化的细胞外调节蛋白激酶(p-ERK)、ERK表达水平。结果 与对照组比较,高剂量脉冲式给药组细胞凋亡率明显增加(P<0.01),同时可明显下调p-EGFR、p-ERK、p-AKT蛋白表达(P <0.05)。结论 吉非替尼高剂量脉冲式给药在一定程度上可以显著抑制PC9/GR细胞增殖,促进细胞凋亡,机制可能与阻断EGFR信号通路传导有关。
非小细胞肺癌;获得性耐药;吉非替尼
网络出版时间:2016-3-8 8:29:01 网络出版地址:http://www.cnki.net/kcms/detail/34.1065.R.20160308.0829.026.htm l
据2014年我国肿瘤统计数据可知,肺癌发病率、死亡率分别为46.08/10万,37/10万,在肿瘤中排名第一[1]。其中约80%为非小细胞肺癌(nonsmall cell lung cancer,NSCLC)。表皮生长因子受体(epidermal growth factor receptor,EGFR)阳性突变率占NSCLC患者50%以上,为研究重点及热点[2]。EGFR酪氨酸激酶抑制剂(EGFR tryosine kinase inhibitors,EGFR-TKIs)对晚期NSCLC患者疗效已被证实[3-4],但耐药问题几乎不可避免[5]。在初始对吉非替尼敏感的患者,再次出现疾病进展后,予以TKIs高剂量脉冲式给药在一定程度上可延缓疾病发展,同时对剂量增加伴随的不良反应可很好地耐受[6]。而减少吉非替尼剂量可能导致EGFR突变阳性者耐药规律的提前出现[7]。但相关作用机制尚未见报道。该研究以吉非替尼耐药细胞株PC9/GR为研究对象,观察吉非替尼不同给药方式对其的增殖凋亡及相关EGFR信号通路变化情况,初步探讨可能作用机制,为临床治疗提供理论依据。
1 材料与方法
1.1 材料 人NSCLC PC9/GR为广东省肺癌研究所惠赠;吉非替尼为英国Astra Zeneca公司惠赠,用DMSO溶液稀释为母液(终溶度为10 mmol/L),在-80℃冰箱冻存,待实验时再稀释至目标溶度,DMSO的终溶度小于0.1%;胎牛血清、高糖DMEM培养基购自美国Hyclone公司;青霉素、链霉素购自哈药集团;MTT粉、DMSO购自美国Sigma公司;AnnexinⅤ-FITC/PI细胞凋亡检测试剂盒购自上海贝博公司;p-EGFR、EGFR、磷酸化的丝氨酸/苏氨酸蛋白激酶(phosphorylated serine/threonine kinase,p-AKT)、AKT、磷酸化的细胞外调节蛋白激酶(phosphorylated extracellular regulated protein kinases,p-ERK)、ERK抗体购自美国Cell Signal Technology公司;β-actin及二抗购自北京中杉金桥生物技术有限公司;化学发光剂购自美国Millipore公司。
1.2 细胞培养 PC9/GR细胞用含10%胎牛血清、含1%双抗(100 U/m l青霉素和100μg/ml链霉素)的高糖DMEM培养液,置于37℃、5%CO2的培养箱中培养,1~2 d换液、胰蛋白酶消化传代,倒置显微镜下观察细胞,取对数生长期的细胞进行实验。
1.3 M TT法检测吉非替尼对PC9/GR细胞增殖的影响 取对数生长期的PC9/GR细胞,以5×104个/m l,每孔各100μl,接种于96孔板中。细胞培养24 h细胞贴壁后,实验组加入吉非替尼(0.390、0.780、1.560、3.125、6.250、12.500、25.000、50.000μmol/L)。对照组加入培养基。72 h后,加入20μl MTT(终质量浓度为5 mg/m l),继续培养4 h,当肉眼见蓝紫色结晶后,加入150μl/孔DMSO,振荡10 min,溶解结晶,在酶联免疫检测仪上检测各孔在490 nm波长处的吸光度(optical density,OD)值,计算细胞增殖抑制率。计算吉非替尼对PC9/GR的半数抑制浓度(half inhibitoryconcentration,IC50)值;每孔设置6个复孔,实验重复至少3次。
1.4 Annexin V-FITC荧光染色观察细胞凋亡形态的变化 取对数生长期的PC9/GR细胞,以1×10接种于6孔板,每孔2 ml。根据IC50值给予不同药物溶度,具体实验为对照组(仅含细胞和培养液,不含药物)、常规IC50药物溶度组、2倍IC50药物溶度脉冲给药组、4倍IC50药物溶度高剂量脉冲给药组。经药物处理后,去上清液,PBS洗涤细胞,按照说明书加入预混试剂,覆盖6孔板的底面,室温下避光反应10 min,在荧光显微镜下观察及拍照。实验至少重复3次。
1.5 流式细胞术检测PC9/GR细胞的凋亡率变化
取对数生长期 PC9/GR细胞,1×105密度接种于6孔板,每孔2 ml。实验分组如上所述。待药物处理后,收集胰酶消化后的细胞,PBS洗涤2次,1 600 r/min离心5min收集细胞,加入10μl Annexin V和5μl PI做标记,震荡混匀后,室温避光孵育15 min,PBS洗2遍后,加400μl Binding buffer悬浮细胞,混匀,流式细胞术检测PC9/GR细胞的凋亡率。实验至少重复3次。
1.6 Western blot法检测EGFR信号通路相关蛋白表达 取对数生长期的PC9/GR细胞,接种于100 mm2的培养皿中;实验分组如上。收集处理后的PC9/GR细胞,PBS洗涤细胞3次,细胞裂解液提取细胞蛋白,根据BCA法确定蛋白质浓度。取50 μg/孔蛋白样品上样,予10%SDS-PDGE电泳分离,电泳后将蛋白质转至PDVF膜,经5%脱脂奶粉室温封闭约1~2 h后,加入一抗(1∶1 000)和β-actin抗体,4℃过夜。TBST洗膜3遍后,加入1∶5 000稀释的二抗,室温反应1 h,TBST再次洗膜3次,每次10 min后,加入ECL,暗室中显影、定影。实验至少重复3次。
1.7 统计学处理 采用SPSS 16.0软件进行分析,计量数据以±s表示。多组间均数的比较采用单因素方差分析。各实验重复3次。
2 结果
2.1 吉非替尼对PC9/GR细胞的增殖抑制作用吉非替尼对PC9/GR细胞的增殖有抑制作用,根据MTT结果,生长抑制-药物溶度呈剂量依赖性生长抑制。吉非替尼作用于PC9/GR 72 h后的IC50值是(5.44±0.91)μmol/L,与对照组比较,差异有统计学意义(F=270,P<0.01)。以后实验分组依据IC50值分为对照组(仅含细胞和培养液,不含药物)、常规IC50药物溶度组、2倍IC50药物溶度脉冲给药组、4倍IC50药物溶度高剂量脉冲给药组,即对照组、5、10、20μmol/L组。见图1。
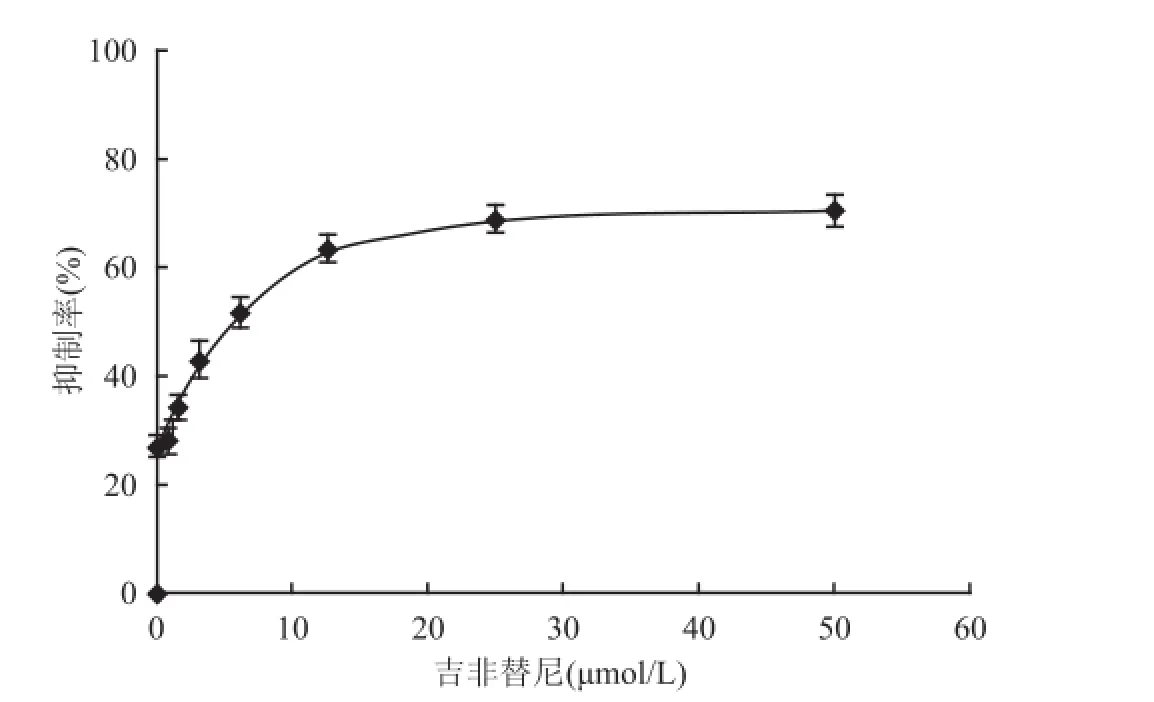

图1 MTT法检测吉非替尼对 PC9/GR细胞增殖抑制率
2.2 荧光显微镜下观察吉非替尼处理后PC9/GR细胞凋亡形态的变化 荧光显微镜下观察显示,与对照组比较,5μmol/L和10μmol/L组可见绿色荧光(早期凋亡细胞)增多,而20μmol/L组,细胞核或细胞质中可见红色荧光(晚期凋亡细胞),同时细胞形态较其他处理组明显不规则。见图2。
2.3 流式细胞术检测PC9/GR细胞的凋亡率变化
据检测结果显示,PC9/GR中,对照组、5μmol/L组、10μmol/L组、20μmol/L组凋亡率分别是(2.24 ±1.71)%、(5.39±1.18)%、(7.44±2.03)%、(22.4±1.46)%。与对照组比较,差异有统计学意义(F=90.90,P<0.05)。实验结果显示20μmol/L组凋亡率明显强于其他组,因此,推测高剂量脉冲给药可能增强细胞促凋亡作用。见图3。
2.4 W estern b lot法检测EGFR信号通路相关蛋白的表达 在耐药细胞株PC9/GR细胞中,与对照组比较,20μmol/L组较5μmol/L及10μmol/L组,p-EGFR、p-AKT、p-ERK蛋白水平明显下降,差异有统计学意义(F=579.30、52.04、104.50,P<0.05)。各处理组细胞中,EGFR、AKT、ERK的表达水平差异无统计学意义(F=0.230、3.377、3.648)。见图4。

图2 Annexin V-FITC荧光染色观察不同剂量吉非替尼处理组中PC9/GR细胞凋亡形态的变化 ×400A:对照组;B:5μmol/L组;C:10μmol/L组;D:20μmol/L组
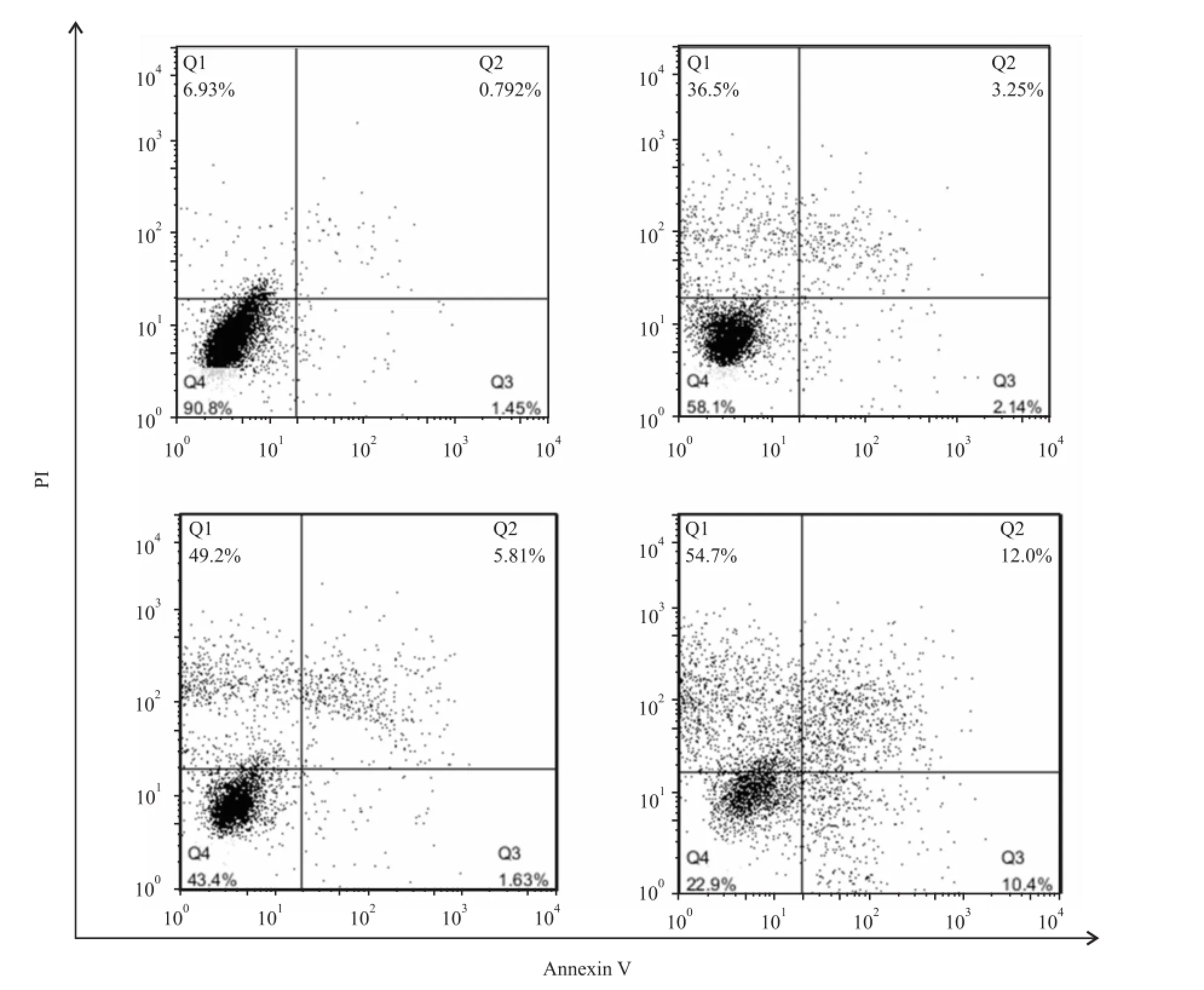
图3 流式细胞术检测不同剂量吉非替尼对PC9/GR细胞凋亡率的影响A:对照组;B:5μmol/L组;C:10μmol/L组;D:20μmol/L组
3 讨论
据美国肺癌联盟报道,超过60%的NSCLC患者体内,检测到驱动基因的存在,且驱动基因间存在互排[8]。由公布的最新中国NSCLC患者驱动基因谱可知,EGFR的突变仍是中国肺腺癌最常见的驱动基因。因此,阻断EGFR信号通路被认为是治疗NSCLC的关键所在。
吉非替尼为阻断EGFR信号通路的经典药物。2003年被美国食品药品局批准临床用于治疗晚期NSCLC患者。其通过与ATP竞争EGFR催化区域上的结合位点,阻止EGFR靶点激活,进一步阻断下游诸如MEK/ERK、PI3K/AKT等信号传导,促进细胞凋亡,抑制细胞增殖[9]。但不幸的是,初始敏感的NSCLC患者均易复发及转移。
近年来,Grommes et al[10]发现在9例EGFR-TKIs治疗失败的肺癌脑转移患者中,给予厄洛替尼脉冲式给药1 500 mg/周,有6例患者获得部分缓解,1例获得稳定,另有2例出现疾病进展,推测脉冲治疗的疗效与EGFR基因突变类型相关。研究[11]显示,在对吉非替尼耐药后,部分患者换用厄洛替尼仍可获益。因此推断EGFR突变患者在对EGFR-TKIs耐药后,仍然存在对EGFR-TKIs敏感细胞,依赖EGFR信号通路,但因为耐TKIs细胞增加,原有剂量的 TKIs剂量不足以抑制 EGFR信号转导活性。可以利用脉冲式给药,即通过在短时间内大剂量给药,在疾病发生过程中迅速达到有效的更高的血药溶度来再次抑制酪氨酸激酶活性,阻断EGFR信号通路,在一定程度上克服EGFR-TKIs耐药。
研究[12]表明EGFR在许多恶性肿瘤中存在异常表达或过度表达,其作为上皮生长因子信号转导受体,参与多种肿瘤细胞的侵袭转移、血管生成、细胞增殖及细胞凋亡。EGFR信号通路激活可以进一步促进下游信号通路PI3K-AKT、RAS-RAF-MEKERK等[13]。由文献[14]可知AKT通过调节细胞周期依赖性蛋白激酶诱导细胞DNA合成;通过抑制Caspase及影响BCL-2家族等诱导细胞凋亡。同时ERK信号的激活可通过级联反应放大信号作用于核转录因子如NF-кB等调控基因表达,促进细胞增殖[15]。故只有同时阻断PI3K-AKT、MEK-ERK信号通路才能克服耐药。

图4 W estern blot法检测不同剂量吉非替尼对PC9/GR细胞EGFR信号通路的影响A:对照组;B:5μmol/L组;C:10μmol/L组;D:20μmol/L组
本研究显示在肺癌耐药细胞株PC9/GR 20 μmol/L组中p-EGFR、p-AKT、p-ERK蛋白表达水平较5μmol/L组和10μmol/L组明显下调。推断提高药物的有效血药溶度可能进一步增加吉非替尼与EGFR突变位点的靶向结合,增加对ATP与EGFR结合位点的抑制性,阻断EGFR信号通路,从而抑制其下游信号通路PI3K-AKT、RAS-RAF-MEK-ERK等。而5μmol/L组和10μmol/L组效果不佳,可能是由于目前的血药溶度不足以抑制EGFR信号通路的转导。此外在细胞凋亡的形态学观察和流式细胞术检测结果中也佐证,高剂量脉冲式给药模式有明显的促进细胞凋亡的作用。
本研究结果显示吉非替尼高剂量脉冲式给药可以克服EGFR-TKIs继发性耐药,其机制可能与阻断EGFR信号通路有关,从而进一步下调PI3K-AKT、RAS-RAF-MEK-ERK等信号通路,为临床高剂量脉冲式治疗NSCLC患者提供实验依据。但由于本实验为体外研究,因此临床应用具体剂量、应用人群尚需进一步探索。
[1] Chen W,Zheng R,Zhang S,et al.Annual report on status of cancer in China,2010[J].Chin JCancer Res,2014,26(1):48 -58.
[2] Leighl N B,Rekhtman N,Biermann W A,et al.Molecular testing for selection of patients with lung cancer for epidermal growth factor receptor and anaplastic lymphoma kinase tyrosine kinase inhibitors:American society of clinical oncology endorsement of the college of American pathologists/international association for the study of lung cancer/association for molecular pathology guideline [J].JClin Oncol,2014,32(32):3673-9.
[3] Yoshimura N,Kudoh S,Mitsuoka S,et al.Phase II study of a combination regimen of gefitinib and pemetrexed as first-line treatment in patients with advanced non-small cell lung cancer harboring a sensitive EGFRmutation[J].Lung Cancer,2015,90(1):65-70.
[4] Zhou C,Wu Y L,Chen G,etal.Final overall survival results from a randomised,phase IIIstudy of erlotinib versus chemotherapy as first-linetreatment of EGFR mutation-positive advanced non-smallcell lung cancer(OPTIMAL,CTONG-0802)[J].Ann Oncol,2015,26(9):1877-83.
[5] Gower A,Wang Y,Giaccone G,et al.Oncogenic drivers,targetedtherapies,and acquired resistance in non-small-cell lung cancer [J].JMolMed(Berl),2014,92(7):697-707.
[6] Kuiper J L,Smit E F.High-dose,pulsatile erlotinib in two NSCLC patientswith leptomeningealmetastases-onewith a remarkable thoracic response as well[J].Lung Cancer,2013,80(1):102-5.
[7] Hayakawa H,Ichihara E,Ohashi K,et al.Lower gefitinib dose led to earlier resistance acquisition before emergence of T790M mutation in epidermal growth factor receptor-mutated lung cancer model[J].Cancer Sci,2013 104(11):1440-6.
[8] Sholl LM,Aisner D L,Varella-Garcia M,etal.Multi-institutional oncogenic driver mutation analysis in lung adenocarcinoma:the lung cancermutation consortium experience[J].JThorac Oncol,2015,10(5):768-77.
[9] Asami K,Atagi S.Epidermalgrowth factor receptor tyrosine kinase inhibitors for non-small cell lung cancer[J].World JClin Oncol,2014,5(4):646-59.
[10]Grommes C,Oxnard G R,Kris M G,et al.“Pulsatile”high-dose weekly erlotinib for CNSmetastases from EGFR mutant non-small cell lung cancer[J].Neuro Oncol,2011,13(12):1364-9.
[11]江 昊,周 涛,高亚杰,等.吉非替尼耐药后加量疗法对比更换厄洛替尼治疗晚期非小细胞肺癌的临床观察[J].肿瘤防治研究,2014,41(11):1223-6.
[12]倪琛琛,于 敏,张志红.EGFR与PI3K/AKT信号通路相关蛋白在非小细胞肺癌组织中的表达及其意义[J].安徽医科大学学报,2011,46(12):1264-6.
[13]JanmaatM L,Kruyt F A,Rodriguez JA,etal.Response to epidermal growth factor receptor inhibitors in non-small cell lung cancer cells:limited antiproliferative effects and absence of apoptosis associated with persistent activity of extracellular signal-regulated kinase or Akt kinase pathways[J].Clin Cancer Res,2003,9 (6):2316-26.
[14]Yip P Y.Phosphatidylinositol 3-kinase-AKT-mammalian target of rapamycin(PI3K-Akt-mTOR)signaling pathway in non-small cell lung cancer[J].Transl Lung Cancer Res,2015,4(2):165-76.
[15]Ciuffreda L,Incani U C,Steelman L S,et al.Signaling intermediates(MAPK and PI3K)as therapeutic targets in NSCLC[J].Curr Pharm Des,2014,20(24):3944-57.
H igh-dose pulsatile epidermal grow th factor receptors tryosine kinase inhibitor overcome the acquired resistance in non-small-cell lung cancer in vitro
Wan Yitao1,Yuan Yuan2,Pan Yueyin3,et al
(1Dept of CadresWard,The Third Affiliated Hospital of AnhuiMedical University,Hefei 230061;
2Central Laboratory of Binhu Hospital,Hefei 230061;
3Dept of Oncology,The First Affiliated Hospital of AnhuiMedical University,Hefei 230022)
Objective To study the antitumor activity of high-dose pulsatile gefitinib administration on non-small cell lung cancer PC9/GR cell and its potentialmechanisms.Methods The proliferation inhibitory effectof different concentrations ofgefitinib on PC9/GR cellswasmeasured with MTTassay and the value of IC50was calculated.According to IC50value,we divided the experiment into the routine gefitinib administration group and gefitinib high dose pulsatile administration group on PC9/GR cell.The cell apoptosismorphological change was detected by the fluorescentmicroscope.The flow cytometry was used to analyze the alteration of cell apoptosis rate.ERFR signal related protein such as p-EGFR,EGFR,p-AKT,AKT,p-ERK and ERK weremeasured using Western blot.Results Compared with the control group,the apoptosis rates weremarkedly increased when treated with high dose pulsatile gefitinib(P<0.01).Western blot results showed that,compared with the control group,gefitinib clearly decreased the expressions of p-EGFR,p-AKT,p-ERK when treated with high dose pulsatile gefitinib(P<0.05). Conclusion High-dose pulsatile gefitinib can significantly inhibit the cell proliferation and induce cell apoptosis. Themechanism of antitumor effectmay be due to themutual interference with the EGFR signaling pathway.
non-small cell lung;drug therapy;gefitinib
R 734.2
A
1000-1492(2016)04-0516-05
2015-12-21接收
安徽高校省级自然科学研究重点项目(编号:KJ2012A157);安徽省科技攻关项目(编号:1301042214);安徽省“十二五”临床重点专科建设项目(编号:03P55)
1安徽医科大学第三附属医院干部病房,合肥 230061
2合肥市滨湖医院中心实验室,合肥 230061
3安徽医科大学第一附属医院肿瘤科,合肥 230022
万宜涛,女,硕士研究生;
潘跃银,男,教授,主任医师,硕士生导师,责任作者,E-mail:yueyinpan1965@126.com;
张 颖,女,教授,主任医师,硕士生导师,责任作者,E-mail:zhangying19650108@163.com
