禽呼肠孤病毒σA和σNS蛋白激活PI3K/Akt信号通路的研究
2016-08-09谢丽基谢芝勋邓显文谢志勤罗思思黄娇玲曾婷婷
谢丽基,谢芝勋,黄 莉,邓显文,谢志勤,范 晴,罗思思,黄娇玲,曾婷婷
(广西壮族自治区兽医研究所 广西动物疫病病原生物学与诊断重点实验室,南宁 530001)
禽呼肠孤病毒σA和σNS蛋白激活PI3K/Akt信号通路的研究
谢丽基,谢芝勋*,黄莉,邓显文,谢志勤,范晴,罗思思,黄娇玲,曾婷婷
(广西壮族自治区兽医研究所 广西动物疫病病原生物学与诊断重点实验室,南宁 530001)
摘要:旨在探讨禽呼肠孤病毒(ARV)的σA和σNS蛋白是否是通过PXXP或YXXXM基序来激活PI3K/Akt信号通路的。作者采用重叠延伸PCR的方法,将σA和σNS基因的PXXP或YXXXM基序进行突变后构建了重组质粒,并在Vero细胞中进行了表达。通过流式细胞术和Western blot,检测转染后Vero细胞磷酸化Akt(P-Akt)的表达量,并与野生型σA和σNS蛋白激活的P-Akt表达量进行比较。结果显示,σA和σNS基因均得到了表达,σA基因的110—114和114—117位的PXXP基序突变后,Vero 细胞P-Akt 的表达量明显下降。可见,ARV的σA蛋白,是通过PXXP基序来激活PI3K/Akt信号通路的。本研究从细胞信号转导角度揭示了ARV与宿主相互作用的机制,也为寻找抗ARV药物作用靶标提供了新的思路。
关键词:禽呼肠孤病毒;PI3K/Akt信号通路;σA蛋白;PXXP基序
禽呼肠孤病毒(avian reovirus,ARV)主要引起鸡出现跛行、免疫抑制和总体生产性能下降(增重减少、饲料转化率低),严重降低鸡的经济价值,成为危害养鸡业健康发展的重要传染病之一[1-3]。P.Y.Lin等[4]使用ARV感染Vero细胞后,通过Western blot检测磷酸化Akt(P-Akt)的表达量,从病毒的角度证实了ARV感染的早期激活了PI3K/Akt信号通路,但并未找到是ARV的哪个蛋白质激活PI3K/Akt信号通路。本课题组的前期研究工作发现,在Vero细胞中表达ARV的σA蛋白和σNS蛋白后,激活了PI3K/Akt信号通路[5],从病毒蛋白质的角度证实了ARV激活了PI3K/Akt信号通路。
PI3K/Akt信号通路可调节多种细胞功能,如细胞增殖和分化、抑制细胞凋亡等,病毒感染通常会干扰这个信号通路[6]。研究表明,病毒蛋白和细胞蛋白等通过PXXP或YXXXM/YXXM基序,与PI3K的P85调节亚基结合,从而激活PI3K/Akt信号通路,使P-Akt的表达量升高,实现抑制细胞凋亡的发生[7-10]。
分析ARV的σA蛋白和σNS蛋白的氨基酸序列发现,这两种蛋白质存在PXXP和YXXXM基序,均没有YXXM基序。目前还不清楚ARV的σA蛋白和σNS蛋白是否也是通过PXXP和YXXXM基序来激活PI3K/Akt信号通路,使P-Akt表达量升高,实现抑制细胞凋亡的发生。因此作者通过重叠延伸PCR的方法,将σA和σNS基因的PXXP或YXXXM基序进行突变并构建重组质粒,在Vero细胞中分别表达σA和σNS蛋白的野生型和突变型后,通过流式细胞术和Western blot检测P-Akt的表达量,分析P-Akt表达量的差异,旨在探讨σA和σNS蛋白是否是通过PXXP或YXXXM基序来激活PI3K/Akt信号通路,从细胞信号转导角度揭示ARV的致病机制,为寻找抗ARV药物作用靶标提供了新的思路。
1材料与方法
1.1材料
1.1.1毒株、质粒和细胞禽呼肠孤病毒S1133标准强毒株(ARV-S1133)购自中国兽医药品监察所;真核表达载体pcAGEN由美国南达科他州大学Xiuqing Wang 教授惠赠;σA-pcAGEN、σNS-pcAGEN和Vero细胞由本实验室保存。
1.1.2试剂及仪器PCR Mix、pMD18-T载体、限制性内切酶(XhoⅠ与NotⅠ)和T4连接酶购自宝生物工程 (大连) 有限公司;胶回收试剂盒、无内毒素质粒大量提取试剂盒购自北京TransGen Biotech公司;Lipofectamin3000购自Invitrogen公司;Alexa fluor 488标记的羊抗鸡IgY、Alexa fluor 488标记的羊抗兔IgG、HRP标记的羊抗鸡IgY 和 HRP标记的羊抗兔IgG购自Abcam公司;β-actin 兔单克隆抗体、Akt兔单克隆抗体和Phospho-Akt 兔单克隆抗体购自CST公司;DMEM培养基购自GIBCO公司;胎牛血清购自Hyclone公司;Cytofix固定/破膜试剂盒购自BD公司;ARV阳性血清由本实验室保存。贝克曼Navios 流式细胞仪;Invitrogen IblotTM干式Western blotting转印仪;BioRad成像系统。
1.2方法
1.2.1引物的设计与合成根据ARV的σA和σNS的基因序列,设计了9对引物(表1)用于σA和σNS基因的突变,表中序列大写碱基标记处为突变碱基。扩增全长σA基因(1 248 bp)的引物为σA-F:5′-gatgatctcgaggccaccatggcgcgtgccatatacgac-3′和σA-R:5′-atcgcggccgcttaggcggtaaaagtggctagaac-3′,扩增全长σNS基因(1 101 bp)的引物为σNS-F:5′-gatgatctcgaggccaccatggacaacaccgtgcgtgtt-3′和σNS-R:5′-`atcgcggccgcttacgccatcctagctggagagac-3′,斜体标记为酶切位点(XhoⅠ与NotⅠ),下划线处为Kozak序列。
1.2.2σA和σNS突变基因的扩增σA-M1(σA的突变基因1)的扩增程序如下:第一次PCR扩增,引物为σA-F + σA-M1-R,模板为质粒σA-pcAGEN,切胶回收PCR产物。第二次PCR扩增,引物为σA-M1-F + σA-R,模板为质粒σA-pcAGEN,切胶回收PCR产物。第三次PCR扩增,引物为σA-F + σA-R,模板为第一次PCR和第二次PCR的胶回收产物(各1 μL),得到的PCR产物为σA-M1,切胶回收。
用相同方法扩增其他突变基因σA-M2、σA-M3、σA-M4、σA-M5、σA-M6、σNS-M1、σNS-M2和σNS-M3。
1.2.3与pMD18-T载体的连接及转化将第三次PCR的胶回收产物与pMD18-T于16 ℃连接过夜,转化到DH5a感受态细胞中,经PCR鉴定,获得的阳性质粒分别命名为σA-M1-pMD18T、σA-M2-pMD18T、σA-M3-pMD18T、σA-M4-pMD18T、σA-M5-pMD18T、σA-M6-pMD18T、σNS-M1-pMD18T、σNS-M2-pMD18T和σNS-M3-pMD18T。
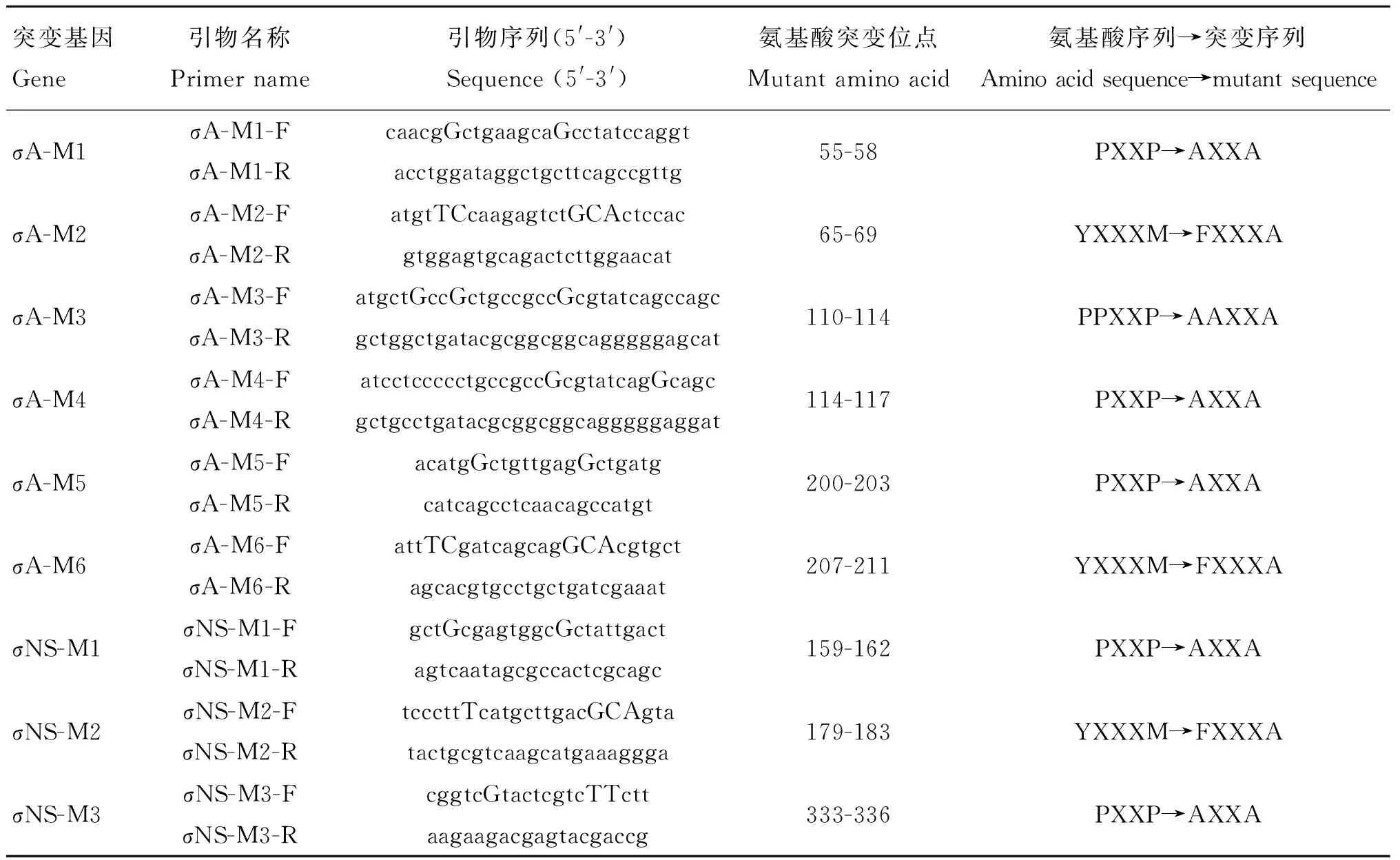
表1 引物序列及突变情况
1.2.4重组质粒的构建使用质粒提取试剂盒提取质粒。将真核表达载体pcAGEN质粒和含有目的基因的pMD18-T质粒分别用XhoⅠ和NotⅠ进行双酶切,切胶回收,使用T4连接酶连接过夜,转化到DH5α感受态细胞中,PCR鉴定重组菌。阳性克隆分别命名为σA-M1-pcAGEN、σA-M2-pcAGEN、σA-M3-pcAGEN、σA-M4-pcAGEN、σA-M5-pcAGEN、σA-M6-pcAGEN、σNS-M1-pcAGEN、σNS-M2-pcAGEN和σNS-M3-pcAGEN。阳性重组质粒送英潍捷基(上海)贸易有限公司进行测序。
1.2.5转染细胞参照无内毒素质粒大量提取试剂盒说明书大量提取质粒(pcAGEN、σA-pcAGEN、σA-M1-pcAGEN、σA-M2-pcAGEN、σA-M3-pcAGEN、σA-M4-pcAGEN、σA-M5-pcAGEN、σA-M6-pcAGEN、σNS-pcAGEN、σNS-M1-pcAGEN、σNS-M2-pcAGEN和σNS-M3-pcAGEN),-20 ℃保存备用。
参照脂质体转染试剂盒LipofectamineTM3000的使用说明,将质粒分别转染长成单层的Vero细胞(6孔板),同时设立阴性细胞组(未转染质粒)。
1.2.6间接免疫荧光和Western blot检测σA和σNS的表达转染Vero 细胞4 h后,用PBST洗涤三次,用置于-20 ℃保存的冷丙酮(丙酮∶乙醇=2∶3)进行固定,500 μL·孔-1,室温作用10 min。用PBST洗涤三次,加入1∶100倍稀释的ARV阳性血清200 μL·孔-1,37 ℃作用l h。用PBST洗涤三次,加入1∶500稀释的Alexa fluor 488标记的羊抗鸡IgY,200 μL·孔-1,37 ℃作用l h。用PBST洗涤三次,加甘油缓冲液(甘油∶PBS=1∶1)100 μL·孔-1。倒置荧光显微镜下观察。
同时,收集转染后的Vero细胞,参照参考文献[11]的方法,使用ARV阳性血清和HRP标记的羊抗鸡IgY对目的蛋白σA和σNS进行Western blot检测。
1.2.7流式细胞术和Western blot检测P-Akt的表达转染Vero细胞4 h后,用Cytofix固定/破膜试剂盒固定细胞20 min,FACS洗涤2次,加入1∶100稀释的Phospho-Akt 兔单克隆抗体作用30 min,FACS洗涤2次,加入1∶500稀释的Alexa fluor 488标记的羊抗兔IgG 作用30 min,FACS洗涤1次,加入300 μL FACS重悬浮细胞,上流氏细胞仪检测P-Akt的表达量,记录分析数据。
同时,收集转染后的Vero细胞,参照参考文献[12]的方法,使用HRP标记的羊抗兔IgG、β-actin兔单克隆抗体、Akt兔单克隆抗体和Phospho-Akt 兔单克隆抗体对Vero细胞中的β-actin、Akt和P-Akt进行Western blot检测。
重复整个试验3次。
2结果
2.1重组质粒的PCR鉴定及测序
重组质粒(σA-M1-pcAGEN、σA-M2-pcAGEN、σA-M3-pcAGEN、σA-M4-pcAGEN、σA-M5-pcAGEN、σA-M6-pcAGEN、σNS-M1-pcAGEN、σNS-M2-pcAGEN和σNS-M3-pcAGEN)的PCR鉴定结果见图1,扩增的基因片段大小与预期大小相符。测序结果也证实了σA和σNS突变基因的正确性。
2.2重组质粒的体外瞬时表达
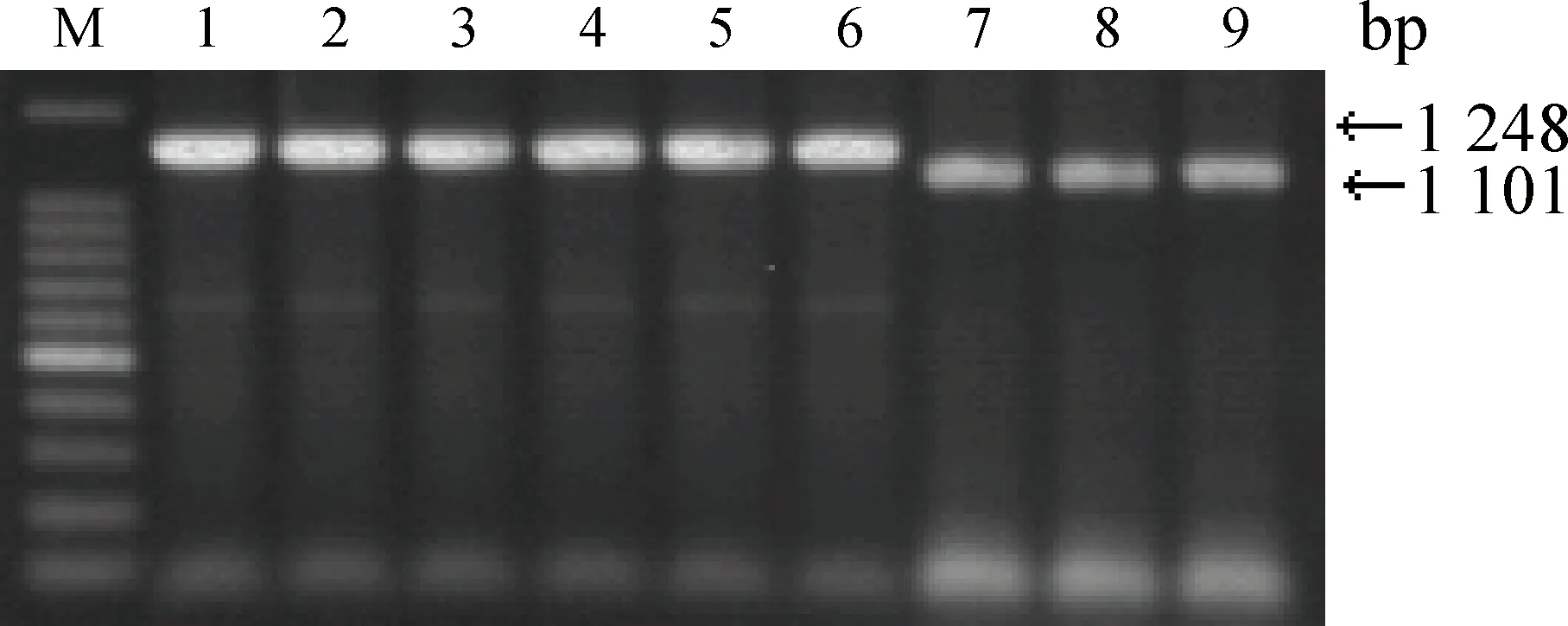
M.100 bp DNA ladder;1.σA-M1-pcAGEN;2.σA-M2-pcAGEN;3.σA-M3-pcAGEN;4.σA-M4-pcAGEN;5.σA-M5-pcAGEN;6.σA-M6-pcAGEN;7.σNS-M1-pcAGEN;8.σNS-M2-pcAGEN;9.σNS-M3-pcAGEN图1 重组质粒的PCR鉴定Fig.1 Identification of the recombinant plasmid by PCR
间接免疫荧光和Western blot检测结果显示,转染σA-pcAGEN、σA-M1-pcAGEN、σA-M2-pcAGEN、σA-M3-pcAGEN、σA-M4-pcAGEN、σA-M5-pcAGEN、σA-M6-pcAGEN、σNS-pcAGEN、σNS-M1-pcAGEN、σNS-M2-pcAGEN和σNS-M3-pcAGEN后,目的蛋白σA和σNS均得到了较好的表达,而空载体pcAGEN组和阴性细胞组均为阴性。间接免疫荧光检测结果见图2,Western blot检测结果见图3。
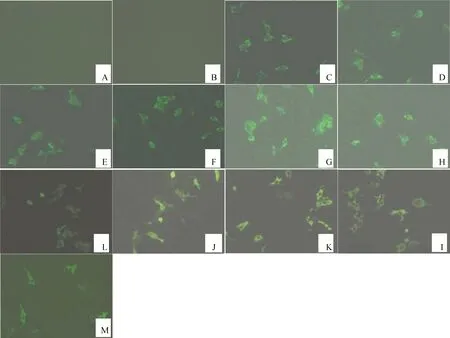
A.Negative control;B.pcAGEN;C.σA-M1-pcAGEN;D.σA-M2-pcAGEN;E.σA-M3-pcAGEN;F.σA-M4-pcAGEN;G.σA-M5-pcAGEN;H.σA-M6-pcAGEN;I.σA-pcAGEN;J.σNS-M1-pcAGEN;K.σNS-M2-pcAGEN;L.σNS-M3-pcAGENA;M.σNS-pcAGENA图2 IFA检测重组质粒转染Vero细胞后的瞬时表达Fig.2 IFA analysis of the expression of recombined plasmid on the transfected Vero cells

1.Negative control;2.pcAGEN;3.σNS-M1-pcAGEN;4.σNS-M2-pcAGEN;5.σNS-M3-pcAGENA;6.σNS- pcAGEN;7.σA-M1-pcAGEN;8.σA-M2-pcAGEN;9.σA-M3-pcAGEN;10.σA-M4-pcAGEN;11.σA-M5-pcAGEN;12.σA-M6-pcAGEN;13.σA-pcAGEN图3 Western blot 检测目的基因的表达Fig.3 Western blot analysis of the expression of the genes
2.3流式细胞术和Western blot检测P-Akt表达
流式细胞术检测P-Akt表达发现,转染Vero细胞后,σA-M3-pcAGEN和σA-M4-pcAGEN组的P-Akt表达量均明显低于σA-pcAGEN、σA-M1-pcAGEN、σA-M2-pcAGEN、σA-M5-pcAGEN和σA-M6-pcAGEN组,但与阴性细胞组和pcAGEN
空载体组差异不大(图4和表2)。Western blot的检测结果(图5)与流式细胞术检测结果相似。结果说明σA蛋白在110—114 (PPXXP→AAXXA)和114—117(PXXP→AXXA)位氨基酸突变后,影响了其使Vero细胞P-Akt表达明显增加的作用。
流式细胞术检测转染σNS 突变体细胞中P-Akt的表达结果(图略)显示,转染Vero细胞后,σNS-M1-pcAGEN、σNS-M2-pcAGEN和σNS-M3-pcAGEN组的P-Akt表达量与σNS-pcAGEN组比较差异不大,但明显高于阴性细胞组和pcAGEN组。Western blot的检测结果与流式细胞术检测结果相似。结果说明σNS蛋白在159—162(PXXP→AXXA)、179—183(YXXXM→FXXXA)和333—336(PXXP→AXXA)位氨基酸突变后,并未明显影响其使Vero细胞P-Akt表达明显增加的作用。
重复3次的检测结果一致。
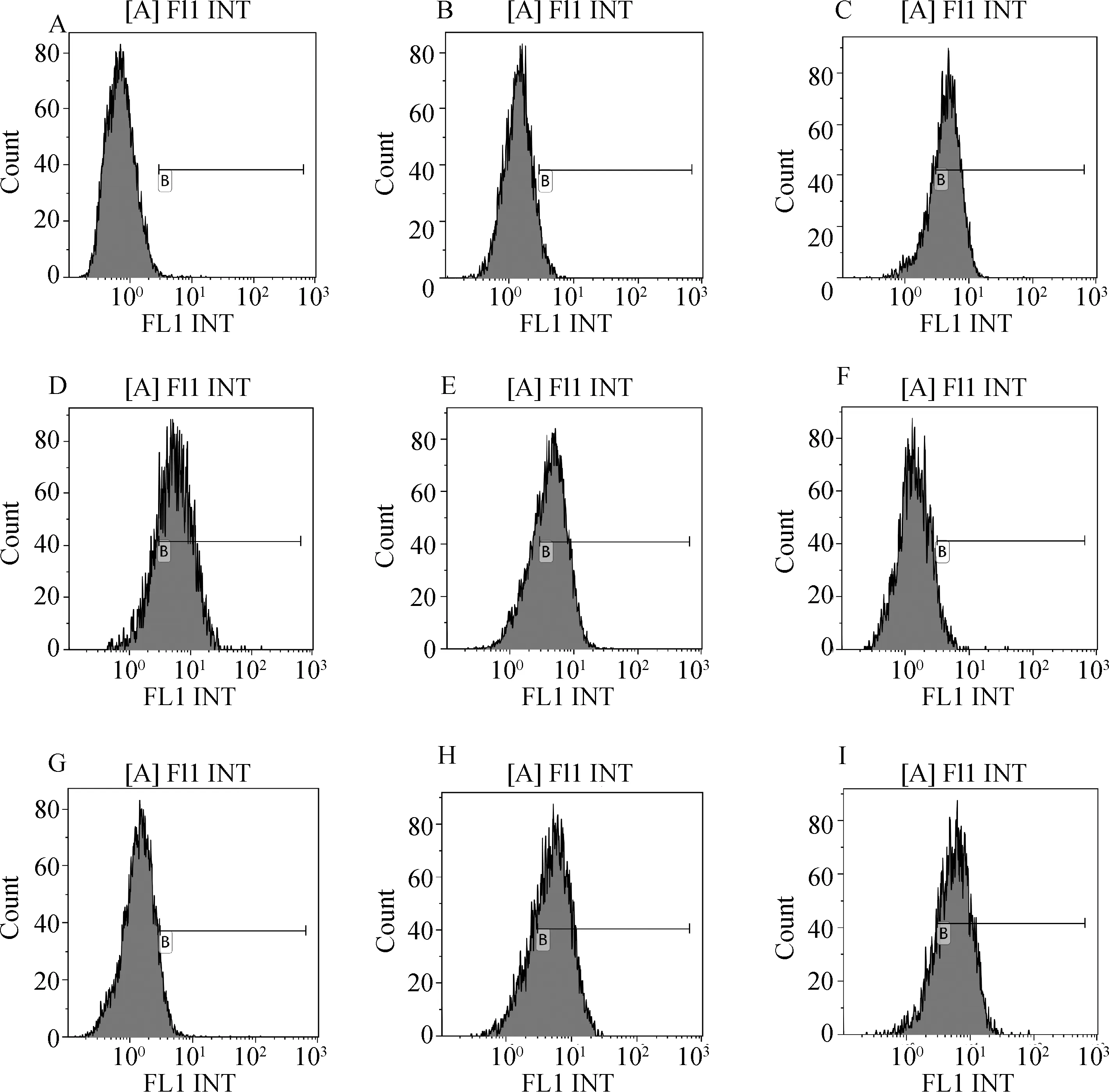
A.Negative control;B.pcAGEN;C.σA-pcAGEN;D.σA-M1-pcAGEN;E.σA-M2-pcAGEN;F.σA-M3-pcAGEN;G.σA-M4-pcAGEN;H.σA-M5-pcAGEN;I.σA-M6-pcAGEN图4 流式细胞术检测P-Akt的表达Fig.4 FCM analysis of the P-Akt expression levels
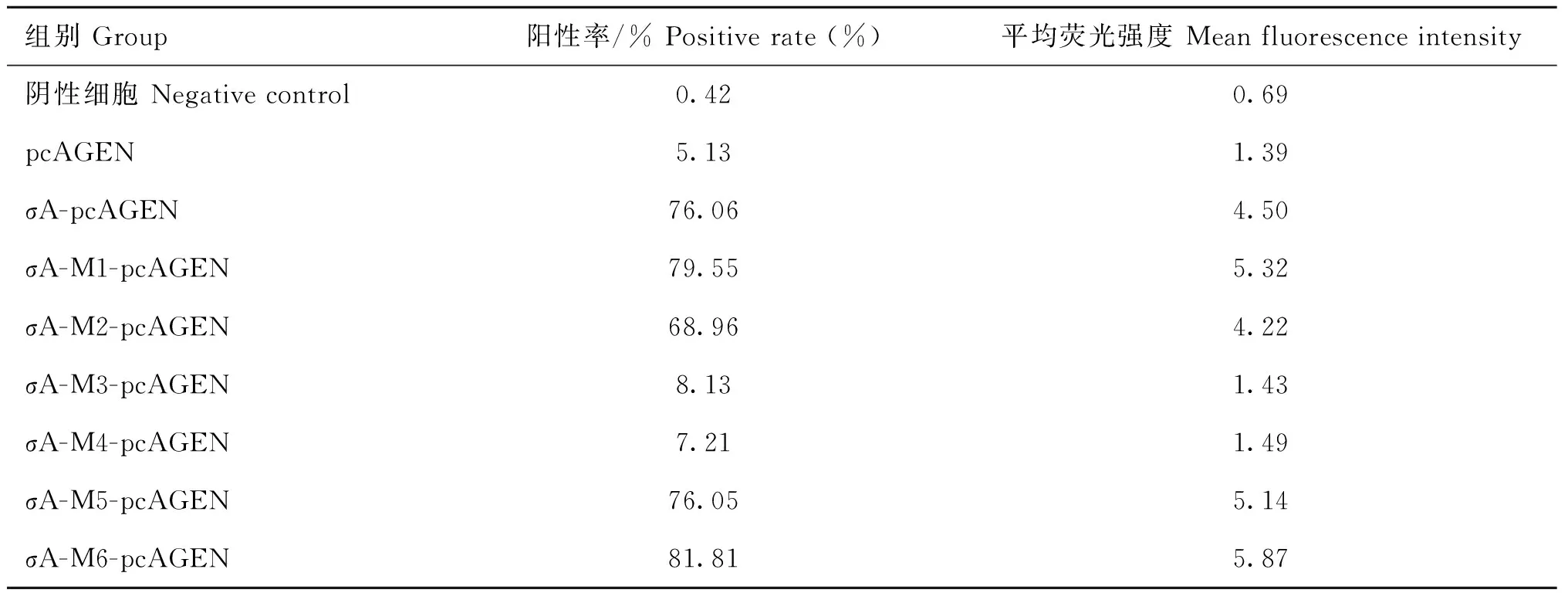
表2 FCM检测P-Akt的表达水平

1.Negative control;2.pcAGEN;3.σA-pcAGEN;4.σA-M1-pcAGEN;5.σA-M2-pcAGEN;6.σA-M3-pcAGEN;7.σA-M4-pcAGEN;8.σA-M5-pcAGEN;9.σA-M6-pcAGEN图5 Western blot 检测P-Akt的表达Fig.5 Western blot analysis of the P-Akt expression levels
3讨论
研究表明,当病毒侵入宿主细胞后,被感染的细胞能被宿主的免疫系统识别,并通过诱导细胞凋亡而对感染病毒的细胞加以清除,从而限制病毒在细胞内的复制及传播[13-15]。但是在选择压力的作用下,许多病毒已经进化出某些可以逃避细胞凋亡的机制,使得病毒在宿主细胞死亡之前能完成其复制周期[9,13-15],这些对抗措施通常是由病毒蛋白质来介导的。病毒蛋白质通过蛋白质—蛋白质的相互作用而调控细胞内信号分子的生物活性,进而激活相关信号通路,促进或抑制相关基因的转录表达,抑制感染细胞的凋亡,在病毒致病中发挥重要作用[16]。
真核细胞内存在多条信号通路,PI3K通路在众多信号通路中发挥中心作用,可通过其主要下游效应分子Akt来调节多种细胞功能,如细胞增殖和分化、抑制细胞凋亡等。PI3K是由催化亚基p110和调节亚基p85所组成的二聚体蛋白,具有类脂激酶和蛋白激酶的双重活性,调节亚基p85具有1个SH3结构域和2个SH2结构域[6,17]。许多病毒蛋白质和细胞蛋白质可通过PXXP基序与p85调节亚基的SH3结构域结合,或通过YXXXM/YXXM基序与P85调节亚基的SH2结构域结合,从而激活PI3K/Akt信号通路,使P-Akt的表达量升高,实现抑制细胞凋亡的发生[7-10],其中,Y.K.Shin等[9]对甲型流感病NS1非结构蛋白的研究表明,NS1蛋白通过PXXP与p85的SH3结构域结合,并通过YXXXM位点与p85的SH2结构域结合,从而激活了PI3K/Akt信号途径。
σA为ARV的结构蛋白,与ARV的抗干扰素效应有关,在ARV组装过程中发挥重要作用[18]。σNS为ARV的非结构蛋白,在ARV的RNA复制方面发挥着重要作用[19]。本课题组的前期研究工作发现,ARV的σA蛋白和σNS蛋白可激活PI3K/Akt信号通路[5]。本研究对ARV σA和σNS蛋白的氨基酸序列进行分析发现,这两个蛋白质均没有YXXM基序,其中,σA蛋白有4个PXXP和2个YXXXM基序,σNS蛋白有2个PXXP和1个YXXXM基序。因此,作者采用重叠延伸PCR的方法,将σA和σNS基因的PXXP或YXXXM基序进行突变后构建了重组质粒,并在Vero细胞中进行表达。通过流式细胞术和Western blot,检测转染重组质粒后Vero细胞P-Akt的表达量,并与野生型蛋白激活的P-Akt表达量进行比较。通过流式细胞术和Western blot的蛋白质双重检测,保证了本研究结果的可靠性。研究结果显示,ARV的σA蛋白在110—114 (PPXXP→AAXXA)和114—117(PXXP→AXXA)位氨基酸突变后,影响了其使Vero细胞P-Akt表达明显增加的作用,使σA蛋白失去了激活PI3K/Akt信号通路的活性。σA蛋白是否与其他病毒一样[7,9],通过PXXP位点与p85的SH3结构域结合,从而激活了PI3K/Akt信号途径,还有待于进一步的研究。
与许多病毒相似,PI3K/Akt信号转导通路的激活与ARV的复制有密切关系[4],因此,有望通过以ARVσA蛋白的PXXP基序作为新的药物靶点来研发新的药物,这个新的药物通过拮抗ARV增殖的宿主细胞信号转导通路,既可抑制ARV的增殖,又不会诱导耐药性的产生,为ARV的治疗提供了新的方向和思路。同时,本研究从细胞信号转导的角度,揭示了ARV的分子致病机制,也为进一步探索针对ARV的有效防治措施提供理论依据。
本研究结果还显示,ARV的σNS蛋白在159—162(PXXP→AXXA)、179—183(YXXXM→FXXXA)和333—336(PXXP→AXXA)位氨基酸突变后,并未明显影响其使Vero细胞P-Akt表达明显增加的作用,推测ARV是通过σNS蛋白的多个位点(2个PXXP和1个YXXXM基序一起)、其他位点来激活PI3K/Akt信号通路的,或者ARV的σNS蛋白是通过中间蛋白与p85调节亚基结合来激活PI3K/Akt信号通路,这些还有待于进一步的研究。
Y.K.Shin等[9]报道,转染空载体pcDNA3.1(-)后,A549 细胞P-Akt的表达量比阴性细胞组高,推测是转染的试剂造成的。本研究也有类似的发现,转染空载体pcAGEN后,Vero细胞P-Akt的表达量也比阴性细胞组高出一定的量,但由于阳性组P-Akt的表达量明显高于pcAGEN空载体组和阴性细胞组(高9倍以上),因此并未影响检测结果的判定。同时,本课题组的前期研究工作还发现[5],转染时间超过6 h后收获细胞,随着转染时间的增加,空载体组P-Akt的表达量会随着转染时间的增加而增加,并且会明显高于阴性细胞组,与阳性组越来越接近,从而影响结果的判定。因此,在本研究中,收获细胞的时间均选择转染后4 h内。本研究结果,给其他需要转染质粒的研究,提供了非常重要的理论参考意义。
4结论
ARV的σA蛋白,通过110—114的PPXXP和114—117的PXXP激活PI3K/Akt信号通路,使Vero细胞P-Akt的表达量增高,从而实现抑制细胞的凋亡。
参考文献(References):
[1]FAHEY J E,CRAWLEY J F.Studies on chronic respiratory disease of chickens II.Isolation of a virus[J].CanJCompMedVetSci,1954,18(1):13-21.
[2]HIERONYMUS D R,VILLEGAS P,KLEVEN S H.Identification and serological differentiation of several reovirus strains isolated from chickens with suspected malabsorption syndrome[J].AvianDis,1983,27(1):246-254.
[3]VAN DE ZANDE S,KUHN E M.Central nervous system signs in chickens caused by a new avian reovirus strain:A pathogenesis study[J].VetMicrobiol,2007,120(1-2):42-49.
[4]LIN P Y,LIU H J,LIAO M H,et al.Activation of PI 3-kinase/Akt/NF-κB and Stat3 signaling by avian reovirus S1133 in the early stages of infection results in an inflammatory response and delayed apoptosis[J].Virology,2010,400(1):104-114.
[5]谢丽基,谢芝勋,黄莉,等.禽呼肠孤病毒蛋白质启动PI3K/Akt信号通路的分析[J].畜牧兽医学报,2015,46(9):1613-1619.
XIE L J,XIE Z X,HUANG L,et al.The study of the activation of PI3K/Akt pathway by the protein of avian reovirus[J].ActaVeterinariaetZootechnicaSinica,2015,46(9):1613-1619.(in Chinese)
[6]VIVANCO I,SAWYERS C L.The phosphatidylinositol 3-Kinase AKT pathway in human cancer[J].NatRevCancer,2002,2(7):489-501.
[7]PAWSON T.Protein modules and signalling networks[J].Nature,1995,373 (6515):573-580.
[8]SONGYANG Z,SHOELSON S E,CHAUDHURI M,et al.SH2 domains recognize specific phosphopeptide sequences[J].Cell,1993,72(5):767-778.
[9]SHIN Y K,LIU Q,TIKOO S K,et al.Influenza A virus NS1 protein activates the phosphatidylinositol 3-kinase (PI3K)/Akt pathway by direct interaction with the p85 subunit of PI3K[J].JGenVirol,2007,88(Pt 1):13-18.
[10]ZHANG B,SPANDAU D F,ROMAN A.E5 protein of human papillomavirus type 16 protects human foreskin keratinocytes from UV B-irradiation-induced apoptosis[J].JVirol,2002,76(1):220-231.
[11]XIE Z,QIN C,XIE L,et al.Recombinant protein-based ELISA for detection and differentiation of antibodies against avian reovirus in vaccinated and non-vaccinated chickens[J].JVirolMethods, 2010,165(1):108-111.
[12]WANG X,ZHANG H,ABEL A M,et al.Role of phosphatidylinositol 3-kinase (PI3K) and Akt1 kinase in porcine reproductive and respiratory syndrome virus (PRRSV) replication[J].ArchVirol,2014,159(8):2091-2096.
[13]BARBER G N.Host defense,viruses and apoptosis[J].CellDeathDiffer,2001,8(2):113-126.
[14]BENEDICT C A,NORRIS P S,WARE C F.To kill or be killed:viral evasion of apoptosis[J].NatImmunol,2002,3(11):1013-1018.
[15]HAY S,KANNOURAKIS G.A time to kill:viral manipulation of the cell death program[J].JGenVirol,2002,83(Pt 7):1547-1564.
[16]KRAJCSI P,WOLD W S.Viral proteins that regulate cellular signalling[J].JGenVirol,1998,79(Pt 6):1323-1335.
[17]OKKENHAUG K,VANHAESEBROECK B.New responsibilities for the PI3K regulatory subunit p85 alpha[J].SciSTKE,2001,2001(65):PE1.
[18]MARTINEZ-COSTAS J,GONZLEZ-LPEZ C,VAKHARIA V N,et al.Possible involvement of the double-stranded RNA-binding core protein sigma A in the resistance of avian reovirus to interferon[J].JVirol,2000,74(3):1124-1131.
(编辑白永平)
doi:10.11843/j.issn.0366-6964.2016.07.019
收稿日期:2015-12-16
基金项目:国家自然科学基金项目(31160512);广西特聘专家专项(2011B020);广西基金项目(2013GXNSFBA019120)
作者简介:谢丽基(1981-),女,广西灵山人,副研究员,硕士,主要从事动物传染病病原分子生物学研究, Tel:(0771)3120371,E-mail: xie3120371@126.com *通信作者:谢芝勋,E-mail: xiezhixun@126.com
中图分类号:S852.659.4
文献标志码:A
文章编号:0366-6964(2016)07-1451-08
The Study of the Activation of PI3K/Akt Pathway by the σA and σNS Protein of Avian Reovirus
XIE Li-ji,XIE Zhi-xun*,HUANG Li,DENG Xian-wen,XIE Zhi-qin,FAN Qing,LUO Si-si,HUANG Jiao-ling,ZENG Ting-ting
(GuangxiVeterinaryResearchInstitute,GuangxiKeyLaboratoryofAnimalEpidemicEtiologyandDiagnostic,Nanning530001,China)
Abstract:The aim of the present study was to find out whether ARV activates the phosphatidylinositol 3-Kinase-dependent Akt (PI3K/Akt) pathway according to the PXXP or YXXXM motif of σA and σNS protein.Gene splicing by overlap extension PCR was used to change the PXXP or YXXXM motif of σA and σNS gene.Recombined plasmids that contain mutant σA and σNS genes were generated.The Akt phosphorylation profile of transfected cells were examined by flow cytometry and Western blot.The results showed that σA and σNS genes were expressed in the Vero cells,and the expression of P-Akt of the σA mutant groups (Amino acid 110-114 and 114-117) decreased markedly.The results indicated that the σA protein of ARV activate the PI3K/Akt pathway by the PXXP motif.The results of this study reveal the mechanisms by which ARV manipulate the cellular signal transduction pathways,which may provide new ideas for novel drug targets.
Key words:ARV;PI3K/Akt pathway;σA protein;PXXP motif
