小尾寒羊间情期和发情期microRNAs差异表达分析
2016-08-09段新崇魏彦辉李相运周荣艳锡建中
段新崇,魏彦辉,李 阳,李相运,周荣艳,锡建中
(河北农业大学动物科技学院,保定 071001)
小尾寒羊间情期和发情期microRNAs差异表达分析
段新崇,魏彦辉,李阳,李相运,周荣艳*,锡建中
(河北农业大学动物科技学院,保定 071001)
摘要:本研究通过构建和分析小尾寒羊间情期和发情期卵巢组织microRNA(miRNA)表达谱,筛选两个时期差异表达的microRNAs,为研究microRNA调控小尾寒羊繁殖过程提供相应的理论基础。利用活体手术法在发情期(第1天)和间情期(第13天)分别采集一侧卵巢。从卵巢中提取总RNA,利用illumina Hiseq2000测序平台获取RNA数据,对表达谱和差异表达microRNAs进行生物信息学分析。实时荧光定量PCR(qRT-PCR)验证差异表达的microRNAs在小尾寒羊卵巢中表达水平。结果,成功地构建出小尾寒羊间情期和发情期microRNA的表达谱,oar-miR-99a和oar-miR-143分别是间情期和发情期表达量最高的microRNA,并筛选出在两个时期间3个显著差异表达的microRNAs,分别为oar-miR-200a、oar-miR-200b和oar-miR-200c。利用qRT-PCR对随机选择的2个显著差异表达的microRNAs进行验证,其表达水平和RNA-Seq分析结果一致。microRNA表达谱为后续的绵羊卵巢microRNA研究提供更详尽的信息。结合靶基因预测及通路富集分析,推测差异表达的microRNAs是通过代谢和免疫途径调控卵巢周期性活动。
关键词:小尾寒羊;间情期;发情期;卵巢;microRNA
microRNA是一类长约22个核苷酸的非编码单链RNA分子,在哺乳动物的卵巢、输卵管、子宫、胎盘等繁殖组织器官中广泛表达[1-3]。它通过与靶mRNA特异性碱基互补配对,引起靶mRNA降解或者抑制其翻译,发挥基因转录后水平调控作用,从而参与细胞分化、增殖、凋亡等一系列生物学过程,而这些生物学过程正是卵泡发生、排卵以及黄体生成所必须的过程[4]。研究发现microRNA参与动物的多项繁殖活动。首先,microRNA影响激素合成:如对体外培养的人颗粒细胞进行miR-15a、Let-7b、Let-7c、miR-17-3p等36种microRNAs的转染,孕酮释放量提高了1.3~2.0倍;miR-16、miR-24、miR-25、miR-122等10种microRNAs转染使孕酮释放量减少了5倍以上;miR-15a、miR-24、miR-25、miR-26a等51种microRNAs对雌激素分泌有抑制作用,最高达4.5倍[5]。在猪有腔卵泡生长过程中,颗粒细胞中的miR-378表达水平上升,抑制芳香酶基因表达和雌激素的分泌[6]。其次,microRNA调节颗粒细胞、卵泡、黄体发育。调控颗粒细胞凋亡的microRNAs主要有miR-145、miR-23a和miR-26b,其中miR-145通过靶作用于激活素受体IB和细胞周期蛋白D2基因而抑制颗粒细胞增殖[7]。LH 峰后颗粒细胞内的miR-21、miR-212表达量增加,miR-21有防止排卵卵泡的颗粒细胞在黄体化过程中发生凋亡的作用,其调控的机理尚不清楚[8];miR-212能够上调受体转录因子CTBP-1在小鼠颗粒细胞核内的表达水平[9]。F.Muramatsu等发现miR-125b、miR-145、miR-31、miR-503和miR-21在反刍动物卵泡与黄体中表达差异显著[10]。最近R.Di等首次确定了滩羊非发情季节卵巢microRNAs表达谱,表达谱中共202个microRNAs,包括63个已知的,136个保守的和3个新预测的microRNAs,miR-n-142是非发情季节表达最丰富的microRNA,其靶基因主要富集在氧化磷酸化、甘油脂代谢和磷脂酰肌醇信号通路中[11]。可见microRNAs在雌性哺乳动物生殖过程中具有极其重要的作用。
小尾寒羊是冀、鲁、豫、苏、皖等地的优良品种,在繁殖性能中具有较为突出的表现,如成熟早、四季发情、产羔率高。其间情期与发情期卵巢经过了一系列变化过程,并最终决定了高繁殖率。建立小尾寒羊间情期与发情期microRNAs的表达谱并筛选两个时期差异表达的microRNAs,为研究microRNAs在调节卵泡发育与排卵生物学过程中的作用机制提供理论依据。
1材料与方法
1.1试验材料
选择3只经产小尾寒羊母羊,用公羊试情判断母羊发情。利用活体外科手术法在3只母羊的间情期和发情期(间隔12 d)分别采取一侧卵巢,立即投入液氮速冻,带回实验室置于-80 ℃保存。
1.2总RNA的提取、文库构建与测序
采用动物组织总RNA提取试剂盒(CWbio.Co.Ltd,China),参照试剂盒说明书提取总RNA。并对样本总RNA进行以下各项质量检测:利用1%琼脂糖凝胶电泳检测RNA降解程度以及是否有污染;RNA纯度由NanoPhotometer(IMPLEN,CA,USA)进行检测;Qubit®2.0(Life Technologies,CA,USA)检测RNA浓度;最后使用Agilent(Agilent Technologies,CA,USA)对RNA的完整性进行检测。
样品检测合格后,小RNA(sRNA)文库及高通量测序由北京诺禾致源生物信息有限公司完成。每个样品需3 μg的总RNA,使用Small RNA Sample Pre Kit(NEB,USA)构建文库,利用sRNA的3′及5′端特殊结构,以总RNA为起始样品在sRNA两端加接头并反转录成cDNA,随后经过PCR扩增,PAGE胶电泳分离目标DNA片段,切胶回收得到的即为cDNA文库。按照有效浓度及目标数据量的要求pooling后进行RNA-Seq测序,得到的序列原始数据(Raw Data)用于基本数据的分析。
1.3生物信息学分析鉴定sRNA
对原始数据进行去除低质量、去除接头、去除污染、去除碱基信息不明确的序列,得到干净的的序列;对sRNA的长度分别进行统计,长度分布峰可以帮助我们判断sRNA的种类,筛选一定长度范围的sRNA进行后续分析;用bowtie软件将sRNA定位到参考序列上,将序列比对到RepeatMasker和Rfam本物种的数据库,去除sRNAs中相应的重复序列以及rRNA、tRNA、SnRNA和SnoRNA等非编码的sRNA;剩余的sRNA对比到miRBase20.0寻找到已知的microRNAs;运用mirdeep2软件预测新的microRNAs;对各样本中已知和新的microRNAs进行表达量统计,并进行表达量TPM归一化处理;将microRNAs表达水平分析中得到的readcount数据,采用基于负二项分布的DESeq[12-13]进行分析,从差异倍数(Fold change)和校正后的显著水平(q value<0.01)进行评估,对差异microRNAs进行筛选。本研究进行生物信息分析时所参考的数据库和分析程序信息见表1。

表1 生物信息学分析软件
1.4real-time PCR验证差异表达的microRNAs
对小尾寒羊两个时期内显著差异表达的oar-miR-200a和oar-miR-200b进行qRT-PCR检测。以U6基因为内参,microRNA及内参基因探针见表2。使用microRNA第一条链合成试剂盒(CWbio.Co.Ltd,China) 合成的cDNA作为qRT-PCR的模板。PCR反应体系20 μL:2 μL cDNA、40 μmol·L-1正反引物、10 μL的SYBR Premix Ex Taq(宝生物工程有限公司,大连)。PCR反应条件:95 ℃预变性10 min;95 ℃变性15 s,60 ℃退火30 s,共14个循环;72 ℃延伸3 min;4 ℃保存。相对表达量结果采用2-ΔΔCt法进行计算分析。
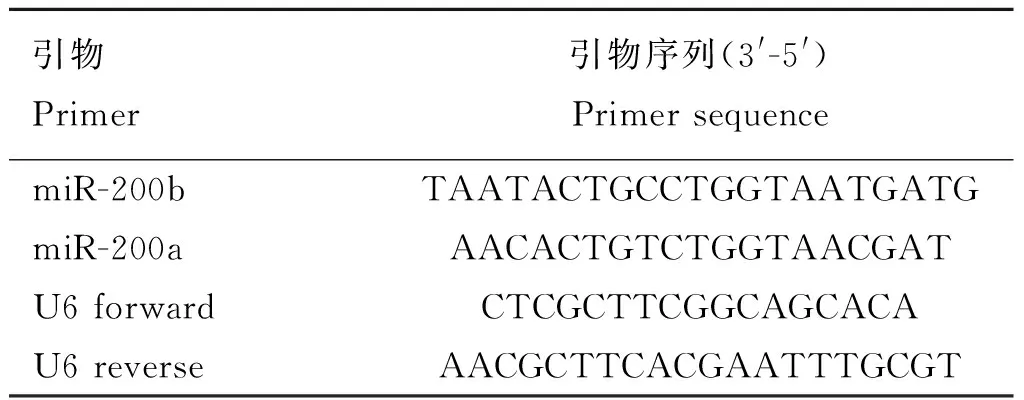
表2 microRNAs定量检测的引物序列
2结果
2.1纯化原始序列及sRNA序列长度分布
原始数据经过去除低质量、接头、污染等过程后得到干净序列(clean reads),发情期(PXW)和间情期(DXW)分别得到clean reads为11 467 290和10 667 271个。sRNA长度分布主要是21~23 bp,测序数据中间情期和发情期长度为22 bp的序列分别占44.55%和43.49%(图1)。统计两样品间公共序列和特有序列的种类(uniq)及数量(total),两个品种间公共序列的种类仅占全部序列的13.05%,而公共序列的数量却占全部数量的93.39%(图2)。
2.2sRNA与参考序列进行比对
使用Bowtie将长度筛选后的sRNA reads定位到参考序列上,分析sRNA在参考序列上的分布情况,可以看出大部分的sRNA都可以匹配到参考序列上,间情期和发情期没有匹配上的sRNA分别仅占12.03%和18.76%(表3)。
2.3microRNAs在间情期和发情期的表达谱分析
间情期与发情期卵巢组织sRNA与miRbase数据库进行比对,得到匹配上的已知microRNAs分别有129、135个。两个时期表达量经TPM标准化处理后,排在前10位的microRNAs相同(图3),分别为oar-miR-143、oar-miR-21、oar-miR-99a、oar-miR-26a、oar-miR-148a、oar-miR-10b、oar-let-7i、oar-let-7f、oar-let-7g、oar-miR-199a-3p。而间情期和发情期表达量TPM值最高的microRNA分别是oar-miR-99a(173 266)和oar-miR-143(187 028)。
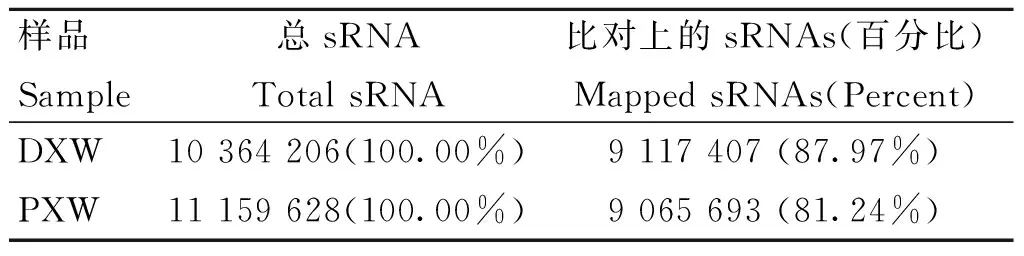
表3 与参考基因组比对信息统计表
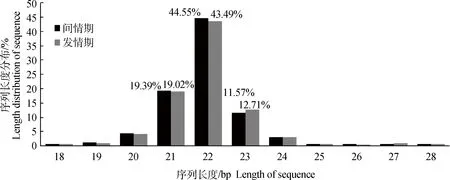
图1 小RNA长度分布Fig.1 Length distribution of small RNA sequencing
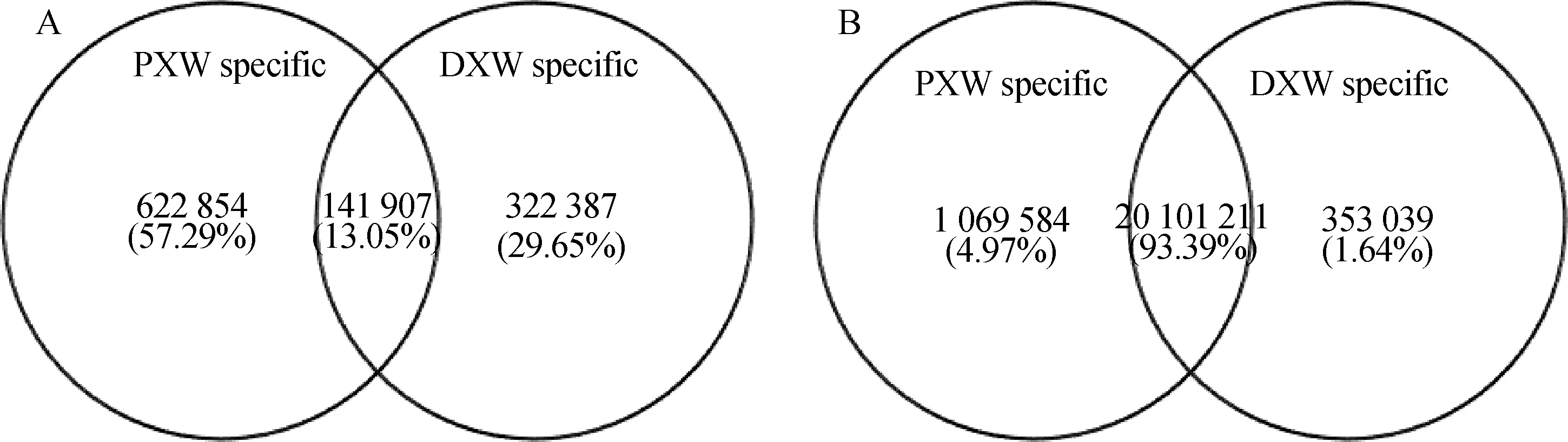
A.两个时期公共及特有序列种类 (Uniq sRNA);B.两个时期公共及特有序列数量统计(Total sRNA)A.Venn chart for uniq sRNAs in 2 periods;B.Venn chart for total sRNAs in 2 periods图2 两个时期公共及特有的序列数量及种类Fig.2 Venn chart for total and uniq sRNAs in 2 periods
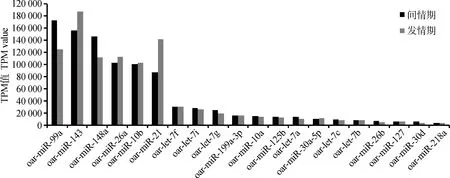
图3 小尾寒羊间情期和发情期卵巢组织前20位的microRNAs表达水平柱形图Fig.3 Bar diagram of top 20 microRNAs expressed in estrus and diestrus ovary in the Small Tailed Han sheep
2.4差异表达microRNAs的筛选
小尾寒羊卵巢组织microRNAs表达量经TPM标准化后,获得3个显著差异表达的microRNAs,在发情期较间情期全部表达下调(log2Fold change<-1)(图4),分别是oar-miR-200a由403.6下调至120.4;oar-miR-200b由119.3下调至26.7;oar-miR-200c由22.4下调至3.1,三者均属于miR-200家族。

方块表示显著差异表达的microRNAs (log2Fold change<-1,p value<0.01,q value<0.01)square shape indicate significant difference in expression of microRNAs(log2Fold change<-1,p value<0.01,q value<0.01)图4 显著差异表达microRNAs分析火山图Fig.4 The volcano plot of significant differentially expressed microRNAs
2.5新microRNAs的预测
使用microRNA预测软件miREvo[12]和mirdeep2[13]进行新microRNA的分析,截取一定长度sRNA比对上的参考序列,通过对其二级结构及Dicer酶切位点信息、能量等特征进行分析,预测样品中新microRNA,此次测序中小尾寒羊间情期和发情期共发现68个新microRNAs:间情期57个,发情期59个。Novel_67在两个时期中表达量TPM值最高,分别是201.4和200.9(图5)。

图5 小尾寒羊间情期和发情期卵巢组织新microRNAs表达水平柱形图Fig.5 Bar diagram of novel microRNAs expressed in estrus and diestrus ovary in the Small Tailed Han sheep
2.6qRT-PCR验证结果
在小尾寒羊间情期和发情期卵巢组织显著差异表达的microRNAs中选取oar-miR-200a和oar-miR-200b进行荧光定量PCR(qRT-PCR)验证。结果表明oar-miR-200a和oar-miR-200b在小尾寒羊卵巢中皆有表达(表4),并且二者在发情期较间情期均表达下调,这与RNA-Seq测序结果基本一致。

表4 qRT-PCR与RNA-Seq结果比较
2.7差异microRNAs的靶基因预测和 GO 功能注释
根据已有数据,oar-miR-200a、oar-miR-200b、oar-miR-200c预测得到的靶基因个数分别为:540、583和687个。对这些靶基因进行GO富集分析,结合图6和在线分析结果可知,在细胞组分分类中,差异表达microRNAs的靶基因绝大部分参与形成细胞成分(占70%),其次参与形成细胞内组分(占35%);在分子功能分类中,绝大部分靶基因参与连接分子类(占71%),其次是催化活性分子类(占55%);而在生物学过程分类中,参与有机物代谢过程的靶基因较多(占52%),然后是初级代谢过程(占51%)。
2.8差异microRNAs靶基因KEGG富集分析
在生物体内不同基因相互协调行使其生物学功能,通过通路显著性富集能确定基因参与的最主要生化代谢途径和信号转导途径。对差异microRNAs靶基因进行KEGG富集分析(P<0.05,FDR<0.4),结果表明,差异microRNAs的靶基因在免疫、凝血、脂肪代谢以及糖代谢等19个通路达到显著富集水平。X.Y.Miao等对不同发情周期小尾寒羊和道赛特羊的转录组进行测序,根据KEGG通路分析提出代谢、免疫等途径可能调控家畜繁殖力[14],并且繁殖力与能量平衡、代谢关系密切[15-16],我们筛选出4条与卵巢繁殖活动关系较大的通路分别是:脂肪酸代谢通路、I型糖尿病通路、补体和凝血级联反应、细胞粘附分子通路(表5)。差异表达microRNAs的靶基因及参与的KEGG通路如图7所示,所有差异表达microRNAs通过相同靶基因FGN、C1S参与补体凝血级联反应,而且通过相同靶基因CD274、ITGA9、ITGA6、NEO1参与细胞粘附分子通路;DYA与OVAR-DQA2作为oar-miR-200c和oar-miR-200b共同的靶基因同时参与细胞粘附分子和I型糖尿病通路,并且oar-miR-200c和oar-miR-200b还通过共同的靶基因ACOX1、CPT1A、OXSM、SCD和ACACB参与脂肪酸代谢通路(图7)。
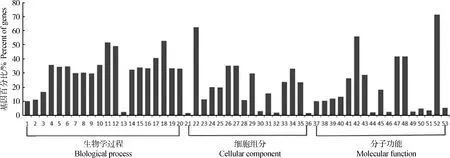
1.DNA复制RNA合成;2.DNA复制;3.DNA代谢过程;4.生物合成过程;5.细胞生物合成过程;6.有机物质生物合成的过程;7.细胞大分子生物合成过程:8.大分子生物合成过程;9.核酸代谢过程;10.氮的化合物代谢过程;11.初级代谢过程;12.细胞代谢过程;13.蛋白质N-链糖基化;14.含碱基化合物代谢;15.细胞氮化合物代谢;16.杂环代谢过程;17.细胞大分子代谢过程;18.有机物质代谢过程;19.有机环状化合物代谢过程;20.细胞芳香族化合物代谢;21.高尔基体运输复合体;22.细胞组分;23.胞质部分;24.有膜细胞器;25.细胞内的有膜细胞器;26.细胞;27.细胞部分;28.细胞外区域;29.细胞外部分;30.线粒体;31.细胞质;32.高尔基体部分;33.细胞器;34.细胞内;35.细胞内的细胞器;36.线粒体膜部分;37.RNA-直接DNA聚合酶的活动;38.DNA聚合酶活动;39.核酸转移酶活性;40.RNA结合;41.转移酶活性;42.催化活性;43.核酸结合;44.β-1,4-甘露糖基-糖蛋白 4 -β-乙酰氨基葡萄糖转移酶活性;45.转移酶活性;46.乙酰葡糖氨基转移酶活性;47.杂环化合物结合;48.有机环状化合物结合;49.UDP葡萄糖基转移酶活性;50.戊糖基转移酶活性;51.一碳基团转移酶活性;52.结合;53.受体结合1.RNA-dependent DNA replication;2.DNA replication;3.DNA metabolic process;4.Biosynthetic process;5.Cellular biosynthetic process;6.Organic substance biosynthetic process;7.Cellular macromolecule biosynthetic process;8.Macromolecule biosynthetic process;9.Nucleic acid metabolic process;10.Nitrogen compound metabolic process;11.Primary metabolic process;12.Cellular metabolic process;13.Protein N-linked glycosylation;14.Nucleobase-containing compound metabolic;15.Cellular nitrogen compound metabolic;16.Heterocycle metabolic process;17.Cellular macromolecule metabolic process;18.Organic substance metabolic process;19.Organic cyclic compound metabolic process;20.Cellular aromatic compound metabolic;21.Golgi transport complex;22.Cellular component;23.Cytoplasmic part;24.Membrane-bounded organelle;25.Intracellular membrane-bounded organelle;26.Cell;27.Cell part;28.Extracellular region;29.Intracellular part;30.Mitochondrion;31.Cytoplasm;32.Golgi apparatus part;33.Organelle;34.Intracellular;35.Intracellular organelle;36.Mitochondrial membrane part;37.RNA-directed DNA polymerase activity;38.DNA polymerase activity;39.Nucleotidyl transferase activity;40.RNA binding;41.Transferase activity;42.Catalytic activity;43.Nucleic acid binding;44.Beta-1,4-mannosylglycoprotein 4-beta-N-acetylglucosaminyltransferase activity;45.Transferase activity,transferring hexosyl groups;46.Acetylglucosaminyl transferase activity;47.Heterocyclic compound binding;48.Organic cyclic compound binding;49.UDP-glycosyltransferase activity;50.Transferase activity,transferring pentosyl groups;51.Transferase activity,transferring one-carbon groups;52.Binding;53.Receptor binding图6 差异microRNAs靶基因的 GO 功能分类图Fig.6 Gene Ontology annotation plot for target genes of microRNAs differentially expressed

表5 4个显著富集的KEGG 代谢途径
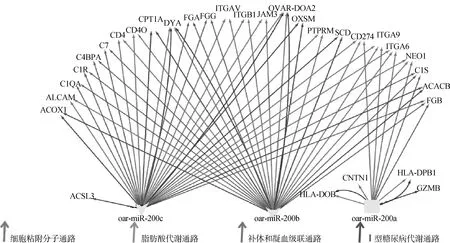
图7 差异表达microRNAs靶基因与4个富集KEGG通路关系图Fig.7 The relationship between target genes of differential expression of microRNAs and the 4 enriched KEGG pathways
3讨论
繁殖性状是绵羊的重要经济性状,而繁殖性状是受多基因控制的,遗传力低,传统的选择方法对其遗传进展的改良非常缓慢,培育新的高繁殖率品种是相当繁琐甚至是不可能实现的。小尾寒羊是世界上具有非季节性发情和多胎特性的高繁殖率绵羊品种之一,研究其microRNA对卵泡发育和排卵的调控机制,开展分子标记辅助选择,为解决这一问题提供了新的方向。
本试验通过对小尾寒羊卵巢组织不同时期microRNA研究,丰富了绵羊microRNA数据库的信息,发情期与间情期共有188种microRNAs表达:其中164种microRNAs在两个时期共同表达,9种在间情期卵巢特异表达,15种在发情期卵巢中特异表达。间情期与发情期表达谱中表达量最多的microRNA分别是miR-99a、miR-143,除此之外一些表达丰富的microRNAs如miR-26a、let-7、miR-21,在人、牛[17]、猪[18]、成年和新生小鼠[19]的卵巢内表达也是非常丰富的。这些保守的microRNAs在哺乳动物生殖阶段高表达,说明它们在卵巢功能中扮演着非常重要的角色。在以往的研究中对这些高表达microRNA的部分功能进行了研究与分析:miR-21确定能够促进排卵期卵泡细胞的存活[20],而miR-143是小鼠原始卵泡形成的关键[21]以及let-7b被证明是黄体正常发育过程中所必须的[22]。miR-99a的高表达结果和胎牛与小鼠卵巢microRNA克隆分析研究中miR-99a表达丰富相一致[19,23]。此外,KEGG通路对microRNA的靶基因富集,这对卵巢功能分析也很重要。例如,miR-143在促性腺激素释放激素信号通路和孕激素介导的卵母细胞成熟途径上显著富集,这样通过内分泌功能、卵泡发育影响卵巢活动[11]。另外,let-7家族的靶基因参与细胞凋亡、Wnt信号通路和C21甾体激素代谢途径,这对颗粒细胞增殖、卵泡的生长发育、黄体形成和退化很重要[24]。以上研究均证明了这些保守的高表达microRNAs在动物卵巢功能中的重要作用,同时也是因为这些作用才使得这些microRNAs在此次卵巢测序中高表达,与本试验结果相对应。
本研究中,间情期和发情期卵巢差异表达的microRNAs(oar-miR-200a、oar-miR-200b、oar-miR-200c)均属于miR-200家族。根据GO以及KEGG通路分析得到,差异表达microRNAs靶基因参与免疫与代谢过程与小尾寒羊卵巢周期性活动有关:细胞粘附分子通路,参与卵泡与黄体颗粒细胞的凋亡[25-26];补体和凝血级联反应则是因为排卵后卵泡破裂引起卵巢的一系列应答反应[27-28];而脂肪酸代谢通路中靶基因富集,可能是由于两个时期卵巢内激素水平的变化对应的结果;糖代谢通路推测与两个时期卵巢活动如卵泡发育、破裂所需的能量代谢有关。而以往对miR-200家族的功能研究多见于肿瘤方面,但是探索其对动物繁殖方面的作用也是很有意义的。ZEB1作为miR-200a、miR-200b、miR-200c共同的预测靶基因,在卵巢的表达模型中直接参与调节卵泡的作用,切除垂体的仓鼠卵巢内ZEB1 mRNA显著增加,而ZEB1蛋白却显著减少,导致mRNA和蛋白差异表达的原因正是由于miR-200转录后的调节作用[29]。H.Hasuwa等发现,缺乏miR-200b和miR-429的雌性小鼠不排卵,而miR-200b和miR-429通过抑制转录抑制因子ZEB1的表达调节小鼠繁殖过程[30]。在其他的报道中,miR-200b在小鼠的子宫、肌肉、肾中表达量较高,通过双荧光素酶报告载体系统验证其靶基因,推测miR-200b通过与靶基因Fog2的相互作用参与小鼠胚胎发育过程[31]。另外,miR-200a在怀孕6天和4天的小鼠子宫内膜中相比较表达量显著下调,表明miR-200a在胚胎着床前后对子宫内膜起到重要的调节作用[32]。
4结论
通过成功地构建小尾寒羊间情期和发情期microRNA的表达谱,为后续的绵羊microRNA研究提供更多更详尽的序列信息。筛选出两个时期差异表达的microRNAs,结合靶基因预测及通路富集分析结果,推测差异表达的microRNAs通过参与代谢与免疫过程调节卵泡的发育进而影响卵巢的周期性活动。
参考文献(References):
[1]HU S J,REN G,LIU J L,et al.MicroRNA expression and regulation in mouse uterus during embryo implantation[J].JBiolChem,2008,283(34):23473-23484.
[2]CARLETTI M Z,CHRISTENSON L K.MicroRNA in the ovary and female reproductive tract[J].JAnimSci,2009,87(14):29-38.
[3]徐盛玉,王定越,吴德.MicroRNA及其对哺乳动物繁殖的影响[J].畜牧兽医学报,2011,42(6):747-753.
XU S Y,WANG D Y,WU D.Effects of MicroRNA on the Mammalian Reproduction[J].ActaVeterinariaetZootechnicaSinica,2011,42(6):747-753.(in Chinese)
[4]CHRISTENSON L K.MicroRNA control of ovarian function[J].AnimReprodSci, 2010,7(3):129-133.
[5]SIROTKIN A V,OVCHARENKO D,GROSSMANN R,et al.Identification of microRNAs controlling human ovarian cell steroidogenesis via a genome-scale screen[J].JCellPhysiol,2009,219(2):415-420.
[6]XU S,LINHER-MELVILLE K,YANG B B,et al.Micro-RNA378 (miR-378) regulates ovarian estradiol production by targeting aromatase[J].Endocrinology,2011,152(10):3941-3951.
[7]YAN G J,ZHANG L,FANG T,et al.MicroRNA-145 suppresses mouse granulosa cell proliferation by targeting activin receptor IB[J].FEBSLett,2012,586(19):3263-3270.
[8]DAVIS B N,HILYARD A C,LAGNA G,et al.SMAD proteins control DROSHA-mediated microRNA maturation[J].Nature, 2008,454(7200):56-61.
[9]VO N,KLEIN M E,VARLAMOVA O,et al.A cAMP-response element binding protein-induced microRNA regulates neuronal morphogenesis[J].ProcNatlAcadSciUSA,2005,102(45):16426-16431.
[10]MURAMATSU F,KIDOYA H,NAITO H,et al.microRNA-125b inhibits tube formation of blood vessels through translational suppression of VE-cadherin[J].Oncogene,2013,32(4):414-421.
[11]DI R,HE J,SONG S,et al.Characterization and comparative profiling of ovarian microRNAs during ovine anestrus and the breeding season[J].BMCGenomics,2014,15(1):899.
[12]WEN M,SHEN Y,SHI S,et al.miREvo:An integrative microRNA evolutionary analysis platform for next-generation sequencing experiments[J].BMCBioinformatics,2012,13(1):140.
[13]FRIEDLANDER M R,MACKOWIAK S D,LI N,et al.miRDeep2 accurately identifies known and hundreds of novel microRNA genes in seven animal clades[J].NucleicAcidsRes,2011,40(1):37-52.
[14]MIAO X Y,LUO Q M,QIN X Y.Genome-wide transcriptome analysis of mRNAs and microRNAs in Dorset and Small Tail Han sheep to explore the regulation of fecundity[J].MolCellEndocrinol,2015,15(402):32-42.
[15]BARTEL D P.MicroRNAs:target recognition and regulatory functions[J].Cell,2009,136(2):215-233.
[16]VALEGGIA C,EILLSON P T.Interactions between metabolic and reproductive functions in the resumption of postpartum fecundity[J].AmJHumBiol,2009,21(4):559-566.
[17]HOSSAIN M M,GHANEM N,HOELKER M,et al.Identification and characterization of miRNAs expressed in the bovine ovary[J].BMCGenomics,2009,10(1):443.
[18]LI M Z,LIU Y K,WANG T,et al.Repertoire of porcine microRNAs in adult ovary and testis by deep sequencing[J].IntJBiolSci, 2011,7(7):1045-1055.
[19]MISHIMA T,TAKIZAWA T,LUO S S,et al.MicroRNA (miRNA) cloning analysis reveals sex differences in miRNA expression profiles[J].Reproduction,2008,136(6):811-822.
[20]CARLETTI M Z,FIEDLER S D,CHRISTENSON L K.MicroRNA 21 blocks apoptosis in mouse periovulatory granulosa cells[J].BiolReprod,2010,83(2):286-295.
[21]ZHANG J F,JI X W,ZHOU D D,et al.miR-143 is critical for the formation of primordial follicles in mice[J].FrontBiosci,2012(1),18:588-597.
[22]OTSUKA M,ZHENG M,HAYASHI M,et al.Impaired microRNA processing causes corpus luteum insufficiency and infertility in mice[J].JClinInvest,2008,118(5):1944-1954.
[23]TRIPURANI S K,XIAO C,SALEM M,et al.Cloning and analysis of fetal ovary microRNAs in cattle[J].AnimReprodSci,2010,120(1):16-22.
[24]ROUSH S,SLACK F J.The let-7 family of microRNAs[J].TrendsCellBiol,2008,18(10):505-516.
[25]MAKRIGIANNAKIS A,COUKOS G,CHRISTOFIDOU-SOLOMIDOU M,et al.N-cadherin-mediated human granulosa cell adhesion prevents apoptosis:a role in follicular atresia and luteolysis?[J].AmJPathol,1999,154(5):1391-1406.
[26]MORA J M,FENWICK M A,CASTLE L,et al.Characterization and significance of adhesion and junction-related proteins in mouse ovarian follicles[J].BiolReprod,2012,86(5):153.
[27]AMBEKER A S,NLIRUJOG R S,SRIKANTH S M,et al.Proteomic analysis of human follicular fluid:a new perspective towards understanding folliculogenesis[J].JProteomics,2013,87(7):68-77.
[28]EBISCH I M W,THOMAS C M G,WETZELS A M M,et al.Review of the role of the plasminogen activator system and vascular endothelial growth factor in subfertility[J].FertilSteril,2008,90(6):2340-2350.
[29]WANG C,ROY S K.Gonadotropins and steroids regulation of ZEB1 expression in the hamster ovary[J].BiolReprod,2011,85(1 Supplement):661.
[30]HASUWA H,UEDA J,IKAWA M,et al.MiR-200b and miR-429 Function in mouse ovulation and are essential for female fertility[J].Science,2013,341(6141):71-73.
[31]任红艳,刘楠,陶聪,等.小鼠体型控制相关microRNA-200b(miR-200b)的表达谱及靶标分析[J].农业生物技术,2013,21(1):47-54.
REN H Y,LIU N,TAO C,et al.The expression profile and target gene analysis of mouse(Musmusculus) body size REgulation related microRNA-200b(miR-200b)[J].JournalofAgriculturalBiotechnology,2013,21(1):47-54.(in Chinese)
[32]鲁之中,陈雪梅,曾兰,等.早孕小鼠胚胎着床前后子宫内膜microRNAs差异表达[J].细胞生物学,2009,31(6):848-852.
LU Z Z,CHEN X M,ZENG L,et al.The different expression of microRNAs in endometrium of early pregnant mouse during embryo implantation[J].ChineseJournalofCellBiology,2009,31(6):848-852.(in Chinese)
(编辑郭云雁)
doi:10.11843/j.issn.0366-6964.2016.07.004
收稿日期:2015-11-13
基金项目:河北省高等学校科学技术研究青年基金项目(QN2015162);河北省首批青年拔尖人才支持计划(2013-2015);河北农业大学青年学术带头人支持项目(2015-2017)
作者简介:段新崇(1989-),女,河北邯郸人,硕士生,主要从事动物遗传育种与繁殖研究,E-mail: 15733202716@163.com *通信作者:周荣艳,副教授,博士,主要从事动物遗传育种研究,Tel: 0312-7528451,E-mail: rongyanzhou@126.com
中图分类号:S826;S813.3
文献标志码:A
文章编号:0366-6964(2016)07-1324-09
Analyzing the Differential Expression of microRNAs in Estrus and Diestrus of Small Tailed Han Sheep
DUAN Xin-chong,WEI Yan-hui,LI Yang,LI Xiang-yun,ZHOU Rong-yan*,XI Jian-zhong
(CollegeofAnimalScienceandTechnology,HebeiAgriculturalUniversity,Baoding071001,China)
Abstract:To explore the theoretical basis of the microRNAs in regulating the reproductive process in Small Tail Han sheep,the ovarian microRNAs profiles were constructed and analyzed in estrus and diestrus.One ovary was collected with surgery method at estrus (the 1st day) and diestrus (the 13th day) from the same sheep,respectively.The RNA sequencing data were obtained with illumina Hiseq2000 sequencing platform.The expression profiles and differential expression of microRNAs were analyzed by bioinformatics method.The real-time quantitative PCR (qRT-PCR) was used for validating the differentially expressed microRNAs between the 2 periods in ovary.The microRNAs expression profiles of Small Tailed Han sheep was constructed in the period of estrus and diestrus in ovaries.The highest expression of microRNA was observed for oar-miR-99a and oar-miR-143 in the period of diestrus and estrus,respectively.Three microRNAs,oar-miR-200a,oar-miR-200b and oar-miR-200c,were significantly differentially expressed between estrus and diestrus.The expression level of 2 randomly selected microRNAs by qRT-PCR was the same as the result by RNA-seq data.These microRNAs expression profiles will be used to provide informations for further studying the microRNAs in sheep ovary.The differentially expressed microRNAs may regulate the ovarian periodic activity through the metabolism and immunity pathway by the analysis of predicted target genes and enriched pathways.
Key words:Small Tailed Han sheep;diestrus;estrus;ovary;microRNA
