恩诺沙星灌注液在健康母猪体内的药代动力学研究
2016-08-09冯庭松黄显会曾松情
冯庭松,黄显会,曾松情,郜 进,谢 顺,刘 宇
(华南农业大学 兽医学院,广州 510642)
恩诺沙星灌注液在健康母猪体内的药代动力学研究
冯庭松,黄显会*,曾松情,郜进,谢顺,刘宇*
(华南农业大学 兽医学院,广州 510642)
摘要:旨在考察恩诺沙星灌注液与恩诺沙星普通注射液在母猪体内的药代动力学特征。作者选用16头健康长白×大白二元杂交成年母猪,随机分成2组,每组8头,分别进行单剂量耳缘静脉注射恩诺沙星普通注射液(2.5 mg·kg-1)和子宫灌注恩诺沙星灌注液(50 mL·头-1),反相高效液相色谱法(RP-HPLC)测定母猪血浆中恩诺沙星及其代谢产物环丙沙星含量,运用药动学软件Winnonlin 5.2.1非房室模型分析并计算出相关药动学参数。结果显示,静脉注射恩诺沙星普通注射液后,其主要药动学参数如下:t1/2(21.71±1.66)h,Vd(1.89±0.33)L·kg-1,Cl(60.18±8.92)mL·h-1·kg-1,AUC0-t(39.94±5.75)mg·h·L-1,AUC0-∞(42.32±6.03)mg·h·L-1。母猪子宫灌注恩诺沙星灌注液后,其主要药动学参数分别如下:t1/2(28.55±2.31)h,Tmax(3.19±1.46)h,Cmax(1.61±0.20)mg·L-1,AUC0-t(49.06±5.18)mg·h·L-1,AUC0-∞(53.55±5.84)mg·h·L-1,F为63.15%。所有样品中均未检测出环丙沙星。结果表明,恩诺沙星灌注液可经子宫灌注吸收进入母猪体内,并且在母猪体内分布广泛,消除缓慢,生物利用度较高,临床用药时应考虑局部给药对机体的全身性影响。
关键词:恩诺沙星;子宫灌注液;药代动力学;母猪
母猪子宫内膜炎发病的主要原因是病原微生物感染[1]。慢性和隐形子宫内膜炎往往在断奶后发情时才会出现流脓症状,此时用常规抗生素疗法,效果不佳,易发生母猪屡配不孕和产仔率下降。因而正确使用药物预防和治疗母猪子宫内膜炎尤为重要。目前常见的预防和治疗母猪产后感染的方法有产前口服、产后肌肉注射抗菌药物[2]。母猪产前正处于攻胎期,采食量增加,易发生消化不良,此时在饲料中添加抗菌药物,不仅会破坏肠道有益菌群,进一步降低母猪消化功能,造成药源性便秘,而且易产生胚胎毒性,影响母猪生殖健康。产后母猪子宫中易发生胎衣碎片、组织液和血液等异物滞留,破坏子宫内环境,单纯的肌肉注射抗菌药物进行消炎是不够的。恩诺沙星为广谱抗菌药物,杀菌作用强,子宫灌注制剂可直接作用于宫内的病原微生物。
作为一种动物专用的广谱喹诺酮类抗菌药物,恩诺沙星主要通过抑制细菌脱氧核糖酸回旋酶(gyrase)和拓扑异构酶(topoisomerase)Ⅳ,干扰DNA的正常转录与复制而呈现抗菌作用[3-4]。恩诺沙星经静脉注射、颈部肌肉注射和口服给药后在仔猪体内的药动学研究已有报道[5-6];许多研究探寻改变恩诺沙星制剂和给药方式以增强药物靶向性和提高局部药物浓度[7-10]。子宫灌注恩诺沙星治疗马子宫炎已有研究[11],但未有恩诺沙星通过子宫给药在成年母猪体内药动学的研究报道。作者研究了恩诺沙星灌注液通过子宫灌注给药后在健康母猪体内的药动学特征,对恩诺沙星灌注液作药动学评价,考察子宫用药时,恩诺沙星在母猪体内的吸收、分布及代谢,并结合药效学探讨恩诺沙星灌注液治疗母猪子宫炎的效果,制定合理的给药方案。
1材料与方法
1.1药品与试剂
恩诺沙星灌注液(含量50 mL:1 g),华南农业大学提供,试验前测定药物的有效含量(以恩诺沙星计)为2.05%;恩诺沙星普通注射液(拜有利注射液,含量5%,批号KP08FDW)由德国拜耳动物保健有限公司(成都)提供;恩诺沙星对照品(含量99.9%,批号H0081206)和盐酸环丙沙星对照品(含量99.8%,批号H0101310)均由中国兽医药品监察所提供;磷酸,三乙胺等均为国产分析纯试剂;甲醇(批号HX080945)为德国产色谱纯级试剂;乙腈(批号083889)为美国Fisher Scientific公司产色谱纯级试剂。
1.2仪器设备
Waters高效液相色谱系列(2695 Alliance型泵,2475型多波长荧光检测器);菲罗门Gemini C18色谱柱(4.6 mm×250 mm,5 μm);电子分析天平(日本岛津Shimadzu AUW120D型);台式高速离心机(德国Centrifuge 5804型);可调微量移液器(德国Eppendorf Research型)等。
1.3标准储备液和标准工作液
恩诺沙星标准储备液:甲醇溶解恩诺沙星对照品,配制质量浓度为500 μg·mL-1;环丙沙星标准储备液:取环丙沙星对照品用甲醇溶解配制为500 μg·mL-1;恩诺沙星和环丙沙星混合标准储备液:恩诺沙星和环丙沙星含量均为250 μg·mL-1。三者均于4 ℃避光保存。临用前使用0.05 mol·L-1磷酸溶液将恩诺沙星和环丙沙星混合标准储备液稀释为系列标准工作液。
1.4实验动物分组与给药
健康长白×大白二元杂交母猪16头,生长期3~4年,体重(213.3±24.5)kg。试验前按常规饲养,饲料为全价日粮(不含抗菌药物),临床观察1周,表现健康。动物随机分为2组,每组8头,给药方法分别为耳缘静脉注射拜有利注射液和子宫灌注恩诺沙星灌注液。静脉注射组给药剂量为单次给药2.5 mg·kg-1,子宫灌注组给药剂量为单次给药50 mL·头-1。子宫灌注时,先用0.1%新洁尔灭溶液消毒母猪外阴部,再使用一次性输精管以常规配种方式将药液输入母猪子宫内。
1.5血样采集
站立式保定猪,自前腔静脉采血,每次采血5 mL左右,给药前采一次空白血(0 h)。给药后分别于0.083、0.167、0.25、0.5、0.75、1、1.5、2、3、4、6、9、12、16、24、36、48、72和96 h采集血液样品。采集后立即将样品置于含0.5%肝素钠抗凝管中,离心10 min(3 000 r·min-1),分离血浆,置-20 ℃冰箱保存,待测。
1.6血药浓度测定
1.6.1血浆样品前处理取血浆样品0.5 mL于2 mL进口离心管中,加入1 mL色谱甲醇,微型旋涡混合仪涡旋混匀,置轨道式摇床上振荡10 min。12 000 r·min-1(4 ℃)离心10 min,吸取上清液,经0.22 μm微孔滤膜过滤至2 mL棕色进样瓶,进行RP-HPLC荧光检测。1.6.2色谱条件色谱柱:C18,250 mm×4.6 mm×5 μm,美国Gemini公司;流动相:0.05 mol·L-1磷酸液(三乙胺调节pH至2.4)∶乙腈 =80∶20;柱温:30 ℃;流速:1.0 mL·min-1;进样体积:20 μL;荧光检测器:激发波长为278 nm,发射波长为455 nm。1.6.3检测限与定量限取空白血浆450 μL,加入恩诺沙星和环丙沙星混合标准工作液,分别制得0.005、0.01、0.02、0.05、0.10、0.20 μg·mL-1系列质量浓度的加标样品。按照“1.6.1”方法进行血浆药物提取,在“1.6.2”色谱条件下测定,以S/N≥ 3的血药质量浓度为检测限(LOD),S/N≥ 10的血药质量浓度为定量限(LOQ)。
1.6.4外标法标准曲线和线性范围取空白血浆450 μL,加入50 μL恩诺沙星和环丙沙星混合标准工作液,分别制得0.02、0.05、0.20、0.50、2.00、5.00 μg·mL-1系列质量浓度的加标样品。按照“1.6.1”方法进行血浆药物提取,按“1.6.2”色谱条件进行测定。将恩诺沙星与环丙沙星色谱峰面积(A)分别与其药物浓度(C)作线性回归,绘制标准曲线,求得各自的标准曲线的回归方程和相关系数。
1.6.5回收率与精密度将恩诺沙星和环丙沙星混合标准工作液加入空白母猪血浆中,制得低(0.02 μg·mL-1)、中(0.20 μg·mL-1)和高(2.00 μg·mL-1)三个样品浓度,每个浓度设5个平行,分3个批次,按“1.6.1”方法处理血浆样品,进行RP-HPLC检测并计算回收率与精密度。
1.7数据处理与统计分析
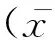
2结果
2.1色谱条件的适用性
在上述处理方法和色谱条件下,恩诺沙星、环丙沙星与血浆中其他组分分离良好,色谱峰保留时间分别为9.1和7.2 min左右,见图1~4。
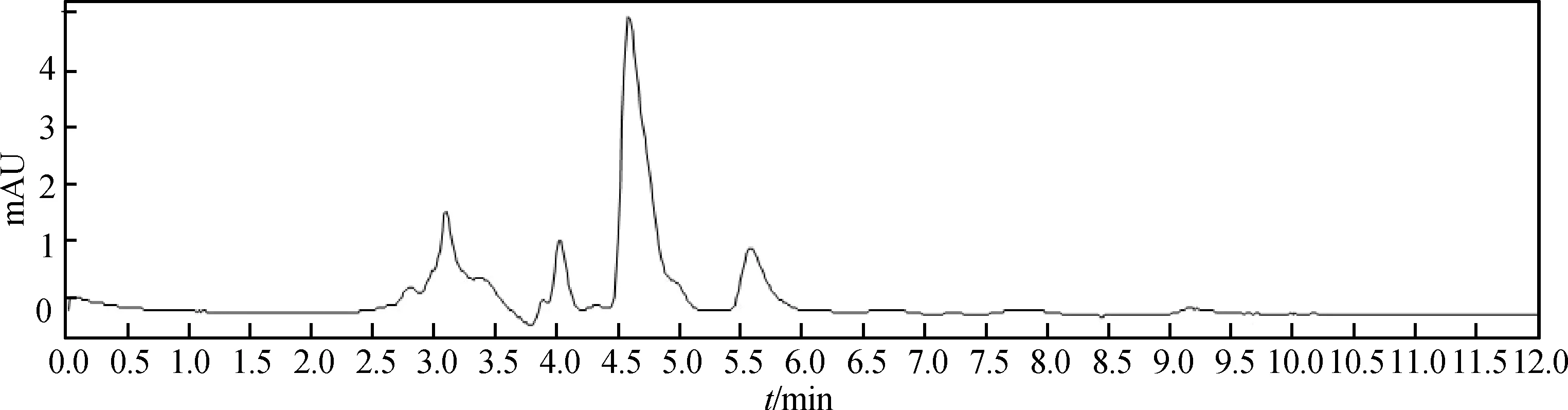
图1 母猪空白血浆样品色谱图Fig.1 Chromatograms of blank plasma samples of sows

图2 恩诺沙星(ENRO,0.02 μg·mL-1)和环丙沙星(CIPRO,0.02 μg·mL-1)混合标准液样品色谱图Fig.2 Mixed standard liquid chromatogram of enrofloxacin (ENRO,0.02 μg·mL-1) and ciprofloxacin (CIPRO,0.02 μg·mL-1)
图3 母猪空白血浆添加恩诺沙星(0.02 μg·mL-1)和环丙沙星(0.02 μg·mL-1)混合标准液的样品色谱图Fig.3 Liquid chromatogram of blank plasma added with enrofloxacin (0.02 μg·mL-1) and ciprofloxacin (0.02 μg·mL-1)

图4 子宫灌注给药(50 mL·头-1)后12 h母猪血浆样品色谱图Fig.4 Chromatogram of sample collected at 12 h after intrauterine administration(50 mL per sow)
2.2检测限与定量限
母猪血浆中恩诺沙星和环丙沙星的检测限均为0.01 μg·mL-1,定量限均为0.02 μg·mL-1。结果表明该方法灵敏度高,可以满足血浆中恩诺沙星和环丙沙星检测需要。
2.3外标法标准曲线和线性范围
空白血浆添加恩诺沙星和环丙沙星的质量浓度为0.02~5.00 μg·mL-1,线性关系良好,回归方程分别为C=2 953 365A-164 817(r=0.999 2)和C=1 134 412A-51 395(r=0.998 3)。
2.4回收率与精密度
恩诺沙星的平均回收率为(93.05 ± 5.21)%,批内变异系数小于7.36%,批间变异系数小于6.91%;环丙沙星的平均回收率为(99.17 ± 7.23)%,批内变异系数小于9.38%,批间变异系数小于8.51%。结果表明该方法回收率高,批内和批间变异系数较小,满足生物样品测定要求。
2.5血药质量浓度和主要药动学参数
健康成年母猪耳缘静脉注射恩诺沙星普通注射液(2.5 mg·kg-1)和子宫灌注恩诺沙星灌注液(50 mL·头-1)后的药时曲线见图5。本研究检出环丙沙星最高值在定量限以下,说明恩诺沙星在母猪血浆内代谢转化极少,故未对其代谢物环丙沙星进行药动学研究。
采用Winnonlin 5.2.1软件的非房室模型处理药—时数据,计算得出各组药动学参数,见表1。由表1可见,静脉注射给药后,表观分布容积(Vd)为(1.89±0.33)L·kg-1,终末半衰期(t1/2)为(21.71±1.66)h,药时曲线下面积(AUC0-t)为(39.94±5.75)mg·h·L-1,AUC0-∞为(42.32±6.03)mg·h·L-1,平均滞留时间(MRT)为(29.03±4.22)h。子宫灌注组的达峰时间(Tmax)为(3.19±1.46)h,达峰浓度(Cmax)为(1.61±0.20)mg·L-1,AUC0-t为(49.06±5.18)mg·h·L-1,AUC0-∞为(53.55±5.84)mg·h·L-1,MRT为(38.65±4.55)h。
3讨论与结论
3.1恩诺沙星在成年母猪体内的药动学特征
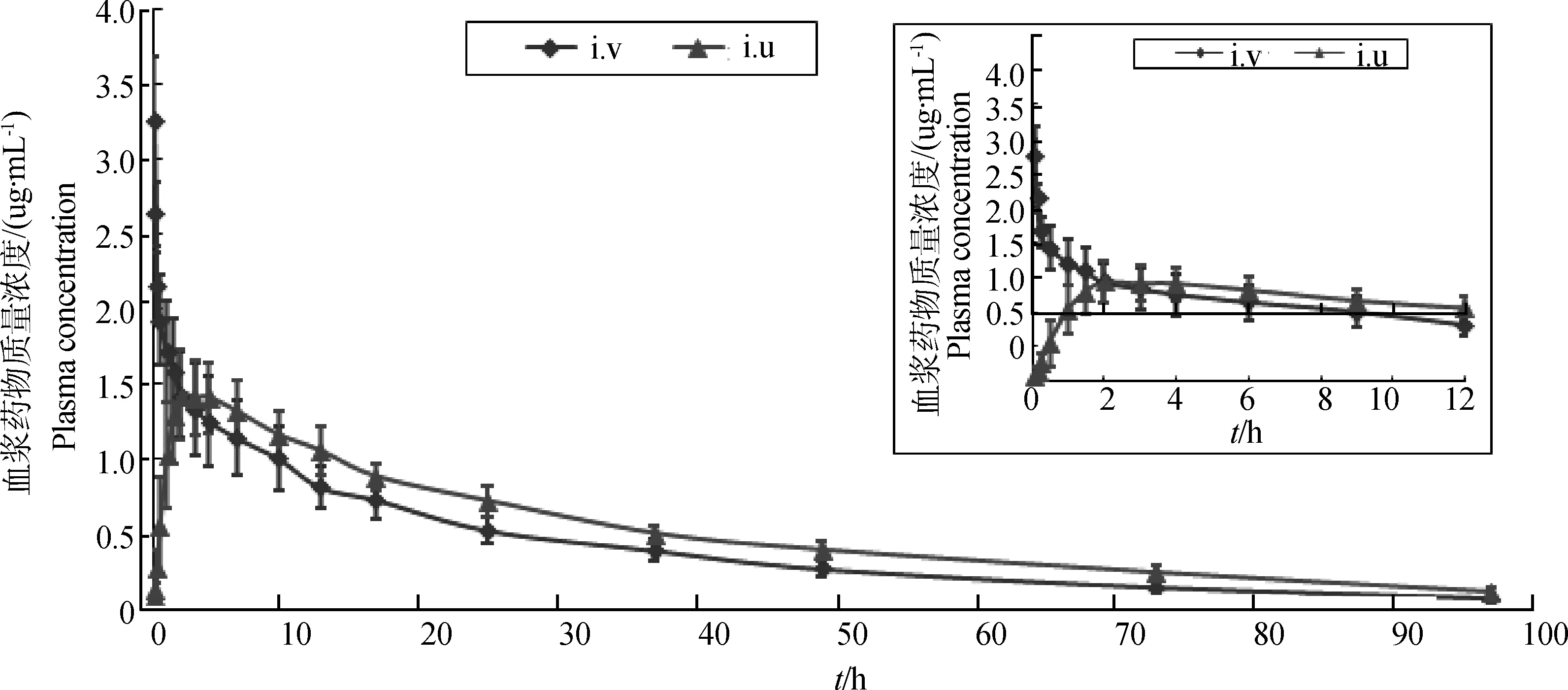
图5 母猪单剂量静脉注射恩诺沙星普通注射液(i.v.,2.5 mg·kg-1)、子宫灌注恩诺沙星灌注液(i.u.,50 mL·头-1)的药时曲线Fig.5 Plasma concentration vs.time curves of enrofloxacin in sows after intravenous (2.5 mg·kg-1) and intrauterine (50 mL per sow) administration at a single dose
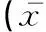
表1 成年母猪静脉注射恩诺沙星普通注射液(2.5 mg·kg-1)、子宫灌注恩诺沙星子宫灌注液(50 mL·头-1)的药动学参数±s)
母猪静脉注射恩诺沙星普通注射液(2.5 mg·kg-1)后,恩诺沙星的表观分布容积Vd为1.89 L·kg-1,表明恩诺沙星在成年母猪体内组织分布广。其他喹诺酮类药物亦见相似特征,麻保沙星和二氟沙星在健康猪的Vd分别为1.27 L·kg-1[12]和4.91 L·kg-1[13]。t1/2为21.71 h,表明恩诺沙星在健康成年母猪体内消除缓慢,显著高于J.T.Howard等报道的16.1 h[9]。与其他氟喹诺酮类药物在健康猪体内的t1/2相比,显著高于麻保沙星(16.22 h)[14]和达氟沙星(8.0 h)[15],与二氟沙星(25.79 h)[16]相似。 子宫灌注恩诺沙星灌注液(50 mL·头-1)后,恩诺沙星在健康成年母猪体内的药动学参数为:Cmax1.61 mg·L-1,Tmax3.19 h,t1/228.55 h,AUC0-∞(53.55±5.84) mg·h·L-1,F63.15%,表明恩诺沙星经子宫灌注后,吸收迅速,消除缓慢,生物利用度较高。Tmax高于肌肉注射和内服恩诺沙星(2.5 mg·kg-1)在健康猪体内的 1.21 h和0.97 h[17],原因可能是因为灌注液为混悬液,其吸收速度受药物溶出速度和扩散速度的限制,延缓了药物吸收。消除缓慢的原因可能是灌注液在母猪子宫内吸收速度缓慢,导致在消除相内仍有药物持续吸收。
3.2给药方案
子宫内膜炎是病原微生物侵入母猪子宫黏膜表层或深层,引起的子宫黏膜的黏液性或脓性炎症过程,主要病原菌为金黄色葡萄球菌、链球菌、绿脓杆菌、大肠杆菌和沙门菌等[1,18-19]。恩诺沙星对猪金黄色葡萄球菌的MIC90为0.25 μg·mL-1,对大肠杆菌和沙门氏菌的MIC90均小于0.128 μg·mL-1,对绿脓杆菌的MIC90为2.04 μg·mL-1,对链球菌的MIC90小于0.75 μg·mL-1[20]。恩诺沙星是浓度依赖性药物,在Cmax/MIC>8、AUC24/MIC>125可发挥良好的细菌学疗效[21]。有研究表明,马子宫内灌注恩诺沙星(2.5 mg·kg-1)后,血浆AUC仅为子宫组织AUC的0.63%[11];环丙沙星通过对人体子宫给药后,药物在阴道组织的浓度要比血浆中的高2~5倍[22]。因而,子宫内组织浓度可能远高于血浆中药物浓度。成年母猪按50 mL·头-1单剂量子宫灌注恩诺沙星子宫灌注液,AUC24为 (24.62±2.62) mg·h·mL-1,对于猪大肠杆菌、葡萄球菌、链球菌的AUC24/MIC远远大于125;灌注给药后,血药浓度在3 h左右达到峰浓度(1.61 μg·mL-1),给药后48 h血药浓度仍维持在0.34 μg·mL-1以上。结合市售恩诺沙星的给药方案,在进行恩诺沙星灌注液治疗母猪子宫内膜炎时,建议给药方案:子宫灌注,每日1次,剂量 50 mL·头-1,疗程3 d。
参考文献(References):
[1]叶健毅,赵学峰,兰邹然,等.规模化猪场母猪子宫内膜炎致病菌的分离鉴定[J].畜牧兽医杂志,2011,30(1):5-7.
YE J Y,ZHAO X F,LAN Z R,et al.Pathogenic bacteria isolation and identification of sow endometritis in scale breeding pig[J].JournalofAnimalScienceandVeterinaryMedicine,2011,30(1):5-7.(in Chinese)
[2]李想.宫炎净灌注液对母猪子宫内膜炎的临床疗效观察[J].中国猪业,2015(1):51-54.
LI X.Treatment effect of Gongyanjing perfusate on endometritis in sows[J].ChinaSwineIndustry,2015(1):51-54.(in Chinese)
[3]WOLFSON J S,HOOPER D C.The fluoroquinolones:structures,mechanisms of action and resistance,and spectra of activityinvitro[J].AntimicrobAgentsChenother,1985,28(4):581-586.
[4]VANCUTSEM P M,BABISH J G,SCHWARK W S.The fluoroquinolone antimicrobials:structure,antimicrobial activity,pharmacokinetics,clinical use in domestic animals and toxicity[J].CornellVet,1990,80(2):173-186.
[5]NIELSEN P,GYRD-HANSEN N.Bioavailability of enrofloxacin after oral administration to fed and fasted pigs[J].PharmacolToxicol,1997,80(5):246-250.
[6]PIJPERS A,HEINEN E.Enrofloxacin pharmacokinetics after intravenous and intramuscular administration in pigs[J].JVetPharmacolTher,1997,20(1):13.
[7]GORE S R,HARMS C A,KUKANICH B,et al.Enrofloxacin pharmacokinetics in the European cuttlefish,Sepia officinalis,after a single i.v.injection and bath administration[J].JVetPharmacolTher,2005,28(5):433-439.
[8]PEYROU M,BOUSQUET-MELOU A,LAROUTE V,et al.Enrofloxacin and marbofloxacin in horses:comparison of pharmacokinetic parameters,use of urinary and metabolite data to estimate first-pass effect and absorbed fraction[J].JVetPharmacolTher,2006,29(5):337-344.
[9]HOWARD J T,BAYNES R E,BROOKS J D,et al.The effect of breed and sex on sulfamethazine,enrofloxacin,fenbendazole and flunixin meglumine pharmacokinetic parameters in swine[J].JVetPharmacolTher,2014,37(6):531-541.
[10]LASHEV L D,DIMITROVA D J,MILANOVA A,et al.Pharmacokinetics of enrofloxacin and marbofloxacin in Japanese quails and common pheasants[J].BrPoultSci,2015,56(2):255-261.
[11]FUMUSO E,CHECURA C,LOSINNO L,et al.Endometrial tissue concentrations of enrofloxacin after intrauterine administration to mares[J].VetResCommun,2002,26(5):371-380.
[12]PETRACCA K,RIOND J L,GRASER T,et al.Pharmacokinetics of the gyrase inhibitor marbofloxacin:influence of pregnancy and lactation in sows[J].ZentralblVeterinarmedA,1993,40(1):73-79.
[13]DING H Z,YANG G X,HUANG X H,et al.Pharmacokinetics of difloxacin in pigs and broilers following intravenous,intramuscular,and oral single-dose applications[J].JVetPharmacolTher,2008,31(3):200-204.
[14]李云峰,曾振灵,陈杖榴,等.麻保沙星(marbofloxacin)在猪体内的药物动力学[J].中国兽医学报,2004,24(2):177-180.
LI Y F,ZENG Z L,CHEN Z L,et al.Pharmacokinetics of marbofloxacin in pigs[J].ChineseJournalofVeterinary,2004,24(2):177-180.(in Chinese)
[15]MANN D D,FRAME G M.Pharmacokinetic study of danofloxacin in cattle and swine[J].AmJVetRes,1992,53(6):1022-1026.
[16]曾振灵,丁焕中,黄显会,等.二氟沙星在猪体内的药物动力学及生物利用度研究[J].中国农业科学,2003,36(7):846-850.
ZENG Z L,DING H Z,HUANG X H,et al.Pharmacokinetics and bioavailability of difloxacin in pigs[J].ScientiaAgriculturaSinica,2003,36(7):846-850.(in Chinese)
[17]曾振灵,冯淇辉.恩诺沙星在猪体内的生物利用度及药物动力学研究[J].中国兽医学报,1996,16(6):607-613.
ZENG Z L,FENG Q H.Pharmacokinetics and bioavailability of enrofloxacin in pigs[J].ChineseJournalofVeterinaryScience,1996,16(6):607-613.(in Chinese)
[18]DE WINTER P J J,VERDONCK M,DE KRUIF A,et al.Bacterial endometritis and vaginal discharge in the sow:prevalence of different bacterial species and experimental reproduction of the syndrome[J].AnimReprodSci,1995,37(3-4):325-335.
[19]DE WINTER P J J,VERDONCK M,DE KRUIF A,et al.Endometritis and vaginal discharge in the sow[J].AnimReprodSci,1992,28(1-4):51-58.
[20]SCHEER M.Enrofloxacin (Baytril) microbiological profile and pharmacokinetics in several species of animal//Veterinary Pharmacology,Toxicology and Therapy in Food Producing Animals[M].Simon F,eds.Budapest:University of Veterinary Science-Unipharma Co Ltd,1990:15-20.
[22]DALHOFF A,WEUTA H.Penetration of ciprofloxacin into gynecologic tissues[J].AmJMed,1987,82(4A):133-138.
(编辑白永平)
doi:10.11843/j.issn.0366-6964.2016.07.024
收稿日期:2016-01-13
基金项目:国家科技支撑计划(2015BAD11B03-06)
作者简介:冯庭松(1991-),男,安徽长丰人,硕士生,主要从事畜禽药动学及药效学研究,E-mail:18819474592@163.com *通信作者:刘宇(1960-),男,副教授,E-mail:lyscau@foxmail.com;黄显会(1969-),男,高级兽医师,E-mail:huangxianhuiscau@foxmail.com
中图分类号:S859.7
文献标志码:A
文章编号:0366-6964(2016)07-1488-07
Pharmacokinetics of Enrofloxacin Perfusate in Healthy Sows
FENG Ting-song,HUANG Xian-hui*,ZENG Song-qing,GAO Jin,XIE Shun,LIU Yu*
(CollegeofVeterinaryMedicine,SouthChinaAgriculturalUniversity,Guangzhou510642,China)
Abstract:This study was designed to compare the pharmacokinetic parameters of enrofloxacin following intravenous and intrauterine administrations to investigate their bioavailability in sows.16 cross-bred (Landrace×Yorkshire) healthy,adult,non-lactating sows,were used.The sows were randomly divided into two groups with eight animals each.The sows of first group were administered with enrofloxacin injection by intravenous route,at a single dose of 2.5 mg·kg-1;whereas those of second group were administered with enrofloxacin uterine perfusate by intrauterine administration at a single dose of 50 mL per sow.Enrofloxacin concentrations were determined by reverse phase-high performance liquid chromatography (RP-HPLC) with fluorescence detection.A non-compartmental analysis of drug plasma concentration vs.time profiles was performed with pharmacokinetic modeling using Winnonlin software.Following intravenous administration,the main pharmacokinetic parameters were as follows:t1/2(21.71±1.66)h,Vd(1.89±0.33)L·kg-1, Cl(60.18±8.92)mL·h-1·kg-1,AUC0-t(39.94±5.75)mg·h·L-1,AUC0-∞(42.32±6.03)mg·h·L-1.The absorption of enrofloxacin was rapid and well absorbed after intrauterine administration,with t1/2of (28.55±2.31)h,Tmaxof (3.19±1.46)h,Cmaxof (1.61±0.20)mg·L-1,AUC0-tof (49.06±5.18)mg·h·L-1,AUC0-∞(53.55±5.84)mg·h·L-1.The absolute bioavailability (F) was 63.15%.Concentrations of the active metabolite ciprofloxacin were not detected in any samples.The results showed that the sows can absorb enrofloxacin well by way of intrauterine administration,with slow elimination and high bioavailability.And the effect on body after intrauterine administration should be considered.
Key words:enrofloxacin;uterine perfusate;pharmacokinetics;sows
