绵羊季节性繁殖相关基因TSHR外显子多态性研究
2016-08-09轩俊丽马晓萌王慧华曹家雪魏彩虹赵福平马友记杜立新
轩俊丽,马晓萌,王慧华,3,曹家雪,魏彩虹,赵福平,马友记,张 莉*,杜立新*
(1.甘肃农业大学动物科学技术学院,兰州 730070; 2.中国农业科学院北京畜牧兽医研究所,北京 100193)
绵羊季节性繁殖相关基因TSHR外显子多态性研究
轩俊丽1,2,马晓萌2,王慧华2,3,曹家雪2,魏彩虹2,赵福平2,马友记1*,张莉2*,杜立新1,2*
(1.甘肃农业大学动物科学技术学院,兰州 730070; 2.中国农业科学院北京畜牧兽医研究所,北京 100193)
摘要:旨在研究乌珠穆沁羊与湖羊这两种具有不同繁殖性能和发情周期绵羊的促甲状腺激素受体(Thyroid stimulating hormone receptor,TSHR)基因外显子区遗传变异特性及其构建的单倍型在品种间的分布和对mRNA和蛋白质二级结构的影响,为进一步揭示其对TSHR表达调控的影响及表型效应奠定基础。本研究采用直接测序的方法对中国蒙古系2个绵羊品种共172个个体TSHR基因的遗传变异情况进行分析。共发现了6个突变位点,独立性卡方检验发现SNP1、SNP3、SNP4和SNP5 4个多态位点的基因型在两个绵羊群体间的分布存在极显著差异(P<0.01),其中SNP5为错义突变,其余为同义突变;对这4个位点进行连锁不平衡分析发现,SNP3和SNP4两个位点完全连锁,其余位点两两之间存在不同程度连锁关系;生物信息学分析发现不同的单倍型使TSHR基因的mRNA二级结构发生改变,SNP5使受体蛋白的二级结构发生改变。结果提示:(1)TSHR基因外显子区存在4个在两个绵羊品种中具有潜在生物学功能和表型效应的突变位点,可组成H1~H6共6种单倍型,其中H1(CGCC)和H4(TTTG)分别在乌珠穆沁羊和湖羊群体中为优势单倍型,这可能与这两种绵羊不同的发情周期有关。(2)外显子区SNP5位点突变影响mRNA和蛋白质二级结构的稳定性,可能是具有潜在表型效应的重要功能位点。
关键词:绵羊;季节性繁殖;TSHR基因;多态性
季节性繁殖活动是哺乳动物对各种环境因素变化的一种适应性保护行为,其中,光周期变化是影响这一活动的主要环境因素。其机理:褪黑激素(Melatonin,MEL)通过下丘脑—垂体—性腺轴(Hypothalamic-pituitary-gonadal axis,HPGA)系统来调节促性腺激素释放激素(Gonadotropin releasing hormone,GnRH)、促性腺激素、黄体生成素以及孕激素等的合成与释放,进而影响哺乳动物的季节性繁殖活动[1-2]。近些年的研究表明,TSHR基因也能影响动物的季节性繁殖活动。
TSHR属于G蛋白偶联受体家族,主要分布于甲状腺,能够通过特异性结合甲状腺激素来提高甲状腺摄入碘的能力,促进甲状腺的生长发育及甲状腺激素的合成分泌。TSHR不仅仅在甲状腺中表达,它也可表达于绵羊的脑部(如下丘脑、松果体和垂体等)、卵巢和血液中[3]。赵赓等[4]研究发现,绵羊卵巢和下丘脑中的TSHR基因序列具有很高的相似性,并推测TSHR可以通过调节神经内分泌过程来影响绵羊的季节性繁殖活动。E.A.Hanon等[5]在Soay绵羊中研究发现光照长短能够影响TSH及其受体TSHR的表达,TSHR能够受到光周期的影响调节绵羊的季节性繁殖活动。进一步研究表明,TSHR在动物脑部中的表达主要集中在第三脑室内皮细胞(Endothelial cell,EC)和垂体结节部[6]。EC细胞能够连通垂体门脉系统和第三脑室的脑脊液(Cerebrospinal fluid,CSF),且能与下丘脑中的GnRH神经元形成突触连接,而CSF中存在大量MEL,其浓度随光周期变化而变化[7]。由此可见,TSHR可能会受光周期的作用,影响GnRH和MEL的分泌,进而影响动物的季节性繁殖活动。C.Viguie等[8]通过试验对其进行了验证,结果发现绵羊的甲状腺被切除后会一直处于季节性繁殖状态,直到在其脑室注射T4后,才对光周期信号重新产生反应,进入休情期。
综上所述,TSHR对绵羊的季节性繁殖活动具有重要作用,它可能通过PT(垂体)-TSH-TSHR-DIO2/DIO3(下丘脑)-TH-GnRH通路,使绵羊感知光照的季节性差异,从而影响松果体分泌MEL,进而影响通路下游GnRH的分泌,并最终影响绵羊季节性的发情行为和繁殖活动[9]。
绵羊是季节性多次发情的动物。中国寒冷地区的绵羊品种,如乌珠穆沁羊及呼伦贝尔羊等绵羊的发情周期处于6月下旬到12月末或来年1月初,主要集中于9~11月份。而湖羊和小尾寒羊等温暖地区的绵羊品种,发情不存在明显的季节性,但也具有秋季较为旺盛的规律。因此,本试验以乌珠穆沁羊和湖羊为研究对象,全面了解TSHR基因SNP多态性、单倍型组成及其在不同群体中的分布,明确各单倍型对mRNA二级结构及其蛋白质二级结构的影响,将有助于筛选出具有潜在生物学功能的单倍型组合,为下一步筛选合适的相关表型进行全基因组关联分析奠定基础。
1材料与方法
1.1试验材料
以两个绵羊品种共172只个体为研究对象,其中乌珠穆沁绵羊(Ujumqin sheep)96只,湖羊(Hu sheep)76只,分别来自内蒙古东乌珠穆沁旗的乌珠穆沁羊原种场和苏州市湖羊种羊场。绵羊颈静脉采血5 mL,肝素抗凝,-20 ℃保存。
1.2基因组DNA提取、检测及DNA池构建
利用动物血液基因组DNA提取试剂盒(天根,北京)提取血样基因组DNA,并用含核酸染料的1%琼脂糖凝胶电泳和紫外分光光度计检测其完整性、含量及纯度。从两个品种中各随机抽取DNA样20份,每个样品各取1 μL,分别构建两个品种基因组DNA池。
1.3SNP检测
1.3.1引物设计与合成通过NCBI网站的GenBank数据库,获得绵羊TSHR基因(NM_001009410.1)外显子序列,利用Primer 3.0在线软件设计12对覆盖TSHR基因外显子的PCR扩增引物(表1),交由天一辉远生物科技有限公司(北京)合成。
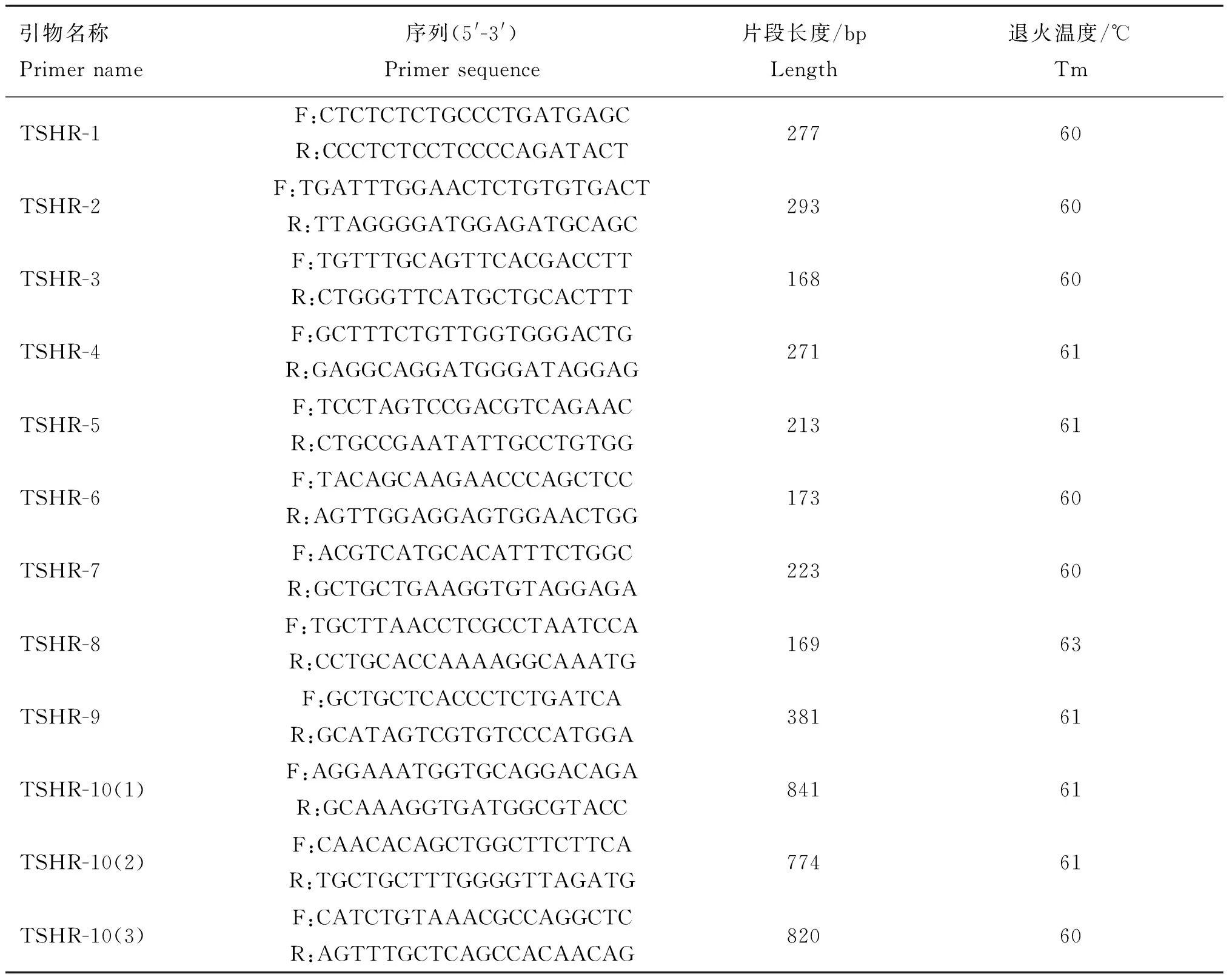
表1 引物序列和扩增产物
1.3.2PCR扩增与测序PCR扩增反应体系(25 μL)包括约20 ng·μL-1的基因组DNA 2 μL,10 pmol的上下游引物各1 μL,2×Taq PCR Master Mix(内含TaqDNA聚合酶、Mg2+dNTPs等)(北京 天根)12.5 μL,灭菌双蒸水8.5 μL。PCR反应程序:95 ℃预变性5 min;94 ℃变性30 s,退火温度退火30 s(退火温度见表1),72 ℃延伸70 s,32个循环;72延伸10 min;4 ℃保存。
PCR扩增产物经1%琼脂糖电泳检测后送北京天一辉远生物科技有限公司回收纯化后进行混池测序。
1.3.3飞行时间质谱(TOF-MS)分析通过混池测序的方法,寻找峰图清晰、有明显双峰的位点,确定其为SNP位点,并应用TOF-MS方法对SNP位点进行基因型分析。为了验证分型的准确率,本试验采用直接测序的方法检验了一部分样品的分型结果。
1.4TSHR基因群体遗传结构分析
利用PopGene1.32软件对SNPs位点进行等位基因频率、基因型频率、有效等位基因数及多态信息含量(Polymorphism information content,PIC)等群体遗传特性进行分析[10];利用χ2适合性检验进行符合Hardy-Weinberg平衡的检验;并利用独立性卡方检验分析等位基因在绵羊品种中的分布[11]。
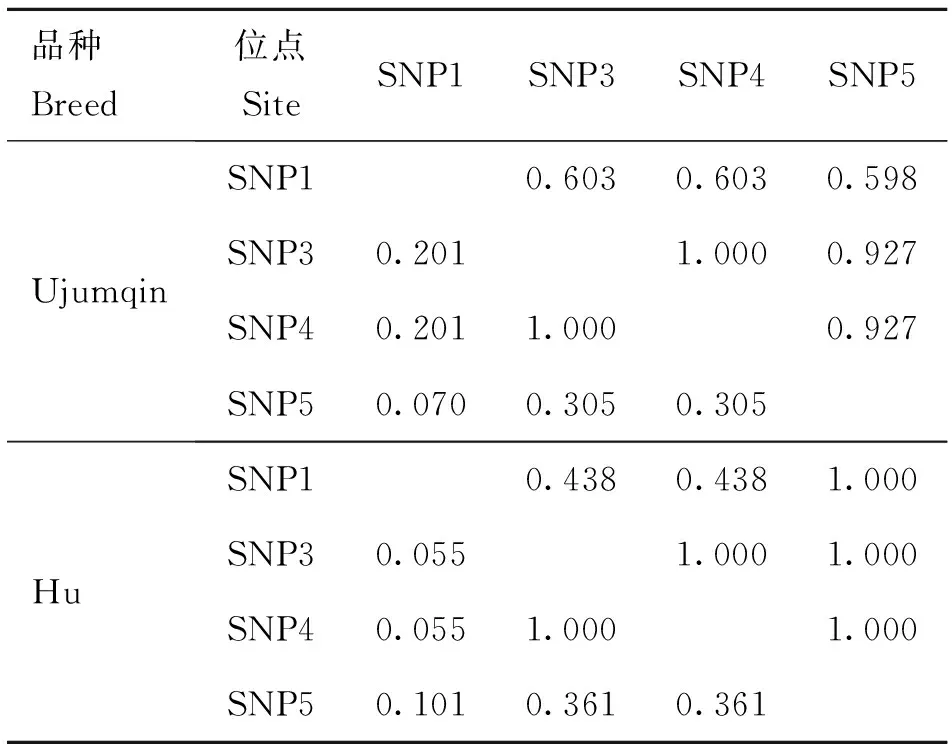
1.5连锁不平衡(LD)和单倍型分析
使用Haploview 4.2软件对卡方独立性检验中差异显著的位点进行连锁不平衡分析及单倍型的构建。
1.6SNP对TSHR基因mRNA及蛋白质二级结构的影响
运用在线软件RNAfold web server(http://rna.tbi.univie.ac.at/cgi-bin/RNAfold.cgi)进行mRNA二级结构预测。运用在线软件(https://npsa-prabi.ibcp.fr/cgi-bin/npsa_automat.pl?page= npsa sopm.html)进行蛋白质二级结构预测。
2结果
2.1混池测序及SNP鉴定
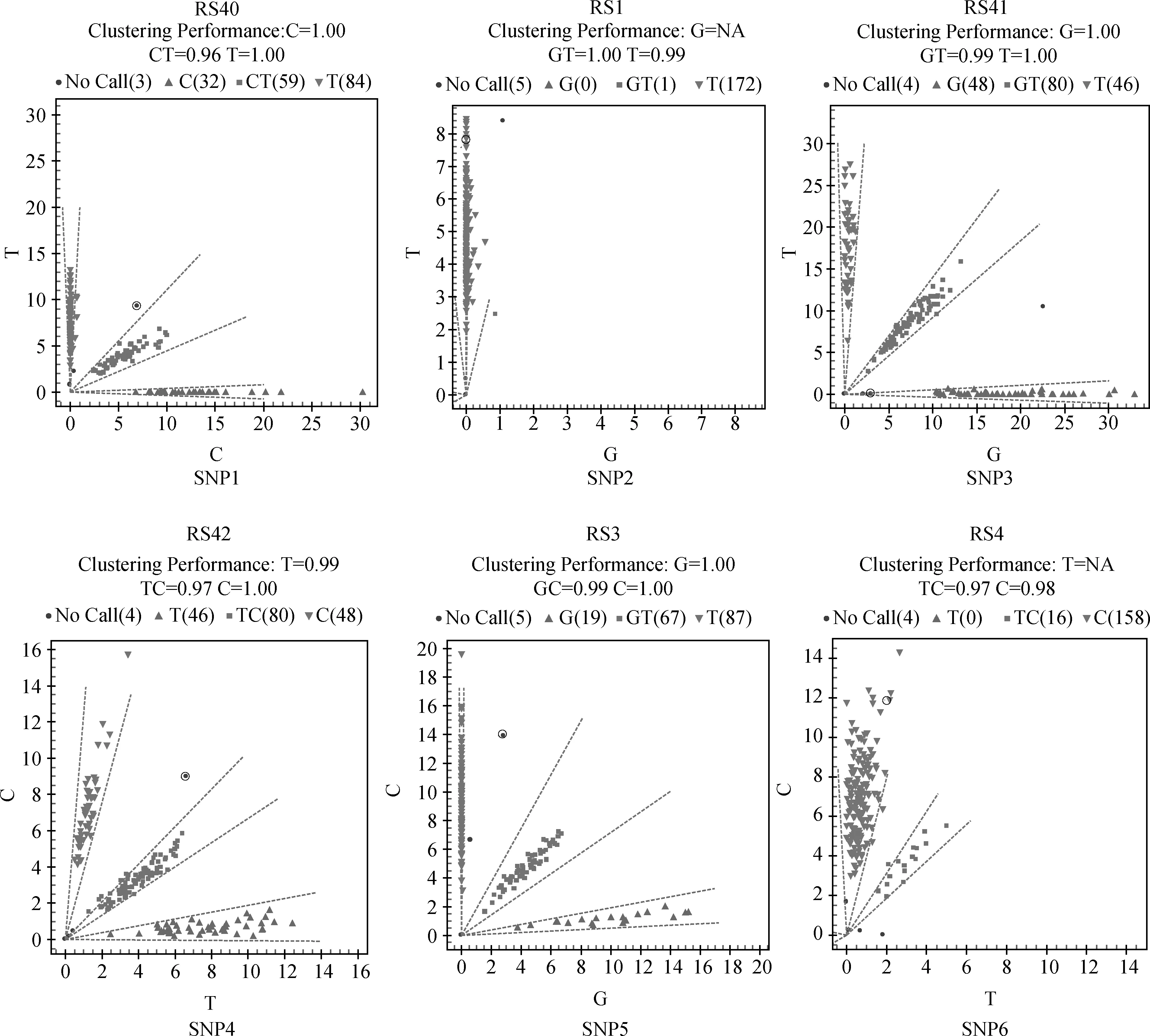
利用动物血液基因组DNA提取试剂盒提取基因组DNA,将所提取的DNA用分光光度计和含核酸染料的1%琼脂糖凝胶电泳进行检测,结果表明DNA质量符合测序标准,可用于下一步试验。利用所设计的12对引物,以构建的DNA池为模板进行PCR扩增,扩增产物经检验后送公司测序,测序结果如图1所示。
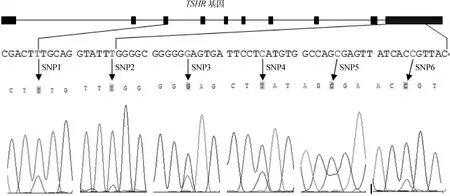
图1 TSHR基因结构示意图及6个SNPs基因型测序Fig.1 TSHR gene structure and sequencing results of the 6 SNPs
在TSHR基因外显子上共发现了6个多态性位点,分别命明为SNP1~SNP6,以TSHR基因外显子第一位为+1,6个SNPs位点具体信息如表2所示。
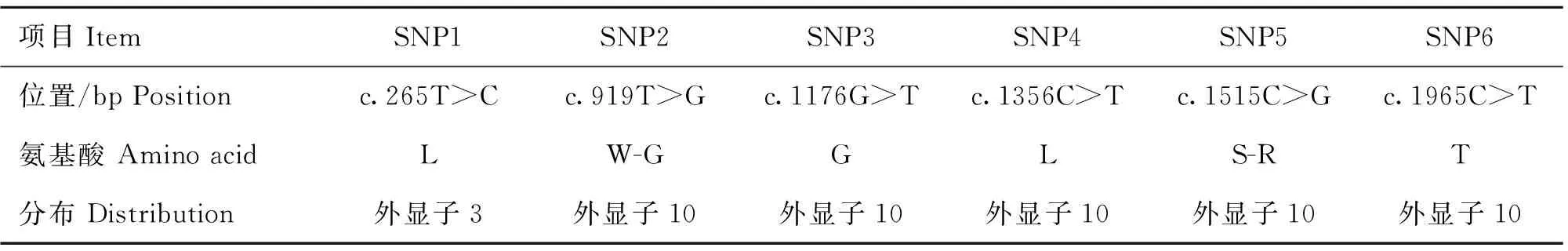
表2 TSHR基因SNPs的信息
2.2飞行时间质谱结果
将测序后挑选出的TSHR基因上的6个SNPs位点利用TOF-MS法进行分型,分型结果如图2所示,除SNP2和SNP6两个多态位点只有2种基因型以外,其余4个多态位点均存在3种基因型。
2.3群体遗传学分析
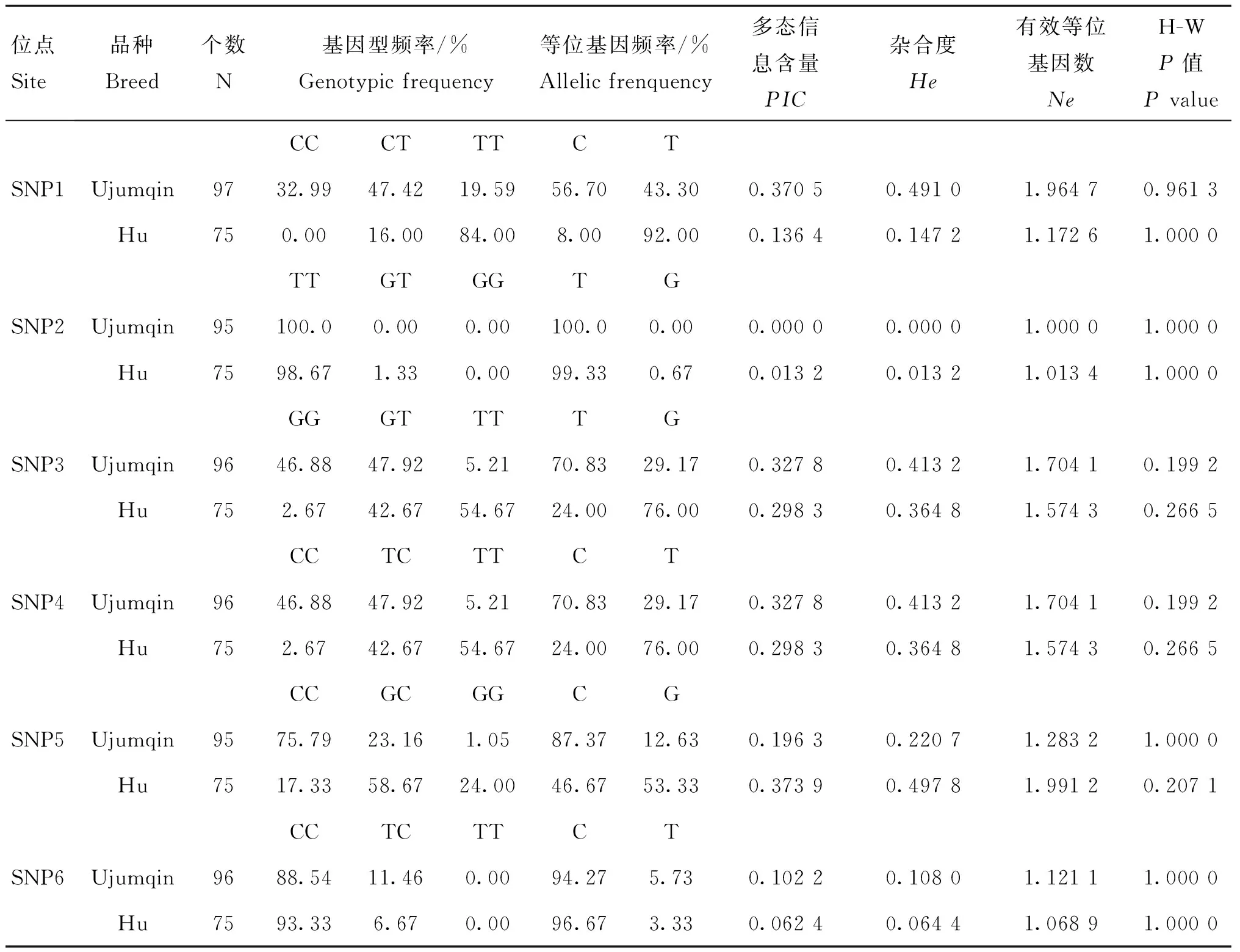
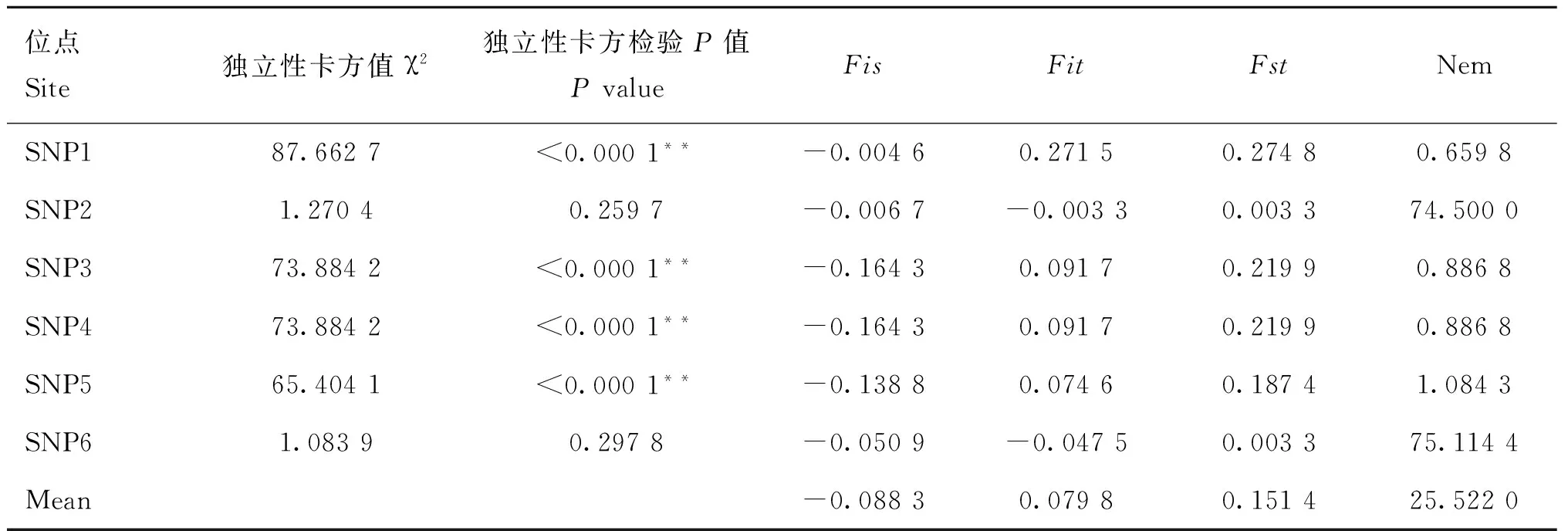
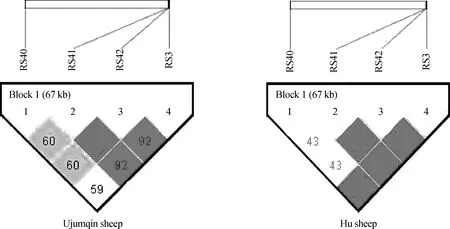
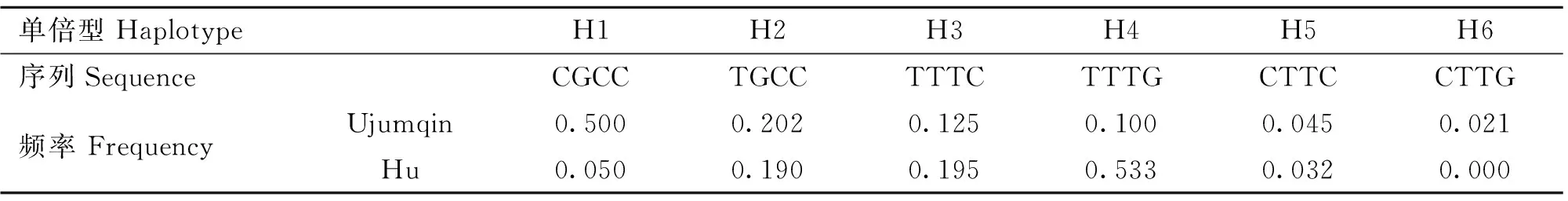
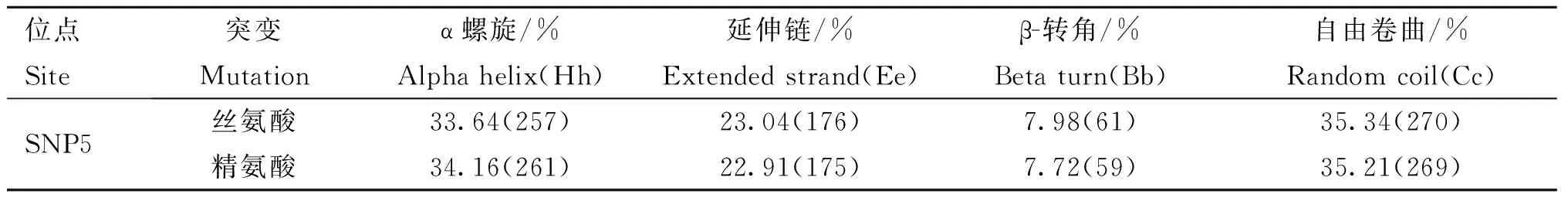
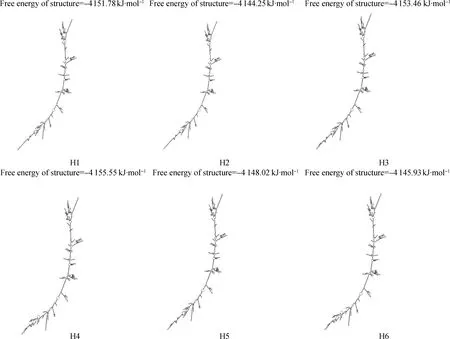
以上6个位点在两个测试群体的基因型频率、等位基因频率、PIC等遗传参数统计值见表3。由表3可知,SNP1在湖羊群体中只存在两种基因型,在乌珠穆沁羊中存在3种基因型;SNP2在湖羊群体中只存在两种基因型,而在乌珠穆沁羊群体中不存在多态性;SNP6位点在两个绵羊群体中均只存在两种基因型。SNP1、SNP3、SNP4和SNP5位点在两个绵羊群体中的优势基因型不同。SNP1位点在乌珠穆沁羊群体中表现为中度多态(0.25 χ2适合性检验表明各个位点在两个群体中均处于Hardy-Weinberg平衡状态(P>0.05)。 图2 飞行时间质谱结果散点图Fig.2 The result of time of TOF-MS 2.4群体间的遗传差异分析 2.4.1两个绵羊品种中6个SNPs位点的基因型分布差异及遗传分化χ2独立性检验结果见表4。由表4可知,SNP1、SNP3、SNP4和SNP5 4个多态位点各基因型的分布在两个绵羊品种间存在极显著差异。在这4个多态位点中单个SNP位点在两个品种间的Fst值为0.187 4(SNP5)~0.274 8(SNP1),普遍大于SNP2和SNP6两个位点,相应的,这4个位点的基因流值也比其余两个位点小。 2.4.2连锁不平衡分析将在两个绵羊品种中分布差异极显著的4个位点(SNP1、SNP3、SNP4、SNP5)进行连锁不平衡分析,如图3和表5所示,TSHR基因上SNP3和SNP4两个多态位点在两个绵羊品种中相互之间的连锁不平衡系数D′和连锁不平衡相关系数r2均为1,即两个位点完全连锁;SNP3与SNP5、SNP4与SNP5之间存在强连锁不平衡(D′>0.75,r2>0.33)。其他几个位点两两之间存在不同程度的连锁关系。 表3 TSHR基因SNP位点基因型频率、等位基因频率及群体遗传特性 表4 TSHR基因SNPs位点基因型在两个品种分布差异的χ2独立性检验及Fst值 **.表示差异极显著(P<0.01) **.Means extremely significant difference at 0.01 level 图3 TSHR基因4个位点连锁不平衡分析图Fig.3 Linkage disequilibrium analysis in TSHR gene 表5 TSHR基因多态位点配对连锁不平衡分析 对角线的上方为D′;对角线的下方为r2 D′ are above the diagonal for SNPs andr2are below the diagonal 2.4.3单倍型分析及其在不同绵羊品种中的分布运用Haploview软件对TSHR基因上SNP1、SNP3、SNP4和SNP5 4个多态位点进行单倍型构建,在乌珠穆沁羊群体中构建6种单倍型,其中优势单倍型为H1(CGCC);而在湖羊群体中构建5种单倍型,优势单倍型为H4(TTTG)。单倍型H6只存在于乌珠穆沁羊群体中(表6)。 2.5生物信息学分析 2.5.1mRNA 二级结构预测利用在线软件RNAfold web server预测TSHR基因不同单倍型mRNA二级结构如图4所示,其最小自由能为-4 155.55 kJ·mol-1~-4 144.25 kJ·mol-1,其中H2的二级结构自由能最大,H4的最小,因此结构稳定性H4最高,H2最低。 2.5.2蛋白质二级结构预测利用SOPM二级结构预测方法对不同基因型的TSHR蛋白质二级结构进行预测,预测结果见图5。由图可知,SNP5位点为错义突变,突变后蛋白质二级结构发生改变,使TSHR基因编码区第655位密码子编码的丝氨酸变为精氨酸,蛋白质二级结构中α螺旋、β折叠、延伸链和自由卷曲所占比例均发生变化(表7)。 表6 两个绵羊品种TSHR基因6个SNPs位点单倍型频率分析 表7 TSHR基因SNP5位点突变前后蛋白质二级结构预测结果 图4 TSHR基因不同单倍型的mRNA二级结构Fig.4 mRNA secondary structure of different haplotypes of TSHR gene A.SNP5位点为C时的蛋白质二级结构;B.SNP5位点为G时的蛋白质二级结构:h、t、c和e分别代表α-螺旋、β-转角、无规则卷曲和延伸链A.Protein secondary structure of C of SNP5;B.Protein secondary structure of G of SNP5;h,t,c and e means alpha helix,beta turn,random coil,extended strand,respectively图5 TSHR基因SNP5位点突变前后蛋白质二级结构Fig.5 Protein secondary structure of SNP5 of TSHR gene before and after mutation 3讨论 3.1乌珠穆沁羊和湖羊的发情特点 根据《中国畜禽遗传资源志·羊志》[12]中记载,湖羊和乌珠穆沁羊均由蒙古羊进化而来,但在长期的进化过程中,它们的繁殖性能也因分布地区的地理环境和气候的不同而有所差异。其中,乌珠穆沁羊为季节性发情,多集中在9~11月份发情,发情周期为15~19 d,发情持续时间为24~72 h,年平均产羔率为113%。而湖羊是常年发情,发情时间主要集中在4~6月份和9~11月份,发情周期长达11 d,经产母羊的年平均产羔率高达277.4%,两年一般能产3胎。本试验对不同繁殖周期绵羊的TSHR基因多态性进行研究,为调控绵羊的繁殖季节性、缩短绵羊的休情期,延长其发情期,提高季节性发情绵羊的生产性能和繁殖力提供理论依据。 3.2TSHR基因的多态性 TSHR在调控繁殖相关激素合成与分泌的信号通路中,首先结合TSH,然后与Gs蛋白进行偶联,激活蛋白激酶A和cAMP系统,进而作用于下丘脑,完成相关激素的合成与分泌。因此,此通路中涉及到的任何相关成分的变化都有可能影响动物的季节性繁殖活动。研究表明,TSHR基因某些位点发生突变,可使相应的氨基酸发生改变进而导致cAMP通路的持续激活。例如,人TSHR第77位的天冬酰胺被谷氨酸替代后,TSHR丧失与TSH的结合能力,第113位天冬酰胺被替代后,TSHR亲和力下降约10倍[13]。同时,TSHR基因的突变可直接影响甲状腺功能的改变[14-16]。A.C.Karlsson等[17]研究发现,TSHR基因的突变可能会通过调节甲状腺激素的血浆水平来影响鸡的孵化时间、忧虑行为及攻击行为等一些重要的性状,这在家禽的驯养过程中具有重要意义。 单核苷酸多态性(Single nucleotide polymorphisms,SNP)是一种普遍存在于动植物中且密度大、能稳定遗传的分子标记[18]。为了探究季节性和常年性发情绵羊之间TSHR基因的多态性差异,本试验将发现的6个多态位点分别命名为SNP1~SNP6,其中SNP2和SNP5属于错义突变,其余位点属于同义突变,且除SNP1位点位于第3外显子外,其余位点均位于第10外显子。本试验在湖羊群体中SNP1位点处未检测到CC基因型,说明其是乌珠穆沁羊特有的基因型;在乌珠穆沁羊群体中SNP2位点处未检测到G等位基因,同时湖羊群体中G等位基因的概率也比较低,仅为0.67%,可能是由于样本量不足或者是该等位基因在两个品种中均很少存在,这有待扩大样本进一步验证;两个绵羊群体在SNP6位点处均没有检测到TT基因型,可能是由于样本量不足或者存在纯合基因型致死现象。Hardy-Weinberg平衡检测表明,6个多态位点在两个羊群均处于Hardy-Weinberg平衡状态(P>0.05),表明上述位点通过长期的进化和选择,在适应性方面可能具有遗传优势。 多态信息含量(PIC)可以衡量位点多态性。PIC值与群体内基因的一致性呈反比,而与群体的变异性和选择潜力呈正比。在本试验中,测试绵羊群体TSHR基因的PIC值在0~0.491 0,除SNP2和SNP5外,其余位点的PIC值在乌珠穆沁绵羊群体中均高于湖羊群体,其中SNP1、SNP3和SNP4位点在乌珠穆沁羊群体中属于中度多态,在湖羊群体中属于低度多态,说明这些位点在两个绵羊群体中的变异程度存在一定差异,并且在乌珠穆沁羊群体中遗传变异较大,通过本品种选育有望获得较大的进展;而两个绵羊群体中其余位点的PIC值比较接近,说明这些位点在这两个绵羊群体中的变异程度未存在太大的差异。独立性χ2检验发现,SNP1、SNP3、SNP4和SNP5 4个位点的基因型在乌珠穆沁羊和湖羊间的分布具有极显著差异(P<0.01)。这4个位点在两个绵羊品种群体中的分布具有共同点,即优势等位基因型不同,且纯合基因型在两个绵羊群体中的分布频率相差较大,例如,SNP4位点在乌珠穆沁绵羊群体中的优势基因型为CC,其频率为46.88%,而其在湖羊群体中的频率仅为2.67%,这一结果与高磊等[19]的研究结果一致,他们发现TSHR基因第10外显子481 bp处,即本研究中的SNP4位点发生了T-C突变,此突变虽为同义突变,但其等位基因的分布在常年发情和季节性繁殖等具有不同繁殖周期的绵羊群体中具有显著差异(P<0.01),等位基因频率T/C 与繁殖特性密切相关,即该多态位点与季节性繁殖性状具有较强的相关性。同时,本研究发现与其他多态位点相比,分布差异极显著的这些位点的Fst值相对较大,说明在这些位点中两个绵羊群体之间存在一定程度的遗传分化,因此,这些位点可作为后续研究的重点。 3.3对mRNA和蛋白质二级结构的影响 大多数表型性状的改变并不是由单个位点突变引起的,而是由多个位点突变形成的单倍型相互作用的结果[20]。本研究对在两个品种中等位基因分布差异极显著的4个位点进行单倍型分析,发现它们在乌珠穆沁羊群中共形成6种不同单倍型,主要以H1为主;在湖羊群体中则形成5种单倍型,以H4为主。mRNA二级结构预测显示,6个单倍型的二级结构和最小自由能均有不同程度的差异,其中H2单倍型的最小自由能最大,H4单倍型的最小自由能最小。因此,H4具有更加稳定的mRNA二级结构。此外,我们还发现SNP3、SNP4和SNP5位点的改变均导致mRNA二级结构发生改变,它们所引起mRNA结构变化有可能影响细胞因子对TSHR基因的加工、转运等,致其表达和成熟异常,进而与繁殖性状变异相关。 进一步的蛋白质二级结构预测发现,SNP5位点的错义突变导致了TSHR蛋白第655位的丝氨酸变成精氨酸,使得其α螺旋、β转角、延伸链和自由卷曲等二级结构的比例均发生改变。TSHR跨膜结构预测显示此位点位于第6和第7跨膜区之间,即第3胞外环结构上,胞内环含有一个蛋白激酶C的作用位点。L.Alberti等[21]通过对甲状腺功能正常和高TSH血症患者进行研究发现,10位患者中有4位存在TSHR基因突变,这些突变导致其受体蛋白的功能发生改变。其中编码受体蛋白的第655位氨基酸处CA碱基的缺失,使受体蛋白缺少第7跨膜片段及胞内尾端,进而导致受体蛋白功能丧失。因此,本研究中SNP5位点的错义突变是否使TSHR的功能发生改变,甚至是否是造成季节性和常年性发情绵羊发情差异的原因之一,还有待进一步的研究。 综上所述,绵羊TSHR基因外显子SNP1、SNP3、SNP4和SNP5 4个位点的多态性在乌珠穆沁羊和湖羊群体中存在极显著差异,SNP1、SNP3和SNP4位点虽为同义突变,但其有可能通过影响mRNA二级结构的稳定性或密码子的偏好性使蛋白质亚基的结构和功能发生改变[22]。黄冬维[23]对山羊TSHR基因多态性的研究发现5个多态位点的基因型分布在季节性品种和非季节性品种间存在显著差异,提示着TSHB基因这5个连锁的多态位点可能与山羊繁殖季节性相关。因此,本研究中两个绵羊品种中基因型分布差异极显著的变异位点很可能与绵羊的季节性繁殖相关。下一步将扩大试验样本和试验绵羊品种,重点分析这些位点对TSHR基因表达和功能的影响,明确其不同基因型和单倍型与繁殖性状的相关性,为对常年发情的绵羊品种的选育和改良,提高绵羊的生产性能和繁殖力提供更加直接的指导和依据。 4结论 4.1在TSHR基因外显子上共发现6个多态位点,其中4个在两个绵羊品种中基因型的分布差异极显著,即具有潜在生物学功能和表型效应的突变位点,它们可组成6种单倍型,乌珠穆沁羊以H1单倍型为主,湖羊以H4为主,他们可能与这两种绵羊季节性和常年性发情有关。 4.2外显子上的SNP5突变位点影响TSHR基因mRNA二级结构的稳定性和蛋白质二级结构,可能是与绵羊季节性繁殖相关的重要功能位点。 参考文献(References): [1]MONTGOMERY G W,TATE M L,HENRY H M,et al.The follicle-stimulating hormone receptor and luteinizing hormone receptor genes are closely linked in sheep and deer[J].JMolEndocrinol,1995,15(3):259-265. [2]EBLING F J.Photoperiodic regulation of puberty in seasonal species[J].MolCellEndocrinol,2010,324(1-2):95-101. [3]BOCKMANN J,WINTER C,WITTKOWSKI W,et al.Cloning and expression of a brain-derived TSH receptor[J].BiochemBiophysResCommun, 1997,238(1):173-178. [4]赵赓,高磊,沈敏,等.中国美利奴成母羊促甲状腺激素受体基因的克隆与组织表达[J].新疆农业科学,2014,51(9):1718-1727. ZHAO G,GAO L,SHEN M,et al.Cloning and expression of thyroid-stimulating hormone receptor gene in sheep[J].XinjiangAgriculturalSciences,2014,51(9):1718-1727.(in Chinese) [5]HANON E A,LINCOLN G A,FUSTIN J M,et al.Ancestral TSH mechanism signals summer in a photoperiodic mammal[J].CurrBiol,2008,18(15):1147-1152. [6]CRISANTI P,OMRI B,HUGHES E,et al.The expression of thyrotropin receptor in the brain[J].Endocrinology,2001,142(2):812-822. [8]VIGUIÉ C,BATTAGLIA D F,KRASA H B,et al.Thyroid hormones act primarily within the brain to promote the seasonal inhibition of luteinizing hormone secretion in the ewe[J].Endocrinology,1999,140(3):1111-1117. [9]HANON E A,ROUTLEDGE K,DARDENTE H,et al.Effect of photoperiod on the thyroid-stimulating hormone neuroendocrine system in the European hamster (Cricetuscricetus)[J].JNeuroendocrinol,2010,22(1):51-55. [10]冉雪琴,赵星艳,王嘉福,等.贵州矮马(Equuscaballus)生长激素受体基因5个单核苷酸位点的多态性研究[J].畜牧兽医学报,2015,46(11):1974-1986. RAN X Q,ZHAO X Y,WANG J F,et al.Polymorphism of five SNPs in exon 10 of growth hormone receptor gene in Guizhou pony(Equuscaballus)[J].ActaVeterinariaetZootechnicaSinica,2015,46(11):1974-1986.(in Chinese) [11]丁月云,朱卫华,薛玮纬,等.安徽地方猪TLR4基因第3外显子的SNP分析[J]. 畜牧兽医学报,2014,45(11):1767-1774. DING Y Y,ZHU W H,XUE W W,et al.Single nucleotide polymorphism (SNP) analysis ofTLR4 gene exon 3 in Anhui native pig breeds[J].ActaVeterinariaetZootechnicaSinica,2014,45(11):1767-1774.(in Chinese) [12]国家畜禽遗传资源委员会.中国畜禽遗传资源志·羊志[M].北京:中国农业出版社,2011. China National Commission of Animal Genetic Resources.Animal Genetic Resources in China·sheep and goat[M].Beijing:Chinese Agriculture Press,2011.(in Chinese) [13]WEBSTER J R,MOENTER S M,BARRELL G K,et al.Role of the thyroid gland in seasonal reproduction.III.Thyroidectomy blocks seasonal suppression of gonadotropin-releasing hormone secretion in sheep[J].Endocrinology,1991,129(3):1635-1643. [14]SCHOENMAKERS N,CHATTERJEE V K.Thyroid gland:TSHR mutations and subclinical congenital hypothyroidism[J].NatRevEndocrinol,2015,11(5):258-259. [15]TONG G X,MODY K,WANG Z,et al.Hypothyroidism caused by the combination of two heterozygous mutations:one in the TSH receptor gene the other in the DUOX2 gene[J].EndocrPathol.2015,26(4):315-319. [16]SATOH M,ASO K,OGIKUBO S,et al.Hypothyroidism caused by the combination of two heterozygous mutations:one in the TSH receptor gene the other in the DUOX2 gene[J].JPediatrEndocrinolMetab,2015,28(5-6):657-661. [17]KARLSSON A C,SVEMER F,ERIKSSON J,et al.The effect of a mutation in the thyroid stimulating hormone receptor (TSHR) on development,behaviour and TH levels in domesticated chickens[J].PLoSOne,2015,10(6):e0129040. [18]曲娟娟,于敏,董蕾,等.SNP在动植物遗传育种中的应用[J].东北农业大学学报,2011,42(12):9-13. QU J J,YU M,DONG L,et al.Applications of SNP in animal and plant genetic breeding[J].JournalofNortheastAgriculturalUniversity,2011,42(12):9-13.(in Chinese) [19]高磊,沈敏,赵赓,等.绵羊TSHR基因第10外显子T481C位点多态性分析[J].农业生物技术学报,2016,24(1):61-67. GAO L,SHEN M,ZHAO G,et al.Polymorphism analysis of T481C locus ofTSHRgene exon 10 in sheep (Ovisaries)[J].JournalofAgriculturalBiotechnology,2016,24(1):61-67.(in Chinese) [20]GURYEV V,SMITS B M,VAN DE BELT J,et al.Haplotype block structure is conserved across mammals[J].PLoSGenet,2006,2(7):e121. [21]ALBERTI L,PROVERBIO M C,COSTAGLIOLA S,et al.Germline mutations of TSH receptor gene as cause of nonautoimmune subclinical hypothyroidism[J].JClinEndocrinolMetab, 2002,87(6):2549-2555. [22]LIU Y,CHU A,CHAKROUN I,et al.Cooperation between myogenic regulatory factors and SIX family transcription factors is important for myoblast differentiation[J].NucleicAcidsRes,2010,38(20):6857-6871. [23]黄冬维.山羊繁殖季节性调控通路相关基因的克隆、多态与表达研究[D].北京:中国农业科学院,2012. HUANG D W.Study on cloning,polymorphisms and expression of genes related with seasonal reproduction pathways in goats[D].Beijing:Chinese Academy of Agricultural Sciences,2012.(in Chinese) (编辑郭云雁) doi:10.11843/j.issn.0366-6964.2016.07.006 收稿日期:2015-12-08 基金项目:国家自然基金联合基金重点项目(U1503285);“十二五”863项目(2011AA100307-02) 作者简介:轩俊丽(1990-),女,河南太康人,硕士生,主要从事动物遗传育种与繁殖研究,E-mail:xuanjunli3566@126.com *通信作者:杜立新,教授,E-mail:lxdu@263.net ;张莉,副研究员,E-mail:zhangli07@caas.cn;马友记,教授,E-mail: yjma@gsau.edu.cn 中图分类号:S826;S813.3 文献标志码:A 文章编号:0366-6964(2016)07-1342-12 Study on Exon Polymorphism of Seasonal Breeding Related GeneTSHRin Sheep XUAN Jun-li1,2,MA Xiao-meng2,WANG Hui-hua2,3,CAO Jia-xue2,WEI Cai-hong2,ZHAO Fu-ping2,MA You-ji1*,ZHANG Li2*,DU Li-xin1,2* (1.CollegeofAnimalScienceandTechnology,GansuAgriculturalUniversity,Lanzhou730070,China;2.InstituteofAnimalScience,ChineseAcademyofAgriculturalSciences,Beijing100193,China) Abstract:The study aimed to investigate the genetic variation of thyroid stimulating hormone receptor (TSHR) gene in Ujumqin sheep and Hu sheep,which had different reproductive performance and oestrous cycle,and the distribution of different haplotypes caused by the polymorphic site and its effects on mRNA and secondary structure of protein.This study provided a theoretical basis for seeking the influence of the mutation on TSHR gene expression and phenotype.Direct sequencing was taken to study genetic variation of the TSHR gene in 172 sheep of 2 Chinese Mongolian sheep strains.6 mutant sites were found and genotyped.Chi-square test for independence was performed to find the genotypes of the 4 SNPs (SNP1,SNP3,SNP4 and SNP5) which were significantly different between the 2 sheep populations(P<0.01).The SNP5 was missense mutation,the other sites were synonymous mutations.Linkage disequilibrium analysis was used to screen the 4 sites,complete linkage happened between SNP3 and SNP4,and the other sites present different degrees of interlocking relationship.Bioinformatics analysis revealed that not only the mutations occured in the TSHR,but also different haplotypes could result in the changes of mRNA and the secondary structure of protein.These results indicate that:(1) The genotypes distribution of 4 sites in TSHR gene have significant differences between the 2 sheep populations.They form 6 haplotypes,among which H1(CGCC) is the advantage haplotype in Ujumqin sheep,and H4(TTTG) is the advantage haplotype in Hu sheep.(2) The SNP5 site affects the stability of mRNA and protein secondary structure of TSHR gene,which may be one of the important functional sites with potential phenotypic effects. Key words:sheep;seasonal breeding;TSHR gene;polymorphism