miR-324-3p通过调控MC1R基因影响黑色素的形成
2016-08-09曾庆宝范瑞文张秋月郝晓娟武良琦任玉红
曾庆宝,范瑞文,张秋月,郝晓娟,武良琦,任玉红
(山西农业大学动物科技学院,太谷 030801)
miR-324-3p通过调控MC1R基因影响黑色素的形成
曾庆宝,范瑞文,张秋月,郝晓娟,武良琦,任玉红*
(山西农业大学动物科技学院,太谷 030801)
摘要:旨在证明miR-324-3p可以通过调控其预测的靶基因MC1R及其下游基因的表达从而对羊驼皮肤黑色素的合成产生影响。本研究在体外培养的羊驼皮肤黑色素细胞中转染miR-324-3p过表达载体,应用qRT-PCR与Western blotting分析比较各试验组中MC1R基因与毛色相关基因小眼畸形相关转录因子(Microphthalmia-associtated transcription factor,Mitf)、酪氨酸酶(Tyrosinase,Tyr)、酪氨酸相关蛋白2(Tyrosinase related protein 2,Tyrp2)的表达差异性,利用酶标仪检测黑色素产量的变化。结果显示:(1)miR-324-3p在棕色与白色羊驼皮肤中均有表达,且在棕色羊驼皮肤中极显著表达(P<0.01),其相对表达量是白色的1.64倍;(2)黑色素细胞被转染了miR-324-3p过表达载体后,处理组靶基因MC1R及其下游调控基因Mitf、Tyr和Tyrp2的表达量与黑色素产量较空白对照组均有下调,且以Mitf基因表达量极显著下调(P<0.01)。综上表明,羊驼皮肤中miR-324-3p可能通过调控MC1R基因的表达,顺势下调MC1R基因下游调控基因Mitf、Tyr与Tyrp2的表达,最终对羊驼皮肤黑色素细胞中黑色素的类型及合成量产生影响。
关键词:miR-324-3p;MC1R;黑色素;羊驼
动物拥有丰富多彩的毛色,决定动物毛色的物质基础主要是酪氨酸源性黑色素,在动物界黑色素有两种类型,一种是真黑素,另一种是伪黑素,正是这些色素分布与合成数量的不同造就了动物不同的毛色[1]。黑色素的生物合成主要受到基因(主控基因及调控基因)与环境因素的影响,已有研究报道,黑素皮质激素受体1(Melanocortin-1 receptors,MC1R)基因被视为影响动物黑色素细胞合成的主控基因之一,其表达于成熟黑色素细胞膜表面,作为G蛋白偶联受体(GPCR)家族的一员,有7个跨膜功能域,当与其天然配体激动剂α-黑素细胞刺激素(α-melanocytes stimulating hormone,α-MSH)相结合后,顺式上调黑色素合成的关键酶—酪氨酸酶基因家族(Tyr、Tyrp1、Tyrp2)基因的表达,进而增加黑色素细胞内真黑素的相对含量[2],而Agouti蛋白可竞争性结合MC1R,导致MC1R受体通路传递信号减弱,促使黑色素细胞相对大量合成伪黑素。MC1R基因的变异与动物的肤色、鸟类羽毛、及人类毛发颜色差异密切相关,而且不同物种参与调控黑色素细胞合成的主效基因作用机制又各有差异;羊驼具有22种天然毛色,可调控黑色素合成的影响因子复杂多样,而且对于MC1R是否直接参与羊驼毛色形成过程及黑色素合成的调控机制少有报道。
MicroRNA(miRNA)是一类长约20~24 nt的非编码调控单链小分子RNA,它们主要与靶基因转录成熟的mRNA分子的3′端非编码区域(3′-untranslated region,3′UTR)不完全互补配对结合,进而抑制或终止翻译过程,实现对基因表达的调控[3]。有研究发现,miRNA在动植物细胞增殖、分化、凋亡、应激与信息传递等方面发挥着重要作用,与癌症等人类疾病的发生、发展及生物进化密切相关[4]。近年来的研究证实,miRNA参与调控动物毛色性状及皮肤毛囊更新生长,朱芷葳等[5]利用miRNA芯片杂交技术分析了羊驼皮肤毛囊中miRNA的表达谱,结果显示有20个miRNAs信号在羊驼皮肤中高表达;X.Tian等[6]借助测序技术构建白色与棕色羊驼皮肤中miRNAs的表达文库,同时预测了不同miRNA可能的靶基因——参与黑色素生成与色素沉着。本研究拟通过Targetscan、miRBase在线软件,预测筛选出miR-324-3p可能靶向调控MC1R基因。有研究表明,miR-324-3p在肾渐进性纤维化、细胞凋亡中起调控作用[7];在鼻咽癌诊疗中,miR-324-3p可直接靶向调控WNT2B与SMAD7基因的表达,其表达量的变化可作为预测组织对辐射抗性及癌细胞增殖或凋亡情况[8-9];但有关miR-324-3p对羊驼黑色素的细胞合成影响的研究较少。本试验预通过体外转染miR-324-3p过表达载体与NC载体于羊驼皮肤黑色素细胞,以期miR-324-3p下调MC1R基因的表达,通过检测MC1R基因下游调控基因(Mitf、Tyr、Tyrp2)表达量及细胞内黑色素产量为反馈,揭示MC1R在羊驼毛色形成机制提供一定的理论依据。
1材料与方法
1.1试验所用主要试剂及仪器
第4代羊驼皮肤黑色素细胞(山西农业大学羊驼生物工程实验室);黑色素细胞培养基MelM(Sciencell Research Laboratories);PCR仪(Bio-RAD);miR-324-3p过表达载体与NC载体(上海生工);PrimeScriptTMRT reagent Kit、荧光定量试剂盒(TaKaRa);Step One Plus Real-Time PCR System(Thermo Fisher);核酸蛋白测定仪ND-1000(Nanodrop);Mitf兔抗多克隆抗体(武汉三鹰);MC1R、Tyr与Tyrp2兔抗多克隆抗体(Abcam);β-actin兔抗多克隆抗体、二抗山羊抗兔IgG/HRP(博奥森)。
1.2方法
1.2.1引物设计应用在线Primer3.0软件设计羊驼miR-324-3p、MC1R、Mitf、Tyr、Tyrp2目的基因和U6、18SrRNA内参基因引物,并利用NCBI中的BLAST功能检测各对引物的特异性,引物均由华大基因公司合成,引物信息见表1。
1.2.2羊驼皮肤黑色素细胞的传代培养及载体转染取冻存的羊驼皮肤黑色素细胞,于37 ℃无菌水浴锅中速融,DMEM稀释,4 ℃、1 000 r·min-1、离心10 min,沉淀用黑色素细胞全培养基重悬,以2×105细胞密度接种于6孔培养板中,37 ℃、5% CO2的培养箱中培养;24 h后换液;待细胞融合度为90%时,用0.25%胰酶消化液消化8 min后,终止液终止消化,吹打并收集细胞液,离心后,重悬细胞沉淀,接种于培养板中,于培养箱中传代培养[10]。
取培养中的第5代羊驼皮肤黑色素细胞进行载体转染。试验分为处理组(miR组,只转染miR-324-3p过表达载体),阴性对照组(NC组,只转染NC载体)及空白细胞组(KB组,不做载体转染);每组设12个重复孔,其中4孔用于提取黑色素,4孔用于提取总RNA,另外4孔用于提取总蛋白;每孔的载体转染量为5 μg,转染试剂量为10 μL。转染12 h后终止转染,在荧光显微镜下观察绿色荧光,鉴定载体转染效率。
1.2.3总RNA的提取及反转录cDNA合成收集已转染载体40 h的羊驼皮肤黑色素细胞,使用Trizol法提取总RNA,琼脂糖凝胶电泳检测总RNA质量。20 μL反转录体系:5×Prime Script Buffer 4 μL、Prime Script RT Enzyme Mix I 1 μL、茎环RT引物(10 μmol·L-1)与U6-R(10 μmol·L-1)或 Oligo dT Primer(50 μmol·L-1)与Random 6 mers(100 μmol·L-1)(引物序列见表1)各1 μL、Total RNA 1 μL、RNase Free Water 12 μL,反应条件:37 ℃ 15 min、85 ℃ 5 s、4 ℃ 保存,反转录产物可直接用于普通PCR或实时荧光定量PCR。
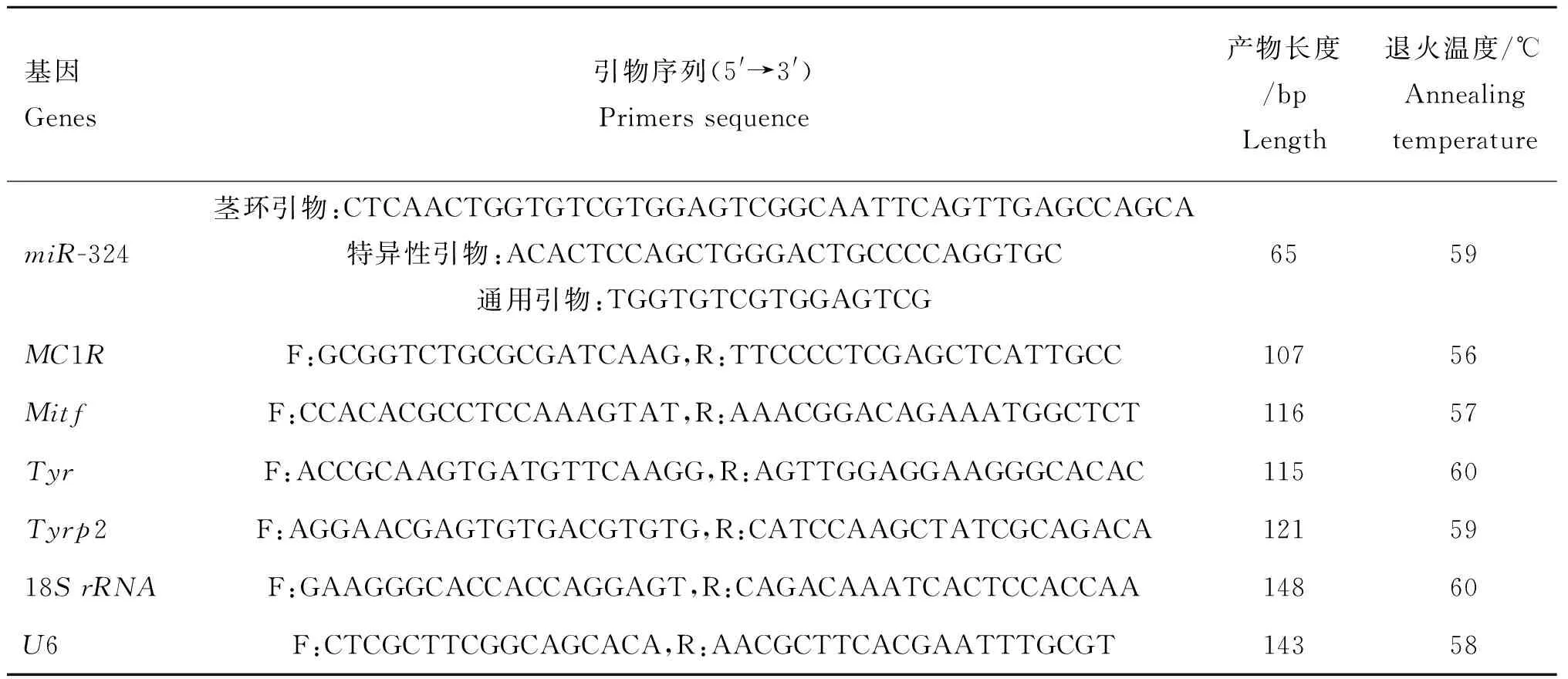
表1 目的基因与内参基因引物信息
1.2.4内源性miR-324-3p的PCR扩增10 μL的PCR反应体系:2×Es Taq Master Mix 5 μL、特异性引物与通用引物(10 μmol·L-1)各0.4 μL、模板1 μL、RNase Free Water 3.2 μL,反应条件:94 ℃预变性5 min;94 ℃变性30 s,59 ℃退火30 s,72 ℃延伸10 s,35个循环;72 ℃延伸5 min,12 ℃保存。同时设立空白对照孔,已检测是否有污染存在。PCR产物琼脂糖凝胶电泳检测,凝胶成像系统采集图像。
1.2.5实时荧光定量PCR10 μL的反应体系:SYBR Premix Ex Taq Ⅱ5 μL,模板1 μL,上下游引物(10 μmol·L-1)各0.2 μL,ROX Reference Dye 0.2 μL,RNase Free Water 3.4 μL。反应程序:95 ℃预变性10 min;95 ℃变性30 s,退火温度Tm(表1)30 s,72 ℃延伸15 s,40个循环。目的基因MC1R、Mitf、Tyr、Tyrp2与内参(18SrRNA)及miRNA-324与内参U6在同一条件不同管内扩增,做4个重复,并且设立以水代替模板的阴性对照,各个基因的相对表达量用2-△△Ct法表示。
1.2.6总蛋白的提取与Western blotting检测收集转染载体56 h的羊驼皮肤黑色素细胞,用RIPA∶PMSF(100∶1)裂解细胞并收集总蛋白;以每孔400 ng的总蛋白上样量进行SDS-PAGE;转移至NC膜上;用5%的蛋白干粉室温下封闭1 h;将膜置于目的基因兔抗多克隆抗体稀释液中,垂直摇床上4 ℃过夜孵育;室温下复温30 min;TBST液洗膜;将膜置于山羊抗兔单克隆抗体(HRP)稀释液中,37 ℃孵育1 h后,洗膜;涂布发光液,照相观察;用Quantity One软件分析各免疫印迹条带相对定量。
1.2.7碱性可溶总黑色素ASM含量的测定采用文献[11-12]的方法测定ASM含量。取转染载体48 h的羊驼皮肤黑色素细胞,用PBS清洗后,收集各试验组细胞至15 mL离心管中,取一小部分进行台盼蓝染色计数;然后以4 ℃、1 000 r·min-1离心10 min,弃上清,PBS重悬细胞,再离心;弃去PBS上清后,最后每管加入1 mL 0.2 mol·L-1的NaOH裂解细胞,裂解液于80 ℃加热5 min。使用酶标仪在475 nm波长处对每组黑色素样品进行吸光值的测量,每组重复5孔,同时设立NaOH空白对照孔,ASM含量用5个重复的处理组A475 nm值与空白对照组A475 nm值的比值表示。
1.2.8统计分析各试验数据及柱状图用Microsoft Excel作统计分析处理,试验结果用“平均值±标准差(Means±SD)”表示,应用SPSS21.0软件进行单因素方差分析检验。
2结果
2.1pPG/miR/eGFP/Blasticidin-miR-324-3p过表达载体
由上海生工构建的pPG/miR/eGFP/Blasticidin-miR-324-3p过表达载体用1%琼脂糖凝胶电泳,电泳结果见图1;载体图谱见图2,其中CMV是载体表达目的基因强启动子,eGFP是鉴定载体转染细胞效率的标记基因,Blasticidin可用来筛选稳定表达miR-324-3p的细胞系。
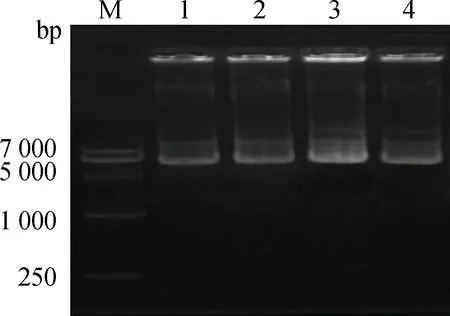
M.DNA marker Ⅵ;1~4.miR-324-3p过表达载体M.DNA marker Ⅵ;1-4.miR-324-3p over-expressive vectors图1 pPG/miR/eGFP/Blasticidin-miR-324-3p载体琼脂糖凝胶电泳检测Fig.1 Agarose gel electrophoresis of pPG/miR/eGFP/Blasticidin-miR-324-3p vector
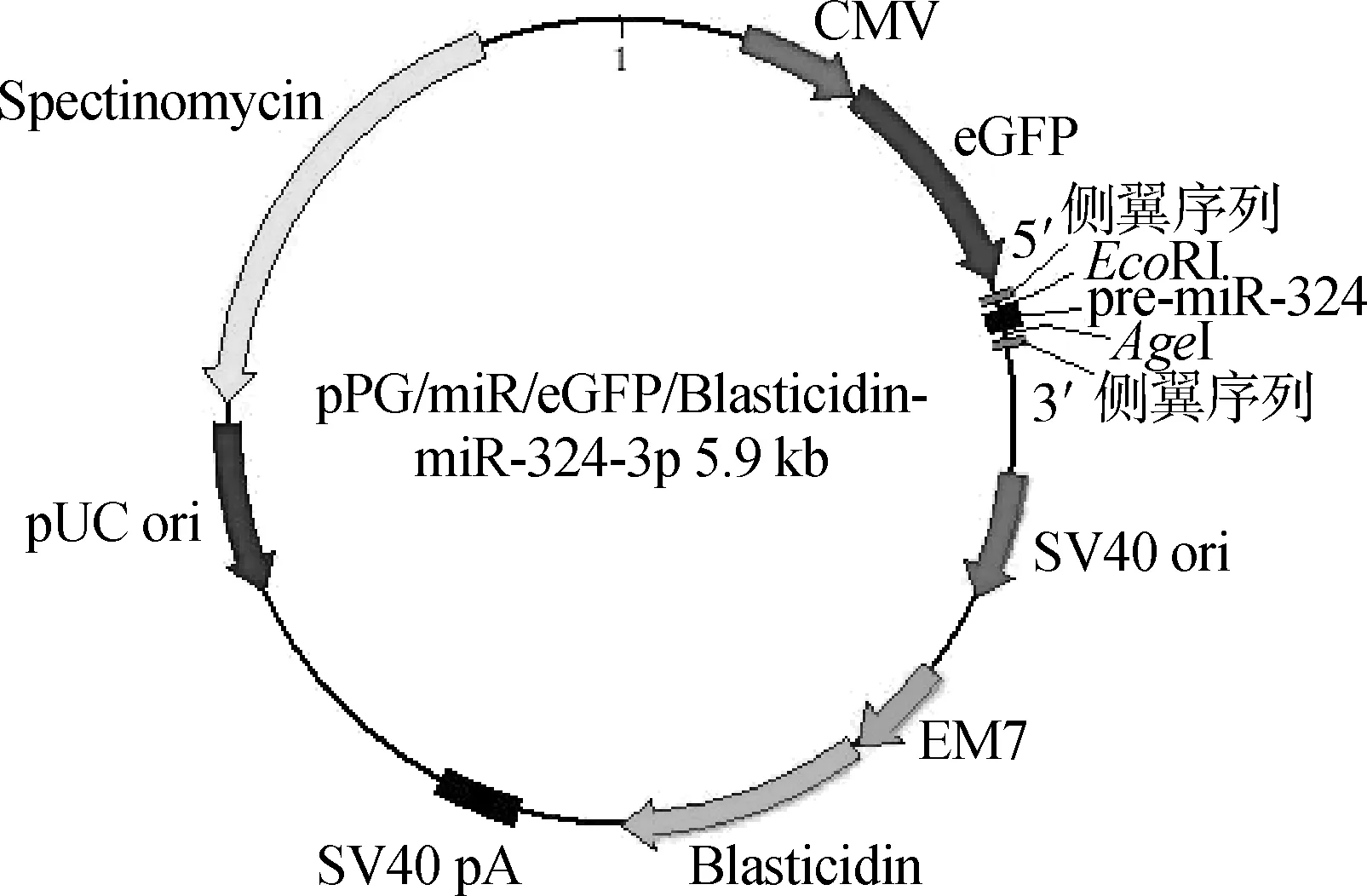
图2 pPG/miR/eGFP/Blasticidin-miR-324-3p载体图谱Fig.2 Vector map of pPG/miR/eGFP/Blasticidin-miR-324-3p
2.2总RNA的鉴定
所提取的总RNA用1%的琼脂糖凝胶电泳进行检测,可清楚看到28S、18S条带,说明RNA未降解,5S条带不太清楚(图3)。用核酸蛋白测定仪测定总RNA浓度,RNA样品的A260 nm/A280 nm值均处于1.8~2.1、A260 nm/A230 nm>2.0,说明提取RNA过程中没有蛋白污染,可以用于后续试验。
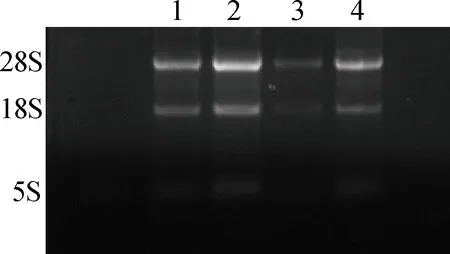
1~2.白色羊驼黑色素细胞总RNA;3~4.棕色羊驼黑色素细胞总RNA1-2.Melanocytes total RNA of White alpaca;3-4.Melanocytes total RNA of Brown alpaca图3 羊驼黑色素细胞总RNA琼脂糖凝胶电泳Fig.3 Agarose gel electrophoresis of melanocytes total RNA on alpaca
2.3PCR扩增
白色与棕色羊驼皮肤黑色素细胞中表达的miR-324-3p经反转录、PCR扩增及2.5%的琼脂糖凝胶电泳进行检测鉴定,得到65 bp片段的DNA产物,与理论片段大小一致,电泳条带清晰,扩增结果良好(图4)。
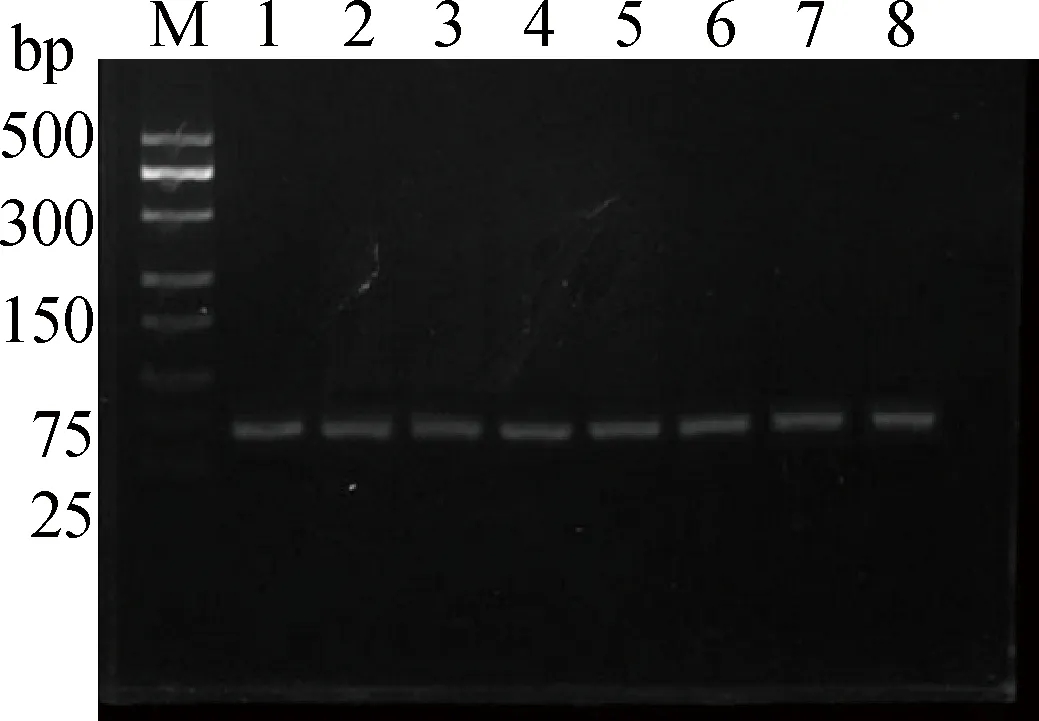
M.低分子量DNA相对分子质量标准;1~4.白色羊驼miR-324-3p的PCR产物;5~8.棕色羊驼miR-324-3p的PCR产物M.Low MW DNA marker;1-4.PCR products of miR-324-3p for White alpaca;5-8.PCR products of miR-324-3p for Brown alpaca图4 白色与棕色羊驼黑色素细胞中miR-324-3p的PCR产物Fig.4 PCR amplification products of miR-324-3p in melanocytes from White and Brown alpaca
2.4miR-324-3p在白色与棕色羊驼皮肤黑色素细胞中的表达差异性
以U6为内参基因,分别以白色与棕色羊驼皮肤黑色素细胞总RNA反转录cDNA为模板,应用qRT-PCR分析miR-324-3p在白色与棕色羊驼黑色素细胞中表达差异性。结果见表2,miR-324-3p在棕色羊驼黑色素细胞中的表达量极显著高于白色的表达量,在棕色羊驼黑色素细胞中的相对表达量是白色羊驼的1.64倍。

表2 miR-324-3p在白色与棕色羊驼黑色素细胞中的相对表达量
a.差异极显著;b.差异显著。表3同
a.P<0.01;b.P<0.05.The same as table 3
2.5过表达载体转染羊驼黑色素细胞后,各试验组中miR-324-3p在转录水平的表达量
各试验组miR-324-3p在转录水平的相对表达量,qRT-PCR结果见表3。结果显示,miR组miR-324-3p在转录水平的表达量是KB组的1.891倍,是NC组的2.260倍,miR组miR-324-3p在转录水平的表达量极显著的高于KB组(P<0.01)。
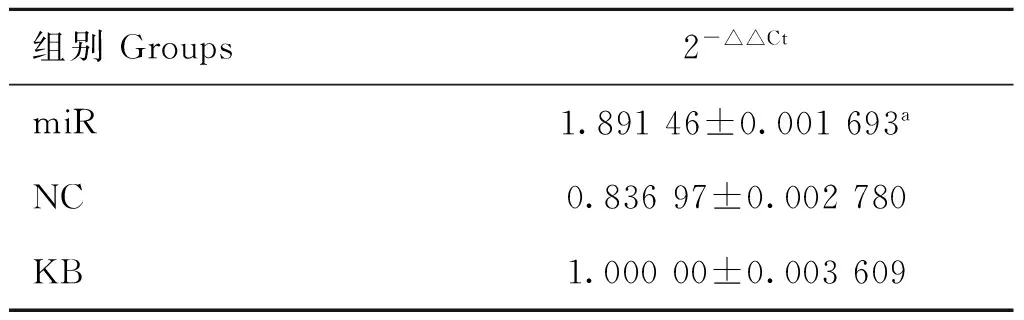
表3 各试验组转染过表达载体后miR-324-3p的相对表达量
miR.转染miR-324-3p过表达载体细胞组;NC.转染了miR-NC空载体细胞组;KB.未作转染的空白细胞组;图5~7同
miR.Cell group transfected over-expression vector of miR-324-3p;NC.Cell group transfected empty vector of miR-NC;KB.Cell group non-transfected;The same as Fig.5-7
2.6过表达载体转染羊驼黑色素细胞后各基因在转录水平表达的变化
qRT-PCR结果,处理组MC1R、Mitf、Tyr及Tyrp2基因在转录水平上的表达见图5。结果显示,miR组MC1R、Mitf、Tyr及Tyrp2基因在转录水平上的表达量较KB组分别下降了0.981、0.679、0.820、0.653,miR组MC1R、Mitf、Tyr及Tyrp2基因在转录水平上的表达量较NC组分别下降了0.802、0.527、0.450、0.080,miR组中MC1R、Mitf、Tyr和Tyrp2较KB组均差异极显著(P<0.01),Tyrp2的miR组较NC组差异显著(P<0.05),MC1R、Mitf、Tyr的miR组较NC组均差异极显著(P<0.01)。
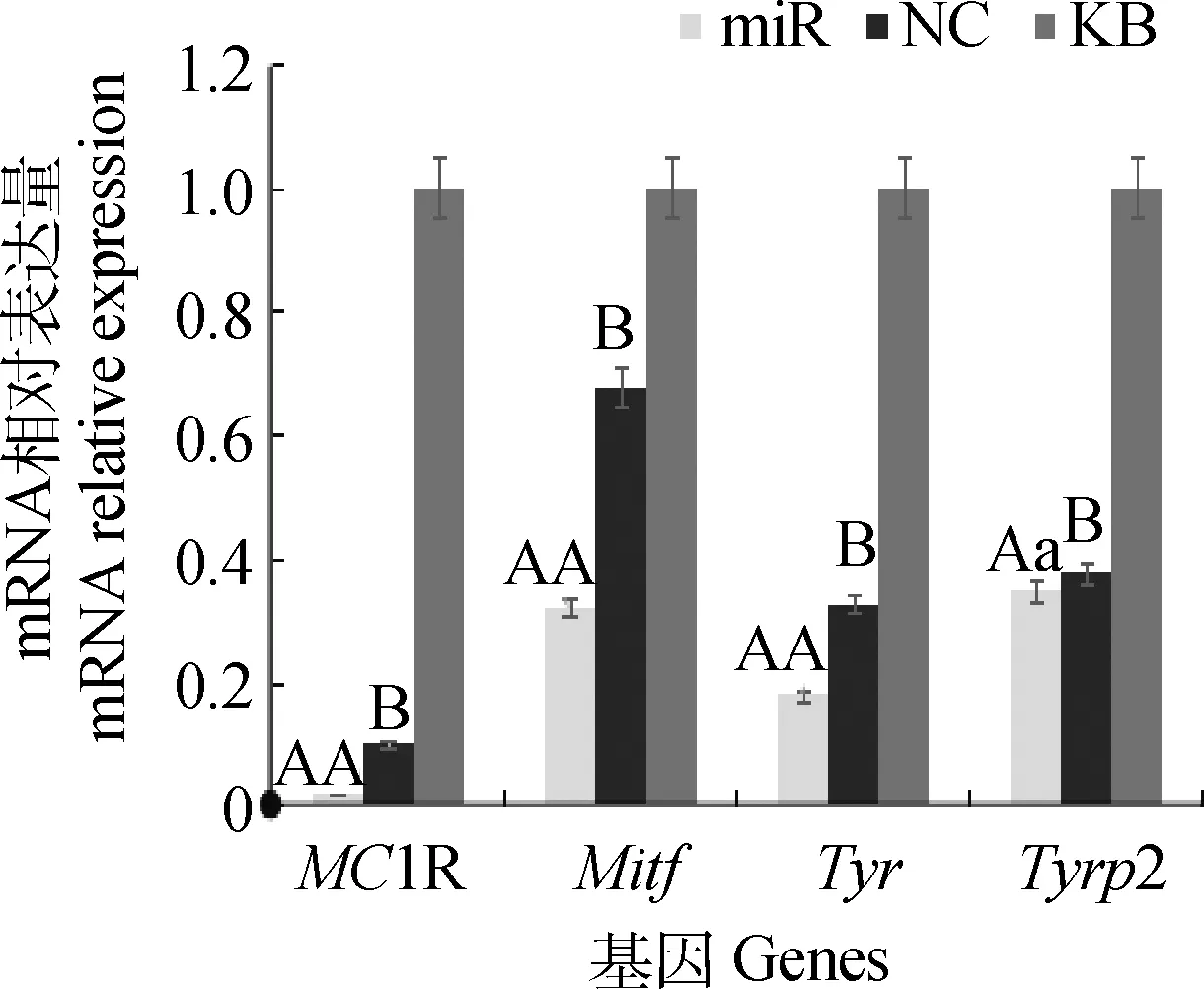
不同大写字母表示差异极显著;不同小写字母表示差异显著。图6、图7同Different uppercase letters.P<0.01;Different lowercase letters.P<0.05.The same as Fig.6 and Fig.7图5 载体转染细胞后羊驼毛色相关基因的表达差异性Fig.5 The expressive difference of coat color related genes from cell groups transfected vectors
2.7miR-324-3p对MC1RMitf、Tyr及Tyrp2基因蛋白表达量的影响
Western印迹结果显示,羊驼黑色素细胞总蛋白中存在可与兔抗MC1R、Mitf、Tyr及Tyrp2多克隆抗体发生免疫阳性反应的蛋白条带(图6A)。对于试验组中各个目的基因蛋白表达量进行定量分析,结果发现,转染miR-324-3p过表达载体于羊驼皮肤黑色素细胞后,靶基因MC1R及其下游调控的Mitf、Tyr及Tyrp2基因的蛋白表达量均下调,且Mitf基因蛋白表达量下调最为显著,各处理组同对照组相比差异显著或极显著(图6B)。
2.8miR-324-3p对羊驼皮肤黑色素细胞内黑色素产量的影响
用酶标仪测定miR组、NC组和KB组中黑色素细胞内黑色素产量的A475 nm吸光值,用各处理组的黑色素产量占空白组的比值表示黑色素相对量。结果显示,miR组与NC组的黑色素细胞内黑色素产量均减少,以miR组的黑色素产量下降最显著(图7)。
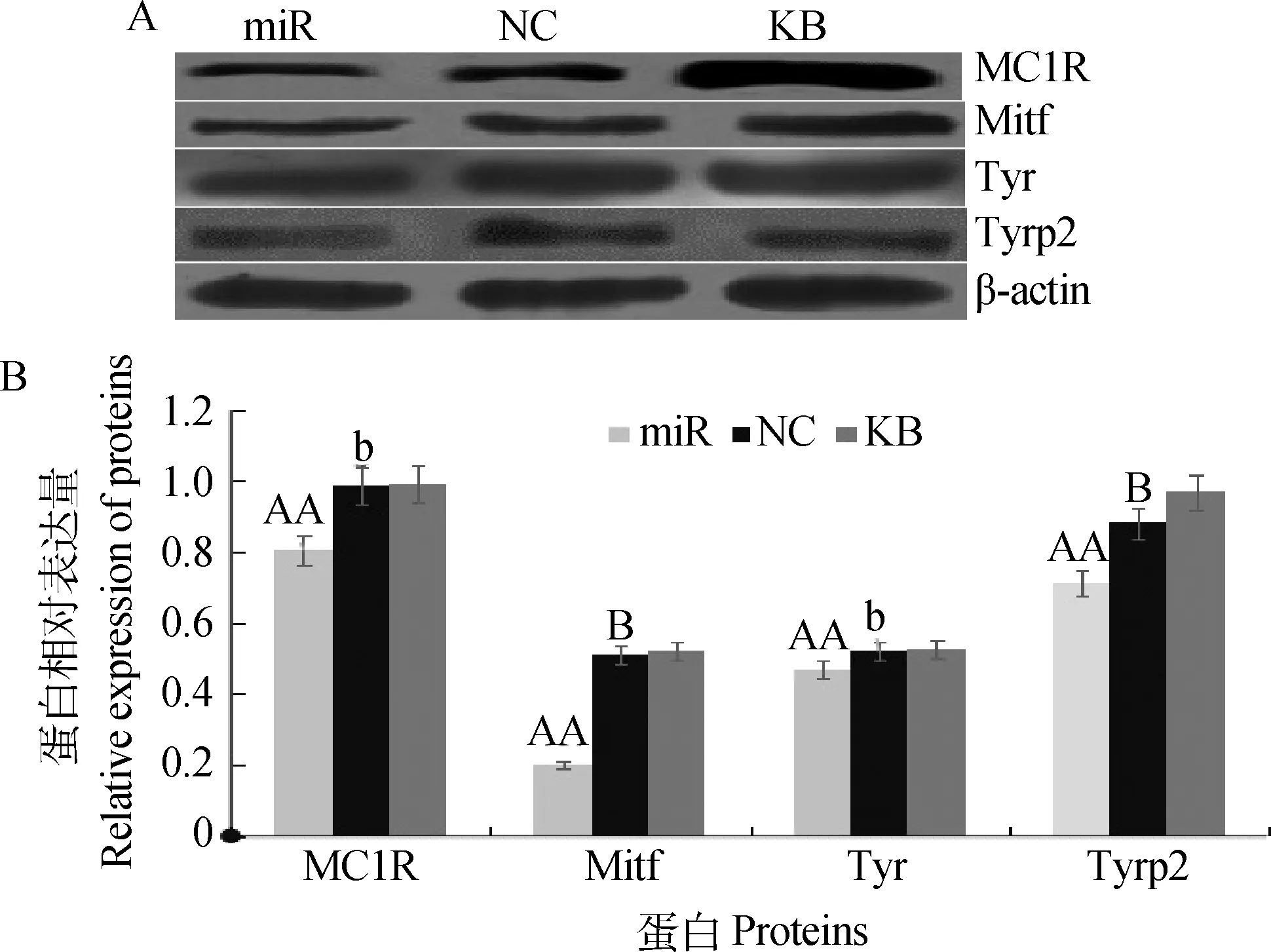
A.蛋白免疫印迹图;B.各蛋白在不同组中的表达差异性A.Western blotting;B.Expressive difference of proteins in each exprimental groups图6 miR-324-3p对羊驼毛色相关基因蛋白表达的影响Fig.6 The effect of protein expression on coat color relative genes by miR-324-3p
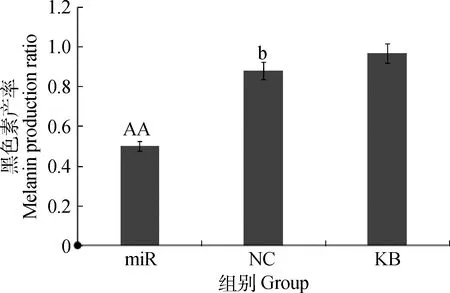
图7 转染载体后各组黑色素细胞内黑色素产量Fig.7 The melanin production of melanocyte groups transfected vectors
3讨论
小RNA分子是非编码的RNA分子(Noncoding RNA,ncRNA),主要包括小干扰RNA(Short interfering RNA,siRNA)和微小RNA(microRNA、miRNA)两类,同一个siRNA或miRNA可以作用于多种mRNA,多个siRNA或miRNA也可以同时作用于同一个mRNA,最终通过调控靶基因参与到真核细胞的多种行为中,因此靶基因的生物学功能验证常常成为研究miRNA功能的手段之一。miRNA通过以不完全互补方式同靶基因mRNA的3′UTR相识别结合,进而抑制该基因的表达翻译过程[13-14]。本试验通过向体外培养的羊驼皮肤黑色素细胞中转染miR-324-3p过表达载体,检测到miR组的miR-324-3p表达量极显著的高于NC组与KB组,而NC组的表达量略低于KB组,造成这种结果的可能原因是具有一定毒性作用的转染试剂引起部分细胞死亡或脱落,致使miR组与NC组的总RNA量下降,进而呈现出NC组miR-324-3p的表达量略低于KB组;研究还发现miR-324-3p在棕色羊驼黑色素细胞中的相对表达量显著高于白色羊驼,揭示miR-324-3p可能通过靶向MC1R基因参与了羊驼黑色素细胞合成的调控。
应用DNAMan软件分析比对了人、鼠及羊驼等多种哺乳动物MC1R-3′UTR区,发现羊驼MC1R-3′UTR与其他动物的有着89%的同源性,预示着不同物种的MC1R-3′UTR区可能具有相同或相近的功能。已有研究表明棕色羊驼皮肤中MC1R的相对表达量是白色羊驼相对表达量的4.32倍[15-16],说明不同毛色羊驼皮肤中表达的MC1R与黑色素的细胞合成间存在一定的相关性。本研究结果显示,靶基因MC1R在转录水平的表达量下调不是极显著,原因可能是与提取总RNA时机有关,但在蛋白水平的表达量下调极显著。对于空白组或者羊驼皮肤组织中的黑色素细胞膜表面的MC1R当与其天然配体特异性结合后,一方面引起胞浆内Ca2+浓度增加,激活蛋白激酶C(PKC),另一方面使胞浆内cAMP水平升高,后者活化cAMP依赖性激酶PKA,PKC、PKA使胞浆内的底物磷酸化或者在细胞核内使核蛋白丝氨酸/酪氨酸磷酸化[17];进而使环磷酸腺苷效应元件结合蛋白CREB(cAMP-responsive element-binding protein)磷酸化,磷酸化的CREB可激活小眼畸形相关转录因子(Microphthalmia-associated transcription factor,Mitf)基因的表达[18];Mitf可与酪氨酸酶家族基因启动子中的M-box结构“CATGTG”序列识别结合,从而促进酪氨酸酶基因家族的表达[19-20];酪氨酸酶是黑色素合成过程中的限速酶,当Tyr基因高表达时,将L-酪氨酸催化氧化聚合为多巴色素(DC),DC经Tyrp2羟化为5,6-二羟基吲哚羟酸(DHICA),DHICA经Tyrp1氧化形成5,6-吲哚醌,进而最终形成真黑素[21];当Tyr基因表达下调时,积聚的L-多巴与谷胱甘肽(GSH)结合,经多步反应生成伪黑素[22]。当MC1R基因表达被下调后顺势引起其下游调控基因表达量降低,这与本试验中Mitf、Tyr和Tyrp2基因在转录水平及蛋白水平表达下调结果相一致,而且Mitf基因表达极显著下调;NC组中MC1R、Mitf、Tyr和Tyrp2基因在转录水平的表达量较KB组也有所下降,分析其原因可能是与转染试剂的毒性作用相关,在提取RNA前,处于不同活力状态的细胞尚未完全恢复,致使目的基因在转录水平的表达量都较低。MC1R、Mitf、Tyr和Tyrp2基因表达量的下降可导致细胞内黑色素合成量的减少,这与检测到的羊驼皮肤黑色素细胞中黑色素合成量减少的结果相一致,这也证实了Tyr同Tyrp2基因表达的变化直接决定着黑色素产量的变化。综上所述,MC1R通过G蛋白偶联内皮素受体通路调控着Mitf与酪氨酸酶基因家族基因的表达,然而MC1R是如何影响羊驼皮肤黑色素细胞内黑色素的合成有待于进一步的研究。
4结论
本研究间接验证了羊驼MC1R基因是miR-324-3p的直接靶基因,miR-324-3p通过从mRNA水平上靶向抑制MC1R基因的表达进而下调靶基因下游调控基因的表达,最终影响羊驼皮肤黑色素细胞中黑色素的形成。
参考文献(References):
[1]STURM R A,TEASDALE R D,BOX N F.Human pigmentation genes:identification,structure and consequences of polymorphic variation[J].Gene,2001,277(1-2):49-62.
[3]华友佳,肖华胜.microRNA研究进展[J].生命科学,2005,17(3):278-281.
HUA Y J,XIAO H S.Progresses on the microRNA study[J].ChineseBulletinofLifeSciences,2005,17(3):278-281.(in Chinese)
[4]VAN ROOIJ E.The art of microRNA research[J].CircRes,2011,108(2):219-234.
[5]朱芷葳,贺俊平,程志学,等.microRNAs在成年羊驼皮肤组织中的表达[J].畜牧兽医学报,2010,41(10):1342-1345.
ZHU Z W,HE J P,CHENG Z X,et al.microRNAs expression in adult alpaca skin[J].ActaVeterinariaetZootechnicaSinica,2010,41(10):1342-1345.(in Chinese)
[6]TIAN X,JIANG J B,FAN R W,et al.Identification and characterization of microRNAs in White and Brown alpaca skin[J].BMCGenomics,2012,13:555.
[7]MACCONI D,TOMASONI S,ROMAGNANI P,et al.MicroRNA-324-3p promotes renal fibrosis and is a target of ACE inhibition[J].JAmSocNephrol,2012,23(9):1496-1505.
[8]LI G,LIU Y,SU Z W,et al.microRNA-324-3p regulates nasopharyngeal carcinoma radioresistance by directly targeting WNT2B[J].EurJCancer,2013,49(11):2596-2607.
[9]XU J H,AI Q,CAO H H,et al.miR-185-3p and miR-324-3p predict radiosensitivity of nasopharyngeal carcinoma and modulate cancer cell growth and apoptosis by targeting SMAD7[J].MedSciMonit,2015,21:2828-2836.
[10]白瑞,于志慧,范瑞文,等.羊驼皮肤黑素细胞体外培养鉴定[J].畜牧兽医学报,2013,44(4):549-556.
BAI R,YU Z H,FAN R W,et al.Culture,identification of alpaca skin melanocytesinvitro[J].ActaVeterinariaetZootechnicaSinica,2013,44(4):549-556.(in Chinese)
[11]ANDO H,ITOH A,MISHIMA Y,et al.Correlation between the number of melanosomes,tyrosinase mRNA levels,and tyrosinase activity in cultured murine melanoma cells in response to various melanogenesis regulatory agents[J].JCellPhysiol,1995,163(3):608-614.
[12]范瑞文,杨姗姗,白俊明,等.羊驼毛纤维中黑色素含量的相关性研究[J].中国农学通报,2013,29(14):7-10.FAN R W,YANG S S,BAI J M,et al.The correlationship between different kinds of melanins in the fleece of alpaca (Lamapacos)[J].ChineseAgriculturalScienceBulletin,2013,29(14):7-10.(in Chinese)
[13]STARK A,BRENNECKE J,BUSHATI N,et al.Animal microRNAs confer robustness to gene expression and have a significant impact on 3′UTR evolution[J].Cell,2005,123(6):1133-1146.
[14]LAGOS-QUINTANA M,RAUHUT R,MEYER J,et al.New microRNAs from mouse and human[J].RNA,2003,9(2):175-179.
[15]任玉红,任彬,范瑞文,等.羊驼MC1R基因克隆及其在不同毛色个体中表达水平研究[J].畜牧兽医学报,2009,40(6):841-845.
REN Y H,REN B,FAN R W,et al.Cloning and expression level analysis ofMC1R gene in alpacas with different coat color[J].ActaVeterinariaetZootechnicaSinica,2009,40(6):841-845.(in Chinese)
[16]任玉红,杨刚,范瑞文,等.黑素皮质素受体1(MC1R)在不同毛色羊驼皮肤组织中的表达与定位研究[J].畜牧兽医学报,2012,43(7):1049-1055.
REN Y H,YANG G,FAN R W,et al.Expression and immunolocalization of melanocortin receptor1(MC1R) in Alpaca skin with different coat color[J].ActaVeterinariaetZootechnicaSinica,2012,43(7):1049-1055.(in Chinese)
[18]LIN J Y,FISHER D E.Melanocyte biology and skin pigmentation[J].Nature,2007,445(7130):843-850.
[19]白瑞,张美萍,乔德瑞,等.MITF基因与动物毛色的研究进展[J].上海畜牧兽医通讯,2006(4):2-3.
BAI R,ZHANG M P,QIAO D R,et al.The research progress ofMITFgenes and animal coat color[J].ShanghaiJournalofAnimalHusbandryandVeterinaryMedicine,2006(4):2-3.(in Chinese)
[21]SEO S Y,SHARMA V K,SHARMA N.Mushroom tyrosinase:recent prospects[J].JAgricFoodChem,2003,51(10):2837-2853.
[22]WEIJN A,BASTIAAN-NET S,WICHERS H J,et al.Melanin biosynthesis pathway in Agaricus bisporus mushrooms[J].FungalGenetBiol,2013,55:42-53.
(编辑程金华)
doi:10.11843/j.issn.0366-6964.2016.07.010
收稿日期:2015-12-30
基金项目:山西省科技攻关项目(20140311019-3);山西农业大学博士科研启动项目(XB2009022)
作者简介:曾庆宝(1985-),男,甘肃白银人,硕士生,主要从事基础兽医学研究,E-mail:gsjybwzqingbao@163.com *通信作者:任玉红,教授,E-mail:renyuhong1963@163.com
中图分类号:S852.2
文献标志码:A
文章编号:0366-6964(2016)07-1381-08
The Effect of miR-324-3p on Melanin Synthesis viaMC1R Gene
ZENG Qing-bao,FAN Rui-wen,ZHANG Qiu-yue,HAO Xiao-juan,WU Liang-qi,REN Yu-hong*
(CollegeofAnimalScienceandVeterinaryMedicine,ShanxiAgriculturalUniversity,Taigu030801,China)
Abstract:To investigate the effect of miR-324-3p on regulating melanin production by targeting MC1R,miR-324-3p was over-expressed by liposome transfection method in alpaca melanocytes in vitro.The expression of MC1R and hair color genes (Mitf,Tyr and Tyrp2) were detected by quantitative real time PCR and Western blotting and the melanin prodution was analyzed by Microplate Reader.The results showed that miR-324-3p was expressed extremely significant difference in the alpaca skins with 1.64 folds in brown alpaca skins vs white alpaca skins(P<0.01),the gene expression of MC1R,Mitf,Tyr and Tyrp2 were down-regulated and the melanin production was reduced(especially Mitf (P<0.01)).The results suggested that miR-324-3p regulated melanogenesis by targeting MC1R gene to down-regulate the expression of the downstream genes including Mitf,Tyr and Tyrp2 in the skin of alpaca.
Key words:miR-324-3p;MC1R;melanin;alpaca
