PLTP在香烟诱导HBECs合成IL-8中的作用①
2016-08-09余秀英黎友伦巫凤苹陈亚娟
余秀英 黎友伦 巫凤苹 陈亚娟
(重庆医科大学附属第一医院呼吸科,重庆400016)
PLTP在香烟诱导HBECs合成IL-8中的作用①
余秀英黎友伦巫凤苹陈亚娟
(重庆医科大学附属第一医院呼吸科,重庆400016)
[摘要]目的:研究磷脂转运蛋白(PLTP)对香烟诱导人支气管上皮细胞(HBECs)合成白介素8(IL- 8)的影响。方法:Wistar大鼠连续3 d被动吸烟,收集支气管肺泡灌洗液(BALF),苏木精-伊红(HE)染色,免疫组织化学法(IHC)检测蛋白表达;体外培养HBECs,不同浓度烟草提取物(CSE)刺激;PLTP siRNA干扰后,进行CSE刺激。MTT法检测细胞增殖,同时检测IL-8含量及PLTP表达。结果:烟熏组BALF白细胞计数以及分类计数较对照组均明显升高(P<0.01),IHC显示烟熏组PLTP和IL-8蛋白表达高于对照组;高浓度CSE(2%、4%)抑制HBECs增殖(P<0.001);不同浓度的CSE作用24 h后,IL-8 mRNA及蛋白表达量增加,而PLTP蛋白表达量下降,并且IL-8蛋白分泌呈现时间依赖性;PLTP siRNA处理后,IL-8表达量明显升高(P<0.001)。结论:PLTP基因缺失促进香烟诱导HBECs合成IL-8。
[关键词]烟草烟雾提取物; 人支气管上皮细胞; 磷脂转运蛋白; 白介素8
吸烟可以导致正常肺及气道结构的破坏,引起肺部严重疾患,如肺损伤、慢性阻塞性肺病、肺癌等。气道上皮作为抵御烟草烟雾的第一道屏障,香烟中的固有成分及在燃烧所产生的有毒物质可以致其严重的炎症反应[1]。Aggarwal等[2]研究证实,中性粒细胞激活在肺损伤的发病机制中起着关键性的作用。而中性粒细胞趋化因子IL-8可以趋化和激活中性粒细胞[3]。研究表明,肺上皮细胞是IL-8的重要来源[4]。
磷脂转运蛋白(Phospholipid transfer protein,PLTP)广泛表达于人和动物的血浆和组织中,主要促进血浆脂蛋白,脂蛋白与细胞间脂质及相关物质转运与交换。近年来PLTP逐渐成为非特异性免疫反应领域中的研究热点[5-7]。文献报道,正常人类和鼠的肺组织是PLTP mRNA表达最为丰富的器官[8],Brehm等[9]研究发现吸烟可以上调肺组织PLTP的表达活性,我们的前期研究证实[10],烟草提取物可以刺激大鼠肺泡Ⅱ型上皮细胞和A549细胞合成PLTP。因此,本文利用支气管上皮细胞,借此研究烟草刺激支气管上皮细胞合成PLTP蛋白的影响以及特异性基因敲除的方法研究PLTP在香烟烟雾诱导HBE细胞合成白介素8(interleukin-8,IL- 8)中的作用,以进一步探讨PLTP参与香烟烟雾所致肺损伤的发病机制。
1材料与方法
1.1药物、试剂和仪器高糖DMEM培养基、胎牛血清、胰蛋白酶均购自美国Gibco公司;BCA蛋白浓度测定试剂盒购于Thermo公司,SDS-PAGE 凝胶配置试剂盒购自碧云天生物技术研究所;IL-8、PLTP抗体购于美国Abcam公司,GAPDH抗体以及辣根过氧化物酶标记山羊抗兔IgG购于Santa公司;IL-8 ELISA KIT购自博士德公司;RNAiso Plus试剂、逆转录试剂盒、SYBR Green Supermix均购自TaKaRa公司,PLTP siRNA(sense:5′-GAGCUGCAACUGAC-AUCUUTT-3′;antisense:5′-AAGAUGUCAGUUGCA-GCUCTG-3′)购自吉玛基因,引物:PLTP (5′- TCTGCCCTGTCCTCTACCAC-3′;5′-GGCTCCAGTTCCT-CTCAGTC-3′),IL-8(5′-TTCAGAGACAGCAGAG-CACA-3′;5′-AGCACTCCTTGGCAAAACTG-3′)购于上海生物工程公司,其余均为国产试剂。宏升牌香烟购自重庆烟草公司,每只烟含焦油11 mg,一氧化碳17 mg,尼古丁1.1 mg。CO2恒温培养箱,美国Thermo Scientific公司;超低温冰箱,美国Revco公司;高速台式离心机,美国Sigma公司;纯水仪,美国Milipore公司;M450酶标仪,实时定量PCR仪,美国Bio-Rad公司; PAC3000型电泳仪、电转仪,北京六一公司。
1.2方法
1.2.1Wistar大鼠吸烟模型的建立以及BALF白细胞计数和肺组织切片HE染色及ICH法检测PLTP、IL-8的表达20只清洁级雄性Wistar大鼠,体重(180±10)g,购自重庆医科大学实验动物中心。将20只Wistar大鼠随机分为2组:正常对照组和烟熏组。将两组大鼠分别放入相同大小特制的烟熏箱中,正常对照组暴露于空气中,而烟熏组则进行被动吸烟,6次/d,每次持续燃烧香烟(2支/3支循环进行)60 min,每次之间间隔至少15 min,共3 d[11]。
最后一次香烟暴露18 h后处理各组Wistar大鼠。各组大鼠采用10%水合氯醛(300 mg/kg)腹腔注射麻醉,腹主动脉放血处死大鼠,结扎左侧肺门,分离出颈部气管,采用外径约1.8 mm的静脉导管进行气管插管,然后注入预热生理盐水(37℃)3 ml,轻轻按摩右肺组织并上下颠倒大鼠后,缓慢回抽灌洗液,然后再将所得液体缓慢注回肺内并重复4次,保证回收率75%以上。BALF加入同体积的70%乙醇,交于实验室进行白细胞人工计数和分类计数。留取左侧肺组织,10%甲醛液固定,石蜡包埋,4 μm切片,HE染色后,光学显微镜观察进行病理学分析。采用SP法进行IHC法检测肺组织PLTP和IL-8的表达。
1.2.2细胞株来源、培养以及烟草烟雾提取物的制备人支气管上皮细胞(Human bronchial epithelial cells,HBECs)源自重庆医科大学生命科学院实验室,用含10%胎牛血清的高糖DMEM完全培养基,于37℃、5%CO2及饱和湿度条件下常规培养,每 2~3 d传代1次,所有实验均在细胞对数生长期进行。
烟草烟雾提取物制备操作步骤如下所述:点燃香烟,去除滤嘴,安放在抽吸装置上。匀速地抽吸,使烟雾通过一个装有10 ml无血清的DMEM培养基的玻璃瓶,此时可见烟草烟雾通过DMEM培养基并产生大小均匀的气泡,收集瓶中出现大量烟雾,且保证每支香烟燃烧约4 min。当10支香烟燃烧产生的烟雾通过该培养基后,停止抽吸。调节香烟烟雾-DMEM培养基混合物的pH至7.4,并用0.22 μm的过滤器除去杂质和细菌,即为烟草烟雾提取物。使用Beckman DU 640 分光计(Fullerton,CA,USA)测定烟草烟雾提取物在320nm处的吸光度值,约为1.36±0.12,将此时对应的CSE浓度设为100%。实验时,根据实验需要将100%烟草烟雾提取物稀释至所需浓度即可[10]。
1.2.3MTT法检测CSE对HBE细胞增殖的影响将约2×103/0.2 ml细胞种植在96孔板内,培养24 h,然后加入相应浓度的CSE继续培养24 h后,吸尽孔板内的培养液,用PBS清洗两次后再在每孔加入20 μl 5 mg/ml的MTT和100 μl培养液混匀,在37℃、5%CO2培养4 h,吸干每孔内的上清,每孔加入DMSO 150 μl震荡使沉淀充分溶解,酶标仪570 nm波长测定OD值。
1.2.4实时定量PCR(RT-PCR)检测IL-8 mRNA的表达取处于对数生长期的人支气管上皮细胞HBE以2×105ml-1的密度接种于6孔板中,分别设置对照组和实验组,常规培养24 h后实验组分别加入终浓度为0.25%、0.5%、1%CSE处理24 h后收集细胞采用Trizol法分别提取各细胞内的总RNA,经核酸浓度测定仪(Fullerton,CA,USA)测定RNA的浓度,并且样品A260/280比值均介于1.8~2.0。使用TaKaRa逆转录试剂盒采用两步法将样品逆转为cDNA,然后在PCR仪(Bio-Rad,USA)上进行实时定量PCR测定IL-8 mRNA的表达量。
1.2.5蛋白质印迹法(Western blot)检测PLTP、GAPDH蛋白的表达取处于对数生长期的人支气管上皮细胞HBE以2×105ml-1的密度接种于6孔板中,分别设置对照组和实验组,常规培养24 h后实验组分别加入终浓度为0.25%、0.5%、1%CSE处理24 h,收集上清液,然后将其置于离心机中4℃,3 000 r/min离心15 min后收集上层液体于-80℃冰箱中保存。收集细胞提取各组细胞总蛋白,BCA法测定蛋白含量。运用酶标仪测定各组蛋白质含量并配平,使各组蛋白终浓度一致。每个点样孔加样60 μg蛋白样品液,电泳、转膜,5%的脱脂牛奶封闭2 h,采用兔抗人PLTP (1∶3 000),兔抗人内参GAPDH多抗(1∶1 000),4℃孵育过夜。用TBST溶液漂洗3次,每次10 min。加入二抗(1∶1 000)常温孵育2 h。TBST溶液漂洗,用ECL试剂发光,曝光。图像扫描后运用图像分析软件Quantity One分析条带的吸光度值,将对照组和实验组的目的条带的灰度值和内参的吸光度值比值表示蛋白质相对表达水平。
1.2.6酶联免疫吸附法(Enzyme-Linked Immuno Sorbent Assay,ELISA)测定IL-8相对含量将收集的上清液稀释十倍之后按每孔100 μl加入事先准备好的ELISA试剂盒孔板中37℃孵育90 min,弃液后每孔加入生物素抗人IL-8抗体工作液100 μl 37℃反应60 min,用PBS洗涤3次后每孔加入ABC工作液100 μl 37℃反应30 min,再次用PBS洗涤5次后每孔按90 μl依次加入TMB显色液,37℃避光反应30 min后每孔加入100 μl TMB终止液。用酶标仪在450 nm测定OD值。根据所测OD值作出标准曲线,然后计算IL-8蛋白表达量。
1.2.7阳离子脂质体法转染siRNA取处于对数生长期的人支气管上皮细胞HBE以2×105ml-1的密度接种于6孔板中,分别设置阴性对照组和实验组常规培养16~24 h,细胞贴壁生长50%左右时,准备转染;DEPC消毒的去酶EP管中加入250 μl Opti-MEM培养液及5 μl RNAiMAX转染试剂,混匀,室温孵育5 min,另取DEPC消毒的去酶EP管加入250 μl Opti-MEM培养液及60 pmol的siRNA,混匀; 5 min之后将RNAiMAX混合试剂和siRNA混合试剂混合,混匀,室温静置20 min后按照分组加入事先用PBS清洗过的孔板中,再加入不含胎牛血清的培养基,总体积为2 ml;37℃孵育6 h后,吸取培养基,加入完全培养基孵育18~24 h后,再将HBE细胞设置为NC siRNA处理组、CSE+NC siRNA处理组、siPLTP处理组、CSE+siPLTP处理组处理24 h之后收取上清液用ELISA法测定IL-8相对含量,提取各组细胞RNA以及总蛋白,分别用RT-PCR测定PLTP、IL-8 mRNA的表达情况以及用Western blot检测PLTP蛋白的表达量。
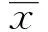
2结果
2.1香烟暴露后大鼠肺组织组织学观察、IHC分析以及BALF白细胞计数情况如图1A所示,3 d香烟暴露之后烟熏组肺组织充血水肿;如图1B所示,HE染色显示正常肺组织肺泡结构完整正常,无炎症细胞浸润,烟熏组血管腔充血,肺间质炎症细胞浸润,肺泡腔扩大断裂,肺泡融合;IHC结果显示,与对照组比较,烟熏组肺上皮细胞PLTP(如图1C所示)和IL-8(如图1D所示)表达升高;如图E所示,BALF中,烟熏组白细胞总数显著高于对照组,并且中性粒细胞、巨噬细胞、淋巴细胞均显著高于对照组。
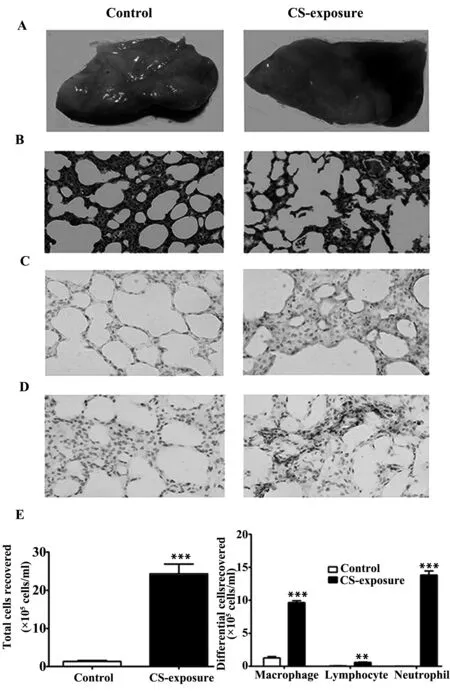
图1 香烟导致大鼠肺损伤Fig.1 Cigarette smoke caused lung injury in ratsNote: A.Lung was photographed to detect changes; B.HE staining was performed to detect pathological changes(HE,×400);C.Expression of PLTP was detected by IHC(IHC,×400);D.Expression of IL-8 was detected by IHC(IHC,×400).E.Total and differential white blood cell counts in BALF.**.P<0.01 vs control group;***.P<0.001 vs control group.
2.2烟草烟雾提取物对人支气管上皮细胞HBE合成IL-8的影响如图2A所示,经不同浓度(0.125%、0.25%、0.5%、1%、2%、4%)的烟草烟雾提取物作用于HBE细胞,采用MTT法,测烟草提取物对HBE细胞增殖情况的影响,我们发现0.125%、0.25%、0.5%、1%浓度的烟草提取物对HBE细胞增殖无明显影响,而2%和4%浓度的烟草提取物可以抑制HBE细胞增殖并且促进其死亡;如图2B、C、D所示,经不同浓度(0.25%、0.5%、1%)和不同时间(6、12、24 h)的烟草烟雾提取物作用于HBE细胞,IL-8表达随着烟草浓度的增加而增加,并且在24 h分泌达到明显升高,与对照组相比差异有统计学意义(P<0.05)。结果表明,烟草烟雾提取物能够刺激HBE细胞合成和分泌IL-8,并且呈现浓度依赖性和时间依赖性。
2.3烟草烟雾提取物对人支气管上皮细胞HBE合成PLTP的影响如图3所示,经不同浓度的烟草烟雾提取物作用于HBE细胞24 h,PLTP的表达随着烟草浓度升高而下降,与对照组相比差异有统计学意义(P<0.05)。结果表明,烟草烟雾提取物能够抑制HBE细胞合成PLTP,而PLTP与IL-8是否存在内在联系,尚需论证。
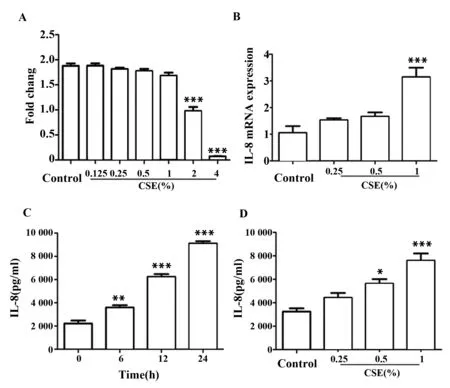
图2 烟草提取物对HBECs释放IL-8的影响Fig.2 Effects of CSE on expression of IL-8 in HBECsNote: A.Effects of CSE on cell growth by MTT;B.IL-8 mRNA expression was detected by RT-PCR;C,D.Protein expression of IL-8 was detected by ELISA.*.P<0.05 vs control group;**.P<0.01 vs control group;***.P<0.001 vs control group.
2.4PLTP转染效率以及在正常情况下和烟草烟雾刺激下其对IL-8 mRNA表达的影响如图4所示,PLTP siRNA转染稳定48 h ,PLTP siRNA的基因沉默率达到70%,并且观察到PLTP基因沉默之后,IL-8 mRNA的表达反而升高,并且PLTP siRNA沉默之后促进烟草提取物刺激HBE细胞IL-8 mRNA的表达。
2.5PLTP基因沉默对烟草烟雾提取物诱导的人支气管上皮HBE细胞PLTP以及IL-8蛋白表达的影响如图5所示,1%的烟草提取物浓度作为工作浓度,PLTP siRNA预处理后,加入烟草提取物共培养24 h,PLTP基因沉默之后可以促进烟草提取物刺激后IL-8蛋白的释放。
图3 WB检测PLTP蛋白表达量Fig.3 Effect of CSE on expression of PLTP in HBECsNote: *.P<0.05 vs control group;***.P<0.001 vs control group.
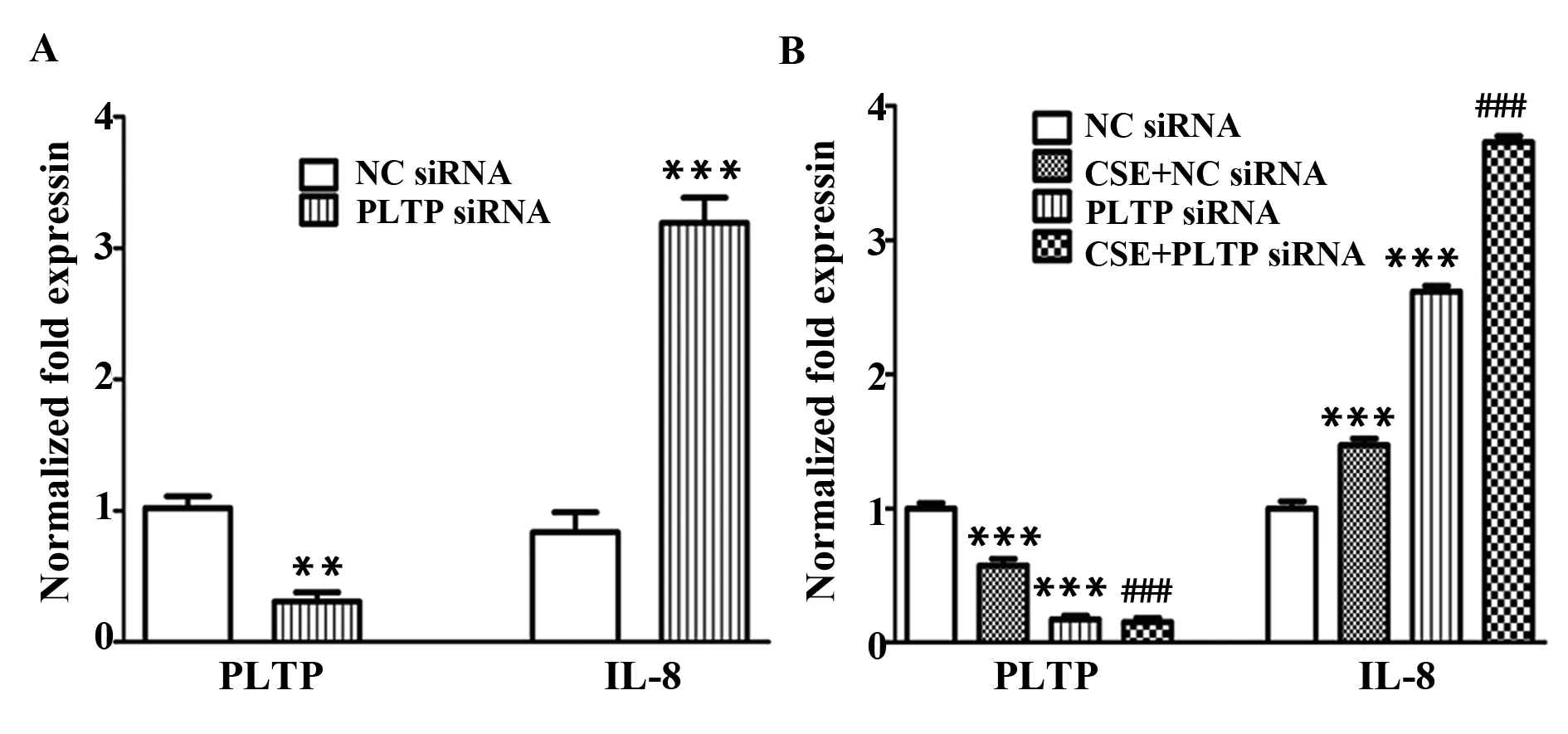
图4 RT-PCR检测转染效率Fig.4 Infection efficiency detected by RT-PCRNote: A.Infection efficiency detected by RT-PCR;B.PLTP mRNA and IL-8 mRNA expression detected by RT-PCR.**.P<0.01 vs NC siRNA group;***.P<0.001 vs NC siRNA group;###.P<0.001 vs NC siRNA+CSE group.
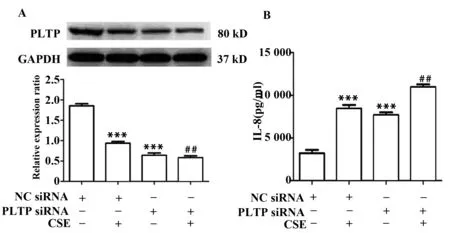
图5 PLTP 及IL-8 表达情况Fig.5 Protein expression of PLTP and IL-8 in each groupsNote: A.Protein expression of PLTP was detected by Western blott;B.Protein expression of IL-8 was detected by ELISA.***.P<0.001 vs NC siRNA group;##.P<0.01 vs NC siRNA+CSE group.
3讨论
烟草烟雾中含有大量自由基(ROS)和有毒物质,吸入人体可导致细胞癌变、气道损伤以及肺部炎症。有研究报道,不管是小鼠吸烟模型还是细胞离体实验中,IL-8表达升高幅度均比其他炎症因子高[12,13]。并且IL-8在烟草烟雾导致的肺损伤中起着重要作用,它可以趋化和激活中性粒细胞,导致其在肺部的浸润。Modelska等[14]研究发现,抗IL-8预处理可阻断中性粒细胞的肺部浸润,显著降低盐酸、内毒素等对血管内皮和肺泡上皮细胞的损伤。
PLTP的主要功能是参与低密度脂蛋白与高密度脂蛋白间的磷脂转运,修饰HDL分子大小及脂质组成。随着研究的不断深入,发现其水平及活性与多种炎症参与性疾病相关。我们前期的研究发现烟草提取物刺激大鼠肺泡Ⅱ型上皮细胞可以引起PLTP显著升高,因此我们此次研究的目的主要是探索吸烟引起的炎症反应与PLTP的关系。
我们的研究发现,在大鼠吸烟模型中,烟熏组白细胞总数、中性粒细胞、PLTP以及IL-8蛋白表达均高于对照组(如图1所示),在离体细胞实验中,PLTP以及IL-8的表达量具有烟草浓度依赖性,随着烟草浓度的升高,合成IL-8的量也不断增加(如图2B~D),然而,PLTP却随着烟草浓度的增加而表达下降(如图3),而通过PLTP基因沉默发现IL-8不管是在基础水平还是在烟草烟雾诱导情况下均显著升高(如图4、5所示),我们的研究结果表明PLTP具有抗炎作用,烟草烟雾引起PLTP下降,抗炎作用减弱,加剧IL-8的合成和释放。然而,PLTP在烟草烟雾诱导HBE细胞中合成减少却与Brehm等[9]研究以及我们前期的研究[10]、烟熏大鼠模型IHC染色截然相反,这是否与细胞类型有关?是否是因为PLTP在肺泡Ⅱ型上皮细胞中的作用有关?Jiang等[8]认为PLTP可以运输肺泡表面活性物质,由于吸烟引起肺泡表面的活性物质显著减少,肺泡Ⅱ型上皮细胞代偿增生,这种改变刺激PLTP合成增加,以运输更多的表面活性物质到达肺泡表面来缓解肺气肿的病理改变。然而,支气管上皮细胞没有合成肺泡表面活性物质的能力,HBECs合成的PLTP仅仅作为细胞的表面成分,而未参与运输肺泡表面活性物质,因此在烟草刺激HBECs导致细胞损伤时PLTP合成减少。有研究报道,在严重的内毒素血症小鼠模型中,与野生型小鼠相比,PLTP-/-小鼠的血浆以及组织中炎症因子水平更高[15],将其分离得到的脾细胞在暴露于脂多糖(LPS)中,其炎症反应比野生型的更为剧烈,并且脾细胞死亡率也显著升高。Brehm等[9]研究也表明,PLTP基因沉默小鼠在脂多糖诱导肺损伤模型中,IFN-γ、TNF-α、IL-1β、MMP-9较对照组显著升高,而相较未处理组,PLTP处理可以抑制IFN-γ、TNF-α、IL-1β、MMP-9的释放。这些研究结果与我们结果一致,表明PLTP有一定的抗炎作用。然而Schlitt等[16]的研究却发现,在动脉粥样硬化小鼠模型中,PLTP-/-小鼠通过下调白介素6(IL-6)达到抗炎作用,这与我们的实验结果相反,可能原因有二,其一是模型的不同,再者就是所测的炎症因子不同,提示PLTP在调节炎症介质表达中作用机制复杂,有待进一步深入研究。
综上所述,我们证实PLTP基因沉默后,香烟诱导人支气管上皮细胞合成和释炎症因子IL-8增加,表明PLTP基因具有一定的抗炎作用。通过此实验,可以为研究烟草烟雾所致的肺部急性炎症疾病致病机制提供思路和参考。
参考文献:
[1]Thorley AJ,Tetley TD.Pulmonary epithelium,cigarette smoke,and chronic obstructive pulmonary disease[J].Int J Chron Obstruct Pulmon Dis,2007,2(4):409-428.
[2]Aggarwal A,Baker CS,Evans TW,etal.G-CSF and IL-8 but not GM-CSF correlate with severity of pulmonary neutrophilia in acute respiratory distress syndrome[J].Eur Respir J,2000,15(5):895-901.
[3]Pease JE,Sabroe I.The role of interleukin-8 and its receptors ininflammatory lung disease:implications for therapy[J].Am J Respir Med,2002,1(1):19-25.
[4]Mortaz E,Henricks PA,Kraneveld AD,etal.Cigarette smoke induces the release of CXCL-8 from human bronchial epithelial cells via TLRs and induction of the inflammasome[J].Biochim Biophys Acta,2011,1812(9):1104-1110.
[5]Vuletic S,Peskind ER,Marcovina SM,etal.Reduced CSF PLTP activity in Alzheimer's disease and other neurologic diseases:PLTP induces apoE secretion in primary human astrocytes in vitro[J].Neurosci Res,2005,80(3):406-413.
[6]Cheung MC,Brown BG,Marino Larsen EK,etal.Phospholipid transfer protein activity is associated with inflammatory markers in patients with cardiovascular disease[J].Biochim Biophys Acta,2006,1762(1):131-137.
[7]Cavusoglu E,Marmur JD,Chhabra S,etal.Elevated baseline plasma phospholipid protein (PLTP) levels are an independent predictor of long-term all-cause mortality in patients with diabetes mellitus and known or suspected coronary artery disease[J].Atherosclerosis,2015,239(2):503-508.
[8]Jiang XC,D'Armiento J,Mallampalli RK,etal.Expression of plasma phospholipid transfer protein mRNA in normal and emphysematous lungs and regulation by hypoxia[J].J Biol Chem,2008,273(25):15714-15718.
[9]Brehm A,Geraghty P,Campos M,etal.Cathepsin G degradation of phospholipid transfer protein (PLTP) augments pulmonary inflammation[J].FASEB J,2014,28(5):2318-2331.
[10]廖科,陈虹,陈亚娟,等.磷脂转运蛋白在烟草提取物诱导Ⅱ型肺泡上皮细胞凋亡中的作用[J].南方医科大学学报,2015,35(7):941-946.
[11]Ghio AJ,Hilborn ED,Stonehuerner JG,etal.Particulate matter in cigarette smoke alters iron homeostasis to produce a biological effect[J].Am J Respir Crit Care Med,2008,178(11):1130-1138.
[12]Tang GJ,Wang HY,Wang JY,etal.Novel role of AMP-activated protein kinase signaling in cigarette smoke induction of IL-8 in human lung epithelial cells and lung inflammation in mice[J].Free Radic Biol Med,2011,50(11):1492-1502.
[13]Li FF,Shen J,Shen HJ,etal.Shp2 plays an important role in acute cigarette smoke-mediated lung inflammation[J].J Immunol,2012,189(6):3159-3167.
[14]Modelska K,Pittet JF,Folkesson HG,etal.Acid-induced lung injury.Protective effect of anti-interleukin-8 pretreatment on alveolar epithelial barrier function in rabbits[J].Am J Respir Crit Care Med,1999,160(51):1450-1456.
[15]Gautier T,Klein A,Deckert V,etal.Effects of plasma phospholipid transfer protein deficiency on lethal endotoxemia in mice[J].J Biol Chem,2008,283(27):18702-18710.
[16]Schlitt A,Liu J,Yan D,etal.Anti-inflammatory effects of phospholipid transfer protein (PLTP) deficiency in mice[J].Biochim Biophys Acta,2005,1733 (2-3):187-191.
[收稿2015-10-20修回2015-11-17]
(编辑倪鹏)
doi:10.3969/j.issn.1000-484X.2016.07.004
作者简介:余秀英(1989年-),女,在读硕士,主要从事呼吸系统疾病发病机制方面的研究,E-mail:405426832@qq.com。 通讯作者及指导教师:陈亚娟(1980年-),女,博士,讲师,主治医师,主要从事呼吸系统小气道疾病发病机制方面研究,E-mail:yajuanchencqmu@sina.com。
中图分类号R563.19
文献标志码A
文章编号1000-484X(2016)07-0952-06
Effect of PLTP on CSE-induced IL-8 production in human bronchial epithelial cells
YU Xiu-Ying,LI You-Lun,WU Feng-Ping,CHEN Ya-Juan.
Department of Respiratory Medicine,First Affiliated Hospital,Chongqing Medical University,Chongqing 400016,China
[Abstract]Objective:To investigate the effect of PLTP gene on CSE-induced IL-8 production in human bronchial epithelial cell line (HBECs).Methods: Wistar rats were exposed to air or cigarette smoke for 6 hours/day on 3 consecutive days,then the lungs were sectioned and examined.The number of total white blood cell and differential white blood cells in BALF were counted.The different concentrations of CSE co-cultured with HBECs for 24 hours.Cells growth was detected by MTT assay.Expression levels of PLTP mRNA and IL-8 mRNA were examined by RT-PCR,protein of PLTP was investigated by Western blot,and production of IL-8 examined by ELISA.Results: The number of white blood cells in BALF was significantly increased compared with controls.Enhanced expression level of PLTP and IL-8 were observed in CS-exposure group.Proliferation of HBECs tends to decrease at high concentrations of CSE(2.0% CSE and 4.0% CSE).The results suggested that the production of IL-8 induced by CSE in a time- and concentration-dependent manner,while the expression of PLTP induced by CSE in a dose-dependent manner.Furthermore,expression levels of IL-8 significantly increased after silence PLTP gene. Conclusion: PLTP siRNA could increase CSE-induced IL-8 production in HBECs.
[Key words]Cigarette smoke extract;Human bronchial epithelial cells; HBECs; PLTP; IL-8
①本文为国家自然科学基金青年基金资助项目(No.81200009)、国家临床重点专科专项资助(卫办医政函[2012]649号)和重庆市卫生局中医药研究课题(ZY20132165)。
