重组毕赤酵母生产凝乳酶发酵优化
2016-08-08宿玲恰段绪果
李 亮,吴 丹,宿玲恰,段绪果,吴 敬*
(1.食品科学与技术国家重点实验室,江南大学,江苏 无锡 214122;2.江南大学 生物工程学院,江苏 无锡214122)
重组毕赤酵母生产凝乳酶发酵优化
李亮1,2,吴丹1,2,宿玲恰1,2,段绪果1,2,吴敬1,2*
(1.食品科学与技术国家重点实验室,江南大学,江苏 无锡 214122;2.江南大学 生物工程学院,江苏 无锡214122)
为了获得毕赤酵母生产凝乳酶的最佳发酵条件,分别从起始诱导OD600、甲醇诱导浓度以及pH等方面研究了P.pastoris GS115在3.6 L发酵罐中表达微小根毛霉来源凝乳酶的高密度发酵,以恒溶氧反馈调节补加甘油和甲醇检测流加控制器在线监测流加甲醇。结果表明,在重组P.pastoris GS115/pPIC9k-chy起始诱导,OD600和甲醇诱导体积分数分别为150和2.0%,诱导pH为5.0时,发酵96 h凝乳酶活达到最大,为1 870 SU/mL,此时对应的生产强度和产物得率均达到最高水平,分别为19.48 SU/(mL·h)和2.42 SU/mL,总蛋白质质量浓度为0.64 mg/mL,凝乳活性与蛋白质水解活性的比值(MCA/PA)为63.43。
毕赤酵母;微小根毛霉;凝乳酶;高密度发酵
凝乳酶(Chymosin,EC3.4.23.4)是干酪制作过程中的关键性酶,属于天冬氨酸家族蛋白酶[1],其主要的生物学功能是能够特异性的切割K-酪蛋白Phe105~Met106之间的肽键[2],破坏酪蛋白胶束,从而导致牛奶凝集。同时由于其具有蛋白质水解能力,它对干酪的质构和特有风味的形成有非常重要的作用,已被广泛应用于干酪制造业和干酪素产业[3]。凝乳酶来源广泛,主要存在于动植物以及微生物中[4]。传统的凝乳酶来源于小牛的皱胃,动物凝乳酶以其凝乳活力与蛋白质水解能力的高比值(MCA/PA)而成为制作奶酪的首选酶。但随着世界范围内干酪产量的剧增,单纯靠宰杀大量的小牛获取凝乳酶无法满足工业生产,导致世界范围内凝乳酶供应缺乏[5]。植物凝乳酶虽然来源广泛,但是其蛋白水解力强,并且植物的生长受时间、地点等的限制难以发展。从1965年起微生物来源凝乳酶开始取代小牛皱胃酶制造干酪以来,较为成功地弥补了小牛凝乳酶短缺的问题。微生物具有生长周期短、产量大,受气候、地域、时间限制小,酶提取方便等优点,可较大地降低生产凝乳酶的成本。目前干酪生产中常用的真菌凝乳酶由于蛋白质水解能力较强,用其制作的奶酪得率低且成熟后一般会产生苦味,并且它的强耐热性也导致了奶酪生产中副产物乳清再利用不便,而基因工程凝乳酶的开发研究将为解决这些问题开辟了新的思路[6],因此成为当前研究的热点。
目前中国干酪生产所用的凝乳酶以进口为主,成本较高,这已经成为制约我国乳品工业干酪生产的重要因素。已知的微生物来源凝乳酶主要有微小毛霉[7]、栗疫菌[8]、和根毛霉属[9]等。据报道,有关凝乳酶基因已经在大肠杆菌[10]、酵母菌[11]、黑曲毛霉[12]等宿主中表达。甲醇利用型巴斯德P.pastoris具有高表达、高稳定、高分泌、容易放大、糖基化程度低、成本低等优点,同时可对表达的蛋白质进行翻译后的加工与修饰,已被广泛用于表达多种蛋白质[13]。国外Toan Hong Phuoc等[14]人在P.pastoris表达获得酶活565 IU/mL,国内张莉等[15]通过在P.pastoris GS115中表达牛凝乳酶基因获得酶活12 SU/mL;王景会等[16]通过在P.pastoris GS115中克隆表达微小毛霉来源凝乳酶基因获得最终酶活311.8 SU/mL;邱重晏等[17]在P.pastoris中KM71中克隆表达微小毛霉凝乳酶基因获得酶活5.4 SU/mL,但目前并未有相关微小根毛霉来源凝乳酶基因在P.pastoris中上罐发酵表达的报道。作者构建了微小根毛霉来源凝乳酶基因在P.pastoris中表达的重组菌,并研究其在发酵罐中高密度诱导表达的最佳条件,为工业化应用奠定基础。
1材料与方法
1.1实验材料
1.1.1菌株重组P.pastoris(Pichia pastoris)菌株由作者所在实验室构建并保存。以P.pastoris GS115为宿主菌,通过同源交换技术整合来自Rhizomucor pusillus菌株中的凝乳酶基因。遗传表型Mutshis+,信号肽序列来自Saccharomyces cerevisiae的α-MF。
1.1.2培养基
1)YPD培养基:10 g/L酵母提取物,20 g/L蛋白胨,20 g/L葡萄糖。
2)种子培养基:10 g/L酵母提取物,20 g/L蛋白胨,YNB 13.4 g/L,甘油30 g/L。
3)BSM培养基:85%H3PO426.7 ml/L,CaSO4· 2H2O 0.93 g/L,K2SO418.2 g/L,MgSO4·7H2O 14.9 g/L,KOH 4.13 g/L,甘油30 g/L,PTM1 4.35 ml/L。
4)PTM1低盐溶液:CuSO46 g/L,KI 0.08 g/L,MnSO4·H2O 3.0 g/L,Na2MoO40.2 g/L,H3BO30.2 g/L,CoCl20.5 g/L,ZnCl220.0 g/L,FeSO4·7H2O 65.0 g/L,生物素0.2 g/L,H2SO45.0 mL/L。
5)补料生长培养基:50%甘油 (含12 mL/L PTM1)。
6)甲醇诱导培养基:100%甲醇 (含12 mL/L PTM1)。
1.1.3试剂脱脂奶粉:国产伊利;蛋白胨、酵母抽提物:Oxiod;酵母无氨基基本氮源培养基(YNB)、遗传霉素G418:上海生工生物工程公司;其他均为国产分析纯试剂。
1.2方法
1.2.1种子摇瓶培养从甘油管中接200 μL菌液于100 mL发酵种子培养基中 (100 mL培养基/500 mL三角瓶),于30℃、200 r/min培养24 h。
1.2.2补料高密度发酵
1)甘油分批发酵阶段:将发酵种子培养基中菌液按10%接种体积分数接入装有900 mL BSM培养基的3.6 L全自动发酵罐(Produktbeschreibung Labors 5,Swit)中分批培养 (以25%氨水控制pH 5.0,温度30℃),调节搅拌转速和通气量维持溶氧在30%以上。
2)甘油补料分批培养阶段:当甘油耗尽 (约17.5 h)时溶氧(DO)迅速上升,此时通过溶氧反馈调节以16.3 mL/(L·h)的流速控制流加补料生长培养基。
3)甲醇诱导发酵阶段:当菌体达到一定浓度后停止补料,并让菌体饥饿约30~60 min,然后通过FC2002型甲醇监测流加控制器 (上海华东理工大学)控制流加可维持恒定浓度的甲醇诱导培养基,诱导凝乳酶的表达。发酵控制过程由发酵罐控制系统软件进行在线控制和数据采集。
1.2.3菌体生物量的测定采用比色法,将菌液稀释到一定倍数后用Bio-photometer于波长600 nm处以去离子水为对照进行比色测定,OD600=OD读数×稀释倍数。称量干燥的5mL离心管,取4 mL菌液放于其中,离心去上清液,然后在105℃下烘干至恒质量,称量并计算菌体干质量。
1.2.4蛋白质质量浓度的测定重组P.pastoris发酵液中总蛋白质质量浓度的测定采用Bradford法,以牛血清蛋白为标样制作标准曲线。
1.2.5凝乳酶活的测定采用Arima K[18]的方法进行凝乳酶活力(MCA)的测定。用浓度为0.01 mol/L 的CaCl2溶液配制质量分数为10%的脱脂乳,此溶液配置后在室温下放置40 min后使用。取1 mL质量分数为10%的脱脂乳于35℃保温10 min,加入0.1 mL适当稀释的凝乳酶液,振荡均匀并开始计时,观察管壁上开始出现凝乳颗粒为终点,记录时间(t)。在上述条件下,40 min凝结1 mL质量分数为 10%脱脂乳的酶量定义为一个 Soxhlet单位(SU)。
MCA(SU)=(2 400/T)×(供试乳量/凝乳酶量)×D式中:2 400为40 min的凝乳时间;T为测试的凝乳时间(s);D为稀释倍数。
1.2.6凝乳酶蛋白水解活力(PA)的测定凝乳酶蛋白水解活力检测采用中华人民共和国专业标准SB/T10317-1999蛋白质水解活力测定方法。取试管,每管加入样品稀释液1 mL,置于40℃水浴锅中预热2 min,各加入经同样预热的酪蛋白1 mL,精确保温10 min,时间到后,立即加入0.4 mol/L三氯乙酸2 mL,终止反应,继续置于水浴锅中保温20 min,残余蛋白质沉淀离心后,取试管,每管内加入滤液1 mL,再加0.4 mol/L碳酸钠5 mL,0.7 mol/L的福林酚试剂1 mL,摇匀,40℃保温发色20 min后进行OD660测定。空白样品,测定同上,加酪蛋白之前先加0.4 mol/L三氯乙酸2 mL,使酶失活,再加入酪蛋白。
蛋白质水解活力(U/mL)=(A/10)×4×N
式中,A为由样品测得值ABS,查标曲得相当的酪氨酸微克数;4为4 mL反应液取出1 mL测定(即4倍);10为反应10 min;N为酶液稀释倍数。
1.2.7聚丙烯酰胺凝胶电泳聚丙烯酰胺凝胶电泳采用碧云天蛋白质电泳试剂盒操作。分离胶质量浓度12 g/dL,浓缩胶质量浓度5 g/dL。发酵液于12 000 r/min离心3 min,发酵上清液直接取20 μL,加入5 μL 5×上样缓冲液混合,沸水浴5 min后上样8 μL,标准蛋白质同样沸水浴5 min,上样4 μL进行电泳。
2结果与讨论
2.1不同起始诱导生物量对重组菌产酶的影响
P.pastoris高密度发酵是工业化生产外源重组蛋白的一个重要途径。通常情况下外源蛋白质的最终表达量与生物量成正比,但实际上生物量达到较高水平后,培养基中营养物质和氧的供给容易受到限制,外源蛋白质的稳定性也会受到影响,因此高细胞浓度诱导下并不一定代表能获得高表达产量[19]。本课题组在利用P.pastoris表达凝乳酶的研究中发现,凝乳酶的表达量并不是一直和初始诱导菌浓成正比。为了在提高凝乳酶的表达产量的同时尽可能在到后期保持P.pastoris细胞活性,我们优化了初始诱导菌浓。当3.6 L罐中初始发酵培养基中的甘油耗尽,开始指数流加不同体积的甘油,当菌体干重分别达到38.79、54.88、71.37 g/L时(OD600分别为100,150,200)开始诱导;诱导阶段通过甲醇电极维持0.5%的甲醇体积分数,诱导温度28℃ ,诱导pH 5.0,维持溶氧在30%左右,28℃诱导96 h。由图1可知,在OD600为150时最终生物量最高,同时结合图2可知,当初始诱导菌浓由38.79 g/L增加到54.88 g/L时,凝乳酶酶活在第96小时从1 111.18 SU/mL增加到1 445 SU/mL,当初始诱导菌浓从54.88 g/L增加到71.37 g/L时,凝乳酶活则下降到1 089.85 SU/mL,因此初始诱导菌浓为54.88 g/L时凝乳酶的表达碎片最高,最终细胞干重维持在148 g/L左右,此时凝乳酶的生产强度、凝乳酶对甲醇得率、细胞对甲醇得率、单位细胞产率也达到最高水平,见表1。以上结论显示,在合适的生物量时诱导能较明显地提高重组酶表达量,这样既能维持细胞平稳生长,提升细胞产率,还能提高底物的利用效率。

图1 不同起始诱导OD600对菌体生长的影响Fig.1 Effect of different initial OD600on cell growth

图2 不同诱导起始诱导OD600对凝乳酶表达的影响Fig.2 Effect of different initial OD600on chymosin expression during the induction phase
一般来说,P.pastoris发酵到后期都会容易产生异源蛋白质的降解问题,尤其是在较高生物量下,后期不良生长环境导致细胞容易裂解释放蛋白酶或者分泌蛋白酶到发酵液中,从而导致目的蛋白质后期降解。初始诱导菌浓越高,所需甘油的流加量也随着增加,导致诱导周期延长,在诱导末期高速离心明显不能离清菌体,表明细胞裂解严重,释放出的蛋白酶可能会降解表达出来的凝乳酶。本研究中通过电泳图(图3)显示,即使在高起始生物量下诱导,发酵后期也没有发现明显的目的条带发生降解,这可能和凝乳酶本身即是一种蛋白酶,因而可以抵抗其它蛋白酶的降解的自身结构有关。

表1 不同起始诱导菌浓下凝乳酶合成过程中的发酵参数的比较Table 1 Comparison of parameters for chymosin produc-tion under different initial OD600during the induction phase

图3 重组凝乳酶聚丙烯酰胺凝胶电泳Fig.3 SDS-PAGE of recombinant chymosin
2.2不同甲醇诱导体积分数对重组菌产酶的影响
P.pastoris表达外源蛋白质的过程中,诱导阶段甲醇体积分数不仅会影响细胞生长,与外源蛋白质的表达产量也存在很大关系。甲醇作为诱导阶段惟一碳源和诱导剂,通过诱导细胞产生甲醇代谢所需醇氧化酶后消耗甲醇为细胞生长产酶提供能量,同时诱导外源蛋白表达,但在代谢甲醇过程中产生的甲醛和H2O2等小分子过氧化物会对细胞产生毒害作用,因此如何控制合适的甲醇体积分数是高密度诱导发酵关键因素之一。
初始诱导OD600控制在150、pH为5.0、温度为28℃,控制溶氧维持在30%左右,研究了不同甲醇体积分数下诱导过程变化。菌体的生长情况见图4。维持在较低的甲醇体积分数时如0.5%和1%下细胞生长过程较为接近,同2%的甲醇体积分数相比明显偏低,说明较低体积分数甲醇无法满足细胞生长和产酶需要。在3%甲醇体积分数下细胞生长最缓慢,说明较高体积分数的甲醇所产生的毒害作用已经影响到了细胞正常生长。相比之下2%甲醇体积分数细胞生长良好。图5显示不同甲醇体积分数下细胞产酶水平变化,与图4的变化趋势较为接近,显示细胞产酶同细胞生长紧密相关。分析表2中的发酵过程参数可知,在较高的3%甲醇体积分数下细胞各参数均维持在最低水平,说明甲醇体积分数过高会严重影响细胞的生长和表达功能。另外在0.5%甲醇体积分数诱导下凝乳酶和细胞分别对甲醇得率高于1.0%甲醇体积分数诱导,说明在一定甲醇体积分数范围内,较低甲醇体积分数下甲醇等底物更容易转化成细胞和产物。然而在诱导体积分数达到2%时,凝乳酶和细胞分别对甲醇得率以及单位细胞的产率反而明显高于0.5%的甲醇诱导体积分数。甲醇作为细胞生长的碳源和合成异源蛋白的碳骨架,低体积分数甲醇显然难以支撑细胞高水平分泌异源蛋白质。因此维持适当的甲醇体积分数来控制细胞的稳定生长并较高水平产酶至关重要。通过不同体积分数下对细胞生长和产酶过程的分析,确定本研究中2%的甲醇体积分数为最佳。

图4 不同甲醇诱导体积分数对菌体生长的影响Fig.4 Effect of different methanol concentration on cell growth during the induction phase

图5 不同甲醇诱导体积分数对凝乳酶表达的影响Fig.5 Effect of different methanol concentration on chymosin expression during the induction phase

表2 不同甲醇诱导体积分数下凝乳酶合成过程参数比较Table 2 Comparison of parameters for chymosin production under different methanol concentration during the induction phase
此外在实验过程还发现,在3%高甲醇体积分数下蛋白质质量浓度接近1.4 mg/mL,见图6。明显高于其它甲醇体积分数诱导结果,但发酵液酶活却仅为300 SU/mL左右。图7显示条带同2%甲醇体积分数粗细接近,说明在较高甲醇体积分数下细胞分泌了大量的其它杂蛋白质到发酵液中而并非分泌了目的蛋白质。下一步需要研究在较高甲醇体积分数诱导时细胞利用甲醇作为碳源和供能底物出现的复杂生理代谢变化,从而更利于针对目的蛋白质的发酵调控。

图6 甲醇体积分数对蛋白质表达的影响Fig.6 Effect of different methanol concentration on protein expression during the induction phase

图7 重组凝乳酶聚丙烯酰胺凝胶电泳Fig.7 SDS-PAGE of recombinant chymosin
2.3不同发酵pH对重组菌产酶的影响
不论是菌体生长还是蛋白质的分泌表达,培养基中pH控制都相当重要。pH值的改变会通过影响菌体的代谢过程从而改变代谢产物的质量和其所占的比例。P.pastoris的生长pH值范围很广,在3.0~7.0内都可生长,但其表达外源蛋白的适宜pH会随着不同目的蛋白而存在很大的差异。由于某些外源蛋白容易受到蛋白酶的水解[20],对pH值比较敏感,因此,当选择了合适的诱导pH值,在保证目的蛋白的高效表达的同时又能抑制蛋白酶对目的蛋白的水解,保持其稳定性。一般通过补加氨水来调控P.pastoris高密度发酵过程中的pH,其中氨水不仅作为酸碱度的调节剂,也能作为氮源提供给P.pastoris发酵消耗。虽然P.pastoris pH生长范围比较宽泛,但是具体到表达不同外源蛋白的基因工程菌,还需要对其最适诱导pH进行优化。
本研究控制初始诱导OD600为150、甲醇诱导体积分数2%、诱导温度28℃,pH分别控制在4.0、5.0 和5.5。如图8所示,当pH为5.0时,P.pastoris最终菌体量达到最大,同时凝乳酶分泌也达到最高水平,见图9。比较表3中产物和细胞对甲醇得率以及单位细胞产率,pH为5.0时处于最高水平,说明控制合适的pH可以有效地提升细胞产酶能力,此时蛋白酶水解活力为29.48 U/mL,MCA/PA为64.43。
从图10可看出,pH为5.5时诱导的发酵液蛋白质质量浓度明显升高,接近2 mg/mL,但是从发酵液酶活分析或者电泳图分析发酵液中凝乳酶的含量则同其它pH值条件下变化不大,说明此时较高的蛋白质质量浓度应该是由酵母分泌的大量杂蛋白质所致。此外,电泳图显示在此条件下发酵后期的目的蛋白质也没有明显的降解现象。

图8 不同诱导pH对菌体生长的影响Fig.8 Effect of different pH on cell growth during the induction phase
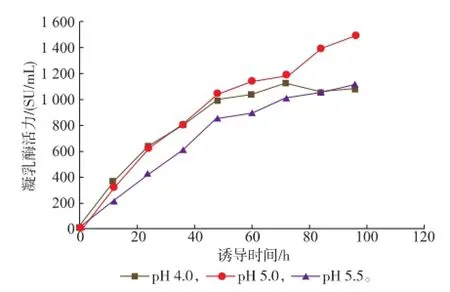
图9 不同诱导pH对凝乳酶表达的影响Fig.9 Effect of different pH on chymosin expression during the induction phase

图10 不同诱导pH对蛋白质表达的影响Fig.10 Effect of different pH on protein expression during the induction phase

表3 不同诱导pH对凝乳酶合成影响的参数比较Table 3 Comparison of parameters for chymosin produc-tion under different pH during the induction phase
3结语
高密度发酵是提高基因工程菌外源蛋白质表达量的重要策略之一。将作者所在实验室构建好的来源于微小根毛霉的凝乳酶重组P.pastoris进行高密度发酵优化,通过考察不同的起始诱导生物量、诱导pH和甲醇体积分数,确定其最佳发酵条件。另外由于甲醇能同时为细胞生长和产酶提供能量和碳骨架,因此诱导阶段控制合适体积分数的甲醇是重组酵母高效表达外源基因的关键因素。在诱导温度为28℃、溶氧控制在30%左右,控制初始诱导OD600为150,pH为5.0,甲醇体积分数为2.0%条件下,最终酶活达到1 870 SU/mL,生产强度达到19.48 SU/(mL·h),单位细胞产率达到2.42 SU/mL,MCA/PA为64.43。通过高密度发酵优化同摇瓶发酵相比酶活提高了6倍[15],同时重组凝乳酶的凝乳酶活与蛋白质水解活力的比值是同类文献报道的2.3倍[21],生产出来干酪的质地和口感更佳,这为后续凝乳酶进一步工业化生产奠定了基础。
[1]Supannee Chitpinityol,M James C.Crabb Chymosin and proteinase[J].Food Chemisty,1998,69(4):395-418.
[2]McMahon D J,Brown,R J,Ernstrom C A.Enzymic coagulation of milk casein micelles[J]. Dairy Sci,1984,67:745-748.
[3]Arima K,Yu j,Iwasaki s.Milk-clotting enzyme from Mucor pussilus[J]. Methods in Enzymology Academic,1970,19(3):446-460.
[4]Sumantha A,Larroche C,Pandey A.Microbiology and industrial biotechnology of food-grade proteases:a perspective[J]. Food Technol Biotechnol,2006,4:21-220.
[5]Sirma Yegin,Marcelo Fernandez-Lahore.A thermolabile aspartic proteinase from mucor mucedo DSM 809:gene identification,cloning,and functional expression in Pichia pastoris[J].Mol Biotechnol,2013,54:661-672.
[6]张丽红,王景会,王昕,等.微小毛霉凝乳酶基因在毕赤酵母中的表达条件及其酶学特性研究[J].食品科技,2010,35(11):2-6. ZHANG Lihong,WANG Jinghui,WANG Xin,et al.Study on the conditions for expression in Pichia pastoris of a milk-clotting enzyme gene from Mulor pusillns and its enzynatic propeties[J]. Food Science and Technology,2010,35(11):2-6.(in Chinese)
[7]Arima K,Yu J,Iwasaki S,Tamura G.Milk clotting enzyme from microorganisms V.purification and crystallization[J].Appl Microbiology,1967,16:1727-33.
[8]Sardinas J L.Rennin enzyme of Endothia parasitica[J].Appl Microbiol,1968,16:248-255.
[9]Gray G L,Hayenga K,Cullen D,Wilson,et al.Primary structure of Mucor miehei aspartyl protease:evidence for a zymogen intermediate[J]. Gene,1986,48:41-53.
[10]Ematage J S,Angal S,Doel M T,et al.Synthesis of calf prochymosin(Pro-rennin)in Escherichia coli[J].Biochemistry,1983,80:3671-3675.
[11]CofferC G,MoirD T,GraviusT C,etal.Expression ofcalfprochymosin in Saccharomyces cerevisae[J].Gene,1984,27(1):35-46.
[12]Thames P.Biotechnological innovation in food processing[M].England:Butterworth Heineman Ltd,1991:113-145.
[13]Cereghino J L,Cregg J M.Heterologous protein expression in the methylotrophic yeast Pichia pastoris[J].FEMS Microbiol Rev,2000,24:45-66.
[14]Toan Hong Phuoc,Mariela Perez,Julio C Dstet,et al.A pichia pastoris fermentation process to express Mucor pusillus rennin[J].Biotecnología Aplicada,2009,26:315-320.
[15]张莉,姜媛媛,张健,等.牛凝乳酶基因在毕赤酵母中的重组表达[J].生物工程学报,2009,25(8):1160-1165. ZHANG Li,JIANG Yuanyuan,ZHANG Jian,et al.Recombinant expression of bosine chymosin in Pichia pastories[J].Chinese Joural of Biotechnology,2009,25(8):1160-1165.(in Chinese)
[16]王景会,李玉秋,郑丽,等.微小毛霉凝乳酶的分泌表达、产物纯化及鉴定[J].吉林大学学报,2011(5):395-398. WANG Jinhui,LI Yuqiu,ZHENG Li,et al.Secretory expression,purification and iden tification of pennet from Mucor pusillus [J]. Joural of Jilin University,2011(5):395-398.(in Chinese)
[17]丘重晏,徐敏,王正祥.凝乳酶的基因克隆序列分析及初步表达[J].食品科学,2005(7):58-62. QIU Chongyan,XU Min,WANG Zhengxiang.Molealan cloning,sequence analysis and prinary expression of Mucor pusillus DNA[J].Food Science,2005(7):58-62.(in Chinese)
[18]Arima K.Milk-clotting enzymes from microorganism,partⅠ.screening test and identification of potent fungus[J].Agricultural Biology and Chemisty,1967,31(5):540-545.
[19]王芸,华兆哲,刘立明,等.重组毕赤酵母高密度发酵生产碱性果胶酶的策略[J].生物工程学报,2008,24(4):635-639. WANG Yun,HUA Zhaozhe,LIU Liming,et al.High-cevel production of alkaline pdygalacturonate lyase in recombinant Pichia pastoris[J].Chinese Jounal of Biotechnology,2008,24(4):635-639.(in Chinese)
[20]刘忠渊,张富春,毛新芳,等.利用毕赤酵母表达外源蛋白的研究[J].生物技术,2004,14(1):56-58. LIU Zhongyuan,ZHANG Fuchun,MAO Xinfang,et al.Study on the Pichia pastories yeast as a heterologius proteins expression system[J].Biotechnology,2004,14(1):56-58.(in Chinese)
[21]郑丽,王昕,王景会,等.微小毛霉凝乳酶基因在毕赤酵母中的诱导表达研究[J].食品工业科技,2011,32(7). ZHENG Li,WANG Xin,WANG Jinghui,et al.Study on induced expression of the renning gene of Mucor pusillus by Pichia pastoris[J]. Science and Technology of Food Industry,2011,32(7).(in Chinese)
Fermentation Optimization of Chymosin Production by Recombinant Pichia pastoris
LI Liang1,2,WU Dan1,2,SU Lingqia1,2,DUAN Xuguo1,2,WU Jing1,2*
(1.State Key Laboratory of Food Science and Technology,Jiangnan University,Wuxi 214122,China;2.School of Biotechnology,Jiangnan University,Wuxi 214122,China)
In order to obtain the optimal condition of chymosin fermentation,we observed the influence of initial inducing OD600,methanol concentration and pH on the high density fermentation process in 3.6 L fermentor of P.pastoris GS115/pPIC9k-chy.By using glycerol feeding strategy with DO control in high-density fermentation and maintained the residual methanol concentration constantly with a methanol sensor.The result showed that the optimum condition were listed as follows:the OD600was 150,the methanol concentration was 2.0%and the pH was 5.0,then the highest chymosin activity(17 80 SU/mL),the highest chymosin productivity(19.48 SU/(mL·h))and the highest yield of products(2.42 SU/mL)were achieved,the total protein content and the ratio of milk-clotting activity to proteolytic activity(MCA/PA)were determined to be 0.64 mg/mL,63.43.
P.pastoris,Rhizomucor pusillus,chymosin,high density fermentation
Q 815
A
1673—1689(2016)05—0457—08
2014-09-09
国家自然科学基金项目(31271813)。
*
吴敬(1969—),女,江苏镇江人,理学博士,教授,博士研究生导师,主要从事基因工程与酶工程方面的研究。E-mail:jingwu@jiangnan.edu.cn
