高血脂骨质疏松症动物模型的建立与评价
2016-08-07龚忠勤潘明珠卢虹玉崔燎刘义
龚忠勤 潘明珠 卢虹玉 崔燎 刘义
1. 广东医学院广东天然药物研究与开发实验室,广东 湛江 524023 2. 广东医学院药理教研室,广东 湛江 524023 3. 广东海洋大学水产品深加工广东普通高校重点实验室,广东 湛江 524088
骨质疏松症(osteoporosis,OP)是以骨量减少,骨微结构退化为特征,导致骨脆性增加,骨折风险增大的全身性代谢性骨骼疾病[1]。研究表明,高血脂是引起OP的一个危险因子,在OP的发生与发展中扮演着重要的角色[2]。目前建立高血脂性骨质疏松动物模型采用脂肪乳剂灌胃[3],但由于脂肪乳剂的制备比较复杂,探究操作简单的高血脂性骨质疏松模型建立方法意义重大。
P407由约70%乙烯氧化物和30%丙烯氧化物组成,是聚氧乙烯-聚氧丙烯-聚氧乙烯的三嵌段共聚物。因具有特殊的方向热凝胶性质,小剂量P407原位凝胶多被用于温敏型药物载体,具有毒性低,刺激性小,生物相容性好等特点[4,5]。近年来,高剂量P407腹腔注射已广泛应用于实验动物高血脂模型的建立[6,7]。本实验通过腹腔注射P407建立大鼠HLP模型,评价其骨密度,骨生物力学及骨微结构的变化,探讨HLP与OP之间的关系,为进一步建立稳定的高血脂骨质疏松动物模型提供实验依据。
1 材料和方法
1.1 材料和试剂
注射用P407生产于浙江八达通精细化学品有限公司(批号:130507);低密度脂蛋白(LDL)、甘油三酯(TG)、总胆固醇(TC)检测试剂盒购于南京建成生物工程研究所;骨形态发生蛋白2(BMP2)、过氧化物酶体增殖物激活受体γ(PPARγ)抗体购于武汉博士德生物有限公司。其他试剂为分析纯。
1.2 动物实验及分组
3月龄雌性SD大鼠20只,体重为200±20 g,由广东医学院实验动物中心提供。室温条件下标准饲料饲养,自由饮用自来水。实验过程对动物的处置符合科技部《关于善待动物的指导性意见》要求。20只大鼠随机分成2组,分别是对照组和高血脂组,每组10只,每周一称重。
1.3 给药方法
分组适应性喂养3 d后,对照组每隔3 d腹腔注射生理盐水(1 mL/10 g),高血脂组每隔3天腹腔注射P407(392 mg/kg)。实验进行12 w心脏取血处死大鼠,收集血清和双侧股骨及第五腰椎(-80℃保存备用)及胫骨(70%乙醇保存备用)。
1.4 血清中血脂水平检测
检测方法按照南京建成LDL,TG,TC试剂盒提供的说明书操作。样品准备好后采用全波长酶标仪(Biotec,USA)测定,并按说明书提供的计算方法得出血清中血脂水平。
1.5 骨密度、骨生物力学检测
把左侧股骨及腰椎粘附的肌肉剃干净后,独立分装在灌有生理盐水、无水乙醇比例为1∶1混合溶液的EP管中,送往上海生物力学研究所检测。其中股骨和腰椎均进行骨密度(BMD),股骨进行骨生物力学检测,包括弹性载荷(EL),最大载荷(ML),断裂载荷(BL),骨刚度系数(BRC)。
1.6 Micro-CT扫描
将大鼠股骨固定于扫描管中,沿骨长轴方向利用Micro-CT(vivaCT40,SCANCO,瑞士)在电压50 kVp,电流160 μA,分辨率为2048×2048下进行扫描。扫描完毕后选取生长板下1 mm×4 mm为松质骨重建区域,重建阈值均为125。重建完毕后可得骨组织体积分数(BV/TV),结构指数(SMI),连接度(Conn.D),骨小梁厚度(Tb.Th),骨小梁数目(Tb.N),骨小梁分离度(Tb.Sp)等反应骨微结构指数及图片。
1.7 HE染色
样本准备遵循本课题组前期报道[8]。石蜡切片4 μm用于苏木素-伊红(HE)染色。石蜡切片经二甲苯脱蜡后,再经高浓度至低浓度酒精,最后入蒸馏水。将已入蒸馏水的切片放入苏木素中染色数分钟,随后酸水及氨水中分色,数秒后用流水冲洗1 h。70%和90%酒精脱水10 min后用伊红染色2~3 min。随后脱水透明,树胶封片后显微镜(E400,Nikon,Japan)下观察拍照。
1.8 骨免疫组织化学
骨免疫组织化学染色按照本课题组前期报道[8]以及试剂说明书操作。
1.9 统计学处理

2 结果
2.1 体重
结果如图1所示,两组间大鼠体重无显著性差异(P>0.05)。

图1 实验大鼠体重变化图Fig.1 The change of body weight of the rats
2.2 大鼠血清血脂指标
HLP组血清中总胆固醇(TC)、甘油三酯(TG)、低密度脂蛋白(LDL)水平均明显高于Cont组(P<0.01)(图2)。结果说明长期使用P407能使大鼠血脂紊乱,出现高血脂症。

图2 实验大鼠血清血脂浓度与对照组相比,** P<0.01 Fig.2 The serum concentrations of LDL, TG, and TC**P<0.01 vs Cont
2.3 股骨及腰椎骨密度
骨密度结果如图3,经P407处理后,HLP大鼠股骨骨密度相较于Cont组无明显变化(P>0.05)。
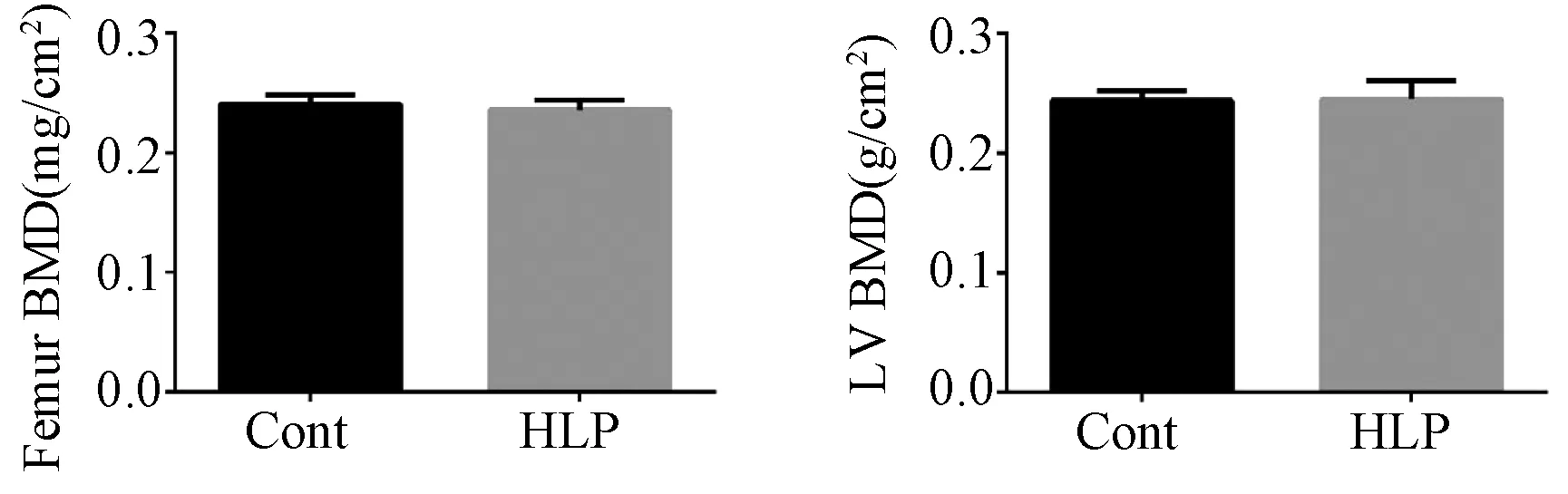
图3 实验大鼠股骨与腰椎骨密度 Fig.3 The BMD of the femur and the lumbar vertebrae
2.4 股骨骨生物力学指数
与Cont相比,HLP组大鼠BL和ML未见显著性差异,但BRC与EL均明显低于Cont组(P<0.05)(图4)。结果说明P407引起的HLP可降低大鼠股骨骨生物力学性能。

图4 实验大鼠股骨骨生物力学指数 与对照组相比,**P<0.01 Fig.4 Bone biomechanical properties of the femur**P<0.01 vs Cont
2.5 Micro-CT扫描
在HLP组中,大鼠BV/TV,Conn.D,Tb.N,Tb.Th均明显下降(P<0.05),而SMI,Tb.Sp显著上升(P<0.05)(图5)。3D重建图及各指数说明注射P407后,大鼠股骨骨微结构出现退化。
2.6 胫骨HE染色
从图6可以看出,HLP组中胫骨生长板下方骨小梁少于Cont组。
2.7 免疫组织化学染色
HLP组与Cont组相比,BMP2平均光密度值显著下降,而PPARγ升高明显(P<0.01),结果见图7。P407可降低BMP2的表达,而使PPARγ表达量上升。
3 讨论
HLP是由于脂肪代谢异常使血浆中一种或几种脂质高于正常,可表现为高胆固醇血症,高三酰甘油血症或两者兼有(混合型高脂血症)。P407可以增加血液中胆固醇以及甘油三酯的浓度,引起动物血脂紊乱,其作用机制可能是P407可阻断脂肪酶和肝素可释放脂蛋白脂酶,减少胆固醇向外周组织转移,抑制甘油三酯水解,增加内生胆固醇的合成,从而导致高血脂症[9,10]。本实验表明,P407腹腔注射可增加大鼠血清脂质(TC,TG,LDL)浓度,证实P407能引起大鼠血脂紊乱从而造成高血脂症。

图5 实验大鼠骨微结构3D重建及相关指数与对照组相比,* P<0.05,** P<0.01Fig.5 3D reconstruction and the trabecular microarchitecture of the femur*P<0.05,**P<0.01 vs Cont.
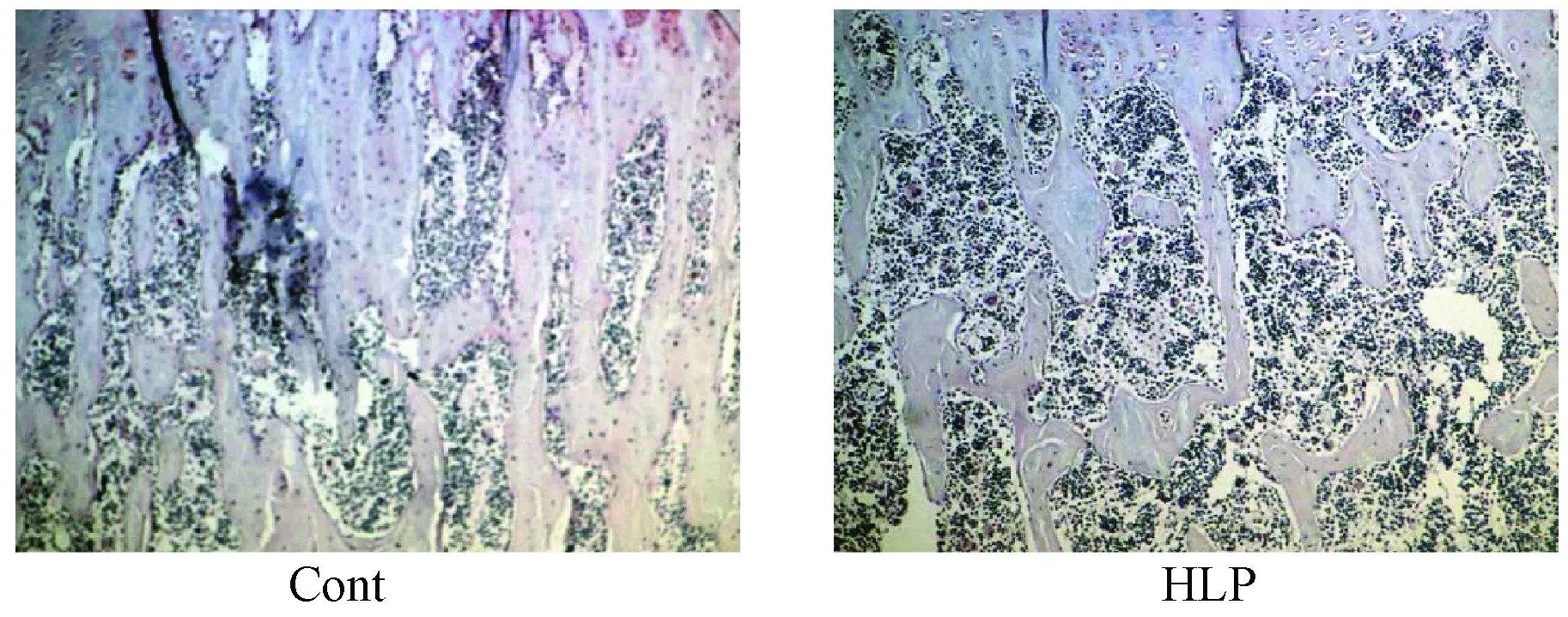
图6 胫骨生长板下骨小梁(HE染色,×100)Fig.6 Trabecular bone in epiphysis of the tibia (HE staining, ×100)

图7 免疫组织化学阳性染色及平均光密度值与对照组相比,** P<0.01Fig.7 The positive staining images of BMP2 and PPARγ and quantitative results of immunohistochemistry staining**P<0.01 vs Cont
骨密度是反应骨量丢失及骨质疏松的一个重要指标,主要通过双能X线吸收测定法(dual energy X-ray absorptiometery, DXA)。由Fig.3 可知,HLP组大鼠股骨及腰椎骨密度并未出现显著的变化,可能的原因是:DXA会将骨组织、骨髓、脂肪和骨外肌肉均看作矿物质,可能引起骨密度测定出现不准确[11];实验周期不够长,注射P407的频率不够高。实验发现,相对于正常组,股骨骨密度出现轻微下降,我们设想,假如延长实验周期,股骨骨密度的变化有可能出现统计学意义,这有待于进一步实验的验证。
研究表明,部分患者骨密度差异不明显,骨折风险也会增大,如糖皮质激素性骨质疏松,其骨生物力学和骨微结构出现明显的下降[12]。骨生物力学是以工程力学为基础,研究骨组织在外界作用下的力学特性和骨组织在受力后的生物学效应,是对骨质量进行评定的一种可靠手段[13]。最大载荷表示骨断裂前所承受的最大载荷,其值越大说明骨试件能承受的外力冲击越大;弹性载荷说明骨在弹性范围所能承受的最大载荷;断裂载荷表示骨断裂或者碎裂所能承受的载荷值;刚度又称外在硬度,反应抗变形的能力。Micro-CT可准确、科学、全面反应骨组织微观结构。SMI是用于评价骨小梁的形态结构,定义骨小梁板状和杆状的程度,理想板状结构为0,理想杆状结构为3,发生骨质疏松时,骨小梁从板状向杆状转变,SMI数值增加[14]。由Fig.4 和5可知,高血脂组中,弹性载荷和刚度下降, BV/TV,Conn.D,Tb.N,Tb.Th均明显下降,而SMI,Tb.Sp显著上升。3D重建图可以看出,HLP组骨微结构退化。结果表明,高血脂可降低大鼠骨生物力学性能,恶化骨微观结构,增加骨折的风险,与文献报道低密度脂蛋白水平升高会增加椎骨骨折的风险[15]一致。这可能HLP可抑制骨形成[2],促进骨髓细胞向破骨细胞分化,促进破骨细胞的成熟,增加骨吸收[16]有关。
免疫组化结果显示HLP组BMP2表达少于Cont组;BMP2是转化生长因子β家族成员,可介导骨形成,BMP2表达下降可使骨形成降低[17]。同时结果也显示腹腔注射P407能增加PPARγ的表达。PPARγ大量表达于白色和棕色脂肪组织中,可调控脂肪分化特异基因,是脂肪形成的关键调控因子[18]。高表达PPARγ可降低人或动物的骨量[19]。HE染色结果进一步证实了P407引起的HLP可减少骨小梁数目,降低骨量。
本研究发现P407腹腔注射不仅能导致大鼠HLP,还能明显的降低大鼠的骨生物力学性能,使骨微结构退化,降低BMP2的表达,使骨形成下降。该动物模型能为寻找预防高血脂骨质疏松症药物提供研究平台。
