CGRP介导束缚应激大鼠骨代谢的实验研究
2016-08-07陈海英蔡阿明张趁华
陈海英 蔡阿明 张趁华
1.福建莆田学院医学院基础医学部,福建 莆田 351100 2.福建莆田学院临床医学院,福建 莆田 351100
CGRP来源于感觉神经,主要分布在骨骺,骨膜及骨髓等骨组织代谢活跃的地方。这些神经肽被认为是间充质细胞包括骨髓干细胞有丝分裂或骨细胞功能的局部调节因子,具备调节骨内微循环、对骨组织双向调控的作用[1]。CGRP是目前已知的作用广泛的内源性舒血管物质,可以减少自由基产生、保护血管内皮细胞、调节免疫反应[2]。束缚应激作为一种非损伤性刺激,能够较好地模拟人类生活中“无法控制”的拥挤、挫折等生活状态,束缚应激对机体各大系统包括骨代谢均产生较大的影响。为模拟人类在生活、工作中处于无法控制的紧张状态而出现的对身心的损害而对动物进行定时和较低强度的束缚,本研究采用特定的束缚工具,应用免疫组化染色观察软骨下骨组织中神经肽CGRP 的阳性表达,深层次探讨CGRP 在束缚应激对骨代谢作用。
1 材料和方法
1.1 大鼠束缚应激模型的建立
束缚应激造模在王逸基础上进行改良[3],包括束缚固定、孤养以及短时间禁食禁水,其中以束缚为主,制束缚应激模型。绳栓术后孤养。大鼠束缚应激(即将大鼠固定在特定束缚固定笼中,大鼠可自由呼吸但不能活动,每天2 h,分别持续7 d、14 d、21 d。束缚时间在08:00-18:00,不影响大鼠正常的昼夜节律。束缚期间禁食、禁水,尚不影响大鼠机体功能。分组为正常组、束缚A组、束缚B组、束缚C组。
1.2 外周血处理
大鼠麻醉后,心脏取血4 mL,置于EP管(10% 依地酸二钠30 μL,抑肽酶2000U)。混匀后离心(4℃, 4500 r·min-1, 10 min),分离血浆。取血浆置于EP管,-70℃冰箱保存。
1.3 软骨下骨组织计量学指标比较
25%的乌拉坦麻醉后取股骨,4%多聚甲醛固定24-36 h,脱水脱脂,再以10%乙二胺四乙酸(EDTA)脱钙,石蜡包埋(冠状面),酸处理,烘干,用多聚赖氨酸包被干燥。切片(德国Leica RM2015)。HE染色,显微镜(日本Olympus BX51T-PHD-J11)观察,镜下观察各组软骨下骨组织中各、骨陷窝、骨小梁。每个切片随机选5个高倍视野,镜下定位生长板下的软骨下区统计出每一视野内的空缺骨陷窝数,求出空缺骨陷窝所占的百分数。
1.4 CGRP的放射免疫测定
本实验严格按照操作试剂盒(北京普尔伟业生物科技有限公司)说明书步骤进行。将200 uL CGRP标准品(包括20、60、150、300、600及1200 pg·mL-1)待测样品先后加入100 uL CGRP抗血清,100 uL125 I-CGRP,免疫分离剂,分离出抗原抗体复合物。3500 r·min-1离心25 min,取上清液,计数器测定复合物的放射性(B),计算各标谁管的结合率(B/B0%),GC-1200型Y放射免疫计数器计算机可自动绘制标准曲线,并给出样品浓度,浓度单位为pg·m L-1。得到各样品CGRP浓度后,再换算成每毫升血浆或每毫克组织CGRP的含量。
1.5 CGRP的免疫组化检测
每组随机选取6只大鼠,麻醉处死,取软骨下骨,多聚甲醛固定, EDTA脱钙处理,切片。按照SABC试剂盒(博士德中国)说明进行,加入羊抗兔CGRP单克隆抗体。FITC标记的羊抗兔IgG二抗,以 PBS代替一抗作为阴性对照,应用 Image-ProPlus 图像分析系统测定平均光密度值(IOD),每张切片随机选取6个高倍视野,观察拍照,测定阳性物质IOD值,并进行统计学分析。
1.6 数据处理
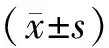
2 结果
2.1 软骨下骨组织观察
HE染色可见正常组软骨下骨骨小梁粗大稍厚(初级骨小梁),排列整齐有序,骨细胞胞质细密,核呈圆形或卵圆形,小梁间为骨髓组织(图1)。A组软骨下骨结构尚无明显变化(图2)。B组可见软骨下区小梁变薄,骨基质染色浅,可见少量空缺骨陷窝(图3)。C组软骨下骨骨小梁变细变薄,不规则弯曲、间距增大,结构紊乱,空骨陷窝明显增多,骨髓腔普遍增大,造血组织明显减少(图4)。
2.2 空缺骨陷窝测定统计学结果
A组的软骨下骨空缺骨陷窝数与CON组(3.70±1.14)比较差别无统计学意义。B、C组的软骨下骨组织空缺骨陷窝数(9.58±0.38,12.21±2.02,P<0.01)均高于正常组,差别有统计学意义 (图5)。
2.3 外周血CGRP含量
各组外周血CGRP与CON组含量(0.337±0.043)(pg·mL-1)比较:A组的外周血CGRP含量(0.370±0.052)没有明显变化,B组的外周血CGRP含量(0.288±0.035)也没有显著差异,C组的外周血CGRP含量(0.189±0.071)表达明显降低,差异有显著统计学意义 (P<0.01)(图6)。
2.4 免疫组化结果检测
造模后时,CON组软骨下骨组织活跃,CGRP的阳性表达在软骨下骨组织,而成熟骨细胞中未见明显着色(图7),A组与CON组比较CGRP呈阳性表达部位大致相同,主要的CGRP的阳性细胞表达数差异无统计学意义(图8)。B组、C组的软骨下骨组织CGRP 的阳性细胞表达数(2.37±0.38.1.75±0.41,P<0.01)均低于正常对照组(图9) (图10),含量明显降低(P<0.01) (图11)。
3 讨论

图1 正常组软骨下骨组织排列整齐,形态正常,HE法,标尺示20μm;图2 A组软骨下骨组织形态正常,HE法,标尺示20μm;图3 B组可见软骨下骨小梁变薄, HE法,标尺示20μm;图4 C组软骨下骨小梁无序排列,空缺骨陷窝.明显增多,HE法,标尺示20μmFig.1 In normal group, cartilage bone showed normal morphology.HE method, Bar=20μm; Fig.2 Normal morphology of cartilage bone in group A.HE method, Bar=20μm; Fig.3 Trabecular bone thinning in cartilage bone of B group, HE method, Bar=20μm; Fig.4 Trabecular bone arrangement disordered and empty bone lacunae increased in cartilage bone of group C, HE method, Bar=20 μm.
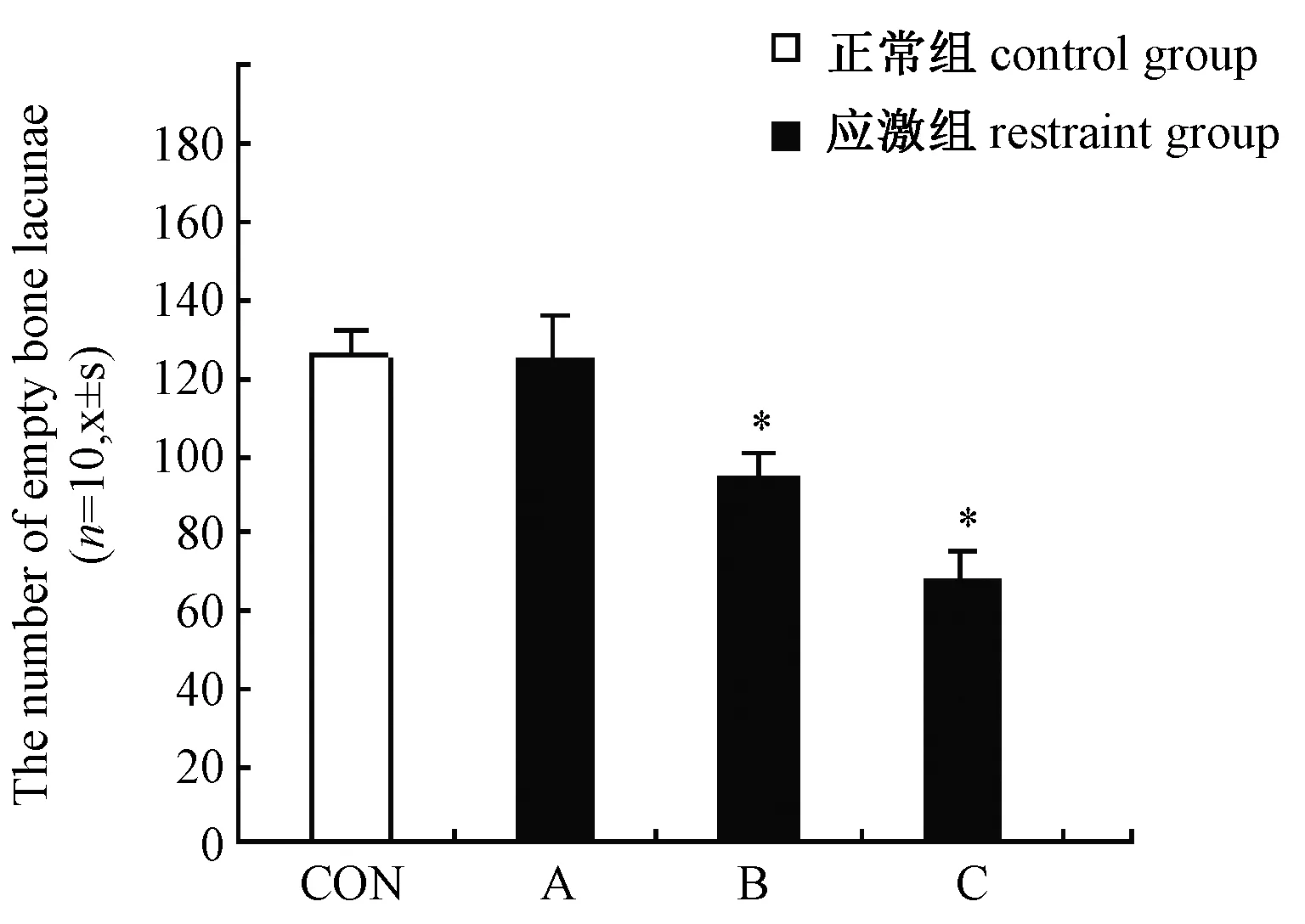
图5 各组软骨下骨空缺骨陷窝数,*P<0.01Fig.5 The namber of empty bone lacunae in cartilage bone of every group *P<0.01

图6 各组外周血CGRP的含量,*P<0.01Fig.6 Concentration of CGRP in plasma,*P<0.01

图7 正常组软骨下骨组织CGRP阳性表达,免疫组化法,标尺示20 μm;图8 A组软骨下骨组织7d周后CGRP 阳性表达,免疫组化法,标尺示20 μm;图9 B组软骨下骨组织14d周后 CGRP 阳性表达,免疫组化法,标尺示20μm;图10 C组软骨下骨组织21d周后 CGRP阳性表达,免疫组化法,标尺示20μmFig.7 Positive expression of CGRP in cartilage bone of normal group, SABC method, Bar=20μm; Fig.8 Positive expression of CGRP in cartilage bone in group A at 7d, SABC method, Bar=20 μm; Fig.9 Positive expression of CGRP in cartilage bone in group B at 14d, SABC method, Bar=20 μm; Fig.10 Positive expression of CGRP in cartilage bone in group C at 21d, SABC method, Bar=20μm

图11 不同组别CGRP阳性表达的IOD值,*P<0.01Fig.11 Comparison of IOD value of CGEP,*P<0.01
近年来已明确神经肽类可调节骨重建再生[4],CGRP是目前已知神经肽类中与成骨关系最密切、在骨组织中分布最为广泛的一种,成骨细胞和破骨细胞表达CGRP受体是CGRP调控功能存在的有力证据,Kawase 等证实每个成骨细胞有3000~3500个CGRP受体[5]。骨组织中含有丰富的神经纤维,骨是神经系统的靶器官, 有研究证实CGRP作为一种具有多种生物活性的神经肽,能够调节成骨细胞的活性,刺激骨形成。CGRP以不同密度广泛分布于骨组织中,在骨代谢活跃的区域,CGRP分布密度较高。皮质骨内CGRP 密度最低,软骨下骨,骨膜、骨髓和骨骺内等骨代谢活跃的区域CGRP分布均明显较骨干丰富[6],通过提高成骨细胞活性、抑制破骨细胞骨吸收作用进而促进骨再生[7]。骨组织神经主要通过其神经末梢分泌的多种神经肽作用于骨组织。CGRP合成于神经节内的感觉神经元,并通过轴浆运输传递到达感觉神经末梢。随着骨的发育周围神经逐渐长入新组织,其中以CGRP阳性神经纤维居多[8]。Jimenez-Andrade 等采用反转录聚合酶链反应的方法发现人成骨细胞表面有CGRP受体的mRNA表达[9];Han N等认为CGRP对成骨细胞增殖具有明显促进作用[10],CGRP能够调节破骨细胞分化、活性,抑制骨质吸收;还能作用于成骨细胞,促进骨质形成,CGRP间接地参与骨折愈合过程的调节[11]。
束缚应激能引起海马锥体神经元萎缩。可降低脑源性神经营养因子表达,直接抑制了神经元的生存、分化和生长等能力,出现神经元的退行性病变[12]。而由于CGRP的释放受到高级中枢的调控,可能与局部刺激及由此引起的轴突反射有关[13],那么由于束缚应激状态下出现机体的神经内分泌功能紊乱,下丘脑调控垂体等内分泌腺体功能障碍[14],导致CGRP在外周神经中的合成受到抑制。另束缚应激状态下肢体的骨代谢活跃区内脂质过氧化物含量升高和氧自由基产生增加等多方面改变[15],抑制了成骨过程,而长期的慢性应激则使机体抗氧化能力下降,失去对机体束缚应激的调节能力,于是在组织上就看到软骨下骨再生修复障碍,骨代谢失衡,并呈现骨衰退状态[16]。另应激所引起的机体CGRP改变可以刺激成骨细胞自分泌IGF-I,间接地影响成骨细胞的活性,影响成骨效应[13]。
