2型糖尿病患者血清chemerin水平与骨密度相关性研究
2016-08-07施良张浩李林徐萍高健青周建明毛朝明
施良 张浩 李林 徐萍 高健青 周建明 毛朝明*
1.江苏大学附属江滨医院核医学科,镇江 212001 2.江苏大学附属江滨医院急诊内科, 镇江 212001 3.江苏大学附属江滨医院内分泌科, 镇江 212001
糖尿病患者常合并骨质疏松或骨代谢异常,2型糖尿病和骨质疏松症关系已被广泛研究,但两者之间的关系仍无定论[1]。目前多数研究认为糖尿病和骨质疏松有共同的病理生理过程—慢性免疫炎症反应[2]。通过对糖尿病和骨质疏松机制的研究发现,糖尿病患者通过对机体众多炎症介质及细胞因子进行调节,可抑制成骨细胞分化,促进破骨细胞分化,进而减少骨形成并增加骨吸收[3]。chemerin 是一种新发现的脂肪细胞因子,迄今研究表明,chemerin主要表达在白色脂肪组织、肝、卵巢、骨组织等组织中[4]。其表达水平与炎症、肥胖、代谢综合征、糖尿病、冠心病和肿瘤发病有着重要的关系[5,6]。国外学者研究发现:chemerin及其受体表达于人关节软骨细胞内,并可以诱导趋化因子CCL2和TLR4信号通路促进炎症介质的释放,其表达水平与IL-6、超敏C反应蛋白及TNF-α等密切相关[7]。提示chemerin可能与骨代谢有关,并在骨质疏松发生的病理过程中发挥重要作用。
本试验研究旨在探讨2型糖尿病患者血清chemerin水平与骨密度及相关因素的关系,以进一步揭示糖尿病患者发生骨质疏松的病理生理学机制。并为糖尿病和骨质疏松之间关系研究及 chemerin抗体治疗骨质疏松提供一定理论依据。
1 对象与方法
1.1 研究对象
选取2012年1月至2014年12月我院内分泌科住院的2型糖尿病患者150人。根据WHO骨质疏松诊断标准(DEXA)[8]分为三组:2型糖尿病骨量正常组42例;2型糖尿病骨量减少组50例;2型糖尿病骨质疏松(OP)组58例。选取同期在我院体检中心行体检健康人群30名为对照组。排除标准:糖尿病急性并发症者,使用噻唑烷二酮类、激素类、调脂类、钙片等影响骨代谢药物者, 其它影响骨代谢的内分泌疾病(如甲状腺疾病、甲状旁腺疾病、库欣病等),合并其他系统性骨病、恶性肿瘤、风湿免疫性疾病、严重肝肾功能疾病、心血管疾病、血液系统疾病者,妊娠及哺乳者,有嗜烟、酒、药物等不良生活习惯者,近期有急慢性感染者,近2周卧床静息制动者。本研究经医院伦理委员会批准,所有受试者均签署知情同意书。
1.2 研究方法
所有研究对象禁食12 h,清晨空腹抽取肘静脉血6 ml, 3 000 r/min离心20 min,分离血清至Eppendorf管,置于-80℃冰箱保存待检。化学发光法检测血清TNF-α水平;酶联免疫吸附法(ELISA)检测血清chemerin(美国Millipore 公司试剂盒)及IL-6水平(武汉博士德生物工程有限公司)。详细记录患者性别、年龄、身高、体重、糖尿病病程等相关资料,计算体重指数(body mass index,BMI),并测定空腹血糖(fasting blood glucose,FBG),采用柱状层析法测定糖化血红蛋白(glycosylated hemoglobin,HbA1c),由我院检验科完成。
采用美国GE公司生产的Lunar DPX-NT双能X线骨密度仪检测正位腰椎(腰1-4)骨密度,取平均值;双侧髋部(股骨颈、大转子、粗隆间)骨密度,取平均值。每日测量之前均进行机器校正。仪器测量变异系数(腰椎和股骨颈)分别是0.8%和1.6%。
1.3 统计学方法
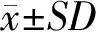
2 结果
2.1 各组一般资料比较
2型糖尿病骨量正常组、减少组及骨质疏松组间在年龄、性、身高、BMI、HbA1c水平、糖尿病病程方面比较均无统计学差异(P>0.05)。三组患者FBG及HbA1c水平均高于正常组,差异均有统计学意义(P<0.05)。糖尿病骨质疏松组BMI高于正常组,差异有统计学意义(P<0.05)。见表1。
2.2 各组血清chemerin、TNF-α及IL-6水平比较
与对照组比较,糖尿病骨量正常组、减少组及骨质疏松组血清chemerin水平升高,差异均有统计学意义;其中糖尿病骨质疏松组升高最明显(P<0.01)。糖尿病骨质疏松组血清chemerin水平高于糖尿病骨量正常组、减少组,差异有统计学意义(P<0.05)。与对照组比较,糖尿病骨量减少组及骨质疏松组血清TNF-α水平升高,差异有统计学意义(P<0.05)。糖尿病骨量正常组与对照组TNF-α水平差异无统计学意义(P>0.05)。糖尿病骨质疏松组血清TNF-α水平高于糖尿病骨量正常组、减少组,差异有统计学意义(P<0.05)。与对照组比较,糖尿病骨质疏松组IL-6水平显著性升高(P<0.05);糖尿病骨量正常组及减少组IL-6水平亦高于对照组,但差异无统计学意义(P>0.05)。见表1。
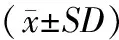

指标对照组non-DM group(n=30)糖尿病骨量正常组DM-normal bone mass group(n=42)糖尿病骨量减少组DM-normal bone mass group(n=50)糖尿病骨质疏松组DM-normal bone mass group(n=58)性别(男/女)Age(male/female)14/1620/2222/2827/31年龄(岁)Age(y)57.3±6.656.2±7.562.7±4.260.1±6.9身高(m)Height1.69±0.051.67±0.031.68±0.051.67±0.08体重(kg)Weight76.8±13.176.2±14.576.9±12.677.8±11.3体重指数(kg/m2)BMI26.1±5.228.2±9.527.9±7.828.5±6.4a空腹血糖(mmol/L)FBG5.6±0.97.1±1.3a7.4±1.9a8.1±2.1a糖化血红蛋白(%)HbA1c5.2±1.79.2±3.5b8.8±2.1a8.5±4.2a病程(年) Duration(y)—6.7±3.37.2±3.67.1±4.8chemerin(ng/mL)60.7±12.265.1±14.9ac 72.5±13.6ac 89.7±16.3bTNF-α(pg/ml)4.3±2.6 5.8±3.2c9.2±7.3ac 15.9±7.6bIL6 (pg/ml)2.3±1.13.3±0.9c4.1±1.6 7.8±3.5a
a:与对照组比较P<0.05;b:与对照组比较P<0.01;c:与糖尿病骨质疏松组比较P<0.05
2.3 血清chemerin与各临床指标的相关性分析
血清chemerin水平与TNF-α、BMI、HbA1c、病程呈正相关,与腰椎(L1-4)骨密度平均值呈负相关。见表2。

表2 血清chemerin水平与各临床指标的相关性分析Table 2 Correlation analysis of serum Chemerin level and clinical parameters
3 讨论
近年来,2型糖尿病(type 2 diabetes mellitus,T2DM)和骨质疏松症之间的关系被广泛研究,大多学者认为糖尿病增加患者骨质疏松和骨折的发生率[9],但两者关系仍无定论。Abdulameer等荟萃分析显示[10]:大多数文献(26篇)报道T2DM患者BMD增加,部分文献(13篇)报道T2DM患者BMD降低,少量文献(8篇)报道T2DM患者BMD正常或与对照组比较无显著性变化。糖尿病导致骨质疏松的发病机制不明,目前认为可能与高血糖、炎症反应和氧化应激等因素相关[11]。DM患者长期血糖控制不佳,高血糖可以通过多种途径引起骨代谢异常。一方面,高血糖导致渗透性利尿致使钙、磷、镁等矿物质排泄增加,同时高尿糖又阻碍肾对钙、镁、磷的重吸收,致使血清钙、磷等矿物质浓度降低,骨质脱钙,骨密度下降[12]。另一方面,长期高血糖状态导致DM患者体内糖基化终产物(Advanced Glycation End Products, AGEs) 蓄积,AGEs 可影响骨蛋白及骨细胞分化,直接或间接导致骨形成减少,骨质量下降,骨脆性增加,引发骨质疏松[13]。此外,糖尿病导致微血管病变会降低骨血流量,导致骨脆性增加、骨量流失[12]。
TNF-α通过激活T细胞,一方面使之分泌大量核因子-κ B 受体活化因子配体(Receptor Activator for Nuclear Factor-κ B Ligand,RANKL),RANKL与破骨细胞表面RANK 识别结合并激活破骨细胞,导致骨吸收增加[14];另一方面,激活的T细胞分泌IL-1、IL-6、IL-11、IL-17等炎症因子,通过Wnt/β-catenin 信号通路调节破骨细胞分化成熟。IL-1、IL-6等炎症因子可通过激活P38MAPK、NF-κB等一系列细胞内信号通路激活破骨细胞,诱导骨髓干细胞向破骨细胞分化,骨吸收效应增强,导致骨质疏松[15]。李粮等研究发现[16]:绝经后2型糖尿病患者BMD 与绝经年限、TNF-α及IL-6 密切相关。本研究发现:糖尿病骨量正常组、减少组及骨质疏松组血清TNF-α及IL-6水平均高于对照组,其中糖尿病骨质疏松组升高最明显。因此有理由推断,炎症反应可能是介导了糖尿病患者骨质疏松的发生。
脂肪因子一直是内分泌代谢性疾病的研究热点,近年来已有多项研究报道脂肪因子adiponectin、leptin、resistin与骨密度存在相关性并直接或间接参与骨代谢活动。chemerin是一种新的脂肪因子,于2007年由Goralski等发现[4]。它是一种多靶器官、多功能的细胞因子,具有多种生物学特性[17,18]。其表达水平与炎症、肥胖、糖尿病、代谢综合征、骨质疏松等疾病有密切联系[19]。Berg等[20]研究发现,chemerin与其相应受体结合后可进一步激活炎症信号,导致炎症因子和基质金属蛋白酶的释放。近年来,有研究证实,chemerin的表达和分泌促进骨髓间充质细胞向脂肪细胞分化[21]。沉默chemerin基因则阻碍脂肪细胞分化,增加成骨细胞骨相关活性基因的表达并促进矿化作用[22]。本研究发现:与对照组比较,糖尿病骨量正常组、减少组及骨质疏松组血清chemerin水平升高,差异均有统计学意义;其中糖尿病骨质疏松组升高最明显(P<0.01)。并且糖尿病骨质疏松组血清chemerin水平亦明显高于糖尿病骨量正常组、减少组(P<0.05)。相关性分析显示:血清chemerin水平与TNF-α、BMI、HbA1c、病程呈正相关,与腰椎(L1-4)骨密度平均值呈负相关。因此,我们推测,作为一种脂肪因子,chemerin不仅参与调节间充质干细胞(bone marrow mesenchymal stem cells,BMSCs)向成骨细胞或者脂肪细胞分化,也与炎症因子相互作用组成一个复杂的免疫、炎症调控网络共同调节糖尿病患者骨代谢活动。
综上所述,T2DM合并骨质疏松患者血清chemerin及炎症因子水平显著升高,且与骨密度呈负相关。提示chemerin、TNF-α参与了T2DM及骨质疏松的发生与发展,chemerin 可能对T2DM合并骨质疏松患者体内的慢性亚临床炎症状态起一定作用。Chemerin可能直接或间接影响着骨代谢,在该领域的深入研究工作有望为骨质疏松的治疗开辟一条新途径。
