乳中志贺氏菌的荧光定量PCR检测方法的建立
2016-08-06郭瑜姚笛侯婷婷张微佐兆杭刘鑫郭德军黑龙江八一农垦大学食品学院黑龙江大庆163319
郭瑜,姚笛,侯婷婷,张微,佐兆杭,刘鑫,郭德军(黑龙江八一农垦大学食品学院,黑龙江大庆163319)
乳中志贺氏菌的荧光定量PCR检测方法的建立
郭瑜,姚笛,侯婷婷,张微,佐兆杭,刘鑫,郭德军
(黑龙江八一农垦大学食品学院,黑龙江大庆163319)
为了快速、有效的检测乳中的志贺氏菌,建立一种特异性强、灵敏度高的荧光定量PCR方法。根据GenBank公布的志贺氏菌ipaH基因的保守序列设计特异性引物,对提取的志贺氏菌DNA模板进行PCR扩增,对目的基因进行克隆和测序,然后利用荧光定量PCR方法,对志贺氏菌进行检测,确定其扩增条件。建立的方法特异性强,检测的灵敏度可达到10-6ng/μL。利用建立的方法可检测乳中2.84 cfu/mL的志贺氏菌。该方法为快速、准确检测乳中的志贺氏菌提供了参考。
荧光定量PCR;志贺氏菌;ipaH基因
牛乳作为一种理想的营养食品被人们广泛食用,人们对乳及乳制品的需求量也在逐年增加,同时牛乳也是一种最易遭受病菌污染发生腐败变质的食品之一。因此,乳品安全问题成为社会各界关注的焦点。目前牛奶最主要的污染致病菌就是细菌,特别是肠道致病菌志贺氏菌(Shigella),该种细菌在低温环境下可存活,在牛奶中可生存1周~2周。
志贺氏菌是引起人类细菌性痢疾的肠道病原菌,为革兰氏阴性杆菌,具有高度传染性,主要传播途径是消化道[1-2],据调查,全球每年有1.6亿人患病,大约有110万人死亡,其中绝大多数是儿童[3-4]。在我国最为常见的是由福氏和宋内志贺菌引起的菌痢,并且在我国内陆地区分布广泛,成为各地卫生部门重点检测的对象。而在我国广大农村地区的卫生条件差,经常会因水源或食品受到志贺氏菌污染而引起痢疾、腹泻等疾病爆发[5-6]。志贺氏菌有较强的附着力和侵袭力,能分泌内、外毒素,可引起腹痛,腹泻,局部黏膜炎症,坏死和溃疡等症状[7]。因此,建立一种快速、准确的志贺氏菌检测方法显得尤为重要。
目前,常规的志贺氏菌检测方法有微生物法、理化法和免疫法等,但是,国内外对志贺氏菌的检验方法大多用培养法和生化鉴定法,这些方法存在着操作步骤繁琐、时间长、灵敏度低、容易出现假阴性等缺点[8]。因此,本研究根据志贺氏菌的ipaH[9]基因的保守序列设计特异性引物,建立志贺氏菌的荧光定量PCR检测方法,该方法具有快速、简便、灵敏等特点,可为志贺氏菌的快速检测提供参考。
1 材料与方法
1.1材料
1.1.1菌株
宋内氏志贺氏菌(Shigella sonnei)标准菌株:黑龙江八一农垦大学食品学院食品微生物实验室保存。
1.1.2试剂
LB培养基为青岛海博公司产品;TaKaRa ExTaqTM(5 U/μL)、rTaq(5 U/μL)、MgCl2(25 mmol/L)、dNTPs (10 mmol/L)、DL2000DNAMarker、6×Loading Buffer、10×Loading Buffer、SYBR Premix Ex TaqTM(Tli RNaseH Plus):TaKaRa公司;细菌基因组DNA抽提试剂盒、质粒抽提试剂盒、胶回收试剂盒等:广州飞扬生物工程有限公司。
1.1.3主要仪器
9700型PCR基因扩增仪:基因有限公司;JY04S-3B电泳仪:北京君意东方电泳设备有限公司;YJ600+型凝胶成像系统:北京君意东方电泳有限公司;Line-Gene K型Real-Time PCR仪:杭州博日科技有限公司;TGL-16B台式离心机:上海安亭科学仪器制造厂。
1.2方法
1.2.1菌株培养
将宋内氏志贺氏菌接种于固体LB培养基中,37℃,24 h,挑取单菌落接种于液体LB培养基中,37℃,200 r/min,过夜培养。
1.2.2DNA模板的制备
热裂解法:取培养液1.0 mL,置于1.5 mL的离心管中,12 000 r/min离心2 min,灭菌ddH2O洗剂两次,最后300 μL ddH2O悬浮,隔水煮沸15 min,8 000 r/min离心15 min,取上清,即为DNA模板[10]。
1.2.3引物的合成
根据GenBank公布的志贺氏菌ipaH基因的保守序列,利用Primer 5软件设计特异性引物,由上海生工生物技术有限公司合成,扩增片段大小为167 bp。
上游引物:5'-GAGACCTAAACAAGATAAGTCCAAC-3'
下游引物:5'-CCTAATAAATGTCCTTCGTATCGC-3'
1.2.4目的基因的扩增和纯化
以提取的志贺氏菌DNA为模板,应用所设计的引物对其进行PCR扩增,扩增条件为:95℃预变性3 min,95℃变性30 s,55℃退火30 s,72℃延伸30 s,经30个循环;最后72℃保温7 min。PCR产物进行2%琼脂糖凝胶电泳,对扩增目的片段进行回收纯化,具体操作按照说明书进行。
1.2.5目的基因的克隆
将纯化后的目的基因与pMD-18 T载体混合均匀,16℃连接2 h,取1 μL的连接产物加入100 μL E. coli DH5α感受态细胞进行重组质粒的转化,取适量均匀涂布于Amp+的LB平板中,37℃培养过夜,挑取平板中的单个菌落,接种于Amp+的LB液体培养液中,37℃180 r/min振摇过夜。按照说明书操作提取质粒,对质粒进行PCR鉴定,将阳性克隆送上海生工进行序列测定。
1.2.6重组质粒标准曲线的绘制
测定重组质粒的浓度C值,计算出原始拷贝数,然后进行倍比稀释,取不同稀释度的质粒模板进行定量PCR扩增。定量PCR的反应体系为:SYBR Premix Ex Tap(2X)(Tli RNaseH Plus)12.5 μL,上、下游引物(10 μmol/L)各0.5 μL,DNA模板2.0 μL,ddH2O 9.5 μL。反应条件为94℃30 s灭活酶,95℃5 s变性,60℃20 s退火、延伸,扩增45个循环,反应结束后,计算机自动计算,形成标准曲线。
1.2.7特异性检测
利用建立的荧光定量PCR检测方法,对蜡样芽孢杆菌、大肠杆菌、沙门氏菌、志贺氏菌4种感染人的食品病原细菌同时进行检测,进一步确定志贺氏菌荧光定量PCR方法的特异性。
1.2.8灵敏性检测
测定所提取的志贺氏菌DNA的浓度,用ddH2O进行10倍梯度稀释,取不同稀释度的样品2 μL进行荧光定量PCR扩增,测定其最低检测值。
1.2.9模拟标本的检测
将志贺氏菌制备一定浓度的菌悬液,用无菌生理盐水10倍梯度稀释,测定菌落总数,将灭菌的牛乳中掺入志贺氏菌,使乳中菌含量为28.4、2.84×102、2.84× 103、2.84×104cfu/mL,混匀后提取DNA模板进行荧光定量PCR扩增。
2 结果与分析
2.1志贺氏菌的ipaH基因的PCR扩增与测序
以志贺氏菌基因组DNA为模板,PCR扩增ipaH基因,扩增结果见图1。

图1ipaH基因的PCR扩增Fig.1 PCR amplification of ipaH gene
由图1可知,扩增带大小与预期的结果一致。将扩增的PCR产物进行回收、连接、转化后,提取重组质粒,并对其进行PCR鉴定,其鉴定结果如图2所示。

图2ipaH基因重组质粒的PCR结果Fig.2 ResuLts the recombinant plasmid of ipaH gene of PCR
将鉴定正确的重组质粒进行测序,测序结果与GenBank进行BLAST比对,结果可知扩增产物与志贺氏菌的ipaH基因的相应区域的同源性为100%。
2.2荧光定量PCR扩增结果
将重组质粒10倍倍比稀释,取浓度依次为1×105、1×106、1×107、1×108、1×109copies/μL,分别以此为模板进行荧光定量PCR扩增,得到标准模板的实时PCR扩增曲线,扩增结果见图3。
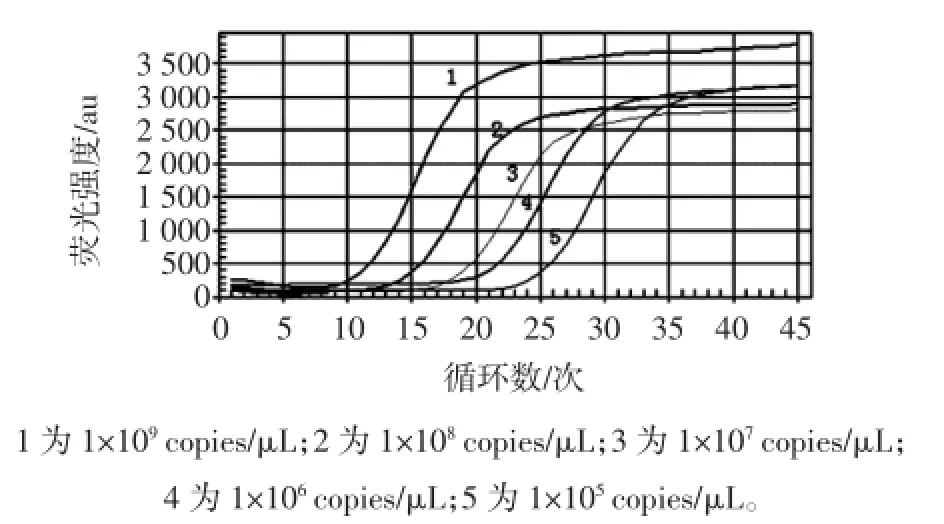
图3 标准模板的荧光定量PCR扩增曲线Fig.3 Dynamic amplification curve of real-time PCR for standard template of Shigella
根据得到质粒标准模板的实时PCR扩增曲线绘制出标准曲线,结果见图4,方程为y=-3.416 0x+ 40.552,相关系数为0.998,表明在稀释的范围内有很好的线性关系。
在SYBR GreenⅠ荧光定量PCR后进行熔解曲线分析,结果见图5。

图4 标准模板的标准曲线Fig.4 Standard curve of real-time PCR with standard template

图5 标准模板的熔解曲线Fig.5 Melting curve of real-time PCR with standard template
由荧光定量PCR的熔解曲线可知,不同浓度的标准品的扩增产物的溶解温度都为81℃。
2.3荧光定量PCR的特异性试验
采用荧光定量PCR方法对蜡样芽孢杆菌、大肠杆菌、沙门氏菌和志贺氏菌同时进行检测,结果见图6。

图6 志贺氏菌荧光定量的特异性检测Fig.6 Specificity detection of real-time PCR for Shigella
结果表明:除志贺氏菌出现良好的扩增曲线,结果为阳性外,其他细菌均未出现曲线扩增、结果为阴性。说明本研究建立的方法对志贺氏菌有很好的特异性,与其他相关细菌无交叉反应。
2.4荧光定量PCR的敏感性试验
将志贺氏菌DNA用dd H2O10倍梯度稀释成1× 10-3、1×10-4、1×10-5、1×10-6、1×10-7ng/μL的浓度,进行荧光定量PCR扩增,结果显示其灵敏度为1×10-6ng/μL。当DNA的浓度只有1×10-6ng/μL时,根据公式copies/μL= (6.02×1023)×(ng/μL×10-9)/(DNA length×660)计算出拷贝数为5.46×104copies/μL,依然可以检测的到,说明荧光定量PCR扩增检测志贺氏菌的稳定性好、灵敏度极高。
2.5模拟标本的检测
灭菌的牛乳中掺入志贺氏菌,使乳中菌的含量为2.84、2.84×101、2.84×102、2.84×103cfu/mL,采用荧光定量PCR方法同时进行检测,结果见图7。
由图7可知:当乳中菌的含量只有2.84cfu/mL时[11],依然可以检测到,说明该方法的灵敏度极好。

图7模拟标本的荧光定量PCR扩增曲线Fig.7 Amplification curve of real-time PCR for simulation specimens
3 讨论
在我国,志贺氏菌在感染性腹泻病原菌中居于首位,是一类有着高度传染性和危害性的肠道致病菌。目前,国内外对乳中致病菌的检验大多用培养法和生化鉴定法进行检测,这种方法存在着操作步骤繁琐、时间长、灵敏度低、容易出现假阴性等缺点。乳胶凝集法、免疫磁珠分离法、酶免疫测定等免疫学方法虽然能弥补传统方法中的一些不足,但仍存在误差大、周期长的局限性。用基因探针检测则存在检测费用昂贵的缺点[8]。荧光定量PCR(Real-time PCR)技术的应用有效地克服了以上技术的诸多缺点,可以同时检测多种致病菌,具有快速、准确、灵敏、特异性高的特点,并且在疾病的诊断中有着广阔的应用前景[12]。
荧光定量PCR检测志贺氏菌的全部操作过程需要3 h左右,不仅大大提高了工作效率,并且除了需开盖加样,其他的全部过程都在密闭的PCR管中实现,有效的避免了由电泳带来的误差。本研究建立的荧光定量PCR技术经过对志贺氏菌及3种相关细菌的检测发现,志贺氏菌的重组质粒在浓度在1×105到1× 109copies/μL之间时呈良好的线性关系,相关系数为0.998,检测的灵敏度达1×10-6ng/μL,计算得出拷贝数为5.46×104copies/μL,且与其他3种相关细菌均无交叉反应。当乳中志贺氏菌的含量为28.4 cfu/mL,依然可检测的出,具有的准确、快速、操作简便、灵敏度高、特异性好等特点,为建立乳中志贺氏菌的检测体系提供了一种高效、便捷、可靠的新技术,拥有较高的应用及推广价值,该荧光定量PCR诊断方法也会在今后试验和应用中不断地得到完善。
[1]Davis H,Taylor JP,Perdue JN,et a1.A shigellosis outbreak traced to commercially distributed shredded lettuce[J].American Journal of Epidemiology,1988(6):1312-1321
[2]Cimpeanu S,Harasim T,Popovici S,et al.Immunoprophylactic effect of dysentery vaccination by liver dysentery vaccine Vadizen(Sh.flexneri 132-Istrati)in children and adμLt collectivities in BT County[J].Archives Roumaines de Pathologie Experimentales et de Microbiologie,1984,43(3/4):305-312
[3]周亚丽,王菊珍.977例小儿急性腹泻细菌病原学调查[J].南京铁道医院学报,1986,5(1):23
[4]Golovliovi,Sjostedt A,Mokrievich A,et al.A method for allelic replacement in Francisella tularensis[J].FEMS Microbiol Lett,2003,222(2):273-280
[5]肖树生,林柳英,林成水,等.闽东农村腹泻病原菌的调查研究[J].中国公共卫生学报,2002,29(6):782
[6]王红,俞守义,钟文龙,等.菌痢暴发的分子流行病学分析[J].中国公共卫生学报,1996,15(2):65
[7]张开瑞.志贺氏菌感染的研究进展[J].临床内科杂志,1996,13(4):4
[8]林晓丽,赖卫华,张莉莉.志贺氏菌检测方法的最新研究进展[J].食品科学,2009,30(15):271
[9]胡建华,李洁莉,马兆飞,等.牛奶样品中志贺氏菌的快速PCR检测技术研究[J].食品科学,2007,28(8):433
[10]马学军,舒跃龙,等校译.精编分子生物学实验指南[M].北京:科学出版社,2005:20-22
[11]李洁莉,钱凯,周晓薇,等.荧光定量PCR法与常规PCR法检测牛奶中肠道致病菌的比较[J].食品科技,2009,34(10):273-377
[12]潘克女,张永乐,张辉,等.核酸试纸条法检测HBV基因型方法的建立[J].中华微生物学和免疫学杂志,2010,30(8):768-769
Establishment of Real-time PCR Method for Detection of Shigella in Milk
GUO Yu,YAO Di,HOU Ting-ting,ZHANG Wei,ZUO Zhao-hang,LIU Xin,GUO De-jun
(College of Food Science,Heilongjiang Bayi Agricultural University,Daqing 163319,Heilongjiang,China)
For fast,effective detection of Shigella in milk,a strong specificity,high sensitivity real-time PCR method was established.The specific primers were designed according to the conserved sequence of Shigella ipaH gene published in GenBank,the extracted Shigella DNA template was amplified by PCR,the target gene was cloned and sequenced,then using the fluorescent quantitative PCR method,to detect Shigella,determine the amplification conditions.The established method specificity is high,the detected sensitivity reach 10-6ng/μL. Using the method of Shigella in milk can be detected at 28.4 cfu/mL.The method provides a reference for fast,accurate detection Shigella in milk.
Real-time PCR;Shigella;ipaH gene
10.3969/j.issn.1005-6521.2016.10.032
黑龙江省大学生创业项目(HNK11A-10-03201410223014)
郭瑜(1993—),女(汉),本科,食品质量与安全专业。
2015-04-12
