芦笋“冠军”花药培养愈伤组织的诱导
2016-08-06包艳存李书华
包艳存, 李书华, 李 霞,李 芳
(山东省潍坊市农业科学院生物所,山东潍坊 261041)
芦笋“冠军”花药培养愈伤组织的诱导
包艳存, 李书华, 李 霞,李 芳
(山东省潍坊市农业科学院生物所,山东潍坊 261041)
摘要[目的]研究芦笋“冠军”花药培养技术。[方法]以杂交一代品种“冠军”为试验材料,研究花药组培过程中影响愈伤组织诱导的因素及生长调节剂对愈伤分化成苗的影响。[结果]采用0.1%升汞灭菌5 min,再接种在添加NAA 0.8 mg/L+6-BA 2.0 mg/L的 MS固体培养基上先暗培养10 d,再光照培养,花药愈伤组织诱导率较高,达16.5%左右。[结论]建立了芦笋“冠军”花药培养技术体系,为开展芦笋全雄育种奠定基础。
关键词芦笋“冠军”;花药培养;愈伤诱导
芦笋学名石刁柏(Asparagus officinalisL.),具有丰富的营养价值和药用价值,被列为世界“十大名菜”之一,在国际市场上享有“蔬菜之王”的美称[1]。芦笋雌雄异株,常规品种中雌雄株比例为1∶1。而雄株与雌株相比,具有高产、抗病的优点(一般雄株的产量比雌株高 20%~30%),因此,培育全雄系品种成为目前国内外芦笋育种的主要研究方向[2-3]。
获得超雄株(MM)是芦笋全雄育种工作的前提和关键。目前,超雄株的获得主要有两性株自交选择和花药培养2个途径。研究利用芦笋两性株培育超雄株纯系,需要连续自交 6 代以上,耗时耗力。而采用雄株花药培养,能得到来源于花粉的单倍体植株,经染色体加倍后可以得到纯合的纯雄系,一代即可纯合,大大节约了选育时间[4-5]。Pelltier等[6]从芦笋花粉离体培养的愈伤组织中观察到 n=10 的单倍体细胞。Dore[7-8]通过芦笋花药培养,首次得到超雄株,并用于芦笋育种。研究表明,芦笋花药培养存在诱导率低、芽分化率低等问题,笔者选用杂交一代品种“冠军”为试材,研究花药组培过程中影响愈伤组织诱导的因素及生长调节剂对愈伤分化成苗的影响,旨在为开展芦笋全雄育种奠定基础。
1材料与方法
1.1试验材料及处理供试材料为山东潍坊市农业科学院种质资源圃中的“冠军”一代杂交种雄株花序。选取标准: 5月上中旬8:00~10:00采摘定植第二年的健康“冠军”单株花蕾作为试验材料,且花蕾采用1~2mm大小[9-14]。将花蕾先在4 ℃冰箱进行低温预处理4d[15-17]。
1.2试验方法
1.2.1不同灭菌方式。在超净工作台上将花蕾先用 75%乙醇溶液浸泡 10~25s后,用无菌水冲洗3遍,再加入 0.1%的升汞溶液浸泡3~10min,用无菌水冲洗6次,最后在超净工作台上剥取花药接种于愈伤组织诱导培养基。接种密度为每 200mL玻璃瓶接种 40个花药,每个处理接种至少5瓶。培养温度为 (26±1)℃,光照强度2 000lx,光照时间14h/d。培养基均附加5g/L琼脂,蔗糖40g/L,pH调至 5.8。
1.2.2不同培养基形态。采用固体培养和液体培养2种培养基,两者唯一的区别是液体培养基中不添加凝固剂。
1.2.3不同基本培养基类型。采用MS、1/2MS、1/4MS3种基本培养基。
1.2.4不同生长调节剂浓度配比。以MS为基本培养基,通过对 6-BA、NAA这2种生长调节剂不同浓度的相互配比,共设置8个组合。
1.2.5不同培养条件。接种后分别置于光照培养、暗培养10d再光照培养、全暗条件下进行培养。
1.2.6花药愈伤组织的增殖和分化 。取 0.2~0.3cm大小的愈伤组织,将其接种至含有6-BA、NAA不同浓度组合的分化培养基上进行增殖分化培养。其中,6-BA设置 1.0、0.8、0.5mg/L3个浓度,NAA则采用 0.20、0.10、0.05mg/L3个浓度,对其进行单独和交叉组合的形式进行试验,调查愈伤组织的增殖分化情况。
2结果与分析
芦笋花药接种在培养基上,整个花药壁逐渐变成黄褐色,培养20d左右开始出现愈伤组织。愈伤组织出现的时间和形态特征表现不同。有的愈伤组织结构致密,有的愈伤组织结构疏松(图1);颜色也表现不同,有的呈白色,有的呈黄白色,还有的呈淡绿色。
2.1不同灭菌方式对外植体的影响由表1可知,用75%乙醇灭菌,处理时间的长短对材料污染、死亡影响不明显,但污染数略有下降,死亡数有所增加,其中以用75%乙醇处理10s的效果较好,诱导率高。而用0.1%升汞灭菌,随着消毒时间的延长,初代培养物的污染率下降,消毒5min时,污染数较低。但死亡数随消毒时间的延长而上升,当消毒时间为10min时死亡率明显上升,可能是花药受到汞离子的毒害而死亡。

注:A.质地坚硬致密的愈伤组织,B.质地疏松的愈伤组织。Note:A.Callus with hard and tight texture,B.Callus with loose texture.图1 愈伤组织形态Fig.1 Callus morphology
综合考虑,芦笋花药灭菌的适宜方法应选择以75%乙醇浸10s后,用无菌水冲洗3遍,再用0.1%升汞浸泡5min后,无菌水冲洗6遍为宜。
2.2不同培养基形态对愈伤组织诱导的影响由表2可知,固体培养基愈伤组织的形成时间比液体培养基早4d,且其愈伤诱导率达 16.16%,是液体培养基诱导率的 2 倍多,两者间差异极显著。同时,固体培养产生的愈伤组织致密(后期发现,致密的愈伤增殖分化率优于疏松的愈伤组织)。由此可知,固体培养比液体培养更适合芦笋花药愈伤组织的诱导。
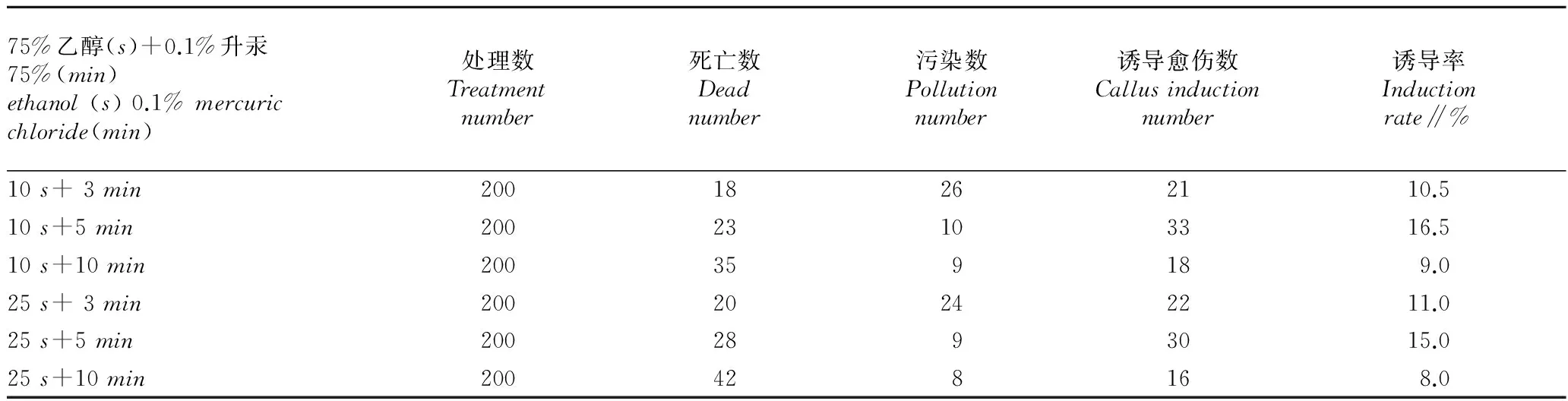
表1 不同消毒时间组合的愈伤诱导率

表2 不同培养基类型对愈伤组织诱导的影响
注:同列不同小写字母表示培养基类型间差异显著(P<0.05),不同大写字母表示培养基类型间差异极显著(P<0.01)。
Note:Differentlowercasesandcapitallettersinthesamecolumnstandforsignificantdifference(P<0.05)andextremelysignificantdifference(P<0.01)amongculturemediumtypes.
2.3不同培养条件对愈伤组织诱导的影响 由表3可知,培养条件不仅影响芦笋花药愈伤组织的诱导率,也影响花药愈伤组织的启动时间及颜色与质地等。暗培养10d后再转入光照培养,诱导率最高,达16.9%。而一直处于暗培养条件下的诱导率达15.8%,显著高于光培养下的诱导率6.5%。同时,暗培养的愈伤启动诱导时间较光培养条件早 9d,表明暗光培养有利于愈伤组织的诱导。
同时也发现,一直处于暗培养条件下所形成的愈伤组织结构疏松,在后期分化培养过程中,分化率低,且易出现玻璃化和黄化死亡现象。因此,适当的光照有利于形成质地致密的愈伤组织。由此可知,先进行10d左右的暗启动培养,再进行14h/d、2 000lx强度的光照培养,有利于花药愈伤组织的诱导。
2.4不同基本培养基对愈伤组织诱导的影响以MS为基本培养基,花药愈伤组织诱导率最高,达 18.5%,极显著高于1/2MS和 1/4MS培养基。其愈伤组织开始形成时间由早到晚依次为MS、1/2MS、1/4MS。以MS为基本培养基,愈伤组织质地致密,多呈黄绿色,褐化少;以1/4MS和 1/2MS为基本培养基,愈伤组织质地多疏松,部分褐化。由此可知,MS基本培养适宜芦笋花药愈伤组织的诱导。
表3不同培养条件对愈伤组织诱导的影响
Table3Theimpactofdifferentcultureconditionsoncallusinduction

培养条件Mediumconditions愈伤组织形成时间Callusformationtime∥d愈伤组织诱导率Callusinductionrate∥%愈伤形态Callusform暗培养Darkculture2515.8愈伤疏松,多乳白色暗10d+光Dark10d+light2716.9愈伤致密,黄色光培养Lightculture346.5愈伤致密,淡绿色
表4不同基本培养基对愈伤组织诱导的影响
Table4Theimpactofdifferentbasicmediumsoncallusinduction

培养基类型Mediumconditions愈伤组织形成时间Callusformationtime∥d愈伤组织诱导率Callusinductionrate∥%愈伤形态CallusformMS2418.5aA愈伤质地致密,黄绿色1/2MS289.5bB愈伤稍显疏松,淡黄绿色1/4MS315.5cC质地疏松,淡黄色或乳白色
注:同列不同小写字母表示不同培养基类型间差异显著(P<0.05),不同大写字母表示不同培养基类型间差异极显著(P<0.01)。
Note:Differentlowercasesinthesamecolumnstandforsignificantdifferenceamongvariousculturemediums,differentcapitallettersstandforextremelysignificanceamongvariousculturemediums.
2.5不同生长调节剂浓度配比对愈伤组织诱导的影响由表5可知,在处理⑦即NAA0.8mg/L+6-BA2.0mg/L的培养基上培养,花药愈伤组织诱导率最高,达 16.86%,且其愈伤质量良好,呈致密的黄绿色。另外,2个因素的不同水平之间差异显著,而6-BA是影响花药愈伤组织形成的主要因子。当6-BA浓度在1.0~2.0mg/L时,诱导率随6-BA浓度的增加而增加。而在6-BA浓度相同的情况下,NAA浓度为0.8mg/L时形成的愈伤组织比NAA浓度为0.5mg/L的结构更致密。
表5不同生长调节剂浓度配比对愈伤组织诱导的影响
Table5Theimpactofdifferentgrowthregulatorcombinationsoncallusinduction
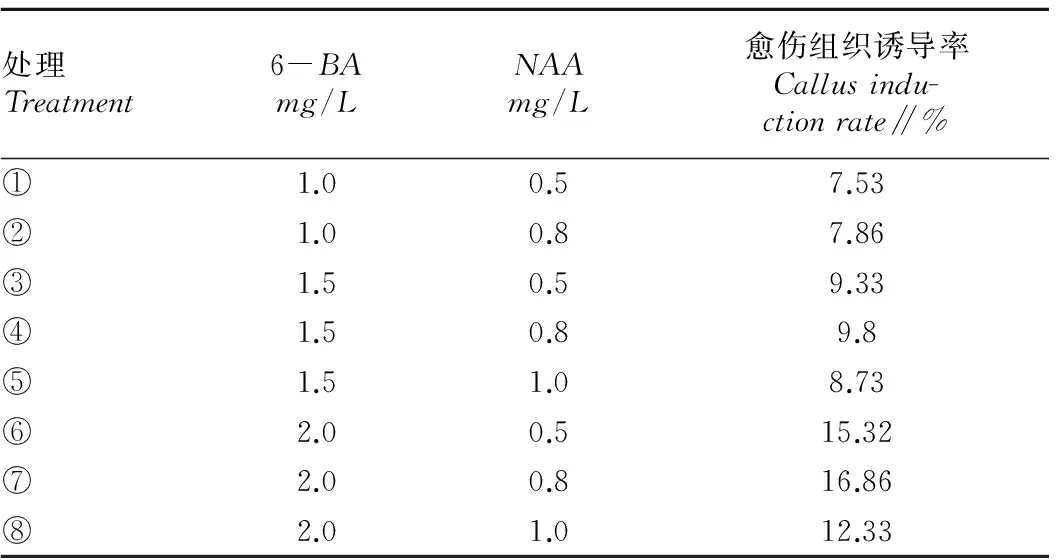
处理Treatment6-BAmg/LNAAmg/L愈伤组织诱导率Callusindu-ctionrate∥%①1.00.57.53②1.00.87.86③1.50.59.33④1.50.89.8⑤1.51.08.73⑥2.00.515.32⑦2.00.816.86⑧2.01.012.33
2.6愈伤组织的增殖分化 结果表明,MS+0.5mg/L6-BA+0.2mg/LNAA是适合花药愈伤组织继代分化的培养基。将上述疏松和致密的2种愈伤组织均接种至分化培养基上,在温度(26±1)℃、光照强度2 000lx、光照时间16h/d下培养,疏松型愈伤组织玻璃化程度高且分化率低,致密型愈伤组织分化率高,分化苗正常(图2)。

注:A.松散型;B.致密型。Note: A. Loose type; B.Compactness. 图2 继代增殖情况Fig.2 The subculture proliferation situation
3结论与讨论
该试验以优良的杂交一代品种“冠军”雄株花序为试材,对室内花药诱导愈伤培养条件进行试验,研究了灭菌方式、培养基类型、培养条件和生长调节剂配比对愈伤组织诱导的影响。结果表明,采用0.1%升汞灭菌5min,再接种至添加NAA0.8mg/L+6-BA2.0mg/L的MS固体培养基上先暗培养10d,再光照培养,花药愈伤诱导率较高,达16.5%左右。
根据前人经验,选用为5月上中旬8:00~10:00采摘定植第二年的健康“冠军”单株花蕾作为试验材料,且花蕾统一采用1~2mm大小。先将花蕾在4 ℃冰箱中低温预处理4d,可提高愈伤诱导成功率。试验过程中发现,形成的愈伤组织有疏松和致密2种类型。在分化培养过程中,松散型愈伤组织易出现玻璃化现象,且分化率低。致密型愈伤组织分化率高,分化苗正常。后期对芦笋花药愈伤组织分化的绿芽进行了茎尖细胞染色体数目检测,发现其染色体数目呈多样性,变化范围大,有单倍体、二倍体、四倍体和非整倍体等,其中分化的二倍体占绝大多数。花药培养中二倍体植株的出现可能是来源于体细胞愈伤组织的干扰,也可能是花药培养中花粉植株染色体的自然加倍形成的[18-19]。因此,后期还应培育再生植株并对再生植株进行倍性和雌雄性别鉴定,明确来源于雄核发育的雄性单倍体植株,以便应用于芦笋的全雄育种。
参考文献
[1] 于继庆.芦笋栽培及加工新技术[M].北京:中国农业出版社,1996:1-9.
[2] 陈海媛,乜兰春,张学英.芦笋花药培养的研究进展[J].北方园艺,2010(18):219-221.
[3] 张磊,石刁柏花药培养的研究及其进展[J]. 天津农学院学报1995,2(3):39-43.
[4] 曹孜义,刘国民.实用植物组织培养技术教程[M].兰州:甘肃科学技术出版社,2003:330.
[5] 吴力人,冯晓棠 . 石刁柏杂交种选育及育种技术研究进展[M]//侯喜林,常有宏.园艺学进展:第2辑.南京:东南大学出版社,1998:613-617.
[6]PELLETIERG,RAQUINC,SIMONG.Lacultuieinvitrod’anthered′asperge(Asparagus officinalisL.) [J].CRAcadSci, 1972, 274:848-851.
[7]DOREC.Productiondeplanteshomozygotesmalesetfemellespartird′antheresd′asperge,Cultiveesinvitro(Asparagus officinalisL.) [J].CRAcadSci, 1974,278:2135-2138.
[8]DOREC.AntherculturedeawaytomardsF1hybrids[C]//Eucharis, 5thasparagussymposium,undertheauspicesoftheHassianMiniterforagriculture,1979:87-90.
[9] 刘贵仁,严仁玲,张磊,等.石刁柏(Asparagus officinalis)花药培养与染色体倍性的观察[J].吉林农业大学学报,1990,12(1):5-9,39.
[10] 范双喜.芦笋花药培养中影响因素的研究[J].北京农业科学,1993,11(6):23-25.
[11] 韩佩来,陈利明,沈革志,等.石刁柏的花药培养与植株再生[J].上海农业学报,1994,10(2):85-88. [12] 萨日娜,陈永胜,黄凤兰,等.植物花药培养技术研究进展[J].内蒙古民族大学学报(自然科学版),2008,23(6):650-653.
[13] 张绿萍,陈红.园艺植物花药培养研究进展[J].安徽农业科学,2007,35(17):5140-5142.
[14] 李守岭,庄南生.植物花药培养及其影响因素研究进展(综述)[J].亚热带植物科学,2006,35(3):76-80.
[15] 裘文建.园艺植物组织培养[M].上海:上海科学技术出版社,1996:64-67.
[16] 严仁玲,张磊,张存金,等.石刁柏花药离体培养及单倍体植株再的研究[J].华北农学报,1992,7(1):75-82.
[17]丁鑫,范双喜,高遐虹,等.石刁柏花药培养愈伤组织诱导影响因素的研究[J].北京农学院学报,2007,22(1):19-23.
[18] 查忠萍,柳俊,刘定富,等.草莓花药培养再生植株的细胞起源[J].华中农业大学学报,2005,24(6):622-625.
[19] 陈斌,赵泓,耿三省,等.辣椒花药培养再生株群体染色体倍性构成的多样性[J].华北农学报,2007,22(1):123-128.
作者简介包艳存(1979- ),女,湖北随州人,农艺师,从事芦笋育种与栽培研究。
收稿日期2016-04-23
中图分类号S 603.6
文献标识码A
文章编号0517-6611(2016)16-157-03
TheCallusInductionofAsparagus“Champion”AntherCulture
BAOYan-cun,LIShu-hua,LIXiaetal
(InstituteofBiology,WeifangAcademyofAgriculturalSciences,Weifang,Shandong261041)
Abstract[Objective] The aim was to study asparagus “champion” anther culture technique. [Method] Using the F1 hybrid asparagus variety “champion” as the test material, callus induction in tissue culture process and effects of growth regulator on callus differentiation were studied. [Result] The results showed that using 0.1% mercuric chloride sterilization 5 min, inoculated on the MS solid medium by adding NAA0.8 mg/L + 6-BA 2.0 mg/L of darkness first 10 days, and then light culture, anther callus induction rate reached about 16.5%. [Conclusion] The asparagus “champion” anther culture technical system is established, which will lay a foundation for carrying out asparagus all male breeding.
Key wordsAsparagus officinalis“Champion”; Anther culture; Callus induction
