各地区FRAX干预阈值在无锡地区骨质疏松防治中的临床应用
2016-08-06李燕云丁绍红高远唐伟
李燕云 丁绍红 高远 唐伟
1. 东南大学医学院附属江阴医院内分泌科,江阴 214400 2. 江苏省老年医院内分泌科,南京 210024
骨质疏松症 (osteoporosis) 是一种以骨量减少和骨微结构破坏为特征,导致骨强度下降、脆性增加并易于骨折的代谢性骨病。随着世界人口老龄化加剧,骨质疏松已成为一项全球化的健康问题。骨质疏松不仅影响患者的生理、心理健康,大大降低生活质量,也给社会带来了严重经济负担。由于骨质疏松症发病隐匿,多在骨折损伤发生后才诊断明确,因此预防尤为重要。目前骨密度(bone mineral density,BMD)检查是诊断骨质疏松的最佳定量指标,常用双能X线吸收法(Dual-energy X-ray absorptiometry,DXA),是诊断骨质疏松的金标准。但是受到医疗资源的限制,DXA检查不能得到广泛的推广。FRAX(Fracture risk assessment tool)系统是通过一系列大样本循证医学数据原始数据计算,建立的用来评价骨折风险的一个计算机评估软件,适用于骨密度<-2.5的骨质疏松患者、没有发生骨折但是有骨量减少的人群[1]。FRAX评估软件有循证医学依据,简易但不缺乏科学性,因此得到WHO的推广。目前FRAX评估软件在欧美各国骨质疏松防治中已经得到广泛的应用,并通过相关的流行病学调查及临床研究制定出符合各国国情的FRAX干预阈值[2-6]。但是目前我国缺少相关的研究,尚无自己的FRAX干预阈值。2011年的中国原发性骨质疏松诊治指南建议临床医生可参照欧美等国家的资料,同时在应用中可根据个人情况酌情决定[7]。因此本项研究的目的在于分析各地区FRAX干预阈值与BMD之间的关系,探讨各地区FRAX干预阈值在本地区临床应用中的价值。
1 材料与方法
1.1 研究对象
2013年健康体检的本院职工。入选标准:①年龄≥40岁;②既往未曾诊断骨质疏松;③长期居住本地,时间≥10年;④既往无类风湿关节炎病史;⑤无可引起继发性骨质疏松的相关病史。
1.2 研究方法
记录入选人群的一般临床资料,如姓名、性别、年龄、身高、体重,既往骨折病史、父母髋部骨折病史、是否吸烟、过量饮酒(3酒精单位/天)、长期应用糖皮质激素(≥5 mg泼尼松,服用3个月以上)、风湿性关节炎、其他继发性骨质疏松相关临床危险因素。骨密度的测量采用双能X线骨密度仪,记录L1-L4及股骨颈的骨密度,通常用T值(T-score)表示。FRAX评估软件登陆网站:http://www.shef.ac.uk/FRAX/ calculation tool-asia-china-china。在信息栏中填入当前患者的各项信息,计算出该患者10年发生主要骨质疏松骨折(major osteoporotic)的概率和髋部骨折(hip osteoporotic)的概率。DXA测量腰椎1~4及股骨颈的骨密度, T值介于-(1~2.5)标准差之间为骨量低下;降低程度≥2.5个标准差为骨质疏松;低于-2.5并且有骨折及骨折病史为严重骨质疏松。
1.3 统计学处理
应用SPSS 19.0统计软件进行统计分析,数据进行正态分布性检验。所有的数据以mean±SD表示,有无BMD计算所得的FRAX评分结果比较用配对T检验。各地区诊断切点的评价指标用敏感性、特异性、阳性预测值、阴性预测值表示;多元线性回归分析法判断年龄、性别、身高、体重对FRAX结果的影响。
2 结果
2.1 一般情况
本项研究共入选532名本院职工,其中男性146名、占总人群的27.4%,女性386名、占总人群的72.6%,男女性别比有明显的统计学差异(P<0.05)。平均年龄(54.38±12.08)岁,平均身高(162.07±6.24)cm,平均体重(61.9±8.27)kg。其中符合骨质疏松诊断的57人,占研究人群比重的10.7%,其中男性6人、女性51人,平均年龄(66.96±9.42)岁;符合骨量减少的有277人,男性99人、女性178人,平均年龄(56.19±11.79)岁,占研究人群的52.1%;骨量正常198人,男性41人、女性157人,平均年龄(48.40±9.16)岁, 占研究人群的37.2%(详见表1)。女性骨质疏松的发病率高于男性(13.2% VS.4.1%;P<0.001);股骨颈的T值较腰椎T值偏高,两者之间有明显的统计学差异(0.03±1.17 VS.-1.34±0.88;P<0.05);无BMD所得的FRAX与有BMD所测得的FRAX之间有明显的统计学差异(2.54±2.05 VS.2.04±1.38;P<0.05)。
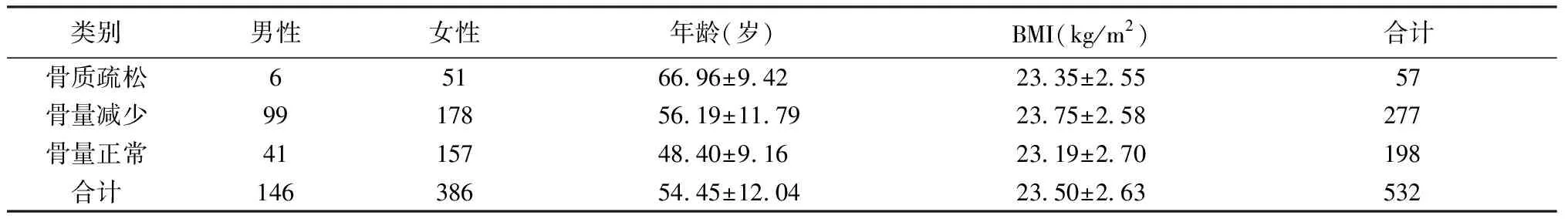
表1 一般情况Table 1 Basic information
2.2 各FRAX干预阈值在本项研究中的应用
根据不同国家和我国新疆乌鲁木齐市所制定的干预阈值,以DXA测量的最小T值作为确诊骨质疏松并开始干预治疗的金标准,计算各干预阈值的敏感性、特异性、阳性预测值及阴性预测值(具体情况见表2)。
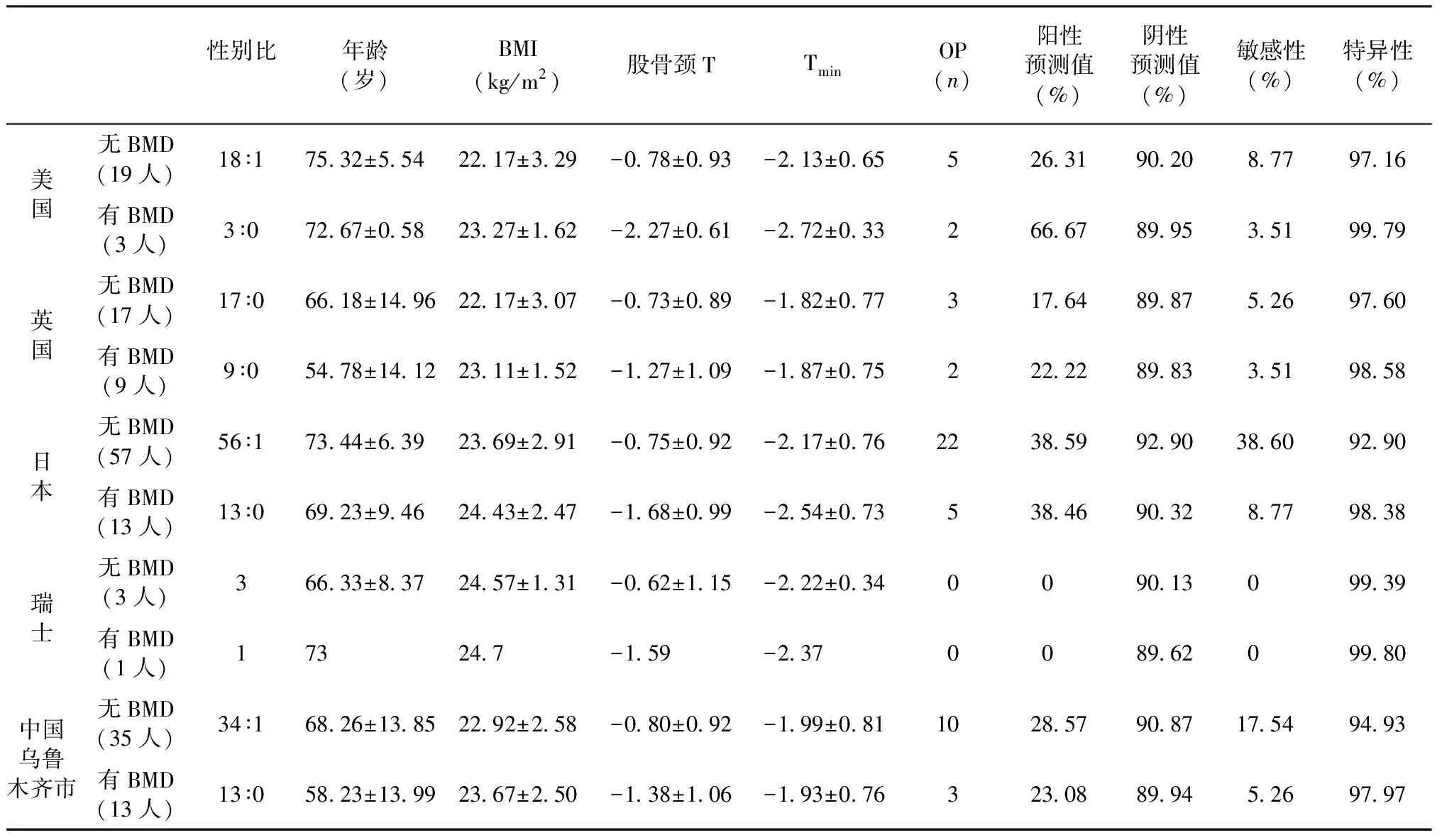
表2 各诊断切点的评价指标Table 2 Evaluation of the different cut-off point
注:性别比(女:男);年龄(mean±SD);OP:骨质疏松,诊断以DXA最小T值为标准;Tmin:最小骨密度值;BMI体重指数:kg/m2。
2.2.1美国的FRAX干预阈值(10年内发生主要骨质疏松骨折风险(major osteoporotic)≥20%,或髋部骨折风险(hip osteoporotic)≥3%)[2]:以10年内发生主要骨质疏松骨折风险≥20%统计,阳性值较低(无BMD组仅有1人,有BMD组0人),因此我们以hip osteoporotic≥3%为干预阈值进行统计。无BMD组需要治疗的人数19人,其中女性18人、男性1人,平均年龄(75.32±5.54)岁,BMI(22.17±3.29)kg/m2, T值诊断骨质疏松患者有5人,敏感性为8.77%,特异性为97.16%,阳性预测值为26.31%,阴性预测值为90.2%;有BMD组FRAX阳性统计为3人,全部为女性,平均年龄(72.67±0.58)岁,BMI(23.27±1.62)kg/m2,T值诊断骨质疏松1人,FRAX的敏感性为3.51%、特异性为99.79%,阳性预测值为66.67%,阴性预测值为89.95%。
2.2.2英国主要骨质疏松骨折(major osteoporotic)≥7%[3]:无BMD组共计阳性17人,全部为女性,平均年龄(66.18±14.96)岁,BMI(22.17±3.07)kg/m2,T值诊断估值疏松3人,敏感性5.26%、特异性97.6%,阳性预测值17.64%、阴性预测值89.87%;有BMD组阳性9人,全部为女性,平均年龄(54.78±14.12)岁,BMI(23.11±1.52)kg/m2,T值诊断骨质疏松2人,FRAX敏感性为3.51%、特异性98.58%,阳性预测值为22.22%、阴性预测值为89.83%。
2.2.3日本的干预阈值≥50岁并且主要骨质疏松骨折(major osteoporotic)≥5%为标准[4]:无BMD组阳性57人,其中1名男性、余为女性,平均年龄(73.44±6.39)岁,平均BMI(23.69±2.91)kg/m2,T值诊断骨质疏松22人,敏感性为38.60%、特异性92.9%,阳性预测值38.59%、阴性预测值92.9%;有BMD组阳性13人,全部为女性,平均年龄(69.23±9.46)岁,平均BMI(24.43±2.47)kg/m2,其中T值诊断骨质疏松5人,FRAX敏感性8.77%、特异性98.38%,阳性预测值38.46%、阴性预测值90.32%。
2.2.4我国乌鲁木齐市主要骨质疏松骨折(major osteoporotic)≥6%[5]:无BMD组阳性35人,其中男性1人,平均年龄(68.26±13.85)岁,平均BMI(22.92±2.58)kg/m2,其中T值诊断骨质疏松10人,敏感性为17.54%、特异性为94.93%,阳性预测值28.57%、阴性预测值90.87%;无BMD组阳性13人,全部为女性,平均年龄(58.23±13.99)岁,平均BMI(23.67±2.50)kg/m2,其中T值诊断骨质疏松3人,敏感性5.26%、特异性97.97%,阳性预测值23.08%、阴性预测值89.94%。
2.2.5瑞士的干预阈值为年龄≥50岁的患者, 10年主要骨质疏松骨折(major osteoporotic)的概率大于15%就应开始治疗[6]:阳性率较低,详见表2。
2.3 各因素对FRAX结果的影响
多元线性回归分析发现,在没有骨密度(BMD)测量条件下,年龄、性别、体重均可以影响FRAX结果,其中年龄对FRAX的影响最大,且是正相关(年龄越大,FRAX值越高,骨折风险的发生率越高),身高对FRAX结果没有影响。在可以测量骨密度(BMD)的条件下,股骨颈T值对FRAX的影响最大,负相关影响(T值越大,FRAX值越低,骨折发生率越低)。详见表3。
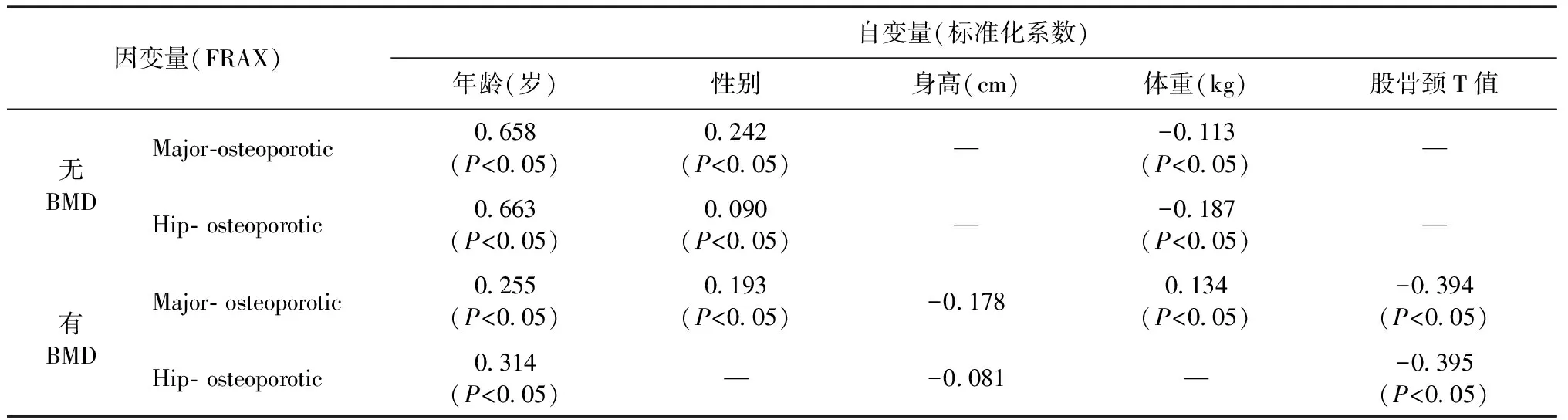
表3 多元线性回归分析各因素对FRAX的影响Table 3 Multiple linear regression analysis of the impact of age, sex, height, weight and the T of Femoral neck on FRAX
注:性别:男=1,女=2
3 讨论
骨质疏松性骨折一旦发生将会严重影响人们的生活质量,并且带来沉重的经济负担。目前常用的双能X线吸收法(DXA),是诊断骨质疏松的金标准。骨密度值预测的风险只是一种相对的总体风险,不能体现每一位个体的绝对风险。FRAX作为一个以计算机软件为基础的评估骨折发生风险的工具,将骨密度、性别、身高、体重、有无骨折史、有无类风湿、父母骨折史、糖皮质激素应用情况、继发性骨质疏松症、有无烟酒嗜好等11种相关因素相结合,能相对个体化的评估其骨折风险,并且其经济、便利、易操作性,为临床医生早期发现骨折高危人群作出治疗决策提供了很好的途径。
随着WHO的推广,FRAX在临床中的实际应用,其优势显现的同时,其局限性也开始显露。法国的一项研究发现FRAX在发现绝经期妇女早期的骨折风险上其敏感性很低。同时,在以人群为基础的OFELY(the Os des Femmes de Lyon (OFELY) cohort)队列研究中,FRAX低估了65岁以上的老年妇女50%的骨折风险。其中50%人群的主要骨折风险低于9%,90%的研究人群主要骨折风险低于21%,而当地FRAX的干预阈值为:主要骨折疏松性骨折≥20%[8]。由此可见,FRAX预测结果在很大程度上低估了受试人群的骨折风险。即便是在FRAX评估工具已经被很好推广的瑞士,FRAX已被很好的量化和标记,仍然是低估了实际骨折的风险[9]。我们的研究也证实了这一现象,从表1中可以看出无论采用哪种干预阈值,其敏感性及阳性预测值均不令人满意。
研究发现,FRAX阳性的受试者中,女性、70岁以上占绝大多数,我们认为性别、年龄对FRAX的贡献较大。本研究采用多元回归分析发现,年龄对FRAX结果总是正相关影响。GLOW(global longitudinal study of osteoporosis in postmenopausal women)是一项跨越10个国家的前瞻性队列观察研究,5年的观察研究结果现实,年龄在评估骨折风险中占的比重最大[10]。澳大利亚的一项回顾性分析研究显示,70岁以上的老年人群,OST(osteoporosis self-assessment screening tool)较之无BMD 的FRAX评估工具其ROC(receiver operating characteristic curves)面积更大,并且指出这两种工具均不能区分需要治疗的骨质疏松高危人群(其中OST=(年龄-体重)/5)[11]。两项研究均支持我们的观点。
本项研究发现股骨颈T值与腰椎最小T值之间有明显的统计学差异。腰椎T值明显低于股骨颈T值,骨量丢失最早应从脊柱骨骨量减少开始的。研究还发现无BMD 的FRAX预测值与有BMD的FRAX的预测值之间有明显的统计学差异,但是其在评估骨质疏松骨折风险的效能是相当的,并且不能取代BMD在指导骨质疏松治疗中的作用。
目前大多数骨质疏松的研究对象设为绝经后的老年女性,如GLOW研究[10]、OFELY研究[8]。男性骨质疏松症并不少见,但受重视程度明显逊于女性。男性原发性骨质疏松症的发病年龄多在 70 岁以后,发病率低于女性,但病情的严重性和死亡率高于女性。尤其是骨质疏松性髋部骨折的死亡率明显高于女性。随着人均寿命的延长,男性骨质疏松症的发生率有明显增高的趋势[12]。
此外FRAX工具本身一直有其局限性。首先,它只是适用于未经治疗的骨量减少的患者。其次,既往骨折史与以后发生骨折的风险相关,FRAX没有考虑到剂量-效应关系,如单次或多次骨折及既往骨折的次数、严重性和类型。第三,跌倒是骨折相关的一个危险因子,但其作为一个变数不能被标准量化而未被纳入目前的FRAX模型中。再者,FRAX尚未包括其他多种骨折危险因子,如糖皮质激素应用的剂量和疗程,继发性骨质疏松的病因和种类,性激素的替代治疗等。最后,目前相关研究证实糖尿病患者骨质疏松的发生率较正常人高,也是骨质疏松的独立危险因子[13-14],但是FRAX并未涉及。
当然我们的研究也有一定的局限性,由于骨代谢受民族、性别、地理环境、气候、饮食习惯及当地的医疗卫生条件,当地居民保健意识的影响,因此我们的研究并不能完全代表当地居民的平均水平。
FRAX的应用使我们从目前仅凭借DXA测定BMD来防治骨质疏松性骨折转向综合各类危险因子评估长期骨质疏松性骨折风险,便于广大基层医疗社区应用FRAX软件筛查骨质疏松高危人群。自2008年WHO推荐使用FRAX进行骨折风险评估以来,国外已经有了大量的临床研究,并且制定了符合其国情的FRAX干预阈值。我国在这方面缺少大样本人群的长期随访研究,尚未制定符合国情的FRAX干预阈值,盲目套用其它地区的干预阈值并不实际,因此我们在期待今后FRAX评估软件在做出适当改进的同时,也应注意开展相关的临床研究,通过大样本的统计分析探究FRAX在使用中的误差,建立更符合中国人群的评估模型,制定符合本地区的预防干预骨质疏松的干预阈值。
