枸杞子乙酸乙酯提取物急性毒性及对切除卵巢大鼠骨质疏松的防治作用
2016-08-06刘舵杨永利雷婷陈宝东张勇杰明磊国
刘舵 杨永利 雷婷 陈宝东 张勇杰 明磊国*
1.西安组织工程与再生医学研究所,西安 710032 2.宁夏华宝枸杞产业有限公司,银川 750001
枸杞子(Fructus lycii)为茄科植物宁夏枸杞(Lycium barbarum)的成熟干燥果实,《本草纲目》中记载枸杞具有“坚精骨”的功效,《神农本草经》中也指出枸杞久服能“坚筋骨”,因此,枸杞子对骨质疏松的治疗存在一定的功效,例如枸杞中的枸杞多糖能够治疗去势雌性大鼠的骨质疏松[1]。然而,大量研究表明中药材中坚筋益骨的功效成分主要为黄酮类物质,如淫羊藿苷[2]、黄芪总黄酮[3]、蜂胶黄酮[4]、骨碎补黄酮[5]及大豆异黄酮[6]等。黄酮类物质被称为植物雌激素,近年来植物雌激素对绝经后妇女骨质疏松症的防治研究备受关注[7]。实验所用的枸杞子乙酸乙酯提取物(ethyl acetate extraction from fructus lycii, EAEF)中黄酮类物质含量较高,可能对骨质疏松有一定的治疗作用。但EAEF属于粗提物,成分复杂,需要先进行急性毒性实验。研究中通过切除雌性大鼠卵巢复制绝经后妇女骨质疏松症,来研究EAEF防治骨质疏松的功效。
1 材料与方法
1.1 材料
1.1.1实验动物:C57/BL6小鼠40只,雌雄各半,6~8周龄,清洁级,18~22 g。雌性SD大鼠40只,6周龄,清洁级,180~260 g。均购自第四军医大学实验动物中心,动物生产许可证号为SCXK(军)2012-0007。
1.1.2实验材料与药品:宁夏枸杞(Lycium barbarum)干果(宁夏华宝枸杞产业有限公司提供),大豆苷元(纯度≥ 98%,上海源叶生物科技有限公司,批号Z27M6L1)。
1.1.3实验仪器:旋转蒸发仪RE-2002(巩义 宇翔),真空冷冻干燥器2-4 LSC(德国 BMH Instruments),Shimadzu GC 2010气相色谱仪(日本 岛津),紫外-可见分光光度计UV-1601(北京 瑞利),自动组织包埋机EG1150C(德国Leica),组织切片机RM2125(德国 Leica),光学显微镜BX41(日本OLYMPUS),Micro CT Inveon(德国 Siements)。
1.2 方法
1.2.1EAEF的制备方法:取5 000 g枸杞干果,用95%乙醇常温浸提3次,每次3 d。合并3次提取液,旋转蒸发仪浓缩,真空冷冻进行干燥,得乙醇提取物。乙醇提取物加入少量水分散,置于分液漏斗,再采用2倍体积的石油醚连续萃取3次,弃上层萃取液,将下层水相,加入2倍体积的乙酸乙酯,重复萃取3次,合并萃取液,于48℃下真空浓缩,真空冷冻干燥后得EAEF。气相色谱测得溶剂乙酸乙酯残留率为0.01%,UV测得多酚类物质含量为30.17%。
1.2.2急性毒理实验: EAEF采用10%的DMSO玉米油溶液配制,将小鼠随机分为1.25、2.50、5.00、10.00 g/kg剂量组及空白组,每组8只,雌雄各半,禁食不禁水。16 h后,在24 h内分4次灌胃给药,每次间隔6 h。给药后立即观察动物反应,记录饮食、排泄、精神、活动等情况,连续观察7 d。给药后第8 d处死并解剖,肉眼观察观察各脏器有无异常,并对心脏、肝脏、脾脏、肺脏及肾脏进行石蜡切片,苏木精-伊红(HE)染色,光学显微镜下进行病理学检查。
1.2.3大鼠骨质疏松防治实验:随机取30只雌性SD大鼠,用35 mg/kg的戊巴比妥钠麻醉,在无菌条件下背部(距背侧下肋缘和脊柱1 cm处)双侧纵行切口,切口约1 cm,依次切开皮肤、皮下组织及肌肉,切除双侧卵巢,切口逐层缝合。随机分为3组,即模型组、大豆苷元组和EAEF组,每组10只。其余10只大鼠为假手术组,以同样步骤手术,但不切除卵巢。恢复5 d,将大豆苷元组腹腔注射20 mg/kg的大豆苷元,EAEF组腹腔注射125 mg/kg EAEF,假手术组和模型组腹腔注射等量的生理盐水,每周3次,连续给药12 w。期间观察大鼠食欲、精神状态和局部感染等情况。实验结束后分离右腿股骨,进行Micro-CT扫描。选择扫描参数:管电压80 KV,电流 500 μA,以360°扫描角度、10.44 μm的扫描分辨率沿股骨长轴方向扫描股骨远端,获取扫描分辨率为21 μm连续的平面μCT图像。扫描完成后在主机上选出生长板上1 μm和股骨远端1.5 mm的区域作为感兴趣区域(region of interest,ROI)。CT值高于1500定为骨组织,行三维重建,进行定量分析,测量如下指标:骨密度(bone mineral density,BMD)、骨体积分数(bone volume fraction,BVF)、骨小梁数量(trabecular number,TN)、骨小梁间隔(trabecular spacing,TS)、骨小梁厚度(trabecular thickness,TT) 和骨表面面积比(bone surface area fraction,BSAF)。
2 结果
2.1 EAEF对急性毒性实验小鼠一般表现与体重的影响
小鼠灌胃给药后,自发活动有所减少,半小时后恢复正常。给药一周内,各组小鼠活动正常,动物外观、四肢活动、进食、呼吸及大小便均未出现异常,亦未出现死亡。实验前各组小鼠间体重无显著性差异(P>0.05)。一周后,各组小鼠体重均显著增加(P<0.01),实验后各组小鼠间体重增长率均无显著差异(P>0.05)。EAEF的LD50及MTD>10 g/kg,根据GB15193.3-2003中的急性毒性分级标准,表明EAEF属实际无毒物。见表1。
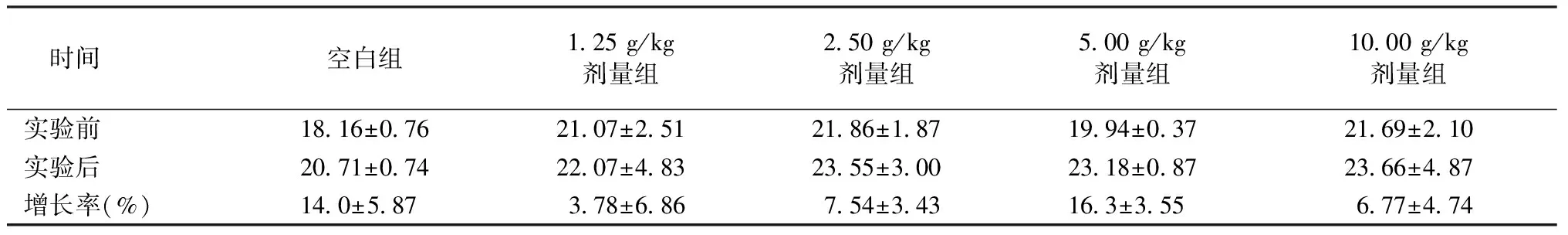
表1 实验前后各组急性毒性实验小鼠体重(n=8,g)Table 1 Body weights of the mice in the acute toxicity experiment (n=8,g)
2.2 EAEF对急性毒性实验小鼠脏器的影响
7天后,处死解剖,观察其内脏颜色、光泽、形态、大小等,均未见异常。对心脏、肝脏、脾脏、肺脏及肾脏进行病理学检查,各实验组小鼠内脏组织结构排列有序,细胞大小、形态正常,胞浆、胞核染色清晰,未见明显异常(图1)。说明EAEF的经口急性毒性不明显,在一定范围的应用是安全可靠的。
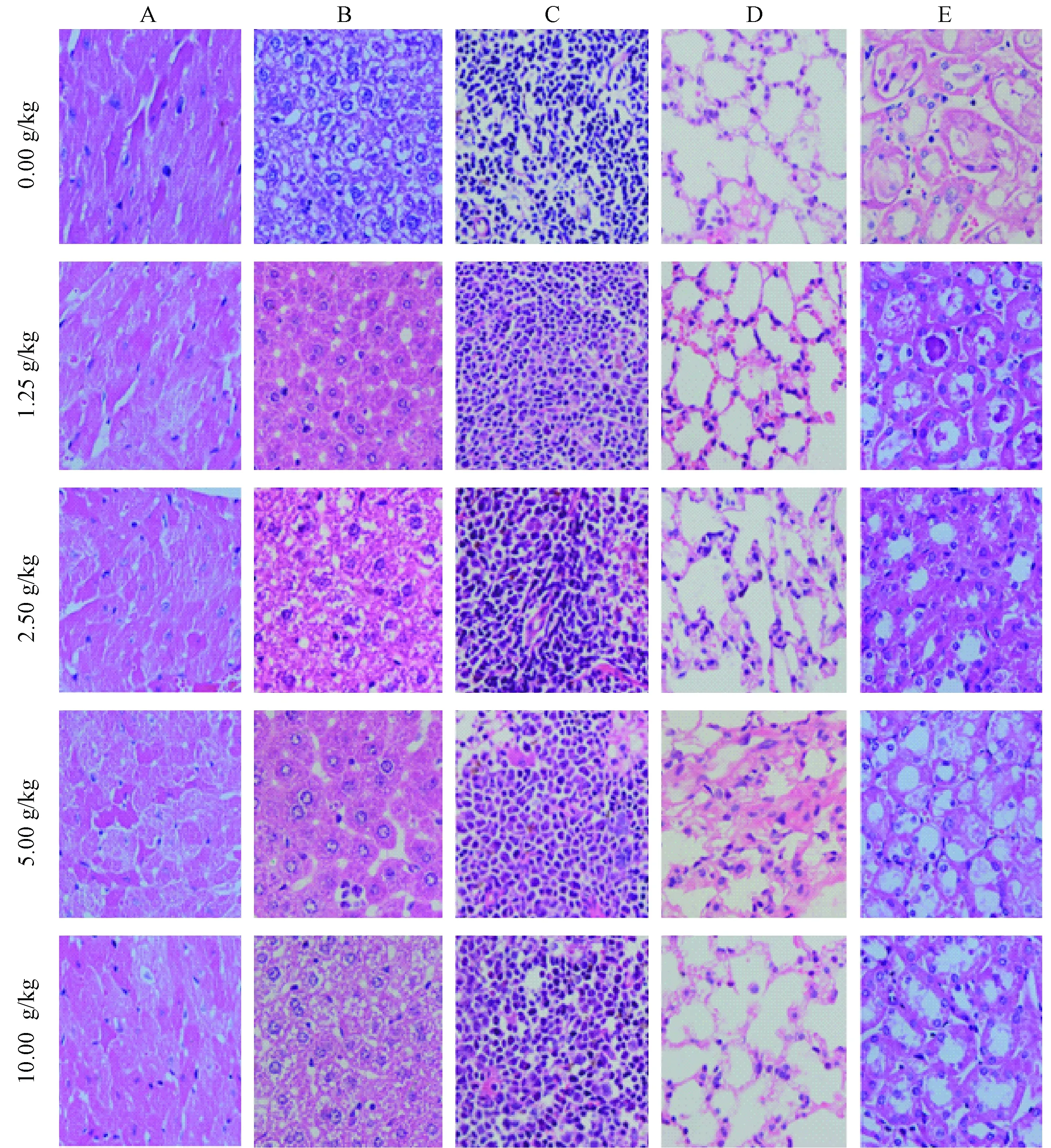
图1 各组急性毒性实验小鼠各主要脏器HE染色图(400×)。A:心脏;B:肝脏;C:脾脏;D:肺脏;E:肾脏 Fig.1 HE staining of the main organs of mouse for acute toxicity experiment (400×). A: Heart; B: Liver; C: Spleen; D: Lung; E: Kidney.
2.3 EAEF对切除卵巢大鼠体重的影响
实验前各组大鼠间体重无显著性差异(P>0.05),实验后各组大鼠体重比实验前均有极显著增加(P<0.01),各组大鼠间体重增长率均无显著性差异(P>0.05),见表2。

表2 实验前后各组骨质疏松实验大鼠体重(n=10,g)Table 2 Body weights of the rats in the osteoporosis experiment (n=10,g)
2.4 EAEF对切除卵巢大鼠股骨远端松质骨骨小梁微观结构的影响
与假手术组相比,模型组大鼠股骨远端松质骨的骨小梁结构均较为纤细且疏松,厚度较薄,结构退化最为严重,大豆苷元组、EAEF组的骨小梁结构退化不及模型组明显,可以初步得出,EAEF对去势大鼠骨质疏松有一定的防治作用(图2)。

图2 各组骨质疏松实验不同组Micro-CT图片。A:股骨纵剖图;B:股骨ROI区横截面;C:股骨ROI区3D模型 Fig.2 Micro-CT images of different groups in the osteoporosis experiment. A: Longitudinal profiles of the femurs; B: Cross sections in ROI area of the femurs; C: 3D models in ROI area of the femurs.
2.5 EAEF对切除卵巢大鼠股骨远端骨质相关参数的影响
与假手术组相比,模型组BD有显著降低(P<0.05),大豆苷元组和EAEF组均有一定程度的恢复,且大豆苷元组与模型组存在显著差异(P<0.05,图3A)。与假手术组相比,模型组BVF、TN显著降低(P<0.05),大豆苷元组和EAEF组均有一定程度的恢复,且与模型组均有显著差异(P<0.05,3B、3C)。与假手术组相比,模型组TS增大极显著(P<0.01),大豆苷元组和EAEF物组均有一定程度的恢复,且大豆苷元组与模型组存在显著差异(P<0.05,图3D)。与假手术组相比,模型组TT有所减小,大豆苷元组和EAEF组均有一定程度的恢复,各组间均无显著差异(P>0.05,图3E)。与假手术组相比,模型组BSAF有所增加,大豆苷元组和EAEF组均有一定程度的恢复,各组间均无显著差异(P>0.05,图3F)。
3 讨论
骨质疏松是一种伴随着骨量降低和骨微观结构退化的系统性骨骼常见多发病[8]。绝经后妇女骨质疏松发病率很高,据调查70岁以下妇女绝经后骨质疏松症的发生率为30%左右,至80岁时40%的妇女发生过骨折[9]。骨质疏松发生过程中,骨结构中的骨小梁的变化表现为骨小梁变细,最终使松质骨的稳定性和力学强度等生物力学性能减退[6]。有研究者认为骨结构的退化对骨的整体性能通常比骨量的减少更具危害性[10],因此通过药物干预保护骨的微观结构,使骨微观结构增强是骨质疏松治疗的重要方向之一。目前切除卵巢大鼠建立骨质疏松模型来研究绝经后妇女骨质疏松已经成为经典模型[11],实验中也采用切除卵巢大鼠来建立骨质疏松模型。

图3 骨质疏松实验不同组松质骨微结构参数(n=10)。A:各组BD;B:各组BVF;C:各组TN;D:各组TS;E:各组TT;F:各组BSAF。*:P≤0.05,**:P≤0.01Fig.3 Trabecular microstructure parameters of different groups in the osteoporosis experiment (n=10).A: BD in each group; B: BVF in each group; C: TN in each group; D: TS in each group; E: TT in each group; F: BSAF in each group.*:P≤0.05,**:P≤0.01.
目前,研究者们通过不同工艺流程提取得到的EAEF成分不尽相同,功效也不尽相同,张丽等人[12]发现EAEF具有良好的抗氧化活性,徐飞等人[13]在EAEF中分离得到了黄酮类物质槲皮素单体。实验中EAEF溶剂乙酸乙酯残留率为0.01%,其值远低于中国药典(2010年版)中乙酸乙酯的残留标准0.5%。EAEF的LD50及MTD>10 g/kg,属实际无毒,其在一定浓度范围内应用是相对安全可靠的。实验中所用的EAEF中多酚类物质含量30.17%,其中包含较多的黄酮类物质,对骨质疏松具有一定的防治作用。大豆异黄酮是典型的植物雌激素,能同时作用于成骨细胞和破骨细胞,发挥协调作用,大豆苷元是大豆异黄酮的主要成分之一,能改善去卵巢小鼠的皮毛蓬松、行动迟缓、反应迟钝和精神不振等症状,增加去卵巢小鼠的子宫重量系数、骨小梁分布密度和骨皮质厚度,还能通过调节OPG/RANKL比例调节骨重建过程中成骨细胞和破骨细胞的平衡,具有良好的抗骨质疏松作用[14],在实验中作为了阳性药物。实验发现,大豆苷元组、EAEF组的大鼠股骨TN、TT、BVF和BD相对模型组增加,而TS和BSAF相对模型组减小,微观结构有所改善,减缓因绝经导致的骨微观结构退化,对骨质疏松具有一定的防治作用。此实验为进一步深入研究开发治疗骨质疏松的药物提供实验基础,并为有针对性的开发利用宁夏枸杞中的活性成分提供理论依据。实验中仅仅使用EAEF进行试验,黄酮类物质含量较高,但无法排除其中的其他物质也对骨质疏松有治疗作用。下一步,还需要对其中的成分进一步分离纯化,设定一定的剂量梯度进行实验。另外,EAEF防治骨质疏松的机制目前还不清楚,有待于进一步深入的研究。
