GLP-1受体激动剂艾塞那肽对MG-63细胞增殖及成骨分化的影响
2016-08-06李颖王潇丽王军徐丽丽杨乃龙郭道瑞
李颖 王潇丽 王军 徐丽丽 杨乃龙* 郭道瑞
1. 青岛大学附属医院内分泌科, 青岛 266000 2. 中国人民解放军第401医院, 青岛 266000 3. 青岛市开发区人民医院骨科, 青岛 266000
近年来肠促胰素与骨代谢的相关研究逐渐成为热点,其中促胰岛素分泌多肽(glucose-dependent insulinotropic ploypeptide,GIP)和胰高血糖素样肽-2(glucagon-like peptide-2,GLP-2)参与骨转换代谢的调节[1]。GIP既促进骨形成,又抑制骨重吸收[2]。近期研究表明[3],GIP受体(GIPR)缺失能够破坏骨皮质的质量与强度。另外皮下注射GLP-2可减少小鼠循环中骨重吸收的分子标记物水平。健康绝经后女性口服GLP-2能够增加髋部及转子的骨密度[4]。关于GLP-1对骨代谢的作用似乎有争议。正常小鼠口服GLP-1对骨结构并无影响,但2型糖尿病及胰岛素抵抗小鼠服用GLP-1后骨质量显著增加[5]。与GLP-1相比,GLP-1受体激动剂具有类似的生物学作用,且其半衰期更长,与GLP-1受体亲和力更高[6-7]。目前研究提示GLP-1受体激动剂具有促进骨形成和抑制骨吸收的双重作用[8-9],然而关于GLP-1受体激动剂对骨吸收影响的研究颇多[10-11],关于GLP-1受体激动剂对骨形成影响的研究相对较少。本研究采用的MG63细胞来源于人成骨肉瘤,其特性与未分化的早期成骨细胞表型类似,且研究发现[12],MG63细胞高表达GLP-1受体并易于获得。故本研究探讨艾塞那肽对MG63细胞增殖及成骨分化的影响,进一步完善GLP-1受体激动剂与骨代谢相关作用研究,为GLP-1受体激动剂的临床应用提供新的思路。
1 材料和方法
1.1 材料
MG63细胞(由中南大学湘雅二院骨代谢内分泌研究所提供),高糖-DMEM、胎牛血清、胰蛋白酶、双抗(Hyclone公司),地塞米松、L-2-磷酸抗坏血酸、β-甘油磷酸(Sigma公司),Cell Counting Kit-8细胞增殖/毒性检测试剂盒、BCA法蛋白定量试剂盒及碱性磷酸酶测定试剂盒(南京建成生物工程研究所有限公司),TRITON-X100(Solarbio公司),艾塞那肽(标准品,由美国Lilly公司提供)。
1.2 实验方法
1.2.1MG63细胞复苏与培养:-80℃冰箱中取出冻存MG63细胞,立即投入37℃~40℃恒温水中迅速晃动至冻存液完全缓解。将细胞悬液移至离心管内,加入5 ml培养液(含高糖DMEM,体积分数为10%胎牛血清,1%双抗),轻轻吹打混匀。将细胞悬液经1 000 r/min离心5 min,弃上清液。向细胞沉淀内加入完全培养液5 ml,轻轻混匀,将细胞悬液转移至培养瓶内,补足培养液进行培养。复苏第2天上午更换培养基,之后每2天换液1次,待细胞长至80%~90%时传代,取细胞进行实验。
1.2.2CCK-8比色法测定细胞增殖率:MG63单细胞悬液以1×105/ml密度接种于96孔细胞培养板中,每孔100 ul,放置于37℃、5%CO2培养箱中孵育24 h,待细胞融合至70%,换用终浓度分别为0 mol/L、10-9mol/L、10-8mol/L、10-7mol/L的艾塞那肽培养液继续培养细胞,每孔100 ul,每组设置5个复孔。36 h后分别于每孔加入10 ul CCK-8溶液,在5%CO2培养箱内孵育2 h,用酶标仪测定450 nm处的吸光度OD值。
1.2.3蛋白浓度的测定:MG63单细胞悬液以1×105/ml密度接种于24孔细胞培养板中,每孔100 ul,放置于37℃、5%CO2培养箱中孵育。10 h后,待细胞融合度达70%,换用终浓度分别为0 mol/L、10-9mol/L、10-8mol/L、10-7mol/L的艾塞那肽培养液培养细胞,每孔100 ul,每组设3个复孔。36 h后吸出24孔细胞培养板内原培养液,PBS漂洗3次,加入0.2%Triton-X100进行裂解,每孔150 ul。收集裂解细胞,1 000 r/min 4℃离心10 min,吸取上清液。在96孔板中分别加入双蒸水10 ul(空白孔)、563 ug/ml标准品10 ul(标准孔)、上述上清液各10 ul(测定孔),空白孔及标准孔设1个复孔,测定孔设2个复孔。每孔加入工作液250 ul,混匀,37℃孵育30 min,酶标仪测定各孔吸光度OD562值,并通过以下公式计算总蛋白浓度:
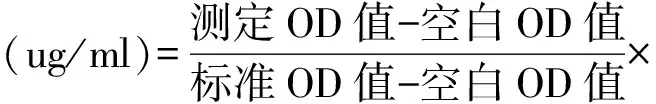
标准品浓度(563 ug/ml)×样本测试前稀释倍数
1.2.4AKP活力测定:96孔细胞培养板中取18孔,各孔分别加入双蒸水5 ul(空白孔)、0.1 mg/ml酚标准应用液5 ul(标准孔)、不同浓度艾塞那肽(0 mol/L、10-9mol/L、10-8mol/L、10-7mol/L)处理后的上清液各5 ul(测定孔),空白孔及标准孔设1个复孔,测定孔设4个复孔。分别于每孔加入缓冲液和基质液各50 ul,充分混匀,37℃水溶15 min,加入显色剂150 ul,轻轻振摇孔板混匀,波长520 nm,酶标仪测定各孔吸光度OD值。
1.3 统计学处理

2 结果
2.1 MG63细胞形态
图1为复苏后MG63细胞,光镜下细胞贴壁生长,形态近似梭形,有少量伪足,核仁清晰、大。

图1 MG-63细胞形态观察(20×)Fig.1 The morphology of MG63 cells (20×)
2.2 艾塞那肽对MG63细胞增殖的影响
实验发现,对照组、10-9mol/L组、10-8mol/L组、10-7mol/L组的OD值分别为0.605±0.468、0.828±0.272、0.748±0.368、0.682±0.487。MG63细胞增殖率测定与对照组相比,实验组各组OD值均显著增高(P<0.05),且随着GLP-1受体激动剂浓度的降低,测定OD值逐渐增高,各组之间差异均有统计学意义(P<0.05)。
2.3 艾塞那肽对MG63细胞成骨分化的影响
实验发现,对照组、10-9mol/L组、10-8mol/L组、10-7mol/L组的AKP活力值依次为7.051±0.995、8.036±0.057、7.365±0.075、7.355±0.113,与对照组相比,实验组各组AKP活力均显著增高(P<0.05),且低浓度的艾塞那肽(10-9mol/L)促进成骨活性能力高于中高浓度组,差异有统计学意义(P<0.05)。
3 讨论
糖尿病可导致骨质量下降,从而增加糖尿病患者骨折风险[13-14]。Janghorbani等[15]的研究显示,T2DM患者髋骨骨折风险增高,与非T2DM患者比,男性风险比为2.8,女性风险比为2.1,T1DM患者髋骨骨折风险则更加显著,RR达6.3,此外糖尿病患者非椎体骨折风险亦明显增加[16]。
GLP-1受体激动剂是糖尿病药物治疗的新兴药物,除了促进胰岛素分泌及抑制胰高血糖素分泌的作用外,还有减缓胃排空、抑制食欲、对心肌的保护、对神经元细胞的保护、对肝炎症与脂肪变性的改善等作用[17]。由于糖尿病患者骨质疏松风险的增高,GLP-1受体激动剂对于骨代谢的影响也逐渐成为研究热点。目前研究显示,GLP-1受体可通过直接或间接作用调节骨代谢向骨形成方向转化[8]。也有研究发现,GLP-1受体激动剂可通过与甲状腺C细胞表面的受体结合促进降钙素分泌,从而抑制骨吸收[10, 18]。Ma等人[9]已证明GLP-1受体激动剂艾塞那肽可降低卵巢切除小鼠尿钙、尿磷的排泄,减少体内钙的丢失,从而缓解骨质疏松的发展。Yamada等人[11]将小鼠GLP-1受体激动剂受体基因敲除后发现骨量减少、骨脆性增加、破骨细胞数目增多、骨吸收活性增强。因此,GLP-1受体激动剂在骨代谢中可能存在促进增殖及抑制吸收的作用。
本实验结果显示GLP-1受体激动剂艾塞那肽在一定范围内可促进MG63细胞增殖,低浓度作用更强,与之前的研究结果一致[8]。AKP活性是成骨细胞分化的功能指标[19],其活性高低可反映成骨细胞的成熟状况,AKP活性越高,表明向成骨细胞分化的程度越高[20]。实验结果中各实验组AKP活力较对照组均增高(P<0.05),提示艾塞那肽对成骨分化有促进作用,与低浓度组相比,中高浓度组的AKP活力均显著降低,提示低浓度的艾塞那肽更能促进成骨分化。艾塞那肽可能通过与MG63细胞高表达的GLP-1受体激动剂受体结合,从而促进其增殖及向成骨细胞分化。
GLP-1受体激动剂除了降糖作用外,还有减体重、改善血脂代谢、改善骨代谢等多种作用。本研究在体外实验中证明了GLP-1受体激动剂可促进MG63细胞增殖并促进成骨细胞分化。当然实际临床应用中GLP-1受体激动剂能否降低糖尿病患者骨折风险尚有待观察。
