肾癌伴淋巴结肿大患者淋巴结阳性的危险因素分析
2016-08-04王雷杜青山张帆李新涛姚远新牛少曦陈路遥马鑫
王雷杜青山张帆李新涛姚远新牛少曦陈路遥马鑫
1中国人民解放军总医院泌尿外科 中国人民解放军总医院肾脏疾病国家重点实验室 100853 北京
论著
肾癌伴淋巴结肿大患者淋巴结阳性的危险因素分析
王雷杜青山张帆李新涛1姚远新1牛少曦1陈路遥1马鑫1
1中国人民解放军总医院泌尿外科中国人民解放军总医院肾脏疾病国家重点实验室 100853 北京
[摘要]目的:肾癌伴淋巴结肿大患者是否行淋巴结清扫有很大争议,探索这类患者伴淋巴结转移的风险因素,以辅助临床决策。方法:回顾性分析2006年1月~2014年12月接受手术治疗且术前检查或术中探查发现淋巴结肿大的全部328例肾癌患者的临床及病理资料,分析年龄、发病症状、肿瘤最大径,pT分期,远处转移,Furhman核分级,肿瘤伴坏死、出血、肉瘤样结构及血管、集合系统、肾被膜受侵与淋巴结转移的关系。结果:在多自变量logistic回归分析中,年龄与肾癌伴淋巴结肿大患者肾根治性切除时淋巴结阳性负相关,远处转移、核分级、肾被膜受侵、pT分期与淋巴结阳性正相关。结论:患病年龄小、伴远处转移、核分级高、肾被膜受侵、pT分期高是肾癌伴淋巴结肿大患者手术时淋巴结阳性的高危因素。
[关键词]肾癌;淋巴结转移;预测性标志物
肾细胞癌(renal cell carcinoma, RCC)占全身恶性肿瘤的2%~3%,约有1/3的患者会发生转移,而30%~40%的转移患者会有淋巴结转移,这是一个在成人RCC中公认的预后不良的指标[1]。当前,在RCC术中是否行淋巴结切除术仍存在争议[2, 3]。既往认为RCC行腹膜后淋巴结清扫术(lymph node dissection, LND) 临床意义不大,因为术前CT未见淋巴结肿大的RCC患者行LND淋巴结转移的阳性率仅4%[4];另外,LND对患者总生存率、无复发生存率及无进展生存率的改善并无作用[5]。盲目扩大手术会增加手术风险、损及患者免疫力、增加围手术期并发症等。然而,有研究表明,对有淋巴结转移高危风险的肾癌行腹膜后LND可改善患者预后。尤其是没有远处转移的患者,淋巴结切除术有可能起到根治的作用,即使是有远处转移的患者,也能最大限度地通过外科切除减少体内瘤负荷[6]。随着肾癌生物治疗的迅速进展,这种去肿瘤与带瘤生存的患者在术后治疗意义上是不同的,改善存活率和治愈率尤为重要。因此,目前临床上急需可靠的预测性因子来预测肾癌患者发生淋巴结转移的风险,辅助临床决策中哪些患者需要进行淋巴结清扫术。
Blom 等发现真正隐匿性的淋巴结转移(是指影像学检查和术中探查均未能发现的淋巴结转移) 是很少的,只占所有淋巴结转移的2%~3%[7, 8]。因此,为探讨肾癌伴淋巴结转移的风险因素,我们回顾性分析了于我院接受手术治疗且术前检查或术中探查发现淋巴结肿大的328例肾癌患者病理、临床特征,探索淋巴结肿大肾癌患者发生淋巴结转移的危险因素。
1资料与方法
1.1临床资料
本研究连续入组了2006年1月~2014年12月于我院接受肾根治性切除术且术前CT检查或术中探查发现淋巴结肿大的全部328例肾癌患者,2例患者因肿大淋巴结粘连严重未予切除,其余326例患者均行选择性腹膜后肿大淋巴结切除术或区域淋巴结清扫术。其中男213例,女113例,年龄6~84岁,中位年龄54岁。根据术后病理结果分为淋巴结阳性组60例(18.4%),淋巴结阴性组266例。两组患者发病症状、肿瘤最大径、pT分期、远处转移、Furhman核分级、肿瘤是否伴坏死、出血、肉瘤样结构、及血管、集合系统、肾被膜受侵情况见表1。
1.2分析方法
本研究运用logistic回归分析的方法探讨淋巴结肿大肾癌患者伴淋巴转移的危险因素。以切除肿大淋巴结病理结果为因变量,患者的临床资料为自变量,包括年龄、术前是否伴腰疼、是否伴血尿、肿瘤最大径,T分期,M分期,Furhman核分级,肿瘤是否伴坏死、出血、肉瘤样结构,以及血管、集合系统、肾被膜受侵情况12项因素,运用单自变量logistic回归分析肾癌伴肿大淋巴结患者淋巴结转移的危险因素,有统计学意义的变量进入多自变量logistic回归分析。肿瘤最大径依据手术切除肿瘤标本测量,肿瘤是否伴坏死、出血、肉瘤样结构,以及血管、集合系统、肾被膜受侵情况依据手术记录及病理报告判断。患者年龄、肿瘤最大径为连续自变量;T分期,Furhman核分级、血管、肾被膜受侵情况为有序分类自变量,血管受侵分为无血管受侵、微小血管受侵和主要静脉受侵3个哑变量,肾被膜受侵分为肾被膜未受侵、侵及肾被膜和侵透肾被膜3个哑变量;M分期,肿瘤是否伴坏死、出血、肉瘤样结构、集合系统受侵为二分类变量。所有数据统计学分析用SPSS19.0软件处理,计量资料使用t检验,所有统计分析以P<0.05为差异有统计学意义。

表1 自变量分布情况
1)中位数(区间,四分位距)
2结果
2.1一般情况
326例肾癌患者中286例肾透明细胞癌,19例乳头状细胞癌,7例嫌色细胞癌,6例集合管癌,4例多房型囊性肾细胞癌,1例Xp11异位性肾癌,3例黏液管状及梭形细胞癌。43例患者就诊时有腰疼症状,59例患者有血尿症状,26例患者伴远处转移。病理报告72例肿瘤伴坏死,63例伴出血,22例伴肉瘤样变,51例伴血管受侵,68例伴集合系统受侵,162例肾被膜受侵。变量在淋巴结阴性和阳性组之间的分布情况见表1。
2.2单自变量Logistic回归分析
单自变量的logistic回归分析结果显示:患者年龄、术前有否伴血尿、肿瘤最大径、T分期、是否远处转移、核分级、肿瘤是否伴肉瘤样结构以及血管、集合系统、肾被膜是否受侵与淋巴结肿大肾癌患者淋巴结转移有相关性。患者年龄与淋巴结转移风险负相关,术前是否伴血尿、肿瘤最大径、T分期,是否远处转移、核分级、肿瘤是否伴肉瘤样结构以及血管、集合系统、肾被膜是否受侵与淋巴结转移风险正相关(HR, 95% CI,P值见表2)。
2.3多因素Logistic回归分析
患者年龄、术前是否伴血尿、肿瘤最大径、T分期、是否远处转移、核分级、肿瘤是否伴肉瘤样结构、以及血管、集合系统、肾被膜是否受侵被纳入多自变量logistic回归分析。结果显示患者年龄、是否远处转移、核分级、肾被膜是否受侵、T分期是肾癌伴淋巴结肿大患者发生淋巴结转移的独立预测因子(HR, 95% CI,P值见表2)。
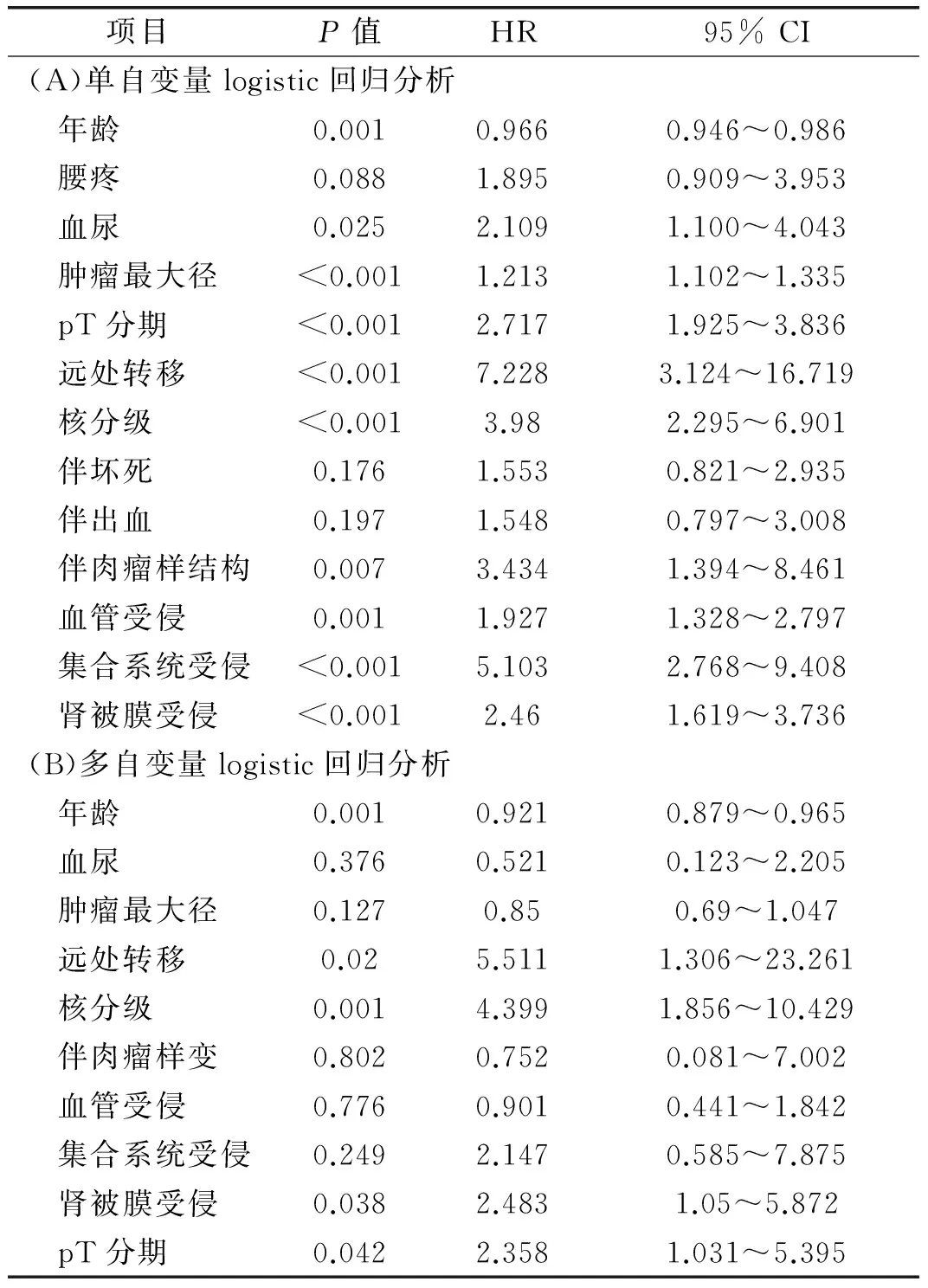
表2 单自变量与多自变量logistic回归分析
3讨论
淋巴转移是肾癌转移的重要途径之一。对做或不做淋巴结切除的TxN0M0期患者,国际抗癌协会不能找到全身、局部或者远处转移的差异[5]。而对仅有淋巴结转移的肾癌患者,Giuliani报告在进行肾癌根治术+扩大淋巴结切除术后,获得了47.9%的5年存活率和31.9% 的10年存活率。这与T3N0M0期患者存活率在统计学上类似,并且明显优于M+患者[6]。对进展期肾癌,有报道在以减瘤 (含淋巴结切除)为目标实施手术后,最终有1%的患者远处转移灶自发性消退。 近期的报告则表明,无论单一机构还是多中心研究,细胞减积术都能够安全进行、改善恶液质,并对系统免疫治疗产生应答,也可能改善存活率[9, 10]。也就是说,对于局限性肾癌患者,目前观点不主张行广泛淋巴结清扫,然而对于有淋巴结转移风险的肾癌患者,例如说发现有淋巴结肿大的患者,是否行淋巴结清扫仍有很大争议。一方面,盲目扩大手术会增加手术风险、损及患者免疫力、影响术后生活质量等。一方面,淋巴结清扫术对有确切淋巴结转移的患者能改善生存时间及生存质量。因此,当前研究的重点在于精准地预测患者淋巴结转移风险,这对手术方式的选择至关重要。国内外对淋巴结转移的危险因子进行了广泛的研究,Blute等[11]的研究入组了1 652例行肾根治性切除术的肾癌患者,多因素分析提示:肿瘤细胞分级为3~4级、存在肉瘤样成分、肿瘤最大径>10 cm、肿瘤分期pT3~pT4以及肿瘤内存在坏死,是肾癌淋巴结转移的风险因素。此外,有发病症状发病、远处转移和下腔静脉癌栓阳性也是淋巴结转移的风险因素。Terrone等[12]的研究结果相似,此外还发现影像学显示淋巴结肿大和晚期转移瘤行细胞减积术的患者也有较高的淋巴结转移率。
无淋巴结肿大的淋巴结转移肾癌患者少见[7, 8],通常临床上对于发现淋巴结肿大的肾癌患者才考虑行淋巴结清扫术。因此,本研究缩小了目标人群,只入组了肾癌伴淋巴结肿大的患者,运用logistic回归分析肾癌伴肿大淋巴结患者伴淋巴结阳性的危险因素。本研究与前文肾根治性切除术肾癌患者淋巴结转移风险研究结果类似,肿瘤最大径、pT分期、伴远处转移、高核分级、肿瘤伴肉瘤样结构及血管受侵同样是肾癌伴淋巴结肿大患者淋巴结转移的风险因素,此外,本研究还发现患病年龄小、集合系统受侵、肾被膜受侵是肾癌伴淋巴结肿大患者淋巴结转移的风险因素。本研究进一步细分发病症状,发现其中血尿是肾癌伴淋巴结肿大患者淋巴结转移的风险因素。
多因素分析中,患病年龄小、远处转移、核分级、肾被膜受侵、pT分期是肾癌伴淋巴结肿大患者发生淋巴结转移的独立预测因子。患病年龄是作为肾癌淋巴结肿大患者淋巴结转移风险独立预测因子的首次报道。Blute等[11]的研究中淋巴结阳性患者的中位患病年龄(61岁)小于淋巴结阴性患者(65岁),但并无统计学意义,原因可能是调查人群的差异,其研究入组标准并不考虑是否伴淋巴结肿大。此外,调查人群中位患病年龄的差异也可能是原因之一。相较于肿瘤细胞核分级、pT分期、肿瘤伴肉瘤样结构、血管受侵等通常在术中术前并不能获取的因素,患病年龄更适合作为指导手术方式选择的淋巴结转移预测因子。年轻的肾癌患者淋巴结转移风险高的原因,我们推测可能与分化程度更低,肿瘤生长速度更快相关,具体机制还需要更深入的研究来探索。
[参考文献]
[1]Ljungberg B, Bensalah K, Canfield S, et al. EAU guidelines on renal cell carcinoma: 2014 update. Eur Urol, 2015,67 (5):913-924.
[2]Ward JF, Blute ML, Cheville JC, et al. The influence of pNx/pN0 grouping in a multivariate setting for outcome modeling in patients with clear cell renal cell carcinoma. J Urol, 2002,168 (1):56-60.
[3]Giberti C, Oneto F, Martorana G, et al. Radical nephrectomy for renal cell carcinoma: long-term results and prognostic factors on a series of 328 cases. Eur Urol,1997,31(4):40-48.
[4]Geller JI, Dome JS. Local lymph node involvement does not predict poor outcome in pediatric renal cell carcinoma. Cancer, 2004,101(7):1575-1583.
[5]Pantuck AJ, Zisman A, Dorey F, et al. Renal cell carcinoma with retroperitoneal lymph nodes: role of lymph node dissection. J Urol, 2003,169(6):2076-2083.
[6]Fantini J, Rognoni JB, Theveniau M, et al. Impaired carcinoembryonic antigen release during the process of suramin-induced differentiation of the human colonic adenocarcinoma cell clone HT29-D4. J Cell Physiol, 1990,143( 3):468-474.
[7]Blom JH, van Poppel H, Marechal JM, et al. Radical nephrectomy with and without lymph node dissection: preliminary results of the EORTC randomized phase III protocol 30881. EORTC Genitourinary Group. Eur Urol,1999,36 (6):570-575.
[8]Phillips CK, Taneja SS. The role of lymphadenectomy in the surgical management of renal cell carcinoma. Urol Oncol, 2004,22(3):214-224.
[9]Wood CG. The role of cytoreductive nephrectomy in the management of metastatic renal cell carcinoma. Urol Clin North Am, 2003,30(3):581-588.
[10]Mickisch GH, Garin A, van Poppel H, et al. European Organisation for Research and Treatment of Cancer (EORTC) Genitourinary Group. Radical nephrectomy plus interferon-alfa-based immunotherapy compared with interferon alfa alone in metastatic renal-cell carcinoma: A randomised trial. Lancet, 2001,358(9286):966-970.
[11]Blute ML, Leibovich BC, Cheville JC, et al. A protocol for performing extended lymph node dissection using primary tumor pathological features for patients treated with radical nephrectomy for clear cell renal cell carcinoma. J Urol, 2004,172(2):465-469.
[12]Terrone C, Guercio S, De Luca S, et al. The number of lymph nodes examined and staging accuracy in renal cell carcinoma. BJU Int, 2003,91(1):37-40.
通信作者:马鑫,urologist@foxmail.com
收稿日期:2016-01-26
基金项目:国家高新技术研究发展计划 (863计划)(2014AA020607)
[中图分类号]R737.11
[文献标识码]A
[文章编号]2095-5146(2016)03-179-04
Corresponding author:Ma Xin, urologist@foxmail.com
Prognostic factors related to positive lymph nodes for renal cell carcinoma with enlarged lymph nodes
Wang Lei1Du Qingshan1Zhang Fan1Li Xintao1Yao Yuanxin1Niu Shaoxi1Chen Luyao1Ma Xin1
(1Department of Urology/State Key Laboratory of Kideny Dieases, Chinese PLA General Hospital, Beijing 100853, China)
AbstractObjective: To assess the prognostic factors related to positive lymph nodes for renal cell carcinoma (RCC) with enlarged lymph nodes, since use of lymph node dissection in these patients was debatable. Methods: We retrospectively reviewed the clinicopathologic data of 328 patients with RCC who underwent radical nephrectomy (RN) and the enlarged lymph nodes were confirmed preoperatively or perioperatively. These patients were treated at the PLA General Hospital from January 2006 to December 2014. A multivariate logistic regression model was used to determine the clinicopathologic features of the primary tumor that were associated with positive regional lymph nodes at RN. Results: Younger age, distant metastasis, high nuclear grade, high tumor stage, and renal capsule invasion were significantly associated with positive lymph nodes in a multivariate setting. Conclusions: Younger age, distant metastasis, high nuclear grade, high tumor stage, and renal capsule invasion are the high risk factors for lymph node involvement at RN in RCC patients with enlarged lymph nodes.
Key wordsrenal cell carcinoma; lymph node metastasis; predictive markers
