5,7-二甲氧基黄酮下调FoxMl基因表达对胰腺癌细胞上皮-间充质转化的影响
2016-08-03曾德余殷先利李蓉蓉杨剑锋
曾德余,殷先利,李蓉蓉,杨剑锋
(1.湖南省肿瘤医院消化泌尿内科,长沙 410003;2.湖南师范大学医学院病理教研室,长沙 410005)
5,7-二甲氧基黄酮下调FoxMl基因表达对胰腺癌细胞上皮-间充质转化的影响
曾德余1,殷先利1,李蓉蓉1,杨剑锋2
(1.湖南省肿瘤医院消化泌尿内科,长沙410003;2.湖南师范大学医学院病理教研室,长沙410005)
【摘要】目的:探讨5,7二甲氧基黄酮(5,7-DMF)对胰腺癌细胞上皮-间充质转化的影响及分子机制。方法:用不同浓度DMF处理人胰腺癌Panc-1细胞,利用划痕法检测5,7-DMF干预后Panc-1细胞侵袭转移能力变化;用Westernblot检测5,7-DMF干预后FoxM1蛋白表达情况;FoxM1siRNA转染人胰腺癌Panc-1细胞后,用Western blot进而检测EMT相关上皮标志分子E-cadherin、间质标志分子N-cadherin蛋白水平的表达变化。结果:5,7-DMF以浓度依赖方式显著抑制Panc-1细胞侵袭转移能力。5,7-DMF干预胰腺癌细胞后显著下调FoxM1表达水平;FoxM1siRNA转染胰腺癌细胞,EMT相关分子E-cadherin表达升高,而N-cadherin表达降低,且与对照组相比均有统计学意义。结论:5,7二甲氧基黄酮可逆转胰腺癌细胞上皮-间充质转化,可能通过下调FoxM1水平是其重要机制之一,但其内在的分子机制尚需进一步探讨。
【关键词】胰腺肿瘤;叉头转录因子M1;上皮-间充质转化
胰腺癌(PC)起病隐匿,一旦确诊多处于中晚期,能手术根治性切除者较少。加之,胰腺癌细胞易对放、化疗抵抗。故研究胰腺癌细胞治疗有效药物对于改善胰腺癌临床治疗至关重要。5,7-二甲氧基黄酮(5,7-Dimethoxyflavone,5,7-DMF)是一种从小花山奈和卡瓦胡椒及其他植物中提取分离的天然黄酮类化合物[1,2]。前期工作中,我们研究发现DMF具有抗肿瘤的潜力以及它对多种肿瘤细胞具有细胞毒效应[3,4,5],有望成为一种有效的抗癌抑制剂。目前,5,7-DMF在胰腺癌细胞研究尚未见文献报道。笔者用不同浓度5,7-DMF干预人胰腺癌Panc-1系,观察其是否可抑制胰腺癌细胞侵袭及转移,即上皮间充质转化变化,并探讨了其可能的机制。
1 资料与方法
1.1材料5,7-二甲氧基黄酮由湖南师范大学医学院曹建国教授惠赠;人胰腺癌细胞PANC-1购自中科院上海生命科学研究院;DMEM、胎牛血清购自HyClone公司;鼠抗人FoxM1、E-cad、N-cad单克隆抗体购自美国SantaCruzBiotechnology公司;鼠抗人β-actin单克隆抗体购自美国Sigma-Aldrich公司;辣根过氧化酶藕联山羊抗鼠IgG二抗购自美国SantaCruz Biotechnology公司;FoxM1siRNA购自Invitrogen公司。
1.2方法
1.2.1细胞培养胰腺癌Panc-1细胞在含10%胎牛血清的RPMI1640培养液,37℃、5%CO、饱和湿度环境的条件下连续培养。
1.2.2FoxM1siRNA转染对PANC-1细胞增殖的影响FoxM1-siRNA,其序列如下:正义链序列:5-GGA GGAAAUGCCACACUUAdTdT-3、反义链序列:3-dTdT CCUCCUUUACGGUGUGAAU-5。转染前1天,将浓度为1.0×105/mL的胰腺癌Panc-1细胞接种于24孔培养板培养,次日转染。分PC-1、NC、Si-FOXM1三组,6.25 nMol/LFoxMlsiRNA转染胰腺癌细胞,用RPMI1640代替FoxM1-siRNA作为空白对照组。连续培养7d,10个高倍镜视野计数各组细胞数。
1.2.3划痕法检测DMF干预后Panc-1细胞迁移不同浓度DMF(1.0、2.0和4.0μmol/L)和0.1%DMSO处理人胰腺癌PANC-1细胞24h;然后用含10%FBS的DMEM完全培养基以每孔4×105的密度接种到6孔细胞培养板,细胞生长85%融合,然后用tip头在中央区域划痕制造伤口。PBS冲洗2次,去除漂浮的细胞和碎片。细胞孵育24小时,计数在划痕区域的细胞数。以0.1%DMSO处理人胰腺癌PANC-1细胞24h迁移细胞数为对照即100%,计算相对迁移细胞百分率(%)。
1.2.4WesternBlot检测蛋白质印迹分析FoxM1 siRNA序列转染后E-cad、N-cad蛋白表达及DMF干预前后FoxM1、E-cad、N-cad蛋白表达。按照文献[6]描述的方法完成。抗FoxM1、抗E-cad、抗N-cad、和β-actin的兔多克隆抗体作为一抗。用增强型ECL蛋白质印迹分析系统进行目的条带信号的检测。
1.3统计学方法各组实验数据均用均数±标准差表示,录入Spss15.0forwindowsevaluation软件,行One WayANOVA方差分析;方差齐性检验后,在方差齐性时,均数间比较采用LSD法,在方差不齐时,均数间比较采用Studentt检验,P<0.05为有统计学意义。并用Sigmaplot10.0作图。
2 结果
2.1FOXM1siRNA干扰对胰腺癌PACN-1细胞增殖作用分PC-1、NC、SiRNA-FOXM1三组,连续观察7天,第1~4d各组细胞增值无统计学差异,第5d Si-FOXM1组细胞增值受到抑制,与PC-1、NC组比较差异有统计学意义(P<0.05),第6~7d细胞抑制更明显(P<0.01)。而PC-1组和NC组细胞增值无统计学差异(P>0.05)(图1)。
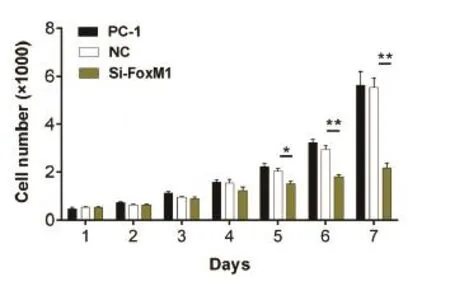
图1 FOXM1 siRNA转染对胰腺癌细胞增殖影响
2.2FOXM1siRNA转染对胰腺癌细胞E-cad、N-cad蛋白表达影响分别以3.15、6.25、12.5nmol/LFOXM1 siRNA转染胰腺癌细胞72h后。结果发现,与对照组比较,各转染组癌细胞E-cad表达水平升高、N-cad蛋白表达水平下降,且与FOXM1siRNA浓度有关。1为对照组,2,3,4分别为3.15,6.25,12.5nmol/LsiRNA组(图2)。
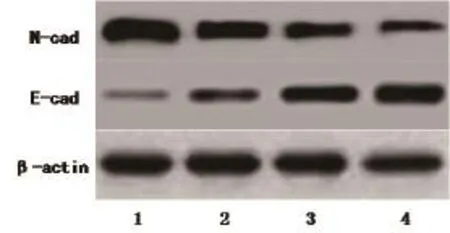
图2 FOXM1 siRNA转染对胰腺癌细胞E-cad、N-cad蛋白表达影响
2.3DMF抑制胰腺癌细胞FoxM1蛋白表达以1.0、2.0和4.0μmol/L不同浓度DMF干预处理Panc-1细胞24h,Westernblot分析各组FoxM1表达情况,人胰腺癌PANC-1细胞FOXM1蛋白表达水平降低(图3),说明:5,7-DMF能有效抑制人胰腺癌PANC-1细胞致瘤性转录因子FoxM1蛋白表达。

图3 不同浓度DMF抑制人胰腺癌PANC-1细胞FOXM1蛋白表达
2.45,7-DMF抑制胰腺癌细胞迁移以1.0、2.0和4.0μmol/L不同浓度5,7-DMF干预Panc-1细胞,划痕法检测DMF干预后Panc-1细胞迁移率。结果发现,5,7-DMF可抑制Panc-1细胞迁移,且随浓度增加抑制效果更明显(图4)。

图4 DMF对人胰腺癌PANC-1细胞体外迁移能力的影响(100×)与对照组比较,*P<0.05;与1.0 μmol/L5,7-DMF组比较,#P<0.05
2.5DMF干预对胰腺癌细胞E-cad、N-cad蛋白表达影响Westernblot分析不同浓度5,7-DMF(1.0、2.0和4.0μmol/L)和0.1%DMSO处理人胰腺癌PANC-1细胞N-cadherin、E-cadherin蛋白表达水平。结果表明:5,7-DMF(1.0、2.0和4.0μmol/L)处理24h,人胰腺癌PANC-1细胞N-cad蛋白表达水平降低,E-cad蛋白表达水平升高(图5),说明:5,7-DMF能有效逆转人胰腺癌PANC-1细胞上皮-间充质转化表型。
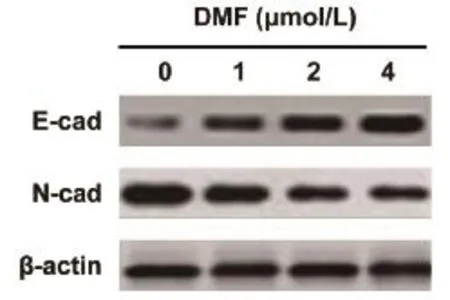
图5 5,7-DMF干预对人胰腺癌PANC-1细胞N-cad、N-cad蛋白表达影响与对照组比较,*P<0.05;与1.0 μmol/L5,7-DMF组比较,#P<0.05
3 讨论
胰腺癌起病隐匿,一旦确诊多处于中晚期,能手术根治性切除者较少,胰腺癌患者平均生存时间为6个月,5年生存率低于5%[7,8]。早期诊断难、临床标志物缺乏、晚期治疗手段抵抗等因素是胰腺癌预后差的主要原因,寻找有效治疗新药物是目前胰腺癌领域的研究热点之一。
叉头框蛋白M1(forkhead box protein M1,FoxMl)是Fox蛋白家族的成员,是典型的增殖相关转录因子。该家族包括50多个成员,均具有一段保守的“翼状螺旋DNA结合结构域”[9]。众所周知,FOXM1是一种关键的细胞周期调控基因,可调节细胞周期G1到S及G2到有丝分裂转变的过程[10]。越来越多的研究表明FOXM1在大多数恶性肿瘤,如胶质细胞瘤、肺癌、肝癌、乳腺癌、胰腺癌等过表达,并在肿瘤发生、血管生成、侵袭与转移中发挥关键作用[10-14]。
EMT是指细胞失去上皮特性逐渐向间充质转变,在此过程中,细胞极性消失,连接松散,更易于经血流转移,在分子学上表现为上皮标志蛋白E-钙黏蛋白等表达下调或缺失,而N-钙黏蛋白等间质标志蛋白表达升高[15]。现今的研究认为EMT是恶性或者良性肿瘤恶性程度增加的一个过渡形态,发生EMT的癌细胞具有更强的化疗药物耐药性、更强的转移侵袭能力,还有研究显示发生EMT的癌细胞有肿瘤干细胞样特性[16];上皮标志蛋白E-cadherin是肿瘤细胞EMT过程中最重要的标志蛋白,它是一种广泛表达于上皮细胞并介导细胞间连接的钙依赖性跨膜蛋白,它的表达缺失伴随着上皮细胞表型的丧失,使细胞粘附能力下降,易于脱落发生转移,而间质标志N-cadherin表达升高使得细胞易于发生侵袭转移。本实验用FoxMl siRNA干扰PANC-1细胞FoxMl表达,PANC-1细胞增殖受抑制,进一步检测N-cadherin、E-cadherin蛋白表达,发现N-cadherin表达下降、E-cadherin蛋白表达升高,说明FoxMl在人胰腺癌PANC-1细胞增殖及上皮-间质转化过程发挥了重要作用。
FoxMl在胰腺癌过表达,在侵袭与转移中发挥关键作用。以不同浓度5,7-DMF处理PANC-1细胞,westernBlot检测FoxMl表达水平,跟对照组相比,实验组显著下降,且随5,7-DMF浓度增加FoxMl表达水平下降程度更大,组间差别有统计学差异。本实验说明5,7-DMF可抑制胰腺癌细胞侵袭和转移,即有效逆转人胰腺癌PANC-1细胞上皮-间充质转化,可能与5,7-DMF靶向抑制FoxMl表达相关。
5,7-二甲氧基黄酮(5,7-dimethoxyflavone,5,7-DMF)系山柰属等多种植物中存在一种多甲氧基黄酮类化合物[1,2]。研究发现5,7-DMF对多种人类恶性肿瘤具有抑制增殖和生长、诱导细胞凋亡作用[3,4,5]。然而,5,7-DMF是否具有抑制胰腺癌细胞侵袭及转移尚未见报道。本实验以不同浓度5,7-DMF干预胰腺癌PANC-1细胞,通过划痕实验发现5,7-DMF干预后PANC-1细胞的侵袭和转移能力明显减弱。Westernblot分析不同浓度5,7-DMF(1.0、2.0和4.0μmol/L)和0.1%DMSO处理人胰腺癌PANC-1细胞N-cadherin、E-cadherin蛋白表达水平。人胰腺癌PANC-1细胞间质性标记N-cadherin蛋白表达水平降低,上皮性标记E-cadherin蛋白表达水平升高,且随浓度增加作用效果更明显,说明5,7-DMF能有效逆转人胰腺癌PANC-1细胞上皮-间充质转化表型。本实验也首次证实5,7-DMF可抑制胰腺癌细胞侵袭和转移,体现了良好的药效学特性。
5,7-DMF以浓度依赖方式显著抑制人胰腺癌PANC-1细胞系胰腺癌细胞上皮-间充质转化,可能与5,7-DMF靶向抑制FoxMl表达相关,其涉及多种分子机制需进一步研究,还需要在动物实验进一步验证,为临床应用提供实验及理论依据。
参考文献
[1] Wanich S, Yenjai C. Amino and nitro derivatives of 5, 7-dimethoxyflavone from Kaempferiaparviflora and cytotoxicity against KB cell line[J]. Arch Pharm Res, 2009, 32(9): 1185-1189.
[2] Yenjai C, Wanich S, Pitchuanchom S, et a1. Structural modification of 5, 7-dimethoxyflavone from Kaempferiaparviflora and biological activities [J]. Arch Pharm Res, 2009, 32(9): 1179-1184.
[3] Wudtiwai B, Sripanidkulchai B, Kongtawelert P, et a1. Methoxyflavone derivatives modulate the effect of TRAIL-induced apoptosis in human leukemic cell lines[J]. J Hematol Oncol, 2011, 4: 52.
[4] Songngam S, Sukwattanasinitt M, Siralertmukul K, et a. A 5, 7-dimethoxyflavone /hydroxypropyl-β-cyclodextrininclusion complex with anti-butyrylcholinesterase activity[J]. AAPS Pharm Sci Tech, 2014, 15(5): 1189-1196.
[5] Kim JK, Mun S, Kim MS, et a1. 5, 7-Dimethoxyflavone, an activator of PPARα/γ, inhibits UVB-induced MMP expression in human skin fibroblast cells[J]. Exp Dermatol, 2012, 21(3): 211-216.
[6] Yang XH, Zheng X, Cao JG, et al. 8-Bromo-7-methoxychrysininducedapoptosis of hepato- cellular carcinoma cells involves ROS and JNK[J]. World J Gastroenterol, 2010, 16: 3385-3393.
[7] Hidalgo M. Pancreatic cancer[J]. N Eng1 J Med, 362(17): 1605-1617.
[8] Li D, Xie K, Wolff R, et a1. Pancreatic cancer[J]. Lancet, 2004, 363(9414): 1049-1057.
[9] Korver W, Roose J, Heinen K, et a1. The human TRIDENT/HFH-11/ FKHL16 gene: structure, localization, and promoter characterization[J]. Genomics, 1997, 46(3): 435-442.
[10] Kalin TV, Ustiyan V, Kalinichenko VV, et a1. Multiple faces of FoxM1 transcription factor: lessons from transgenic mouse models[J]. Cell Cycle, 2011, 10(3): 396-405.
[11] Bowman A, Nusse R, et a1. FoxM1 mediates beta-catenin nuclear translocation and promotes glioma tumorigenesis[J]. Cancer Cell, 2011, 20(4): 415-416.
[11] Balli D, Zhang Y, Snyder J, et a1. Endothelial cell-specific deletion of transcription factor FoxM1 increases urethane-induced lung carcinogenesis[J]. Cancer Res, 2011, 71(1): 40-50.
[12] Yang C, Chen H, Yu L, et a1. Inhibition of FOXM1 transcription factor suppresses cell proliferation and tumor growth of breast cancer[J]. Cancer Gene Ther, 2013, 20(2): 117-124.
[13] Xia L, Huang W, Tian D, et a1. Upregulated FoxM1 expression induced by hepatitis B virus X protein promotes tumor metastasis and indicates poor prognosis in hepatitis B virus-related hepatocellular carcinoma[J]. J Hepatol, 2012, 57(3): 600-612.
[14] Xia JT, Wang H, Liang LJ, et a1. Overexpression of FOXM1 is associated with poor prognosis and clinicopathologic stage of pancreatic ductal adenocarcinoma[J]. Pancreas, 2012, 41(4): 629-635.
[15] Thiery JP. Epithelial-mesenchymal transitions in tumor progression[J]. Nat Rev Cancer, 2002, 2(6): 442-54.
[16] Kong X, Li L, Li Z, et a1. Dysregulated expression of FOXM lisoforms drives progression of pancreatic cancer[J]. Cancer Res, 2013, 73(13): 3987-3996.
【中图分类号】R575.2
【文献标识码】A
【文章编号】1673-016X(2016)03-0007-04
收稿日期:2016-01-10
基金项目:湖南省科技厅基金(2013FJ3013)
通讯作者:杨剑锋,Email:yjfbl@sohu.com
Effect of FoxMl down-regulation by 5,7-Dimethoxyflavone on epithelial-mesenchymal transitions of pancreatic cancer cell line PANC- 1
Zeng De-yu1, Yin Xian-li1, Li Rong-rong1, Yang Jian-feng2
(1. Department of Medical Oncology ,Hunan tumor hospital; 2. Department of Pathology, Medical College , Hunan Normal University, Changsha 410006, China)
[Abstract]Objective To investigate the effect of 5,7-Dimethoxyflavone(5,7-DMF) on epithelial-mesenchymal transitions(EMT) of pancreatic cancer cell line PANC-1. Methods Different concentrations of 5,7-DMF treated human pancreatic cancer Panc-1 cells. Wound scratch assay were employed to evaluate the cell invasion and metastasis after treatment of5,7-DMF. Western blotting was used to detect changes in the expressions of FoxM1 in the cells. After FoxM1siRNA transfection of human pancreatic cancer Panc-1 cells, Western blotting was used to observe changes in the expressions of E-cadherin, and N-cadherin in the cells. Results 5,7-DMF significantly suppressed the invasion and metastasis of Panc-1 cells in a concentration dependent manner. 5,7-DMF significantly reduced the expression of FoxM1 in pancreatic cancer cells after intervention. FoxM1 SiRNA transfection of pancreatic cancer cells.5,7-DMF could down-regulate the FoxMl expression in a dose-dependent manner.FoxM1 SiRNA significantly increased E-cadherin expressions, lowered N-cadherin expressions, and And compared with the control group were statistically significant. Conclusion 5,7-DMF can reverse the epithelial mesenchymal transition of pancreatic cancer cells. It is the one of the important mechanisms through down-regulate FoxM1 levels,but the molecular mechanism need to be explored further.
[Key words]pancreaticcarcer;forkhead box protein M1;epithelial mesenchymal transition
